过滤和蒸发学案
- 格式:doc
- 大小:65.50 KB
- 文档页数:2

萃取有机物——高中化学《过滤和蒸发》优秀教案。
一、教学目标1.了解萃取的定义和基本原理;2.掌握萃取的用途和步骤;3.熟练掌握过滤和蒸发等技术操作;4.培养学生的实验操作技能和团队合作能力;5.加深学生对化学实验的认识和理解。
二、教学内容1.萃取的定义和基本原理萃取是一种将混合物中的某一组分与另一种溶剂分离的方法。
其原理是利用各组分在不同溶剂中的溶解度不同,通过挥发、冷却、蒸馏等方式分离其中成分。
2.萃取的用途和步骤萃取常用于化学合成、有机分离和提纯等工作中。
其一般步骤为:步骤一:将待萃取混合物与另一种溶剂混合。
步骤二:会发现两种剂不相溶,分成两层:上层为溶剂,下层为混合物。
步骤三:开孔漏斗(会有提词文件中提过)要比普通漏斗精确,将上层溶剂留下,过滤过滤的上清液收集到干净的容器里。
步骤四:在溶液与溶剂分离的同时,待萃取成分自然被萃取到另一层。
可以将下层与溶剂浸泡一段时间,让待萃取成分充分地被提取出来。
步骤五:倒出萃取液,并进行蒸发操作,将萃取所得的有机物提纯。
3.技术操作要求本实验要求学生具备过滤和蒸发等基本技能。
过滤是为了去除混合物中的杂质,蒸发是在分离离子时将蒸馏器上部的盖子拆下来,通过低压加热、挥发等方式将溶液中的水分或其他有机物质蒸发出来,从而得到更纯净的化合物。
4.实验流程本实验分为萃取过程和蒸发过程两部分,主要步骤如下:萃取过程:步骤一:将待萃取混合物与另一种溶剂混合均匀。
步骤二:将混合物装入开孔漏斗并进行过滤,将筛选后的上清液收集在干净的容器中,得到提取物。
步骤三:将提取物倒入圆底烧瓶中,进行蒸发操作,得到纯净的有机物。
蒸发过程:步骤一:将圆底烧瓶以能够恰好接触到酒精灯火焰的角度倾斜,并且将火焰调至适当的大小,使得瓶底温度升高,使液体开始蒸发。
步骤二:使用烧杯将提取物收集起来,分析其性质。
5.实验注意事项1.操作过程中要注意安全,避免产生火灾、烫伤等意外事件。
2.进行萃取时,应根据不同溶剂的特性选择适合的萃取剂。

优质资料---欢迎下载第一章从实验学化学第一节化学实验基本方法第2课时过滤和蒸发学习目标1.明确实验规则,培养实验安全意识。
2.初步了解混合物分离和提纯的方法与技巧;巩固过滤、蒸发的基本操作。
3.通过粗盐提纯的探究与实施,初步形成简单实验的思路、方法。
学习过程思考与交流1你知道沙里淘金吗?淘金者是利用什么性质和方法将金子从沙里分离出来?思考与交流2如果有铁屑和沙混合物,你用什么方法将铁屑分离出来?思考与交流3如果有铁屑和铜的混合物,你能用哪些方法将铁屑分离除去?分离和提纯就是要除掉杂质。
化学上所指的杂质都是有害和无价值的吗?你怎样看待这个问题?能举出一些例子吗?一、基本概念分离:把混合物中几种物质分开,每一组分都保持不变。
(若原来是固体,最后还是固体)提纯:将混合物中的主要成分(或某种指定物质)净化,而把其他杂质除去。
二、过滤和蒸发(1)过滤:利用物质的溶解性不同分离难溶物与可溶物。
操作要点:“一贴二低三靠”一贴:滤纸紧贴漏斗内壁;二低:滤纸上沿低于漏斗边缘;液面低于滤纸上沿;三靠:倾倒液体的烧杯紧靠玻璃棒;玻璃棒紧靠三层滤纸处;漏斗下端紧靠烧杯内壁。
若滤液浑浊,应再过滤一次,直到滤液澄清。
(2)蒸发:利用溶液中溶质与溶剂沸点不同加热使溶剂挥发,分离溶质与溶剂。
操作要点:①液体体积不得超过蒸发皿容积的2/3;②加热过程中要用玻璃棒不断搅拌液体以防止局部过热,造成液体飞溅;③当蒸发皿中出现较多固体时,停止加热,利用余热将液体蒸干。
④取下未冷却的蒸发皿时应把它放在石棉网上,而不能直接放在实验台上。
【想一想】由海水晒制的盐是粗盐,你知道经过什么样的处理可以得到精盐吗?实验探究1-1三、粗盐的提纯实验目的:除去粗盐中混有的杂质(泥沙、CaCl2、MgCl2、硫酸盐)实验仪器:天平、烧杯、玻璃棒、漏斗、铁架台、铁圈、蒸发皿、石棉网【想一想】粗盐提纯中用到几次玻璃棒?作用分别是什么?【小结】化学实验中常用到的玻璃棒的作用有:搅拌、引流、转移固体、蘸取液体等。
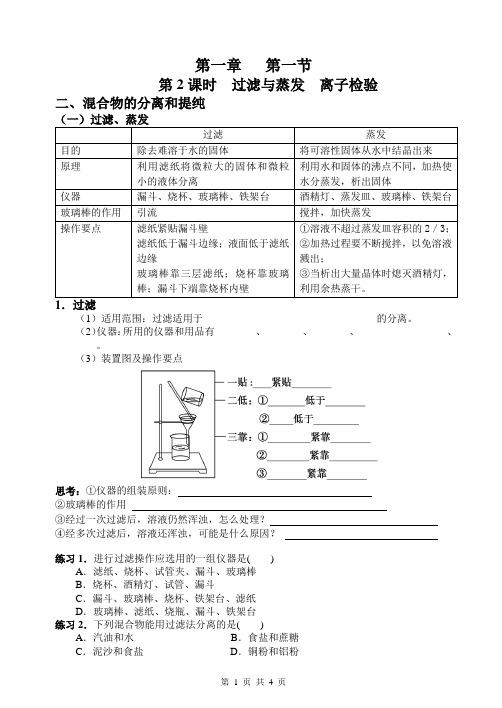
第一章 第一节第2课时 过滤与蒸发 离子检验二、混合物的分离和提纯(1)适用范围:过滤适用于__________________________________的分离。
(2)仪器:所用的仪器和用品有________、________、________、__________________、________。
(3)装置图及操作要点思考:①仪器的组装原则: ②玻璃棒的作用③经过一次过滤后,溶液仍然浑浊,怎么处理? ④经多次过滤后,溶液还浑浊,可能是什么原因?练习1.进行过滤操作应选用的一组仪器是( )A .滤纸、烧杯、试管夹、漏斗、玻璃棒B .烧杯、酒精灯、试管、漏斗C .漏斗、玻璃棒、烧杯、铁架台、滤纸D .玻璃棒、滤纸、烧瓶、漏斗、铁架台练习2.下列混合物能用过滤法分离的是( )A .汽油和水B .食盐和蔗糖C .泥沙和食盐D .铜粉和铝粉练习3.某学生发现滴瓶中的溶液有悬浮物,拟用如图所示操作进行过滤,操作上错误的地方有()A.0处B.3处C.2处D.1处2.蒸发(1)概念:分离溶于溶剂中的固体溶质的一种方法。
(2)主要仪器及用品__________、__________、__________、__________。
(3)装置图及操作要点③使用蒸发皿应用夹持,然后放在上;④蒸发皿中溶液不超过蒸发皿容积的练习4.实验室进行NaCl溶液蒸发时,一般有以下操作过程,其正确的操作顺序是() ①放置酒精灯②固定铁圈位置③放上蒸发皿④加热搅拌⑤停止加热,余热蒸干A.②③④⑤①B.①②③④⑤C.②③①④⑤D.②①③④⑤(二)粗盐的提纯1.粗盐中含有泥沙、氯化钙、氯化镁、硫酸盐等杂质,要通过________、________、________进行提纯。
以上操作都要用到玻璃棒,它们的作用依次是:(1)________溶解。
(2) 。
(3)________________________。
2.粗盐中可溶性杂质的去除方法①过滤后的溶液中除Na+、Cl-外还存在的离子有、、。

第一节化学实验基本方法(第2课时混合物的分离和提纯——过滤和蒸发)【课标要求】1.初步学会粗盐提纯的实验技能2.掌握过滤、蒸发的实验操作3.初步了解离子的检验方法和物质的除杂方法【重点难点】1.掌握过滤、蒸发实验操作方法及应用范围2.SO42-等离子的检验方法【课前知识回顾】、1.过滤是分离_____________________的方法;主要的玻璃仪器有_______ _______________________________________________。
装置图如下图所示:过滤的操作要点有哪三点?具体内容有哪些?(1)“________”:______________________________________________;(2)“________”:指①滤纸边缘稍低于漏斗边缘②滤液液面稍低于滤液边缘;(3)“________”:①烧杯尖嘴紧靠_________________②玻璃棒紧靠_____________③漏斗末端紧靠___________。
2.蒸发是___________________的方法,主要仪器是__________________。
装置图如下图所示:操作要点:液体的量不得超过蒸发皿容量的_________;加热过程中,用玻璃棒_________________________,防止由于_________________;当_______________________时,停止加热。
热的蒸发皿应用____________取下,不能直接放在____________上,以免烫坏实验台。
如果确要立即放在实验台上,则要垫在_______________上。
【知识要点】一、混合物的分离提纯1.分离:是通过适当的方法,把混合物中________________________,每一组分都要保留下来,______________________,得到比较纯的物质。
2.提纯:指______________________________,把其余杂质通过一定方法都除去。

过滤与蒸发【预习导教案】1.过滤—合用于固液混淆物的分别(1)主要仪器: _______、烧杯、 ________、铁架台、滤纸等。
(2)在进行过滤操作时要注意以下几个问题:过滤时,将滤纸折叠好放入漏斗,加入少许 _______,使滤纸紧贴 __________ 。
滤纸边沿应略_____漏斗边沿,加入漏斗中液体的液面应略 _______滤纸的边沿。
向漏斗中倾倒液体时,烧杯的尖嘴应与______接触;玻璃棒的底端莺歌过滤器的______轻轻接触;漏斗颈的尾端应与_____相接触;以上就是平时所说的“一贴”“二低”“三靠”。
2. 蒸发 --- 合用于分别溶于溶剂中的溶质(1)主要仪器: _______、 ________、酒精灯、玻璃棒。
(2)在进行蒸发操作时要注意以下几个问题:①在加热蒸发过程中,应用________不停搅拌,防备因为________造成液滴飞溅。
②加热时蒸发皿中节余_______时(出现许多晶体)时应停止加热,用余热蒸干。
③热的蒸发皿应用_______取下,不可以直接放在_______上。
【知识精讲】一、 1、分别和提纯的差别:分别是经过适合的方法,把混淆物中的几种物质分开,分别获得原状态的纯净物。
分别的对象中不分主体物质和杂质。
提纯是经过适合的方法把混淆物中的少许杂质除掉,以获得纯净物质。
提纯的对象中分主体物质和杂质。
2、提纯的原则不增:不增添新的物质;不减:不减少被提纯的物质;易分:杂质变换为积淀、气体等易分别除掉。
3、物质分别和提纯的一般方法物理法:如过滤、蒸发结晶、蒸馏或分馏、萃取、分液、升华等。
化学法:如积淀法、汲取法、转变法、离子互换法。
过滤(1)定义:将不溶性固体物质与液体分别的一种方法。
(2)仪器与用品:漏斗、玻璃棒、滤纸、烧杯、铁架台(带铁圈)。
( 3)装置:(4)注意事项“一贴”,滤纸紧贴漏斗的内壁,中间不留有气泡“二低”,滤纸的边沿低于漏斗口,漏斗里的液体低于滤纸的边沿“三靠”,倾倒液体的烧杯尖口重要靠玻璃棒,玻璃棒的尾端轻靠在三层滤纸的一边,漏斗下端的管口靠烧杯内壁。

过滤和蒸发教案第一篇:过滤和蒸发教案过滤和蒸发本课选自人教版新课标必修一,第一章第一节化学实验的基本方法。
教学目标1.知识与技能掌握溶解、过滤、蒸发等基本操作。
2.过程与方法通过视频播放和教师指导,让学生掌握做好实验的方法。
3.情感态度与价值观通过组织学生观看实验视频,让学生发现问题并讨论如何解决问题,培养学生的合作精神,增加学生的学习兴趣。
重点难点过滤和蒸发的操作教学过程〖引入新课〗阐述物质的分离和提纯是重要的化学实验基本操作,本节内容要求我们掌握四个基本操作,我们先来学习两个。
〖教师讲解〗1.分离和提纯的概念。
2.物质分离和提纯的基本原则:“不增”(不引入新的杂质);“不减”(不减少被提纯物);“易分离”(被提纯物与杂质易分离);“易复原”(被提纯物易复原)。
〖过渡〗讲述如何淘金,引出过滤的概念。
〖视频播放〗播放关于过滤的视频,让学生仔细观察,并找出操作要点。
〖提问并讨论〗假如由你们来做这个实验,还要注意那些细节问题?〖小结〗过滤的注意事项。
⑴过滤时的“一贴二低三靠”;⑵如果想要得到的是固体物质,则还需要洗涤操作(本实验不需要)。
〖过渡〗关于物质的分离方法,除了过滤,我们还要了解一种,那就是蒸发。
〖视频播放〗播放关于蒸发的视频,让学生仔细观察,并找出操作要点。
〖小结〗蒸发的注意事项。
⑴蒸发时要用玻璃棒不断搅拌,当溶液中出现较多量固体时即停止加热,靠余热蒸发剩余的水分,或用小火烘干;⑵搅拌时不能太剧烈,要始终用坩埚钳夹住蒸发皿,要防止固体小颗粒飞溅引起烫伤。
〖思考与交流〗过滤和蒸发都适用于固体和液体混合物的分离,他们适用的对象一样吗?过滤适用于固体不溶于液体,若固体易溶于液体则要用蒸发的方法进行分离。
〖补充习题〗某学生发现滴瓶中溶液里有悬浊物,拟用右图所示操作进行过滤,请指出其中错误的操作。
第二篇:高一上册《过滤与蒸发》教案第一章从实验学化学第一节化学实验基本方法第一课时过滤与蒸上课时间:8月29日11:30~12:10 上课地点:绿春一中明理楼101 一.课程目标1.知识与技能(1)知道现实生活中常见的一些混合物分离和提纯的方法,用已有的生活经验使学生加深对混合物分离、提纯等实验的认识;(2)了解食盐提纯的基本操作(3)会用合理的方法检验SO42-、CO32-等常见离子;(4)初步学会溶解、过滤和蒸发等基本操作。
高一化学学案(过滤与蒸发)一、过滤1、适用范围:将 与 分开。
2、实验用品: 。
3、实验仪器: 。
4、注意事项:一贴: ;二低: ;三靠: 。
二、蒸发1、适用范围:加热使液体挥发或减少溶剂从而获得。
2、实验仪器: 。
其中铁架台和铁圈也可用 代替。
3、注意事项:①液体的量不超过蒸发皿容积的②加热过程中,用 不断搅拌液体,以免液体局部过热而使液体飞溅。
③液体接近 时,停止加热。
三、常见离子的检验1、Cl -:向待测液中加入 后,再加入 溶液,生成 色沉淀。
2、SO 42-:向待测液中加入 后,再加入 溶液,生成 色沉淀。
3、CO 32-:向待测液中加入 后,产生 ,通入 中产生 色沉淀。
4、Ca 2+:向待测液中加入 溶液后,生成 色沉淀。
5、Mg 2+:向待测液中加入 溶液后,生成 色沉淀。
6、AL 3+:向待测液中加入过量的 溶液看到 的现象。
7、Fe 3+:向待测液中加入 溶液后,生成 色物质。
8、Fe 2+:9、Na ,+,K +应用练习1.在粗盐提纯的实验中,蒸发时正确的操作是 ( )A .把浑浊的液体倒入蒸发皿内加热B .开始析出晶体后用玻璃棒搅拌C .待水分完全蒸干后停止加热D .蒸发皿中发现大量固体时即停止加热2.某学生使用托盘天平称食盐时,错误的将食盐放在右托盘,而把砝码放在左托盘,称得食盐的质量为15.5g (1g 以下只能使用游码)。
如果按正确的放法,食盐的质量应为( )A .15.5gB .15.0gC .14.5gD .14.0g3.下列是有关实验操作的步骤和做法,不正确的是 ( )A .粗盐提纯操作的顺序是:溶解、过滤、蒸发B .实验室制取氧气完毕后,应先取出集气瓶,再取出导管,最后停止加热C .不慎将浓硫酸洒在桌上,应先用烧碱溶液中和,再用湿布抹净D .用试管夹夹持试管时,把试管夹从试管底部往上套,夹在试管中上部4.下列离子检验的方法正确的是 ( )A .某溶液生产白色沉淀,说明原溶液中有Cl - B .某溶液生产白色沉淀,说明原溶液中有SO 42- C .某溶液生产蓝色沉淀,说明原溶液中有Cu 2+ D .某溶液生成无色气体,说明原溶液中有CO 32-+稀硫酸 +NaOH 溶液 +BaCl 2溶液 +AgNO 3溶液5.某溶液中含有Fe2+、Al3+、Ag+、Cu2+,为了分别得到各含一种金属阳离子的沉淀,可采取:①通入H2S;②通入CO2,③加HCl溶液,④加NaOH溶液4个步骤,设试剂均过量,且每次都把所生成的沉淀过滤出来.其正确的操作顺序是() A.③①④②B.①③④②C.④②①③D.④②③①6.为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作.其中正确的操作顺序是()①过滤②加过量的NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液A.①④②⑤③B.④①②⑤③C.④②⑤①③ D.⑤②④①③7.在允许加热的条件下,只用一种试剂就可以鉴别(NH4)2SO4、KCl、MgCl2、Al2(SO4)3和Fe2(SO4)3溶液,这种试剂是() A.NaOH B.NH3·H2O C.AgNO3D.BaCl28.在粗盐的提纯实验中,用到玻璃棒的实验步骤有、、。
第一节化学实验基本方法第2课时过滤、蒸发和离子检验课前预习学案预习目标结合初中的化学实验的基本操作,知道过滤和蒸发操作的操作要领二.预习内容(%1)基本操作1. 过滤(1) 过滤:利用物质的可溶性不同分离难溶物与可溶物(2) 过滤操作“一贴”,滤纸紧贴 ,中间不留有气泡(操作时要用手压住,用水润湿)“二低”,滤纸的边缘低于 ,漏斗里的液体液面低于“三靠”,倾倒液体的烧杯尖口要紧靠 ,玻璃棒的末端轻靠在的一边,漏斗下端的管口靠接液。
若:滤液浑浊应再过滤一次2. 蒸发(1) 蒸发:利用溶液沸点不同加热使溶剂挥发,分离溶质与溶剂(2) 蒸发操作%1蒸发皿的液体不超过容积的%1加热时,用不断搅拌%1出现较多固体时,应停止 ,利用蒸干%1取下未冷却的蒸发皿时,要放在上3. 实例演练以“粗盐提纯”为例练习基本操作分析:1. 粗盐的成分: _________________________________________________________2. 适合用哪些操作 _______________________________________________________3. 所用主要仪器有哪些?4.操作现象1 .溶解2.过滤3.蒸发思考这样提纯的食盐纯净吗?怎样检验?(%1)物质的检验1、硫酸及可溶性硫酸盐检验(实验1-2 )2、可溶性氯化物的检验(实验1・3 )(三)物质的提纯(除杂)2+ , Ca 2+ , SO2- 食盐溶液中存在的Ba 4应用哪些试剂除去--------- ,------三.提出疑惑I同学们,通过你的自主学习,你还有哪^疑*^ ;巴它填在下面的表格中------------------------- 祝奁&U "Er课内探究学案%1.学习目标1. 知道溶解,过滤,蒸发操作的操作要领2. 学会离子检验的方法及除杂问题的基本原则%1.学习过程探究一1、不溶性的泥沙与盐分离是哪一步骤?2、蒸发过程利用的是物质的什么性质?3、蒸发后得到的盐的成分可能是么?探究二:如何除掉粗盐中的可溶性杂质CaCl2、MgCl2、硫酸盐?杂质加入试剂化学方程式硫酸盐MgCi2 —GaGb——探究二:加入你选择的试剂除掉杂质后,有没有引入其它离子?想一想可用什么方法再把它们除去?%1.反思总结1. 除杂原则不增不得引入新的杂质不减尽量不消耗被提纯的物质易分杂质转换为沉淀、气体等易分离除去的物质,如:将NaCI溶液中可能存在的Na 2SO4转换为沉淀BaSO42. 根据杂质特征选择除杂剂,通常选择易与杂质反应生成气体、沉淀的物质为除杂剂,符合()反应类型。
化学必修1混合物的分离与提纯导学案高一化学组班级:姓名:混合物的分离与提纯导学案(一)学习目标:1.体验科学探究的过程,学习运用以实验为基础的实证研究方法。
2.树立安全意识,能识别化学品安全使用标识,初步形成良好的实验工作习惯。
3.掌握物质过滤、蒸发操作的方法,能根据常见物质的性质设计除杂质方案。
重点难点:过滤、蒸发操作的掌握及应用。
【自主探究】混合物的分离与提纯物质的分离:将中各物质通过变化或变化,把各成分彼此分开的过程.物质的提纯:把中的杂质除去,以得到的过程.(注意两者的区别。
)一、过滤和蒸发(1)过滤a、适用范围:把_______________________________ 分离的一种方法。
b、所用仪器:_______________________________ ____________。
c、操作注意事项:一贴:滤纸紧贴漏斗内壁;二低:滤纸边缘低于漏斗边缘;液面低于滤纸边缘;三靠:烧杯紧靠玻璃棒;玻璃棒下端紧靠三层滤纸一边;漏斗下端管口紧靠烧杯内壁。
d、实例:(2)蒸发a、原理:利用的方法,使固体溶质从溶液中析出。
b、所用仪器:_____________ __________________________ 。
c、操作要点:蒸发过程中要不断。
当有析出时,停止加热,用余热蒸干。
d、实例:(3)(降温)结晶a、适用范围:溶解度随温度变化较大的可溶性固体的分离。
b、操作步骤:_____________ _______________________ ___。
c、实例:【互动交流】SO42-离子检验的方法:_______________________________________ 。
实验1-1 粗盐提纯步骤:溶解、过滤、蒸发。
粗盐中常含有CaCl2、MgCl2以及可溶性的硫酸盐等,如何将以上杂质除去?注意加入试剂的顺序、试剂用量和过量后的处理。
【课堂展示】【达标检测】1.实验室进行过滤和蒸发时,都要用到的仪器是( )A.烧杯B.玻璃棒C.蒸发皿D.酒精灯2.在进行过滤操作时,除了铁架台、烧杯、玻璃棒外,还需要的仪器是()A.酒精灯B.托盘天平C.蒸发皿D.漏斗3.在“粗盐提纯”的实验中,蒸发时正确的操作是()A.把浑浊的液体倒人蒸发皿内加热B.开始析出晶体后用玻璃棒搅拌C.蒸发时液体不超过蒸发皿容积的1/3D.蒸发皿中出现大量固体时即停止加热4.从KNO3和NaCl的混合物中提纯KNO3的主要操作步骤是( )A.溶解和蒸发B.溶解和过滤C.溶解、蒸发、结晶D.溶解、结晶、过滤5.为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序:①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液A.⑤②④③①B.④①②⑤③C. ②⑤④①③D. ①④②⑤③。
高中化学过滤和蒸发教案教学目标:
1. 了解过滤和蒸发的原理和应用
2. 掌握过滤和蒸发的操作方法
3. 学会分析实验数据,总结实验规律
教学内容:
1. 过滤和蒸发的原理介绍
2. 过滤和蒸发的实验操作
3. 实验数据分析及实验总结
教学准备:
1. 实验器材:真空漏斗、过滤纸、三角瓶、烧杯、电热板等
2. 实验试剂:可溶性固体和溶液
3. 实验记录表格
教学步骤:
1. 过滤实验操作步骤:
a. 准备漏斗和过滤纸
b. 将混合物倒入漏斗中
c. 收集过滤液,留下固体
d. 将固体干燥或称重
2. 蒸发实验操作步骤:
a. 将溶液倒入烧杯中
b. 将烧杯放在电热板上加热
c. 记录加热过程中的变化
d. 观察溶液蒸发后的残留物
3. 实验数据记录及分析:
a. 记录过滤和蒸发的实验数据
b. 分析实验结果,总结过滤和蒸发的应用规律
4. 实验总结及反思:
a. 总结过滤和蒸发的原理和实验方法
b. 探讨过滤和蒸发在日常生活中的应用
教学延伸:
1. 让学生设计不同条件下的过滤和蒸发实验,加深理解
2. 通过实际例子,引导学生探讨过滤和蒸发在各种实际情况下的应用评估方法:
1. 观察学生实验操作及数据记录情况
2. 针对学生的实验总结和分析进行评价
扩展阅读:
1. 《化学实验室基本操作手册》
2. 《化学实验技术》
注:本教案仅供参考,具体实施时可根据教学实际情况做适当调整。
第一章从实验学化学
第一节化学实验基本方法
第2课时过滤和蒸发
【三维教学目标】
知识与技能:掌握物理和化学法除杂、掌握离子检验方法
过程与方法:通过“粗盐提纯”实验,掌握物理、化学方法对混合物分离提纯的原理与操作,加深对提纯操作原理和方法的理解
情感态度与价值观:通过物质分离与提纯的学习,体会化学在生活中的重要应用
【重点】离子检验及化学法除杂
【难点】杂质离子检验与除去,除杂试剂的选择及加入顺序
【当堂检测重点】化学法除杂
【学习过程】
【导入】①沙里淘金
利用物理方法分离混合物。
②如何分离铁屑和沙的混合物?
【复习旧识】
1.过滤——适于固液混合物的分离
(1)主要仪器:、烧杯、、铁架台、滤纸等。
(2)简易装置图
(3)过滤操作要领
“一贴”,滤纸紧贴,中间不留有气泡(操作时要用手压住,用水润湿)
“二低”,滤纸的边缘低于,漏斗里的液体液面低于
“三靠”,倾倒液体的烧杯尖口要紧靠,玻璃棒的末端轻靠在的一边,漏斗下端的管口靠着。
若:滤液浑浊应再过滤一次
玻璃棒的作用:
2.蒸发——适于分离溶于溶剂中的溶质
(1)主要仪器:、、酒精灯、玻璃棒。
(2)蒸发操作注意事项
①蒸发皿的液体不超过容积的
②加热时,用不断搅拌,防止由于造成液滴飞溅;
③出现较多固体时,应停止,利用蒸干
④热的蒸发皿应用取下,不能直接放在上,以免烫坏实验台或遇
上引起蒸发皿破裂。
如果确要立即放在实验台上,则要垫在
上。
玻璃棒的作用:
【问题思考】1.粗盐中都有哪些杂质?
2.过滤和蒸发操作能出去哪些杂质?得到的是纯净的NaCl固体
吗?
3.对于可溶性杂质有哪些?如何除去?
【新课讲授】
一、除去粗盐中可溶性杂质
1.粗盐的成分:主要为NaCl、并有CaCl2、MgCl2以及Na2SO4等杂质。
2.除杂试剂及反应原理:
阅读课本P7中的溶解性表,小组讨论填写下列空格
杂质加入试剂化学方程式
CaCl2
MgCl2
Na2SO4
3.问题讨论
(1)除溶液中的硫酸根离子能否改用硝酸钡溶液?除MgCl2时能否用KOH?除CaCl2时能否用K2CO3溶液?
(2)为除去溶液中的杂质,所加试剂应是过量的,过量的氯化钡是怎样除去的?
顺序可以是:
结论:
(3)过量的氢氧化钠、碳酸钠又是怎样除去的?写出有关的化学方程式。
(4)过滤操作是在哪一个环节进行?
注意:除杂试剂要适当过量;设计所加试剂的先后顺序!
4.除杂原则:
(不引入新杂质)
(不损耗样品)
(容易分离——生成完全不溶物)
(除去各种过量杂质,还原到目标产物)
二、离子检验
SO42-:
Cl-:。