2015-2016学高中化学 2.3.1 氧化还原反应(精讲优练课型)课时自测-当堂达标区 鲁科版必修1
- 格式:doc
- 大小:128.50 KB
- 文档页数:2

氧化还原反应(30分钟50分)一、选择题(本题包括6小题,每小题5分,共30分)1.(2015·淄博高一检测)下列有关化学基本概念正确的是( )A.含非金属元素的离子,在氧化还原反应中一定作还原剂B.分解反应一定是氧化还原反应C.依据化合物在水溶液中的导电能力强弱,将化合物分为电解质和非电解质D.氧化还原反应的本质是电子的转移【解析】选D。
含非金属元素的离子,在氧化还原反应中不一定作还原剂,如Mn,A不正确;分解反应不一定是氧化还原反应,如碳酸氢铵的分解,B不正确;电解质和非电解质区分的依据是溶于水或者是熔融状态下能否电离,C不正确;氧化还原反应的本质就是电子的转移,D正确。
2.(双选)(2015·镇江高一检测)下列实验现象中与氧化还原反应有关的是( )A.碳酸钠溶液中加入氯化钙溶液产生沉淀B.铜粉在空气中加热变为黑色粉末C.石灰石溶于盐酸并产生无色无味的气体D.氢气在空气中燃烧,火焰为淡蓝色【解析】选B、D。
碳酸钠溶液与氯化钙溶液发生反应生成的是碳酸钙沉淀,是复分解反应,不是氧化还原反应,A不正确;铜粉在空气中加热变为黑色粉末主要是由于铜粉在空气中与氧气发生氧化还原反应生成CuO,B正确;石灰石溶于盐酸并产生无色无味的气体是由于二者发生复分解反应,C不正确;氢气在空气中燃烧,火焰为淡蓝色主要是空气中的氧气与氢气发生氧化还原反应,D正确。
3.从化合价升降的角度分析,下列变化过程中,属于还原过程的是( )A.MnO2→MnB.Al→Al(OH)3C.As→AsD.S→SO2【解析】选C。
B、D项中均没有化合价的变化,所以既不属于氧化过程也不属于还原过程;A项MnO2→Mn是一个化合价升高的过程,是氧化过程;C项As→As是一个化合价降低的过程,是还原过程。
4.(2014·聊城高一检测)下列四类反应:①置换反应,②复分解反应,③有单质参加的化合反应,④有单质生成的分解反应。


第一节氧化还原反应(第一课时)(一)、课前知识准备:1、从氧化还原的角度分类,我们把物质的反应叫做氧化反应,把物质的反应叫做还原反应,一种物质被氧化,同时另一种物质被还原的反应叫做。
2、离子化合物中某元素的一个原子,该元素就显正几价,就显负几价。
共价化合物中,有几对某元素的一个原子,该元素就显负几价,若则显正几价。
(二)、名师解读点拨:一、氧化还原反应的概念知识点1、从得氧失氧的角度认识氧化还原反应物质得到氧的反应叫氧化反应,该反应物是还原剂;物质失去氧的反应叫还原反应,该反应物是氧化剂。
一种物质被氧化,同时另一种物质被还原的反应叫氧化—还原反应。
即:还原剂→氧→被→发生反应、氧化剂→氧→被→发生反应。
凡是有的反应就是氧化还原反应。
知识点2、从化合价升降的角度认识氧化还原反应元素化合价的反应叫氧化反应,该反应物是;元素化合价的反应叫还原反应,该反应物是。
即:还原剂→化合价→被氧化→氧化反应氧化剂→化合价→被还原→还原反应凡是有的反应就是氧化还原反应。
【拓展】为什么氧化还原反应中一定会发生化合价的变化?知识点3、从电子转移的角度认识氧化还原反应凡是有的反应就是氧化还原反应即:还原剂→电子→化合价升高→被氧化→氧化反应氧化剂→电子→化合价降低→被还原→还原反应显然:是氧化还原反应的特征(也是判断氧化还原反应的依据),而才是氧化还原反应的实质。
【拓展】为什么引起化合价变化的本质原因是电子的转移?故离子化合物中:元素化合价数=该元素一个原子数化合价升高数=的电子数、化合价降低数=的电子数共价化合物中:元素化合价数=该元素一个原子与其它原子形成的数化合价升高数=共用电子对数、化合价降低数=共用电子对数可见氧化还原反应中化合价变化的实质是(统称电子转移)(三)、拓展整合创新:1、氧化还原反应的判断【例1】(原创)下列反应中,属于氧化还原反应的是()A、CaCO3受热分解放出CO2B、以MnO2为催化剂,KClO3分解放出O2C、铁与稀硫酸反应D、固体NaCl与浓H2SO4反应放出HCl气体【变式1】(原创)判断下列反应是否属于氧化还原反应;是氧化还原反应的标出化合价变化。

第3课时氧化还原反应[学习目标] 1.能够从化合价升降和电子转移的角度认识氧化还原反应,并会分析判断。
2.会判断氧化剂和还原剂,会比较物质氧化性或还原性的强弱。
1.氧化还原反应的概念2.氧化还原反应的特征一种或几种元素的□08化合价发生变化。
3.氧化还原反应的实质氧化还原反应的实质是电子的□09转移(即电子的得失或偏移)。
1.在一个化学反应中能否只存在氧化反应或只存在还原反应?提示:不能,在化学反应中,有物质被氧化,必然同时有物质被还原,氧化反应和还原反应必然同时存在于一个反应中。
2.同一个氧化还原反应中,氧化剂、还原剂一定为不同物质吗?提示:不一定,有些反应中氧化剂和还原剂为同一物质,如Cl2+2NaOH===NaCl+NaClO+H2O中Cl2既是氧化剂,又是还原剂。
一、氧化还原反应中几个概念之间的关系在氧化还原反应中,氧化剂得电子,所含元素化合价降低,发生还原反应,得到还原产物;还原剂失电子,所含元素化合价升高,发生氧化反应,得到氧化产物;它们之间的关系可表示为:知识拓展氧化还原反应与四种基本反应类型间的关系(1)置换反应一定属于氧化还原反应。
(2)复分解反应一定不属于氧化还原反应。
(3)有单质参与的化合反应和有单质生成的分解反应,均属于氧化还原反应。
(4)图示关系:特别提醒:(1)有单质参与的化学反应不一定是氧化还原反应,如3O2===2O3。
(2)无单质参与的化合反应也可能是氧化还原反应,如H2O2+SO2===H2SO4。
[练习与实践]1.下列反应中,属于氧化还原反应的是( ) A .CaCO 3=====高温CaO +CO 2↑B .Na 2CO 3+2HCl===2NaCl +CO 2↑+H 2OC .2Cu +O 2=====△2CuOD .Fe 2O 3+3H 2SO 4===Fe 2(SO 4)3+3H 2O 答案 C解析 根据反应前后是否有元素化合价发生变化来判断某一个反应是不是氧化还原反应。

人教版高中化学必修一氧化还原反应公开课优质课课件教案人教版高中化学必修一氧化还原反应公开课优质课课件教案视频 -2.3.1氧化还原反应(一)公开课教学设计一、学习目标1.了解氧化还原反应的概念,并能判断某反应是否是氧化还原反应。
2.掌握氧化还原反应的实质。
3.体会氧化还原反应的普遍存在,并能举例说明生产、生活中常见的氧化还原反应。
二、教学重点、难点教学重点:用化合价升降和电子转移的观点理解氧化还原反应。
教学难点:理解氧化还原反应的本质就是发生了电子转移。
三、教学方法:自主学习、合作学习、探究学习四、教学过程:【检查自主学习情况】小组互查,教师抽查。
金太阳P28-30【引言】初中我们学习过氧化反应和还原反应,回忆一下什么叫氧化反应?什么叫还原反应?【板书】氧化还原反应【探究一】从得失氧的角度分析氧化还原反应【小组交流、展示】【总结】得氧失氧同时发生【过渡】有氧得失的反应元素的化合价是否变化?如何变化?【探究二】从化合价变化的角度分析氧化还原反应【小组交流、展示】【总结】氧化还原反应:有元素化合价升降的化学反应氧化反应:物质所含元素化合价升高的反应还原反应:物质所含元素化合价降低的反应并非只有得失氧的反应才是氧化还原反应。
【过渡】氧化还原反应中元素的化合价为什么会发生反应呢?【探究三】氧化还原反应的实质【小组交流、展示】【总结】氧化还原反应的实质是电子的转移(包括得失和偏移)。
氧化还原反应的特征是元素化合价的变化。
电子转移与元素化合价变化的关系:失n个电子,化合价升高n价得n个电子,化合价降低n价氧化还原反应与元素化合价的变化、电子转移的关系:升-失-氧,降-得-还【过渡】我们知道化学反应有四大基本类型,那么氧化还原反应是否属于第五大基本类型呢?它们之间有何关系?【探究四】氧化还原反应与四种基本反应类型的关系【小组交流、展示】【总结】化合反应、分解反应既可能是氧化还原反应,也可能是非氧化还原反应;复分解反应一定是非氧化还原反应;置换反应一定是氧化还原反应。
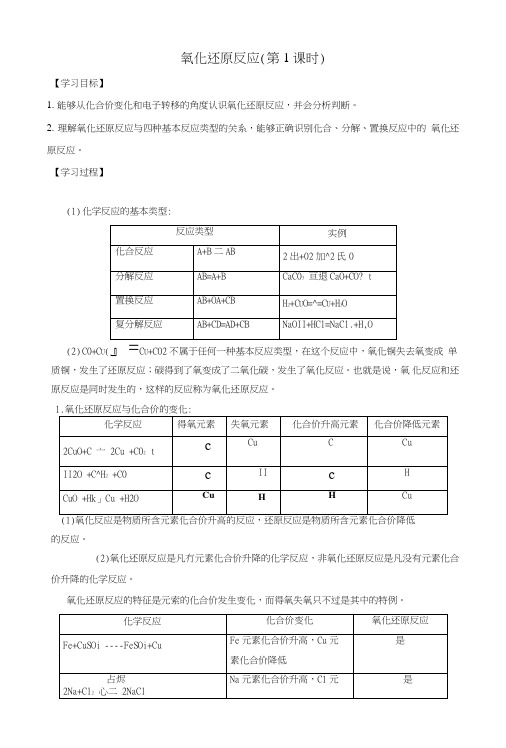
氧化还原反应(第1课时)【学习目标】1.能够从化合价变化和电子转移的角度认识氧化还原反应,并会分析判断。
2.理解氧化还原反应与四种基本反应类型的关系,能够正确识别化合、分解、置换反应中的氧化还原反应。
【学习过程】(1)化学反应的基本类型:(2)C0+C U(C U+C02不属于任何一种基本反应类型,在这个反应中,氧化铜失去氧变成单质铜,发生了还原反应;碳得到了氧变成了二氧化碳,发生了氧化反应。
也就是说,氧化反应和还原反应是同时发生的,这样的反应称为氧化还原反应。
1.氧化还原反应与化合价的变化:(1)氧化反应是物质所含元素化合价升高的反应,还原反应是物质所含元素化合价降低的反应。
(2)氧化还原反应是凡冇元素化合价升降的化学反应,非氧化还原反应是凡没有元素化合价升降的化学反应。
氧化还原反应的特征是元索的化合价发生变化,而得氧失氧只不过是其中的特例。
2.氧化还原反应与电子转移:(1)反应中化合价升降的原因:反应中化合价升降的原因是电子的得失(或偏移)。
电子的得失(或偏移)的结果是形成稳定结构。
(2)氧化还原反应的本质:有电子转移(得失或偏移)的反应都是氧化还原反应。
失去(或偏离)电子的发生氧化反应,得到(或偏向)电子的发生还原反应。
化合价卉高,头电子,被氧化;化合价臨低,倉电子,被注原。
3.氧化还原反应与基本反应类型的关系:C02+CaO^CaCOs 化合反应无否NH4HCO3=^=NH3 f +CO2 f +H2O 分解反应无否MnO: 2KC10:i=S= 2KC1 + 3O2 t分解反应有是Fe+2HC1——FeCl2+H2 t 置换反应有是Zn + CuSO4―ZnSO(+Cu 置换反应有是HC1+KOH KC1+H20 复分解反应无否BaCl2+Na2S04 BaSOi I +2NaCl 复分解反应无否化合反应和分解反应可能是氧化还原反应,有单质参加的化合反应和有单质生成的分解反应一定是氯化还原反应,所有的置换反应一定是氧化还原反应,所有的复分解反应一定是非氧化述原反应。
氧化还原反应
1.(2015·山东学业水平模拟)氧化还原反应的实质是( )
A.元素化合价发生变化
B.反应中有氧原子的得失
C.反应中有电子得失或电子偏移
D.反应后生成新物质
【解析】选C。
氧化还原反应的实质是元素的原子间有电子的得失或偏移。
2.(2015·通辽高一检测)下列化学反应,不属于氧化还原反应的是( )
A.2Al+Fe2O32Fe+Al2O3
B.Fe2O3+3CO2Fe+3CO2
C.3Fe+2O2Fe3O4
D.CaCO3CaO+CO2↑
【解析】选D。
Al化合价由0价→+3价,Fe化合价由+3价→0价,化合价发生变化,为氧化还原反应,故A 不符合题意;Fe化合价由+3价→0价,C化合价由+2价→+4价,化合价发生变化,为氧化还原反应,故B不符合题意;Fe化合价由0价→+2、+3价,O化合价由0价→-2价,化合价发生变化,为氧化还原反应,故C不符合题意;各元素的化合价没有发生变化,不属于氧化还原反应,故D符合题意。
3.(2015·宁波高一检测)在空气中,有下列反应发生:①N2+O22NO;
②2NO+O22NO2;③3NO2+H2O2HNO3+NO;④2SO2+O22SO3;⑤SO3+H2O H2SO4;
⑥SO2+H2O H2SO3;⑦3O22O3。
其中属于氧化还原反应的是( )
A.①②③④
B.①②③④⑦
C.①②④⑦
D.①②③④⑤⑥⑦
【解析】选A。
判断一个反应是不是氧化还原反应主要是看反应前后元素有没有化合价的变化,根据这个条件可以判断①②③④是氧化还原反应。
4.(2015·大庆高一检测)下列有关氧化还原反应的叙述正确的是( )
A.在氧化还原反应中,一定是一种元素被氧化,而另一种元素被还原
B.在反应中不一定所有元素的化合价都发生变化
C.分解反应一定属于氧化还原反应
D.化合反应和复分解反应都不是氧化还原反应
【解析】选B。
氧化还原反应也可以发生在同种元素之间,A不正确;在氧化还原反应中并不是所有的元素的化合价均发生变化,只有被氧化或被还原的元素的化合价才有变化,B正确;分解反应只有一部分是氧化还原反应,C不正确;化合反应一部分是氧化还原反应,D不正确。
5.(双选)下列反应中,电子转移发生在同种元素之间的是( )
A.2H2S+SO23S+2H2O
B.2FeCl2+Cl22FeCl3
C.2KClO32KCl+3O2↑
D.Cu2O+H2SO4CuSO4+Cu+H2O
【解析】选A、D。
A中的电子转移全部是在硫元素之间,是-2价的硫元素将电子转移给+4价的硫元素;B中的电子转移是在铁元素和氯元素之间;C中的电子转移是在氯元素和氧元素之间;D中的电子转移是在铜元素之间,+1价的铜变成了0价和+2价。
6.(2015·武汉高一检测)实验室可用2Na2O2+2H2O4NaOH+O2↑制备O2。
(1)该反应中元素得电子,发生反应; 元素失电子,发生反应。
(2)转移2 mol电子时,生成标准状况下的O2L。
【解析】(1)2Na2+2H2O4+↑,氧元素由-1→-2价,得电子发生还原反应;氧元素由-1→0价,失电子发生氧化反应。
(2)由O2~2e-的关系式可知,当转移2 mol电子时,生成1 mol O2,在标准状况下的体积为V(O2)=1 mol×
22.4 L·mol-1=22.4 L。
答案:(1)氧还原氧氧化(2)22.4。