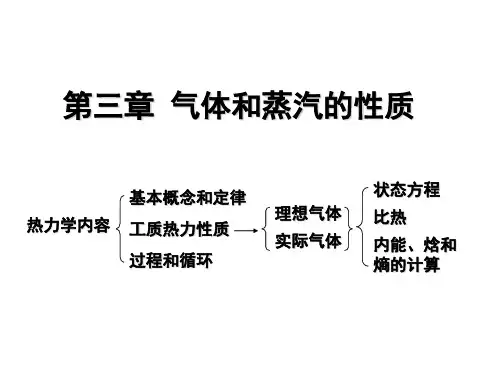
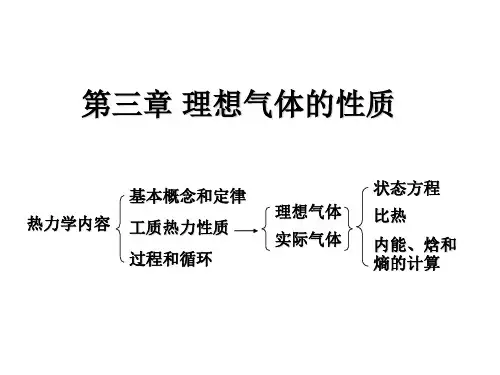
第3章焓、熵、热容与温度、压力的关系
- 格式:ppt
- 大小:3.33 MB
- 文档页数:87







第三章热力学第二定律3.1 卡诺热机在的高温热源和的低温热源间工作。
求(1)热机效率;(2)当向环境作功时,系统从高温热源吸收的热及向低温热源放出的热。
解:卡诺热机的效率为根据定义3.2 卡诺热机在的高温热源和的低温热源间工作,求:(1)热机效率;(2)当从高温热源吸热时,系统对环境作的功及向低温热源放出的热解:(1) 由卡诺循环的热机效率得出(2)3.3 卡诺热机在的高温热源和的低温热源间工作,求(1)热机效率;(2)当向低温热源放热时,系统从高温热源吸热及对环境所作的功。
解:(1)(2)3.4 试说明:在高温热源和低温热源间工作的不可逆热机与卡诺机联合操作时,若令卡诺热机得到的功r W 等于不可逆热机作出的功-W 。
假设不可逆热机的热机效率大于卡诺热机效率,其结果必然是有热量从低温热源流向高温热源,而违反势热力学第二定律的克劳修斯说法。
证: (反证法) 设 r ir ηη>不可逆热机从高温热源吸热,向低温热源放热,对环境作功则逆向卡诺热机从环境得功从低温热源吸热向高温热源放热则若使逆向卡诺热机向高温热源放出的热不可逆热机从高温热源吸收的热相等,即总的结果是:得自单一低温热源的热,变成了环境作功,违背了热力学第二定律的开尔文说法,同样也就违背了克劳修斯说法。
3.5 高温热源温度,低温热源温度,今有120KJ的热直接从高温热源传给低温热源,求此过程。
解:将热源看作无限大,因此,传热过程对热源来说是可逆过程3.6 不同的热机中作于的高温热源及的低温热源之间。
求下列三种情况下,当热机从高温热源吸热时,两热源的总熵变。
(1)可逆热机效率。
(2)不可逆热机效率。
(3)不可逆热机效率。
解:设热机向低温热源放热,根据热机效率的定义因此,上面三种过程的总熵变分别为。
3.7 已知水的比定压热容。
今有1 kg,10℃的水经下列三种不同过程加热成100 ℃的水,求过程的。
(1)系统与100℃的热源接触。
(2)系统先与55℃的热源接触至热平衡,再与100℃的热源接触。

第三章热力学第二定律3.1 卡诺热机在的高温热源和的低温热源间工作。
求(1)热机效率;(2)当向环境作功时,系统从高温热源吸收的热及向低温热源放出的热。
解:卡诺热机的效率为根据定义3.2 卡诺热机在的高温热源和的低温热源间工作,求:(1)热机效率;(2)当从高温热源吸热时,系统对环境作的功及向低温热源放出的热解:(1) 由卡诺循环的热机效率得出(2)3.3 卡诺热机在的高温热源和的低温热源间工作,求(1)热机效率;(2)当向低温热源放热时,系统从高温热源吸热及对环境所作的功。
解:(1)(2)3.4 试说明:在高温热源和低温热源间工作的不可逆热机与卡诺机联合操作时,若令卡诺热机得到的功r W 等于不可逆热机作出的功-W 。
假设不可逆热机的热机效率大于卡诺热机效率,其结果必然是有热量从低温热源流向高温热源,而违反势热力学第二定律的克劳修斯说法。
证: (反证法) 设 r ir ηη>不可逆热机从高温热源吸热,向低温热源放热,对环境作功则逆向卡诺热机从环境得功从低温热源吸热向高温热源放热则若使逆向卡诺热机向高温热源放出的热不可逆热机从高温热源吸收的热相等,即总的结果是:得自单一低温热源的热,变成了环境作功,违背了热力学第二定律的开尔文说法,同样也就违背了克劳修斯说法。
3.5 高温热源温度,低温热源温度,今有120KJ的热直接从高温热源传给低温热源,求此过程。
解:将热源看作无限大,因此,传热过程对热源来说是可逆过程3.6 不同的热机中作于的高温热源及的低温热源之间。
求下列三种情况下,当热机从高温热源吸热时,两热源的总熵变。
(1)可逆热机效率。
(2)不可逆热机效率。
(3)不可逆热机效率。
解:设热机向低温热源放热,根据热机效率的定义因此,上面三种过程的总熵变分别为。
3.7 已知水的比定压热容。
今有1 kg,10℃的水经下列三种不同过程加热成100 ℃的水,求过程的。
(1)系统与100℃的热源接触。
(2)系统先与55℃的热源接触至热平衡,再与100℃的热源接触。

关于焓和熵的理解熵:物理学上指热能除以温度所得的商,标志热量转化为功的程度。
表示物质系统状态的一个物理量(记为S),它表示该状态可能出现的程度。
在热力学中,是用以说明热学过程不可逆性的一个比较抽象的物理量。
孤立体系中实际发生的过程必然要使它的熵增加。
熵的单位就是焦耳每开尔文,即J/K。
熵是热力系内微观粒子无序度的一个量度,熵的变化可以判断热力过程是否为可逆过程。
(可逆过程熵不)热力学能与动能、势能一样,是物体的一个状态量。
能可以转化为功,能量守恒定律宣称,宇宙中的能量必须永远保持相同的值。
那么,能够把能量无止境地转化为功吗?既然能量不灭,那么它是否可以一次又一次地转变为功?1824年,法国物理学家卡诺证明:为了作功,在一个系统中热能必须非均匀地分布,系统中某一部分热能的密集程度必须大于平均值,另一部分则小于平均值,所能荼得的功的数量妈决于这种密集程度之差。
在作功的同时,这种差异也在减小。
当能量均匀分布时,就不能再作功了,尽管此时所有的能量依然还存在着。
德国物理学家克劳修斯重新审查了卡诺的工作,根据热传导总是从高温到低温而不能反过来这一事实,在1850年的论文中提出:不可能把热量从低温物体传到高温物体而不引起其他变化。
这就是热力学第二定律,能量守恒则是热力学第一定律。
1854年,克劳修斯找出了热与温度之间的某一种确定产关系,他证明当能量密集程度的差异减小时,这种关系在数值上总在增加,由于某种原因,他在1856年的论文中将这一关系式称作“熵”(entropy),entropy一诩源于希腊语,本意是“弄清”或“查明”,但是这与克劳修斯所谈话的内容似乎没有什么联系。
热力学第二定律宣布宇宙的熵永远在增加着。
然而,随着类星体以及宇宙中其他神秘能源的发现,天文学家们现在已经在怀疑:热力学第二定律是否果真在任何地方任何条件下都成立熵与温度、压力、焓等一样,也是反映物质内部状态的一个物理量。
它不能直接用仪表测量,只能推算出来,所以比较抽象。