厦门大学物化考研试题分析研究
- 格式:doc
- 大小:35.50 KB
- 文档页数:5

厦门大学分析化学考研真题思睿厦大考研网厦门大学XX年分析化学考研真题科目代码:科目名称:分析化学招生专业:分析化学、化学生物学、纳米材料化学专业考生须知:答案必须使用黑色墨水笔;不得在试题纸上作答;凡未按规定作答均不予评阅、判分一、选择题1对置信区间的正确理解是:一定置信度下以真值为中心包括测定平均值的范围一定置信度下以测定平均值为中心包括总体平均值的范围总体平均值落在某一可靠区间的概率一定置信度下以真值为中心的可靠范围/溶液与下列何种物质组成的缓冲溶液,其pH=:已知:CH3的=;NH3的=;的=;6N4H+的=;吡啶 CH3 NH3 6N4H+ 3下列各组酸碱对中,属于共轭酸碱对的物质是:H2CO3-CO32- H3O+-OH-42--PO43- NH3+CH2-NH3+CH2-4.卤化银对卤化物和各种吸附指示剂的吸附能力如下:二甲基二碘荧光黄>Br->曙红>Cl->荧光黄如用法扬司法分别测定Br-和Cl-时,应分别选择的指示剂是:二甲基二碘荧光黄和荧光黄二甲基二碘荧光黄和曙红荧光黄和曙红曙红和荧光黄5右图所示的滴定曲线最有可能代表的滴定反应是:滴定滴定滴定Na2CO3 滴定6在含有Fe3+和Fe2+的溶液中,加入下列何种溶液,Fe3+/Fe2+电对的电位将升高:已知相关络合物常数为:Fe3+与H3PO4的lg1=;Fe3+与H2C2O4的lg13=;Fe2+与H2C2O4的lg13=;Fe3+与邻二氮菲的lg13=;Fe2+与邻二氮菲的lg13=;Fe3+与磺基水杨酸的lg13=;Fe2+与磺基水杨酸的lg13=H3PO4 H2C2O4 邻二氮菲磺基水杨酸7在pH=10的溶液中,用滴定/2+和/3+混合溶液中的Zn2+,加入三乙醇胺掩蔽Al3+,此时和三乙醇胺的酸效应为:同时削弱主反应同时增进主反应思睿厦大考研网前者增进主反应,后者削弱主反应前者削弱主反应,后者增进主反应8 8-羟基喹啉在氯仿-水中存在右图所示的平衡;在pH=时,8-羟基喹啉在氯仿-水中的分配系数与分配比相等,由此可以判断8-羟基喹啉在pH=的水溶液中存在的主要型体是:H2L+ HL L- H2L-与L- 9 对离子交换树脂性能参数表述正确的是:交联度大有利于大分子的选择性分离交联度大交换速度快,有利于提高分离速率交联度大有利于小分子的选择性分离交联度小表明单位重量树脂的交换基团少 10极谱分析是特殊的电解,是由于在电解测量时:被测物不必%的被电解溶液必须保持静止状态滴汞电极产生浓差极化使用滴汞电极作为微电极定量分析法被测定元素的灵敏度、准确度在很大程度上取决于:光源系统原子化系统检测系统分光系统 12 某物质能吸收红外光辐射,产生红外光谱,那么其分子结构必然是:具有共轭体系具有极化度的变化具有偶极矩的变化具有对称性13 在液相色谱中,范式方程中的哪一项对柱效能的影响可以忽略不计?涡流扩散项分子扩散项固定相传质阻力项流动相中的传质阻力14下列几个检测器中哪一个是作为高效液相色谱中的通用型的浓度检测器:紫外-可见光度检测器电导检测器荧光检测器差示折光检测器15在溴乙烷的质谱图中,观察到两个强度相等的离子峰,最大可能的是: m/e为15和29 m/e为93和15 m/e为29和95 m/e为95和93 二、计算题1某实验室研制出一台氨基酸快速测试仪用此新仪器测量食品标准样品的氨基酸,5次测量的结果的平均值为%,标准差为%问此结果与标准值相比是否有显著性差异显著性水平2=的t值表d 3 4 5 6 7t2.用/溶液滴定/L某弱酸HA,当滴定完成一半时,溶液对应的pH为试计算化学计量点的pH,并指出滴定时应选择什么指示剂?3已知某3试样约含1%3,今称取试样,溶解成25mL溶液,然后用思睿厦大考研网滴定Pb2+,若用6N4CH2)6N4H+缓冲溶液控制pH=,请计算以二甲酚橙作为指示剂时滴定的终点误差已知:=,=,pH=时,=;醂=,M=,M=4从长的填充色谱柱上测得如下数据:化合物保留时间tR 峰底宽度Y 空气A组分B组分请计算:求B组分有效塔板数;求A、B两组分的分离度R;为了使A、B两组分色谱峰完全分开,色谱柱至少该有多长?三、简答题5 简要回答与解释列出下列酸碱组分的:① 浓度为② 浓度为简要说明水溶液中金属离子萃取分离的原理6实验室备有:标准酸碱溶液、常用酸碱指示剂和广泛与精密pH试纸现有一个未知的一元弱酸样品,可采用碱标准溶液滴定,请用上述物品以最简要的分析方法测定该一元弱酸的解离常数近似值7简述采用离子计测量未知溶液的pH值时,要考虑哪些主要的问题和关键的实验步骤?为什么普通的玻璃电极只能用于测量1<pH<10范围溶液的pH值?8简述电子轰击粒子源质谱图可以提供哪些谱图参数?这些谱图参数如何体现出分子结构的信息?9请扼要指出试样的分析全过程涉及到哪些重要的环节;并指出可以用哪些主要指标评价某个仪器分析方法四、综合题10请设计一个实验方案:分析食品中蛋白质的含量,要求给出分析方法、指示剂和计算式11某一卤水样品中含有常量级的Ca2+、Mg2+、Fe3+和Cl-离子,请设计一套实验方案:采用化学分析方法测定该卤水样品中这四种离子的浓度12请分别画出紫外-可见分光光度计与分子荧光分光光度计各主要部件的结构狂如、框图,并扼要说明它们之间差别的原因13某化合物的分子式为C8H12O4,波谱图如下:。
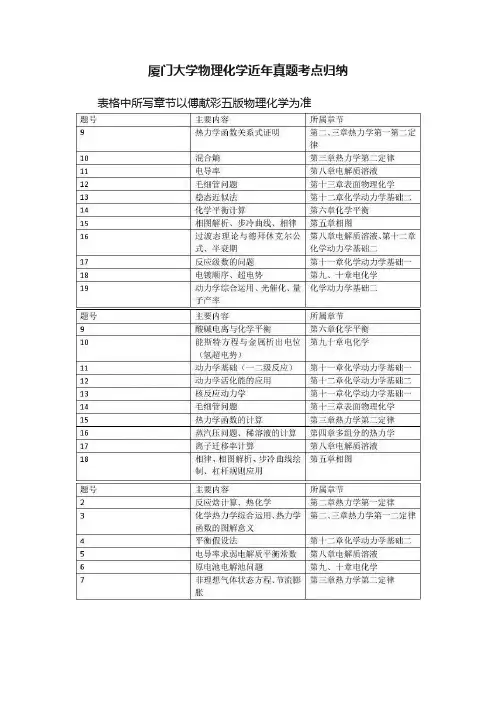
厦门大学物理化学近年真题考点归纳表格中所写章节以傅献彩五版物理化学为准
以上列了近几年厦门大学物理化学考试科目大题的主要考点。
厦门大学的物理化学不同于其他学校,他考察的题型比较单一。
一般12~16分的选择题,然后剩下的大概十道左右的大题。
首先,复习过程中一般使用傅献彩的物理化学课本,据悉厦大本校上课也是使用这本教材。
第一章气体的不用看,统计热力学一般就考一个选择,也可舍弃(明确说明只考概念),第十四章胶体近年来也只考选择,也可考虑舍弃。
厦大的物化热力学考察并非重点,但热力学函数的关系、麦克斯韦关系要会熟练推导,并要求熟悉各个函数的意义,今年来有向热化学、能源方面考察的趋势。
相图每年必考,且分值较大,考察的相图也较为常规,多进行几个典型相图的练习总结规律就行,步冷曲线也一般会要求绘制,杠杆规则的应用,并注意这部分可以和第四章结合考察。
化学平衡也几乎年年考,这部分相对简单。
电解质这一章本身就比较简单,一般是求电导率以及弱电解质平衡常数。
第九十章电化学每年必考大题,能斯特方程要熟练运用,注意超电势的问题以及电解过程中离子浓度的改变。
第十一十二章动
力学每年考察的比重比较大,常用的反应级数求解、稳态近似平衡假设的使用及其使用条件、过渡态理论中热力学函数与活化能的关系、重要的关系式的推导。
第十三章也年年考大题,开尔文公式、毛细现象,都很简单,但要注意浸润与不浸润时方程中R的正负(14年考的汞和玻璃,非常遗憾做错了)
最后,厦大物化最重要的参考书是孙世刚编写的物理化学的学习指导以及物理化学题库,历年真题很多出自上面。
要将上面的习题反复练习。


厦门大学有机化学考研真题分析一、考试题型分析:①中(英)文命名及考查化合物结构的题目常考点:环烷烃、立体异构、羧酸及羧酸衍生物、烯烃、卤代烷、烯炔、苯的取代物、胺醇、醚、酮、费歇尔结构式、酯、酰胺、胺、桥环;通常一个化合物中会涉及3个小点,注意费歇尔结构,立体异构(手性),官能团优先顺序等。
考查有机物结构的方式主要有:芳香性判断,对映体判别,光学活性有否判断,费歇尔结构的书写等。
②碱或酸性大小顺序排列:通常会涉及英文,有些甚至考查α-H酸活性的强弱。
要求对基团的吸电子效应、推电子效应比较熟悉,以及共轭效应、溶剂消应等掌握熟练。
考查的范围比较广,但应该不难做。
或化合物熔沸点高低的排序;反应速率比较或产率比较(如影响亲电、亲核反应的因素);结构稳定性比较(如酮式与烯醇式)或受热后的产物,或者物质在不同溶剂条件下的主要存在形式或酸碱水解产物、醇解产物;优势构象,紫外吸收波长的排序;③同种物质在不同条件下发生的特色反应(如烯烃、醛基),或以同一种物质为原料合成不同类型的化合物,或由不同物质经过不同的反应途径合成同一种物质,注意知识点如苯环上的定位效应。
④已知逆合成分析过程或已知反应试剂,完成合成路线;或者反应试剂、反应条件都告诉,要求写出反应产物(常考查其立体构型)。
主要考查对化学反应试剂、必要条件及产物结构等的掌握。
⑤对反应机理的认识考查,中间体的结构,电子或电子对转移方向。
能利用反应机理对反应结果作出解释或能根据反应结果推测可能的反应机理。
⑥化合物结构推测:要注意牢记掌握一些特色反应。
⑦有机物红外光谱、H-核磁共振图谱的应用,能根据图谱推测出结构式,牢记重要官能团伸缩振动峰的大致位置。
⑧实验题25分题型:单选,多选,简答,判断,填空,改错。
估计就只能多做题了。
⑨注意一些具有异曲同工之妙的方法总结,如将羰基还原成亚甲基的方法。
注意特色反应的归纳总结(如碘仿反应,与饱和亚硫酸钠的反应)。
⑩??芳香性大小排序。

目 录2011年厦门大学830高分子化学与物理考研真题2010年厦门大学830高分子化学与物理考研真题2009年厦门大学830高分子化学与物理考研真题2008年厦门大学830高分子化学与物理考研真题2007年厦门大学430高分子化学与物理考研真题2006年厦门大学347高分子化学与物理考研真题2001年厦门大学高分子化学考研真题2001年厦门大学高分子物理考研真题2011年厦门大学830高分子化学与物理考研真题厦门大学2011年招收攻读硕士学位研究生入学考试试题料目代码:830科目名高分子化学与物造招:上专业:高分子化学与物潭考生明答糊必笈任用黑(苣〉色暖水建】不希在试观(草稿)鱼」.作答;凡未附R定作答±9不予汗四、判分.一、简答:技5分》!■为计么聚芯辈二甲咬乙二命队靖体洋火时再刊透明悻!为汴义等规PMMA建不透明的?透职的聚鹿薄棘在室温…氧六环中浸泡数分薛就变为不透明,这是为ft么?.L竞聚率的定义?它有何物理意义?久什么是活性康登钩?础于聚台佬辑成为典型活姓聚合的结向因素是什么TL在焦机械施垓上,为什么PMMA的商弹区范国比J悟的大?(已MPMMA的Tg-37BK,TEw433T73K;PS的lg=373K,If=玮3顼HK)5、为什女-纶用湿法舫建,而漆轮用落融纺丝?..试就聚乙嫌坷答下列问麴(2。
分)⑴品样时的分子形态如何非晶体时分子形志又如何?(2)高M,注和低压法所得到的产品在璃构上和性能上主要差别赴什么?⑶两神支谜型聚乙搦样品,主糙和支链的怖节比相同,而支笛大小耳同,在相周条件*结晶,其培晶度是否相同,可能情讽如何?EJ为什么聚工折的内聚能密度小于弹牲体.反而作为澳.利使用丫<5)纳晶度为钮醒的聚含物,在常温下处于何神力学状态?三、要合成分子遂中有以下特征基团的聚合物.应选用娜燹甲体,牌通池何种反腐分亍世学上翱理it i Si X J01应橐台而成?导出反应式(12分)< 1 ; -NH-CO-(2)-UN CO-O-< 3)(4) -OCH j CH j -五.清就“刷性因于”概念回答下列问题.(15分)(!)下'列聚合物的刖性因干分别为:型二甲墓蛙氧烷L4-L6:聚异成二 烯1.5F.7;聚ZJR1.83:聚旅乙烯22 -24:硝化纤维禳42。

厦门大学2022年648生物化学考研真题一、填空题1、由肌肉组织释放并在肝中转变为糖的氨基酸为。
2、含修饰性RNA最多的RNA种类为。
3、血红蛋白和肌红蛋白的区别在于血红蛋白与氧的结合和解离表现为协同性,而后者无。
4、ATP易水解的原因是。
5、PCR引物的基本要求是。
6、细胞色素氧化酶所含金属是。
7、体内最广泛存在的活性最高的转氨酶是把氨基酸的氨基转给。
8、糖代谢中受ATP/ADP的浓度比以及柠檬酸、长链反式脂肪酸反馈调控的限速酶是。
9、端粒酶的RNA起作用。
10、浓度与冠心病发生呈负相关的脂蛋白是。
11、乳糖脱氢酶透析后催化活性显著降低,原因是透析导致酶的丢失。
12、Tyr苯环上-OH大约解离0.01%,PI值按极性非游离氨基酸计算,测得Tyr 的pK1=2.20,pK2=9.11,pK3=10.07,则Tyr的PI值为。
13、假尿嘧啶核苷酸的糖苷键不是通常的C-N键,而是。
14、己糖激酶以葡萄糖为底物时,Km=1/2[S],反应速度V是Vmax的。
15、临床上常用于辅助治疗婴儿惊厥和妊娠呕吐的维生素是。
二、选择题1.下列选项互为差向异构体是()A.D-葡萄糖和D-山梨糖B.D-葡萄糖和D-甘露糖C.D-半乳糖和D-甘露糖D.D-山梨糖和D-果糖2.仅含非必须氨基酸的是()A.芳香族氨基酸B.碱性氨基酸C.支链氨基酸D.酸性氨基酸3.在生理条件下,()既可作为H+的受体,也可以作为供体。
A.His的咪唑基B.Lys的ℇ-氨基C.Arg的胍基D.Cys的巯基4.下列关于酶竞争抑制性作用的叙述哪些不正确()A.抑制剂与底物结构相似B.对Vmax无影响C.增加底物可减弱抑制剂作用D.使Km值变小5.下列化合物哪个不含腺苷酸组分()A.CoAB.FMNC.FADD.NAD+6.糖酵解的速度主要取决于()A.磷酸葡萄糖变化酶B.磷酸果糖激酶C.醛缩酶D.磷酸甘油酸激酶7.α-酮戊二酸脱氢氧化生成琥珀酸,在有氧条件下的完整线粒体中,一分子α-酮戊二酸氧化生成()分子ATP。

历年厦门大学826物理化学考研真题试卷与真题答案一、考试解读:part 1 学院专业考试概况:①学院专业分析:含学院基本概况、考研专业课科目:厦大化学学院的考试情况;②科目对应专业历年录取统计表:含厦门大学826物理化学相关专业的历年录取人数与分数线情况;③历年考研真题特点:含厦门大学考研826物理化学专业课各部分的命题规律及出题风格。
part 2 历年题型分析及对应解题技巧:根据厦门大学826物理化学各专业考试科目的考试题型(选择题、简答题、论述题、材料题等),分析对应各类型题目的具体解题技巧,帮助考生提高针对性,提升答题效率,充分把握关键得分点。
part 3 2018真题分析:最新真题是厦门大学考研中最为珍贵的参考资料,针对最新一年的厦门大学考研真题试卷展开深入剖析,更多真题可在群贤厦大考研网查看;帮助考生有的放矢,把握真题所考察的最新动向与考试侧重点,以便做好更具针对性的复习准备工作。
part 4 2019考试展望:根据上述相关知识点及真题试卷的针对性分析,提高2019考生的备考与应试前瞻性,令考生心中有数,直抵厦门大学考研的核心要旨。
part 5 厦门大学考试大纲:①复习教材罗列(官方指定或重点推荐+拓展书目):不放过任何一个课内、课外知识点。
②官方指定或重点教材的大纲解读:官方没有考试大纲,高分学长学姐为你详细梳理。
③拓展书目说明及复习策略:专业课高分,需要的不仅是参透指定教材的基本功,还应加强课外延展与提升。
part 6 专业课高分备考策略:①考研前期的准备;②复习备考期间的准备与注意事项;③考场注意事项。
part 7 章节考点分布表:罗列厦门大学化学专业的专业课试卷中,近年试卷考点分布的具体情况,方便考生知晓厦门大学考研专业课试卷的侧重点与知识点分布,有助于考生更具针对性地复习、强化,快准狠地把握高分阵地!二、厦门大学历年考研真题与答案详解:包括了2002-2018年考研真题试卷,并配备2010-2018年考研真题答案详解,本部分包括了(解题思路、答案详解)两方面内容。
厦门大学物理化学考研试题分析研究一、历年考题所考查各章节的分数分布情况:气体0热力学第一定律 6 热力学第二定律 6 多组分系统热力学 5 相平衡 18化学平衡15 统计热力学基础 4 电化学 34界面现象10化学动力学38胶体化学 2其他7二、2005-2011期间各章节所考查知识点的统计:⑴气体:范德华方程⑵热力学第一定律:绝热可逆膨胀过程、节流膨胀过程,对系统温度的影响;两者的P-T图的区别及在冷冻机的制冷过程中是如何应用的。
由生成焓求反应热;热量计算的综合知识运用;若已知臭氧催化分解主要是在冰晶或固体水合物表面进行,试根据有关热力学原理说明为什么南极上的臭氧层空洞较其他地方多。
节流膨胀过程中的转换温度;当温度与转换温度满足不同关系时,对节流膨胀过程温差正负的影响。
相变焓、相变过程中的熵变;两者能否应用于过程方向的判断。
三种获得低温的方法,比较优缺点;对确定过程的热力学函数变判断;热力学函数之间的计算;卡诺热机的应用-燃烧热转化为有用功的计算;⑶热力学第二定律:理想气体PVT过程焓变的计算,标准摩尔生成吉布斯自由能,标准摩尔生成焓变计算。
相变焓;等效过程设计;相变过程中的热力学函变;吉布斯判据;亥姆霍兹判据。
标准摩尔反应吉布斯自由能变与温度的关系图,及与反应方程式存在的对应关系;标准摩尔反应吉布斯自由能的计算;标准摩尔生成焓变、熵变的求法。
恒温条件下,可逆过程中系统对环境做最大功;最大功与吸收热的关系;体系经过一个不可逆过程对体系、环境熵的影响。
TdS=CvdT+T[δp/δT]dV;试问两物质应以什么比例,能获得最大混合熵;标准摩尔生成吉布斯自由能的求法;标准摩尔反应焓变的求法。
水在真空容器中汽化的热力学函变;热力学函变在生物化学中的应用。
对反应方向的判断;确定过程的热力学函数变计算。
⑷多组分系统热力学:稀溶液的依数性;活度,真实液态化合物的性质。
化学势;理想液体混合物;物质的量分数、质量分数与饱和蒸汽压的关系;拉乌尔定律;蒸气是理想气体与否,对溶剂标准吉布斯自由能变的影响。
用调节化学势的方法定性描述稀溶液的三种依数性,可借助图形。
活度系数;蒸汽压下降;溶剂活度系数与稀溶液依数性间的关系;亨利常数的求法,已知PH。
⑸相平衡:二组分真实液态混合物的气液平衡,等压相图中各相区的相态、自由度,绘制步冷曲线,指出步冷曲线上各段的自由度,水合物能否和水溶液及冰共存需满足的条件。
各区的相态、自由度;绘制步冷曲线,并指出步冷曲线上各段的自由度;相图的应用。
绘制合金相图,绘制步冷曲线,指出各段的相变情况,计算在其中某一段时液相固相的物质的量之比。
系统组分数;T、p 时,系统中各相平衡共存;系统组分数、相数、自由度数的求法;三相线上的相平衡关系式;液态混合物冷却时能得到多少某种纯组分。
各相区稳定时存在的相;绘三相线;三相线上的相平衡及相平衡间的关系;绘步冷曲线,注明各阶段的相变化和自由度。
绘制二元相图;指出各平衡区的相态;绘制步冷曲线,并指出各段路径的相变化。
独立组分数的计算;自由度的判断;相图的应用,对某确定状态下,各组分间的物质的量之比;相图的应用,如利用相图提纯物质。
⑹化学平衡:压力平衡常数,基于浓度的标准平衡常数,温度、压力对化学反应平衡的影响,温度、压力对最终平衡状态的决定关系,反应平衡常数计算。
转化率;反应物产物浓度与热力学函数间(H、G)的关系式;温度、压强及惰性气体对反应平衡的影响。
连串反应达平衡时,中间物质的浓度比;反应平衡常数与焓变、熵变的关系。
压力对化学反应平衡的影响;压力反应平衡常数。
化学反应的摩尔焓变、摩尔熵变与化学反应方程式、平衡状态的关系;压力反应平衡常数的计算方法。
平衡温度;分解温度;稳定性判断。
⑺统计热力学基础:定域粒子体系和离域粒子体系的热力学函数与分子配分函数,平动熵和转动熵(比较相同温度和压力时CO和N2),配分函数。
振动、转动、平动能级间隔大小比较;非理想气体的性质,全同粒子体系、相依粒子体系,独立可别粒子体系、定域可别粒子体系。
配分函数概念的理解认识。
摩尔平动熵最大的气体。
离域子系统;最低平动能级和相邻能级的间隔;N2和CO 的摩尔熵比较。
基本振动频率;振动特征温度。
⑻电化学:分配系数、标准电极电势的定义,电动势与温度的关系,电解质浓度与电极电势的关系及与平衡常数的关系,金属在阴极析出的顺序,及析出金属时对应的电压,某种金属析出或某特定现象发生时,电解液中某离子的浓度的确定;存在超电势时对电极反应的影响。
电解质溶液的性质、浓度与溶液电阻的关系,由离子摩尔电导率求相关非电解质水溶液的解离常数的方法。
电极电势与电解质浓度间的关系;摩尔电导率的计算;摩尔电导率、电解质溶液浓度、溶液电阻三者间的关系;原电池和电解池的电极极化曲线),电阻超电势,电极极化的主要形式;如何降低极化引起的超电势。
电池反应达平衡时电池的电动势;F;电池可逆放电产生的热效应;摩尔电导率,电阻,解离常数,解离度,电解质的浓度;保证金属沉淀和某阳离子氧化所需施加的最小电解电势;电极反应式的书写;阴阳极电极材料对电极反应的影响。
电动势不能用伏特计测量而要用对消法的原因;离子活度积与原电池电势间的关系;在电解池中阴阳极析出或溶解的顺序,并需考虑超电势对它们可能产生的影响;正负离子迁移数的求法;根据离子浓度改变,求从系统析出的物质的组成。
原电池的标准电动势与电极电势的关系;如何设计原电池,来通过测定电动势,求难溶盐的活度积;用极限摩尔电导率讨论电解质溶液电导能力的原因;电极电势与溶液离子浓度关系,及与溶液PH间的关系。
电导、电导率、摩尔电导率三者之间有何联系,各自的单位;电极反应书写;超电势、分解电压;超电势对电极反应的影响。
离子的摩尔电导率;阴阳离子迁移数;电极反应式、电池反应式的书写;电化学与热力学相联系的部分-燃料电池;电池的标准电动势的求解方法;分解电压;电解液电阻、电流密度、超电势与外加电压间存在的关系。
⑼界面现象:人工降雨的原理,微小液滴的饱和蒸汽压,解释为什么会存在湿度大而不下雨的状况。
液固界面,表面活性物质。
界面张力。
相同温度下,水和冰表面张力的比较;弯曲液面的附加压力;界面张力;毛细管内的水向毛细管的那一段移动。
朗缪尔吸附等温式(基于的假设);气相中有相邻气泡将发生的变化。
弯曲液面的附加压力;状态改变时,毛细管中水的行为变化;若毛细管的内壁涂一层石蜡,对液面会产生什么影响。
若毛细管中间有一扩大部分,会对液面产生什么影响。
气体在固体表面发生等温吸附过程,熵如何变化;在毛细管内装入润湿性液体,在毛细管一端加热,则管内液体将如何变化;若已知溶液表面张力与活度的关系,则溶液中溶质的表面过剩可能会与活度存在怎样的关系;利用毛细现象设计永动机的可行性。
朗缪尔吸附等温式;弯曲液面的附加压力;三种常见的亚稳态,“气泡室”的亚稳态原理。
溶液表面张力与活度的关系;溶质的表面过剩与活度的关系;活化能;温度对链式化学反应的影响;表面张力,微小液滴的饱和蒸汽压公式、计算方法。
⑽化学动力学:单分子反应lindeman理论;速率方程的确定(微分形式);表观活化能,活化能与反应速率间的关系;表观活化能、标准摩尔反应焓及反应速率平衡常数三者之间可能存在何种关系;多相催化反应,催化反应的速率方程式;aA,速率常数,反应速率与温度、压强的关系。
反应速率方程,中间产物浓度最大的时刻;提前因子与热力学函数间的关系;反应级数;速率常数与温度的关系;活化能值的求法;达到预定反应状态所需时间;半衰期、阿氏活化能与反应速率常数的关系;稳态法推导反应速率表达式;确定反应速率方程所需满足的条件。
ZM,双分子反应速率常数;催化剂(绝缘体催化剂、酶催化剂、金属催化剂、广义酸碱催化剂)上的活性中心;反应速率常数的应用;已知反应速率常数时,求中间物质浓度达最大时的时间,及此时中间物质的最大浓度。
半衰期,反应进行到某一条件所需时间;根据反应机理和反应速率常数写出总的反应速率方程;确定反应级数所要求的反应速率常数间要满足的关系;表观速率常数与某物质浓度的关系确定;阿伦尼乌斯方程,及压强会对方程产生的影响。
计算某一时刻不能核素间的物质的量比;衰变过程放出的热量。
摩尔键焓、活化能;对连串反应,稳态渐进法成立的条件,在此条件下的各物质浓度-时间曲线;压力平衡常数的求法;德拜休克尔公式,与盐效应公式的联系;半衰期的应用;反应级数的确定;精确计算反应级数应如何设计实验;已知解离常数和反应级数,确定反应至某一阶段的时间;反应历程的理解;反应速率的求解;用热力学有关公式说明气体制冷的原理;用温-熵图定性表示绝热去磁制冷原理。
单原子分子间发生化学反应的机理;活化能、临界能、势垒间存在的关系;反应级数、活化能、速率常数与反应活化熵存在的关系;半衰期的应用考查;反应速率方程的推导及深刻理解;对反应过程具备基本的合理性判断。
反应的量子产率计算;光化学反应;平行反应反应速率的求法;化学反应速率方程中系数的求解;反应速率方程对反应机理的反应;催化剂表面上的吸附;设计确定反应速率方程的实验步骤;旋光度对反应速率方程的影响;在给定条件下反应级数的求解;半衰期与活化能的关系;Michaelis机理,稳态渐进法。
⑾胶体化学:MgSO4和Na2SO4聚沉能力比较;对临界胶束浓度概念的理解;胶体结构式;胶团结构式;天空呈蔚蓝色和鲜红色的原因;胶粒带电性判断;⑿其他:根据一些键能及标准摩尔反应焓计算某物质的共振能。
分离提纯时,如何防止或减少物质的聚合作用;如何根据温度、压力和化学方程式来估算反应是否可能发生。
三维平动子的平动能能级的简并度;永动机工作的原理和其不可能造成的原因。
残余熵;电离平衡;溶解平衡;气液界面;蒸发热;活化能;相对扩散速率。
已知能级差,又知基态是二重简并,则第一激发态与基态上的原子数之比。
受激物的磷光光谱产生的原因;对公式的掌握理解,总结形式相同的公式。
对公式、符号的考查。
三、2001-2004老题型中对各章知识点的考查:⑴气体:压缩因子在等温下随压力的变化;超临界气体应用的要求。
可逆过程、恒压过程、恒温过程中的热力学函变。
摩尔单原子理想气体状态变化过程中的热力学函变计算。
⑵热力学第一定律:气体节流膨胀过程中的致冷致热效应判断;如何利用相图求解相变过程中的热力学函变。
热力学函数之间的运算,应熟悉它们之间的关系式,并掌握它们的应用条件;物质在特定热力学状态下的稳定性判断及能够平衡共存的温度;相变过程。
相变过程的热力学函变。
⑶热力学第二定律:热力学函数之间的运算,应熟悉它们之间的关系式,并掌握它们的应用条件;物质在特定热力学状态下的稳定性判断及能够平衡共存的温度。
判断过程方向可以用哪些热力学函数,判据式的依据;恒温过程。