氨基酸种类文档19页word
- 格式:doc
- 大小:74.50 KB
- 文档页数:18

人体所有氨基酸
人体中有20种氨基酸,它们是蛋白质的构建块。
这些氨基酸可以分为两类:必需氨基酸和非必需氨基酸。
必需氨基酸(9种):人体无法自行合成,必须通过食物摄取。
1.亮氨酸(Leucine)
2.缬氨酸(Isoleucine)
3.苯丙氨酸(Phenylalanine)
4.赖氨酸(Lysine)
5.色氨酸(Tryptophan)
6.甲硫氨酸(Methionine)
7.苏氨酸(Threonine)
8.组氨酸(Histidine)
9.缬氨酸(Valine)
非必需氨基酸(11种):人体可以自行合成。
10.丙氨酸(Alanine)
11.马尿酸(Asparagine)
12.门冬氨酸(Aspartic acid)
13.半胱氨酸(Cysteine)
14.谷氨酸(Glutamic acid)
15.谷氨醋酸(Glutamine)
16.甘氨酸(Glycine)
17.缬氨酸(Proline)
18.丝氨酸(Serine)
19.胱氨酸(Tyrosine)
20.脯氨酸(Arginine)
这些氨基酸通过蛋白质合成过程,组合成各种不同类型的蛋白质,对于维持人体正常的生理功能至关重要。

氨基酸的种类氨基酸是生命体内重要的基本组成单元,它们在蛋白质合成中起着关键的作用。
据统计,目前已经发现了20种常见的氨基酸,它们在生物体内具有各自的特性和功能。
本文将介绍这20种氨基酸的种类及其在生物体内的作用。
1. 构成氨基酸构成氨基酸是指在其分子结构中含有氨基(NH2)和羧基(COOH)。
这两个基团使得氨基酸具有亲水性,使得它们能够参与蛋白质的合成和稳定。
2. 20种常见氨基酸的分类根据它们的结构和性质,20种常见氨基酸可以分为以下几类:2.1 构成氨基酸构成氨基酸是指其侧链(R基团)不具有特殊功能的氨基酸,这类氨基酸包括丝氨酸(Ser)、甘氨酸(Gly)、丙氨酸(Ala)等。
它们的侧链较小,相对不容易改变蛋白质的结构和性质。
2.2 极性氨基酸极性氨基酸是指其侧链中含有极性基团的氨基酸,这类氨基酸包括谷氨酸(Glu)、赖氨酸(Lys)、天冬酰胺酸(Asn)等。
它们能够与水分子相互作用,因此在蛋白质的折叠和稳定中发挥重要作用。
2.3 疏水氨基酸疏水氨基酸是指其侧链中含有疏水基团的氨基酸,这类氨基酸包括亮氨酸(Leu)、异亮氨酸(Ile)、缬氨酸(Val)等。
它们能够形成疏水相互作用,在蛋白质的结构和功能中起到重要的作用。
2.4 硫氨基酸硫氨基酸是指其侧链中含有硫原子的氨基酸,这类氨基酸包括半胱氨酸(Cys)、甲硫氨酸(Met)等。
硫氨基酸在生物体内起到重要的作用,例如半胱氨酸能够形成二硫键,对蛋白质的结构和功能具有重要影响。
3. 氨基酸在生物体内的作用氨基酸作为蛋白质的构成单元,在生物体内扮演着重要的角色。
它们不仅能够合成新的蛋白质,还能够参与能量代谢、信号传导和抗氧化等生物过程。
此外,氨基酸还能够通过转化为其他生物活性物质来发挥作用。
例如,赖氨酸可以转化为精氨酸,对细胞分裂和生长发育具有影响;色氨酸可以转化为血清素,对情绪和睡眠产生影响。
结论20种常见的氨基酸在生物体内具有各自独特的结构和功能。

氨基酸的分类及功能氨基酸是构成蛋白质的基本单元,大约有20种天然氨基酸。
它们可以按照聚合方式和侧链性质进行分类。
按照聚合方式,氨基酸可以分为两类:必需氨基酸和非必需氨基酸。
必需氨基酸是人体无法合成的,必须通过饮食摄入。
共有9种必需氨基酸,包括异亮氨酸、亮氨酸、苏氨酸、色氨酸、甲硫氨酸、苏氨酸、精氨酸、缬氨酸和苯丙氨酸。
非必需氨基酸是人体可以合成的,一般来自我们的饮食,共有11种非必需氨基酸,包括丙氨酸、谷氨酸、甘氨酸、丝氨酸、组氨酸、缬氨酸、半胱氨酸、脯氨酸、酪氨酸、天冬氨酸和赖氨酸。
按照氨基酸的侧链性质,可以将氨基酸分为非极性氨基酸、极性氨基酸和带电氨基酸。
非极性氨基酸的侧链是由碳和氢组成的,不带电荷。
这类氨基酸包括甘氨酸、丙氨酸、丙基甘氨酸、异亮氨酸、亮氨酸、缬氨酸、亮缬氨酸、苏氨酸和苏缬氨酸。
极性氨基酸的侧链含有带有氧(-OH)或氨基(-NH2)的极性基团。
这类氨基酸包括苏氨酸、丝氨酸、酪氨酸、脯氨酸和色氨酸。
带电氨基酸的侧链含有带正电荷或负电荷的基团。
这类氨基酸包括天冬氨酸、谷氨酸、精氨酸、组氨酸和半胱氨酸。
每一种氨基酸都有其独特的功能和作用。
以下是一些常见氨基酸的功能:1.色氨酸:色氨酸是血清素的前体,它在神经系统中起着调节情绪、睡眠和食欲的作用。
2.蛋氨酸和胱氨酸:蛋氨酸和胱氨酸是硫氨酸的前体,它们参与胶原蛋白的结构和稳定,维持皮肤、骨骼和关节的健康。
3.谷氨酸和天冬氨酸:谷氨酸和天冬氨酸是神经递质的前体,它们在神经系统中传递兴奋信号,参与学习、注意力和记忆的过程。
4.丙氨酸和丝氨酸:丙氨酸和丝氨酸是脱氧核糖核酸(DNA)和核糖核酸(RNA)的构建单元,它们对于细胞增长和分裂至关重要。
5.缬氨酸和苏氨酸:缬氨酸和苏氨酸是肌肉合成和修复所需的重要氨基酸,对于运动员和健身者来说尤为重要。
6.赖氨酸和精氨酸:赖氨酸和精氨酸参与氨基酸代谢和尿素循环,帮助排除体内代谢废物和毒素。
总结起来,不同氨基酸在人体中具有各自独特的功能和作用,包括参与蛋白质合成、神经递质的合成、细胞生长和分裂、肌肉修复和合成等。

人体中氨基酸种类
人体中氨基酸的种类繁多,包括二十多种。
其中,根据人体是否能够自行合成,氨基酸分为必需氨基酸和非必需氨基酸两类。
必需氨基酸是指人体不能合成或者合成速度不够人体需要的氨基酸,一般需要从食物或药物进行补充,包括亮氨酸、异亮氨酸、缬氨酸、苏氨酸、色氨酸、苯丙氨酸、蛋氨酸、赖氨酸等。
非必需氨基酸是指人体可以自行合成,不需要依靠食物或药物补充的氨基酸,包括谷氨酸、丙氨酸、甘氨酸、天门冬氨酸、胱氨酸、脯氨酸、丝氨酸和酪氨酸等。
除了上述常见的氨基酸外,人体中也常见于半胱氨酸、甘氨酸、色氨酸等多种氨基酸。

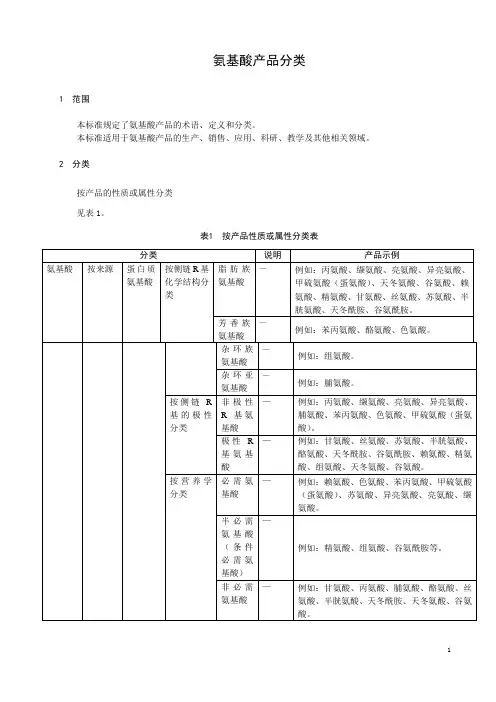
20种常见氨基酸的名称和结构式中文名称英文缩写结构式缩写非极性氨基酸甘氨酸(?-氨基乙酸)甘Gly GGlycine丙氨酸(?-氨基丙酸)丙Ala AAlanine亮氨酸(?-甲基-?-氨基戊亮Leu L酸)*Leucine异亮氨酸(?-甲基-?-氨基戊异亮Ile I酸)*Isoleucine缬氨酸(?-甲基-?-氨基丁缬Val V酸)*Valine脯氨酸(?-四氢吡咯甲酸)脯Pro PProline苯丙氨酸(?-苯基-?-氨基丙苯丙Phe F酸)*Phenylalanine蛋(甲硫)氨酸(?-氨基-?-甲蛋Met M 硫基戊酸) *Methionine色氨酸[?-氨基-?-(3-吲哚色Trp W 基)丙酸]*Tryptophan不带电荷的极性氨基酸丝氨酸(?-氨基-?-羟基丙酸)丝Ser S Serine谷氨酰胺(?-氨基戊酰胺酸)谷胺Gln Q Glutamine苏氨酸(?-氨基-?-羟基丁苏Thr T 酸)*Threonine半胱氨酸(?-氨基-?-巯基丙半胱Cys C 酸)Cysteine天冬酰胺(?-氨基丁酰胺酸)天胺Asn N Asparagine酪氨酸(?-氨基-?-对羟苯基酪Tyr Y 丙酸)Tyrosine酸性氨基酸(带负电荷)天冬氨酸(?-氨基丁二酸)天Asp D Aspartic acid谷氨酸(?-氨基戊二酸)谷Glu E Glutamic acid碱性氨基酸(带正电荷)赖氨酸(?,?-二氨基己酸)*赖Lys K Lysine精氨酸(?-氨基-?-胍基戊酸)精Arg R Arginine组氨酸[?-氨基-?-(4-咪唑组His H 基)丙酸]Histidine* 为必需氨基酸。

氨基酸种类结构
氨基酸是构成蛋白质的基本单位,临床上种类比较多,主要包括赖氨酸、色氨酸、蛋氨酸等。
1、赖氨酸:为碱性必需氨基酸,由于谷物食品中的赖氨酸含量甚低,且在加工过程中易被破坏而缺乏,故称为第一限制性氨基酸。
赖氨酸主要存在于动物性食物和豆类中,谷类食物中赖氨酸含量很低,在促进人体生长发育、增强机体免疫力、抗病毒、促进脂肪氧化、缓解焦虑情绪等方面具有积极的营养学意义。
2、色氨酸:是植物体内生长素生物合成重要的前体物质,其结构与IAA相似,在高等植物中普遍存在,也是人体中重要的神经递质-5-羟色胺的前体,可用于妊娠期妇女营养补充剂和乳幼儿的特殊奶粉,用于烟酸缺乏症,可作为安神药,可调节精神节律,改善睡眠。
3、蛋氨酸:是含硫必需氨基酸,与生物体内各种含硫化合物的代谢密切相关。
蛋氨酸可利用其所带的甲基,对有毒物或药物进行甲基化起到解毒的作用,可用于防治慢性或急性肝炎、肝硬化等肝脏疾病。
此外常见的氨基酸还包括组氨酸、亮氨酸、异亮氨酸、丙氨酸、谷氨酸等,均具有重要的临床意义。

各种物质详细介绍1、精氨酸营养成:精氨酸是一种α氨基酸,亦是20种普遍的自然氨基酸之一。
天然精氨酸为L-型,从水中结晶的产物含两分子结晶水,在乙醇中结晶的是无水物。
由于胍基的存在,精氨酸呈碱性,易与酸反应形成盐。
精氨酸是由瓜氨酸透过胞质酵素精氨基琥珀酸合成酶(ASS)及精氨基琥珀酸裂解酶(ASL)合成。
这个过程所要求较大的能量,这是因为要将每一个分子合成精氨基需要将三磷酸腺苷(A TP)水解成一磷酸腺苷(AMP),即两个三磷酸腺苷当量。
作用:1、细胞分裂2、伤口复原3、排出氨4、免疫功能5、分泌激素副作用:精氨酸是一种可以在体内自然产生的必需氨基酸。
通过营养补充剂摄入有可能带来一定副作用,如导致呼吸急促,瘙痒,湿疹,恶心和胃痛,血液化学品改变等过敏反应等。
此外,存在肝脏和肾脏疾病的人也容易出现不良反应。
但大多数人对精氨酸保健品反应良好,只有少数人在持续使用几个月后会出现明显副作用。
过敏反应是最常见的精氨酸副作用。
尽管任何形式的营养品都有可能出现这类问题,但注射液形式最常见。
如果发现过敏症状,应立即停止使用这种保健品。
左旋精氨酸作为一种常见的氨基酸保健品形式还可能引起其他一些副作用,如恶心,腹部痉挛,胃痛和大便增加等。
哮喘患者如果吸入还有可能引起更严重副作用。
有些人甚至还会痛风发作。
一些人可能在注射左旋精氨酸时会出现面部潮红,头痛和腰痛等严重症状。
有些人甚至还会出现不宁腿和静脉刺激,甚至造成注射点周围组织死亡。
肝脏或肾脏有疾病的人可能出现的精氨酸副作用更严重。
因此,应该在医生监督下谨慎使用这类产品。
存在糖尿病或血糖问题的患者同样容易在服用精氨酸后出现不良反应,因为这种营养品会导致一些人的血糖水平提高。
如果正在服用控制血糖药物,就会带来危险。
如果发现精氨酸的副作用很严重或不断恶化,最好是马上看医生。
总之,任何人都应该遵照使用说明补充这种营养品,尽量避免不必要的副作用。
2、瓜氨酸营养成分:是一种α氨基酸,名字是由首先抽取出瓜氨酸的西瓜而来。

氨基酸表氨基酸是构成蛋白质的基本单位,它们由氨基基团(NH2)、羧基(COOH)、氢原子(H)和一个特定的侧链组成。
共有20种常见的氨基酸,它们在侧链的结构和性质上有所差异,因此在生物体内发挥不同的功能。
下面是常见的氨基酸及其侧链的简要介绍:1. 甘氨酸(Glycine,Gly):侧链只有一个氢原子,是最简单的氨基酸,具有较高的亲水性。
2. 丝氨酸(Serine,Ser):侧链含有一个羟基(-OH),在蛋白质的酶活性和磷酸化中起重要作用。
3. 苏氨酸(Threonine,Thr):侧链含有一个羟基(-OH)和一个甲基(-CH3),在蛋白质的磷酸化和甘油磷酸酯代谢中起作用。
4. 缬氨酸(Valine,Val):侧链为一支链状结构,属于疏水性氨基酸。
5. 亮氨酸(Leucine,Leu):侧链为一支链状结构,属于疏水性氨基酸,对于蛋白质的结构和功能具有重要影响。
6. 异亮氨酸(Isoleucine,Ile):侧链为一支链状结构,属于疏水性氨基酸,对于蛋白质的结构和功能具有重要影响。
7. 苏氨酸(Methionine,Met):侧链含有一个硫原子,是蛋白质合成的起始氨基酸。
8. 苯丙氨酸(Phenylalanine,Phe):侧链为苯环结构,属于芳香性氨基酸。
9. 色氨酸(Tryptophan,Trp):侧链含有一个吲哚环结构。
10. 酪氨酸(Tyrosine,Tyr):侧链含有一个苯环和一个羟基(-OH)。
11. 苏氨酸(Cysteine,Cys):侧链含有一个巯基(-SH),对于蛋白质的结构和功能具有重要影响。
12. 苏氨酸(Asparagine,Asn):侧链含有一个酰胺基团(-CONH2)。
13. 谷氨酸(Glutamic acid,Glu):侧链含有一个羧基(-COOH),在神经系统中起重要作用。
14. 苏氨酸(Glutamine,Gln):侧链含有一个酰胺基团(-CONH2),在蛋白质合成和氨基酸代谢中起作用。

氨基酸分类4、构成生物体蛋白质的氨基酸约有20种,其中有12种非必需氨基酸,8种必需氨基酸,必需氨基酸必须从食物中获得,人体不能合成。
婴儿必需氨基酸有9种,还包括组氨酸。
5、1、脂肪族氨基酸:丙、缬、亮、异亮、蛋、天冬、谷、赖、精、甘、丝、苏、半胱、天冬酰胺、谷氨酰胺;6、2、芳香族氨基酸:苯丙氨酸、酪氨酸;7、3、杂环族氨基酸:组氨酸、色氨酸;8、杂环亚氨基酸:脯氨酸。
氨基酸介绍蛋氨酸蛋氨酸是含硫必需氨基酸,与生物体内各种含硫化合物的代谢密切相关。
当缺乏蛋氨酸时,会引起食欲减退、生长减缓或不增加体重、肾脏肿大和肝脏铁堆积等现象,最后导致肝坏死或纤维化。
蛋氨酸还可利用其所带的甲基,对有毒物或药物进行甲基化而起到解毒的作用。
因此,蛋氨酸可用于防治慢性或急性肝炎、肝硬化等肝脏疾病,也可用于缓解砷、三氯甲烷、四氯化碳、苯、吡啶和喹啉等有害物质的毒性反应。
(3)色氨酸色氨酸可转化生成人体大脑中的一种重要神经传递物质――5–羟色胺,而5–羟色胺有中和肾上腺素与去甲肾上腺素的作用,并可改善睡眠的持续时间。
当动物大脑中的5–羟色胺含量降低时,表现出异常的行为,出现神经错乱的幻觉以及失眠等。
此外,5–羟色胺有很强的血管收缩作用,可存在于许多组织,包括血小板和肠粘膜细胞中,受伤后的机体会通过释放5–羟色胺来止血。
医药上常将色氨酸用作抗闷剂、抗痉挛剂、胃分泌调节剂、胃粘膜保护剂和强抗昏迷剂等。
(4)缬氨酸、亮氨酸、异亮氨酸和苏氨酸缬氨酸、亮氨酸与异亮氨酸均属支链氨基酸,同时都是必需氨基酸。
当缬氨酸不足时,大鼠中枢神经系统功能会发生紊乱,共济失调而出现四肢震颤。
通过解剖切片脑组织,发现有红核细胞变性现象,晚期肝硬化病人因肝功能损害,易形成高胰岛素血症,致使血中支链氨基酸减少,支链氨基酸和芳香族氨基酸的比值由正常人的3.0~3.5降至1.0~1.5,故常用缬氨酸等支链氨基酸的注射液治疗肝功能衰竭等疾病。
此外,它也可作为加快创伤愈合的治疗剂。
20种必须氨基酸如果是讨论20种常见氨基酸(包括必需氨基酸和非必需氨基酸),如下:一、结构通式氨基酸的结构通式为:一个中心碳原子连接着一个氨基(-NH₂)、一个羧基(-COOH)、一个氢原子(-H)和一个侧链基团(R基)。
不同氨基酸的R基不同,这是区分不同氨基酸的关键结构。
二、20种常见氨基酸分类及简介1. 必需氨基酸(8种)- 赖氨酸- 符号:Lys。
- 特点:在蛋白质的结构和功能中起着重要作用,例如在胶原蛋白的合成中是必需的。
缺乏赖氨酸可能影响生长发育、导致贫血等。
- 色氨酸- 符号:Trp。
- 特点:是合成神经递质血清素(5 - 羟色胺)的前体物质,对调节情绪、睡眠等生理功能有重要意义。
- 苯丙氨酸- 符号:Phe。
- 特点:在体内可转变为酪氨酸,参与甲状腺素、肾上腺素等激素的合成。
苯丙氨酸代谢异常会导致苯丙酮尿症。
- 甲硫氨酸(蛋氨酸)- 符号:Met。
- 特点:是体内甲基的供体,参与多种生物分子的甲基化修饰,对蛋白质的合成起始有重要意义。
- 苏氨酸- 符号:Thr。
- 特点:在维持机体蛋白质平衡、促进生长发育方面有重要作用。
- 异亮氨酸- 符号:Ile。
- 特点:与亮氨酸和缬氨酸一起,在调节血糖、提供能量等方面发挥重要作用,尤其是在肌肉代谢中。
- 亮氨酸- 符号:Leu。
- 特点:是一种支链氨基酸,能够刺激肌肉蛋白质合成,在运动营养方面有重要意义。
- 缬氨酸- 符号:Val。
- 特点:同样是支链氨基酸,对维持肌肉协调、调节血糖水平等有作用。
2. 非必需氨基酸(12种)- 丙氨酸- 符号:Ala。
- 特点:可通过糖异生作用转化为葡萄糖,为机体提供能量。
- 精氨酸- 符号:Arg。
- 特点:在幼年动物体内为必需氨基酸,在尿素循环中起重要作用,同时也是一种重要的免疫调节因子。
- 天冬酰胺- 符号:Asn。
- 特点:对神经细胞的功能维持有一定作用。
- 天冬氨酸- 符号:Asp。
- 特点:参与三羧酸循环,在能量代谢和氨基酸代谢的相互转换中起重要作用。
氨基酸(化学式为RCHNH2COOH),蛋白质水解后的小分子,氨基酸种类繁多,共有20种,大概可以分为必需氨基酸和非必需氨基酸,其中非必需氨基酸中也有更细致的划分,氨基酸是构成蛋白质的最基本的分子形式,所以说氨基酸对于生物体来说是组成的根本。
一必需氨基酸
必需氨基酸(essential amino acid)指人体(或其它脊椎动物)不能合成或合成:必需氨基酸速度远不适应机体的需要,必需由食物蛋白供给,这些氨基酸称为必需氨基酸。
成人必需氨基酸的需要量约为蛋白质需要量的20%~37%。
共有8 种其作用分别是:赖氨酸:促进大脑发育,是肝及胆的组成成分,能促进脂肪代谢,调节松果腺、乳腺、黄体及卵巢,防止细胞退化;色氨酸:促进胃液及胰液的产生;苯丙氨酸:参与消除肾及膀胱功能的损耗;蛋氨酸(甲硫氨酸) :参与组成血红蛋白、组织与血清,有促进脾脏、胰脏及淋巴的功能;苏氨酸:有转变某些氨基酸达到平衡的功能;异亮氨酸:参与胸腺、脾脏及脑下腺的调节以及代谢;脑下腺属总司令部作用于甲状腺、性腺;亮氨酸:作用平衡异亮氨酸;缬氨酸:作用于黄体、乳腺及卵巢。
二半必需氨基酸和条件必需氨基酸
精氨酸:精氨酸与脱氧胆酸制成的复合制剂(明诺芬)是主治梅毒、病毒性黄疸等病的有效药物。
组氨酸:可作为生化试剂和药剂,还可用于治疗心脏病,贫
血,风湿性关节炎等的药物。
20种常见氨基酸的名称和结构式名 称中文 英文缩写 结构式等电点丙氨酸(-氨基丙酸) Ala nine缬氨酸丙( -甲基--氨基丁酸)*Vali ne亮氨酸缬( -甲基--氨基戊酸)* Leuc ine异亮氨酸亮( -甲基--氨基戊酸) * Isoleucine苯丙氨酸异亮( -苯基--氨基丙酸) *Phe ny lala nine色氨酸苯丙[ -氨基--(3-吲哚基)丙酸]*Tryptopha n蛋(甲硫)氨酸 色( -氨基--甲硫基戊 蛋酸) *Methio nine 脯氨酸(甲硫)(-四氢吡咯甲酸) Proli ne 脯非极性氨基酸AlaVaiLeuIlePheTrpMetProCH 「CH — COO_NH 3(CH92CH — CHCOO -+NH 3(CH 3)2CHCH 2- CHCOO+NH 3CH 3CH 2CH — CHCOOCH3+ NH 3-LCH 厂 gHCOO+NH 3HI CH 2CH — COO" +NH 3CH 3SCH 2CHr CHCOO4NH 3(-氨基乙酸) Glyci ne 甘GlyGCH 厂 COO 'NH 3丝氨酸(-氨基--羟基丙酸) 丝SerSHOCH 厂 CHCOO Seri ne+ NH 3非电离的极性氨基酸 甘氨酸苏氨酸(-氨基--羟基丁酸)*Thre onine半胱氨酸(-氨基--巯基丙酸)Cystei ne酪氨酸(-氨基--对羟苯基丙酸)Tyros ine天冬酰胺(-氨基丁酰胺酸)Asparagi ne谷氨酰胺(-氨基戊酰胺酸)Glutami ne苏Thr TCH3CH— CHCOO —1 +OH +NH3半胱Cys CHSCH2—CHCOO-NH3酪Tyr YHO—' CHr CHCOO'十NH3O天胺Asn N H2N- C-CH2CHCOO _NH3O谷胺Gln Q H2N— c—CH2CH2CHCOO -NH3碱性氨基酸组氨酸[-氨基--(4-咪唑基)丙酸]Histidi ne赖氨酸(,-二氨基己酸)* Lys ine精氨酸(-氨基--胍基戊酸)Argi nine 组His HN --------- C H 2CH — COO -"N 「NH31H赖Lys K + NH3CH2CH2CH2CH2CHCOONH2+ NH2精Arg R H2N—C- NHCH 2CH2CH2CHCOO"NH2天冬氨酸天冬Asp D HOOCCH 2CHCOO_(-氨基丁二酸)Aspartic acid + NH3谷氨酸HOOCCH 2CH2CHCOO (-氨基戊二酸)谷Glu EGlutamic acid + NH3 酸性氨基酸带“ * ”为必需氨基酸。
氨基酸的种类氨基酸的种类较多,在自然界分布很广,并且都是人体必需的。
它们分别是:天冬氨酸、苏氨酸、谷氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、蛋氨酸、赖氨酸、色氨酸、胱氨酸、组氨酸、精氨酸,其中,异亮氨酸是一个典型的模型生物碱,可由光学纯硝酸盐还原得到。
在动物体内,除组氨酸和精氨酸是构成蛋白质的基本物质外,其余10种氨基酸对动物体的生长、发育、繁殖、遗传及疾病防治等生命活动起着极其重要的作用,缺乏某种氨基酸,将导致生长发育不良,机体抵抗力下降而易于患病。
我国发现并定名了16种,包括异亮氨酸、亮氨酸、赖氨酸、蛋氨酸、苏氨酸、色氨酸、苯丙氨酸、缬氨酸、亮氨酸、异亮氨酸、酪氨酸、甲硫氨酸、组氨酸、精氨酸。
这些氨基酸中有些为动物生长所必需,而另一些则是合成蛋白质的基本单位。
多种氨基酸之间可以相互转化,例如:色氨酸经氨基转移酶作用,可转变为苏氨酸;组氨酸经转氨酶作用,可转变为精氨酸;蛋氨酸经甲硫氨酸转氨酶作用,可转变为胱氨酸;酪氨酸经胱氨酸转氨酶作用,可转变为蛋氨酸;苯丙氨酸经酪氨酸转氨酶作用,可转变为酪氨酸等。
氨基酸可以参与人体代谢,被吸收利用后直接参与人体各项生命活动过程,或者在激素、酶、维生素等共同作用下促进人体生长发育、新陈代谢,或者通过氧化、脱羧、脱氨基作用,转变为糖、脂肪、二氧化碳或水排出体外,为人体提供能量。
由此看来,补充氨基酸可以使人体维持健康,延缓衰老。
但补充氨基酸的方法有两种:口服和注射。
口服的氨基酸不经消化系统吸收,而直接进入血液循环。
注射氨基酸则必须先进入血液,再在肝脏分解,才能进入血液循环。
因此,采取这种方法,必须保证氨基酸已经进入体内,否则就不能发挥作用。
有时必须同时注射几种氨基酸,以便获得营养价值高的氨基酸混合制剂。
口服的氨基酸常用于糖尿病的饮食治疗,注射的氨基酸常用于治疗肾病综合征。
因为氨基酸注射后半小时才能在血液中达到最大浓度。
多种氨基酸都能用作药物。
精氨酸、脯氨酸及胱氨酸等在临床上用途很广,主要用于抗氧化剂。
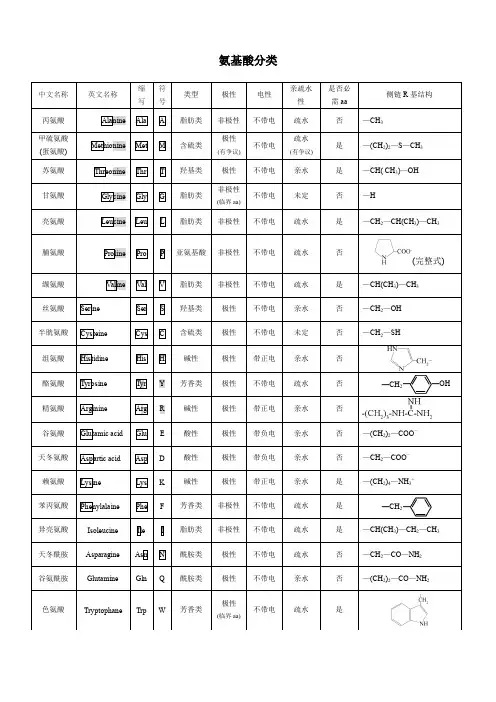
20种蛋白质氨基酸在结构上的差别取决于侧链基团R的不同。
通常根据R基团的化学结构或性质将20种氨基酸进行分类根据侧链基团的极性1、非极性氨基酸(疏水氨基酸)8种丙氨酸(Ala)缬氨酸(Val)亮氨酸(Leu)异亮氨酸(Ile)脯氨酸(Pro)苯丙氨酸(Phe)色氨酸(Trp)蛋氨酸(Met)2、极性氨基酸(亲水氨基酸):1)极性不带电荷:7种甘氨酸(Gly)丝氨酸(Ser)苏氨酸(Thr)半胱氨酸(Cys)酪氨酸(Tyr)天冬酰胺(Asn)谷氨酰胺(Gln)2)极性带正电荷的氨基酸(碱性氨基酸) 3种赖氨酸(Lys)精氨酸(Arg)组氨酸(His)3)极性带负电荷的氨基酸(酸性氨基酸) 2种天冬氨酸(Asp)谷氨酸(Glu)根据氨基酸分子的化学结构1、脂肪族氨基酸:丙、缬、亮、异亮、蛋、天冬、谷、赖、精、甘、丝、苏、半胱、天冬酰胺、谷氨酰胺2、芳香族氨基酸:苯丙氨酸、酪氨酸3、杂环族氨基酸:组氨酸、色氨酸4、杂环亚氨基酸:脯氨酸从营养学的角度1、必需氨基酸(essential amino acid):指人体(或其它脊椎动物)不能合成或合成速度远不适应机体的需要,必需由食物蛋白供给,这些氨基酸称为必需氨基酸。
成人必需氨基酸的需要量约为蛋白质需要量的20%~37%。
共有8种其作用分别是:赖氨酸:促进大脑发育,是肝及胆的组成成分,能促进脂肪代谢,调节松果腺、乳腺、黄体及卵巢,防止细胞退化;色氨酸:促进胃液及胰液的产生;苯丙氨酸:参与消除肾及膀胱功能的损耗;蛋氨酸(甲硫氨酸):参与组成血红蛋白、组织与血清,有促进脾脏、胰脏及淋巴的功能;苏氨酸:有转变某些氨基酸达到平衡的功能;异亮氨酸:参与胸腺、脾脏及脑下腺的调节以及代谢;脑下腺属总司令部作用于甲状腺、性腺;亮氨酸:作用平衡异亮氨酸;缬氨酸:作用于黄体、乳腺及卵巢。
2、半必需氨基酸和条件必需氨基酸:精氨酸:精氨酸与脱氧胆酸制成的复合制剂(明诺芬)是主治梅毒、病毒性黄疸等病的有效药物。
组氨酸:可作为生化试剂和药剂,还可用于治疗心脏病,贫血,风湿性关节炎等的药物。
人体虽能够合成精氨酸和组氨酸,但通常不能满足正常的需要,因此,又被称为半必需氨基酸或条件必需氨基酸,在幼儿生长期这两种是必需氨基酸。
人体对必需氨基酸的需要量随着年龄的增加而下降,成人比婴儿显著下降。
(近年很多资料和教科书将组氨酸划入成人必需氨基酸)3、非必需氨基酸(nonessentialamino acid):指人(或其它脊椎动物)自己能由简单的前体合成,不需要从食物中获得的氨基酸。
例如甘氨酸、丙氨酸等氨基酸。
编辑本段氨基酸的缩写符号编辑本段性质一般性质缬氨酸无色晶体,熔点极高,一般在200℃以上。
不同的氨基酸其味不同,有的无味,有的味甜,有的味苦,谷氨酸的单钠盐有鲜味,是味精的主要成分。
各种氨基酸在水中的溶解度差别很大,并能溶解于稀酸或稀碱中,但不能溶于有机溶剂。
通常酒精能把氨基酸从其溶液中沉淀析出。
紫外吸收性质氨基酸的一个重要光学性质是对光有吸收作用。
20种Pr——AA在可见光区域均无光吸收,在远紫外区(<220nm)均有光吸收,在紫外区(近紫外区)(220nm—300nm)只有三种AA有光吸收能力,这三种氨基酸是苯丙氨酸、酪氨酸、色氨酸,因为它们的R基含有苯环共轭双键系统。
苯丙AA最大光吸收在259nm、酪AA在278nm、色AA在279nm,蛋白质一般都含有这三种AA残基,所以其最大光吸收在大约280nm波长处,因此能利用分光光度法很方便的测定蛋白质的含量。
分光光度法测定蛋白质含量的依据是朗伯—比尔定律。
在280nm处蛋白质溶液吸光值与其浓度成正比。
氨基酸酸碱性质1、两性解离与等电点氨基酸在水溶液或结晶内基本上均以兼性离子或偶极离子的形式存在。
所谓两性离子是指在同一个氨基酸分子上带有能释放出质子的NH3正缬氨酸离子和能接受质子的COO-负离子,因此氨基酸是两性电解质。
氨基酸的等电点:氨基酸的带电状况取决于所处环境的PH值,改变PH值可以使氨基酸带正电荷或负电荷,也可使它处于正负电荷数相等,即净电荷为零的两性离子状态。
使氨基酸所带正负电荷数相等即净电荷为零时的溶液PH值称为该AA2、解离常数解离式中K1和K2′分别代表α-碳原子上-COOH和-NH3的表现解离常数。
在生化上,解离常数是在特定条件下(一定溶液浓度和离子强度)测定的。
等电点的计算可由其分子上解离基团的表观解离常数来确定。
氨基酸解离常数列表:缩写中文译名支链分子量等电点羧基解离常数氨基解离常数 Pkr(R) R基Gly G 甘氨酸亲水性 75.07 6.06 2.35 9.78 -HAla A 丙氨酸疏水性 89.09 6.11 2.35 9.87 -CH3Val V 缬氨酸疏水性 117.15 6.00 2.39 9.74 -CH-(CH3)2Leu L 亮氨酸疏水性 131.17 6.01 2.33 9.74 -CH2-CH(CH3)2Ile I 异亮氨酸疏水性 131.17 6.05 2.32 9.76 -CH(CH3)-CH2-CH3 Phe F 苯丙氨酸疏水性 165.19 5.49 2.20 9.31 -CH2-C6H5Trp W 色氨酸疏水性 204.23 5.89 2.46 9.41 -C8NH6Tyr Y 酪氨酸疏水性 181.19 5.64 2.20 9.21 10.46 -CH2-C6H4-OH Asp D 天冬氨酸酸性 133.10 2.85 1.99 9.90 3.90 -CH2-COOH Asn N 天冬酰胺亲水性 132.12 5.41 2.14 8.72 -CH2-CONH2Glu E 谷氨酸酸性 147.13 3.15 2.10 9.47 4.07 -(CH2)2-COOH Lys K 赖氨酸碱性 146.19 9. 60 2.16 9.06 10.54 -(CH2)4-NH2 Gln Q 谷氨酰胺亲水性 146.15 5.65 2.17 9.13 -(CH2)2-CONH2 Met M 甲硫氨酸疏水性 149.21 5.74 2.13 9.28 -(CH2)-S-CH3Ser S 丝氨酸亲水性 105.09 5.68 2.19 9.21 -CH2-OHThr T 苏氨酸亲水性 119.12 5.60 2.09 9.10 -CH(CH3)-OHCys C 半胱氨酸亲水性 121.16 5.05 1.92 10.70 8.37 -CH2-SH Pro P 脯氨酸疏水性 115.13 6.30 1.95 10.64 -C3H6His H 组氨酸碱性 155.16 7.60 1.80 9.33 6.04Arg R 精氨酸碱性 174.20 10.76 1.82 8.99 12.483、多氨基(碱性氨基酸)和多羧基(酸性氨基酸)氨基酸的解离解离原则:先解离α-COOH,随后其他-COOH;然后解离α-NH3+,随后其他-NH3。
总之羧基解离度大于氨基,α-C上基团大于非α-C上同一基团的解离度。
等电点的计算:首先写出解离方程,两性离子左右两端的表观解离常数的对数的算术平均值。
一般PI值等于两个相近PK值之和的一半。
如天冬氨酸赖氨酸。
4、氨基酸的酸碱滴定曲线以甘氨酸为例:摩尔甘氨酸溶于水时,溶液PH为5.97,分别用标准NaOH和HCL滴定,以溶液PH值为纵坐标,加入HCL和NaOH的摩尔数为横坐标作图,得到滴定曲线。
该曲线一个十分重要的特点就是在PH=2.34和PH=9.60处有两个拐点,分别为其PK1和PK2。
规律:pH<pK1′时,[R]>[R±]>[R]; pH>pK2′时,[R]>[R±]>[R+]; pH=pI时,净电荷为零,[R]=[R-]; pH<pI时,净电荷为“+”; pH>pI时,净电荷为“-”。
编辑本段基本反应及检测1、茚三酮反应(ninhydrin reaction)试剂颜色备注茚三酮(弱酸环境加热)紫色(脯氨酸、羟脯氨酸为黄色)(检验α-氨基)2、坂口反应(Sakaguchi reaction)丙氨酸α-萘酚+碱性次溴酸钠红色(检验胍基精氨酸有此反应)3、米隆反应(又称米伦氏反应)HgNO3+HNO3+热红色(检验酚基酪氨酸有此反应,未加热则为白色)4、Folin-Ciocalteau反应(酚试剂反应)磷钨酸-磷钳酸蓝色(检验酚基酪氨酸有此反应)5、黄蛋白反应浓硝酸煮沸黄色(检验苯环酪氨酸、苯丙氨酸、色氨酸有此反应)6、Hopkin-Cole反应(乙醛酸反应)加入乙醛酸混合后徐徐加入浓硫酸乙醛与浓硫酸接触面处产生紫红色环(检验吲哚基色氨酸有此反应)7、Ehrlich反应P-二甲氨基苯甲醛+浓盐酸蓝色(检验吲哚基色氨酸有此反应)8、硝普盐试验Na2(NO)Fe(CN)2*2H2O+稀氨水红色(检验巯基半胱氨酸有此反应)9、Sulliwan反应1,2萘醌、4磺酸钠+Na2SO3 红色(检验巯基半胱氨酸有此反应)氨基酸10、Folin反应1,2萘醌、4磺酸钠在碱性溶液深红色(检验α-氨基酸)肽键(peptide bond):一个氨基酸的羧基与另一个氨基酸的氨基缩合,除去一分子水形成的酰胺键。
肽(peptide):两个或两个以上氨基通过肽键共价连接形成的聚合物。
是氨基酸通过肽键相连的化合物,蛋白质不完全水解的产物也是肽。
肽按其组成的氨基酸数目为2个、3个和缬氨酸4个等不同而分别称为二肽、三肽和四肽等,一般含10个以下氨基酸组成的称寡肽(oligopeptide),由10个以上氨基酸组成的称多肽(polypeptide),它们都简称为肽。
肽链中的氨基酸已不是游离的氨基酸分子,因为其氨基和羧基在生成肽键中都被结合掉了,因此多肽和蛋白质分子中的氨基酸均称为氨基酸残基(amino acid residue)。
多肽有开链肽和环状肽。
在人体内主要是开链肽。
开链肽具有一个游离的氨基末端和一个游离的羧基末端,分别保留有游离的α-氨基和α-羧基,故又称为多肽链的N端(氨基端)和C端(羧基端),书写时一般将N端写在分子的左边,并用(H)表示,并以此开始对多肽分子中的氨基酸残基依次编号,而将肽链的C端写在分子的右边,并用(OH)来表示。
目前已有约20万种多肽和蛋白质分子中的肽段的氨基酸组成和排列顺序被测定了出来,其中不少是与医学关系密切的多肽,分别具有重要的生理功能或药理作用。
多肽在体内具有广泛的分布与重要的生理功能。
其中谷胱甘肽在红细胞中含量丰富,具有保护细胞膜结构及使细胞内酶蛋白处于还原、活性状态的功能。
而在各种多肽中,谷胱甘肽的结构比较特殊,分子中谷氨酸是以其γ-羧基与半胱氨酸的α-氨基脱水缩合生成肽键的,且它在细胞中可进行可逆的氧化还原反应,因此有还原型与氧化型两种谷胱甘肽。