提馏段操作线方程
- 格式:ppt
- 大小:1.16 MB
- 文档页数:20
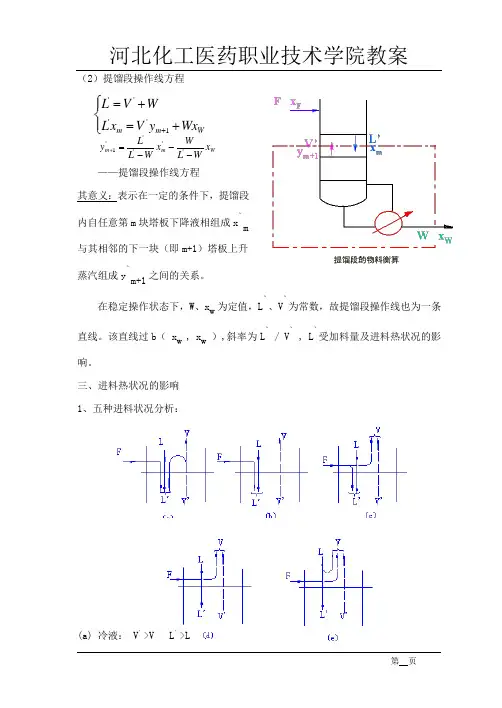
(2)提馏段操作线方程W m m x WL W x W L L y ---=+'''''1 ——提馏段操作线方程其意义:表示在一定的条件下,提馏段内自任意第m 块塔板下降液相组成x `m与其相邻的下一块(即m+1)塔板上升蒸汽组成y `m+1之间的关系。
在稳定操作状态下,W 、x w 为定值,L `、V `为常数,故提馏段操作线也为一条直线。
该直线过b ( x w , x w ),斜率为L ` / V ` , L `受加料量及进料热状况的影响。
三、进料热状况的影响1、五种进料状况分析:(a) 冷液: V ’>V L ’>L⎪⎩⎪⎨⎧+=+=+W m m Wx y V x L W V L 1''''(b) 饱和液体(泡点进料): V ’=V L ’=L+F(c) 气液混合物:V > V ’ L ’>L(d )饱和蒸汽(露点进料): L ’=L V=V ’+F(e)过热蒸汽: V > V ’ L ’<L设:q —进料热状态参数 q 的定义式为: FL L q )('-= 即每1kmol 进料使得L ’较L 增大的摩尔数。
通过对加料板作物料及热量衡算,就能得到q 值得计算式:==原料液的汽化潜热的热量进料变为饱和蒸汽所需将1kmol 1kmol q 均泡均均r t t c r F )(-+ 均r ——原料液的平均摩尔汽化热,kJ/kmol ;均c ——原料液的平均摩尔比热容,kJ/(kmol ·℃);泡t ——原料液的泡点,℃;F t ——进料温度,℃。
则: L ’=L+qF V=V ’+(1-q)F则提馏段操作线方程为: 【例题7-4】 课堂练习:习题7-7练习:用某精馏塔分离丙酮-正丁醇混合液。
料液含30%丙酮,馏出液含95%(以上均为质量百分数)的丙酮,加料量为1000k g /h ,馏出液量为300kg /h ,进料为沸点状态。

(2)提馏段操作线方程W m m x WL W x W L L y ---=+'''''1 ——提馏段操作线方程其意义:表示在一定的条件下,提馏段内自任意第m 块塔板下降液相组成x `m与其相邻的下一块(即m+1)塔板上升蒸汽组成y `m+1之间的关系。
在稳定操作状态下,W 、x w 为定值,L `、V `为常数,故提馏段操作线也为一条直线。
该直线过b ( x w , x w ),斜率为L ` / V ` , L `受加料量及进料热状况的影响。
三、进料热状况的影响1、五种进料状况分析:(a) 冷液: V ’>V L ’>L⎪⎩⎪⎨⎧+=+=+W m m Wx y V x L W V L 1''''(b) 饱和液体(泡点进料): V ’=V L ’=L+F(c) 气液混合物:V > V ’ L ’>L(d )饱和蒸汽(露点进料): L ’=L V=V ’+F(e)过热蒸汽: V > V ’ L ’<L设:q —进料热状态参数 q 的定义式为: FL L q )('-= 即每1kmol 进料使得L ’较L 增大的摩尔数。
通过对加料板作物料及热量衡算,就能得到q 值得计算式:==原料液的汽化潜热的热量进料变为饱和蒸汽所需将1kmol 1kmol q 均泡均均r t t c r F )(-+ 均r ——原料液的平均摩尔汽化热,kJ/kmol ;均c ——原料液的平均摩尔比热容,kJ/(kmol ·℃);泡t ——原料液的泡点,℃;F t ——进料温度,℃。
则: L ’=L+qF V=V ’+(1-q)F则提馏段操作线方程为: 【例题7-4】 课堂练习:习题7-7练习:用某精馏塔分离丙酮-正丁醇混合液。
料液含30%丙酮,馏出液含95%(以上均为质量百分数)的丙酮,加料量为1000k g /h ,馏出液量为300kg /h ,进料为沸点状态。

提馏段操作线方程
一、定义:
提馏段操作线方程,是一种考虑到提馏段的传输功能,由多个功能组成的操作线方程,考虑不同的输入及输出条件,来表示提馏段处理过程中的特征变化。
二、功能:
1、提馏段操作线方程可以用来评估提馏段的质量,从而控制配置参数,使之满足入口或出口条件的特殊要求。
2、提馏段操作线方程可以用于模拟提馏段处理过程中的效果,以分析提馏段的传输拐点以及功率放大比等数值。
3、提馏段操作线方程可以用于测量和控制提馏段的状态参数,确保提馏段的质量稳定。
三、示例:
提馏段操作线方程可以表示为:
Vin——Vout=Ac(变比)+Bc(截距)+F(换算因子)
其中,Ac为变比,表示提馏段的放大倍数;Bc为截距,表示提馏段的偏置电压;F为换算因子,表示提馏段的电容比或电感比。
- 1 -。

(2012) (20分)用一精馏塔分离某双组分混合液,在塔中部以饱和蒸汽进料,已知进料中易挥发物组成x f =0.5,塔顶产品中易挥发组成x D =0.9,塔釜中易挥发组成x w=0.05(以上均为摩尔分率),该物系平均相对挥发度为3,回流比R=2R min ,试计算:(1)提馏段操作线方程;(2)进入第一块理论板(从顶往下数)的汽相浓度;(3)若因故塔釜停止加热,欲维持x D 不变应如何操作?此时塔釜排液x w=?(2011) (15分)用相当于3块理论板的精馏塔分离含氨0.4%(摩尔)的氨-水混合物,预热成饱和蒸气后从第2和第3块理论板之间进料。
使用全凝器将来自塔顶的蒸气混合物冷凝成饱和液体。
每1摩尔的进料有1.35摩尔的冷凝液回流进第1块塔板,其余冷凝液作塔顶产品。
从最低的一块塔板下降的液体进入再沸器后,每1摩尔进料有0.7摩尔被汽化并升入第3块理论板,剩余液体作为塔底产品。
设全塔的平衡关系可表示为y = 12.6x分别计算从进料板下降液体中氨的组成和塔底、塔顶产品中氨的组成。
(2010)4.(20分)在一常压连续操作的精馏塔中分离某双组分混合液,塔釜采用间接蒸汽加热,塔顶采用全凝器,泡点回流。
已知该物系的平均相对挥发度为2.5,进料为饱和蒸汽,其组成为0.35(易挥发组分的摩尔分数,下同),进料量为100kmol/h 。
塔顶馏出液量为40kmol/h ,精馏段操作线方程为y n+1=0.8x n +0.16试计算:(1)提馏段操作线方程;(2)若测得塔顶第一块板下降的液相组成为x 1=0.7,求该板的气相默弗里板效率E mv,1;(3)当塔釜停止供应蒸汽,保持回流比不变,若塔板数无穷多,塔釜产品浓度将为多少?(2009)七.(18分)用精馏塔分离相对挥发度为2的双组分混合物,塔顶产品的轻组分摩尔含量为90% 。
精馏段中蒸汽进入某一块板的流率为150kmol/h ,摩尔浓度为60%,流入该板的液体流率为100kmol/h. 该板用气相浓度表示的Murphree 效率为0.5,计算(1) 精馏段的操作线方程,(2) 离开该板的气相和液相摩尔浓度各为多少?(假定为恒摩尔流操作)(2008)二、(20分)一个常压连续精馏塔分离苯和甲苯混合物。

精馏计算公式
精馏线计算公式
1、q线方程就是精馏段操作线方程和提馏段操作线方程交点的轨迹方程,也称为进料方程。
2、精馏段操作线方程:y=(L/V)x+(D/V)xD
提馏段操作线方程:y=(Lˊ/V')x-(W/Vˊ)xW
两线交点的轨迹应同时满足以上两式,将上式代入q=(Lˊ-L)/F,即得q线方程:y=﹛q/(q-1)﹜x-﹛1/(q-1)﹜xF
精馏塔计算公式
(1)物料平衡:进入某装置或设备的物料量必等于排出某装置或设备的物料量与过程累积的量。
当无累积量时,即:进料量=排出量。
对于精馏塔 F=D+W;体现了塔的生产能力,主要由F、D、W调节。
(2)汽液相平衡:是精馏操作的基础;体现了产品的质量及损失情况。
由操作条件(T、P)及塔板上汽液接触的情况维持。
只有在温度、压力固定时才有确定的汽液平衡组成,
(3)热平衡:是物料平衡和汽液平衡的基础。
Q入=Q出+Q损
各层塔板上的热平衡 Q汽化=Q冷凝
影响因素:塔釜加热蒸汽量、塔顶冷凝剂量、物料平衡、汽液平衡。
总之三大平衡相互制约,操作中常以物料平衡的变化为主,相应调节热量平衡以维持汽液平衡。
《精馏段和提馏段操作线方程》教学设计节复习回顾导入新知复习:精馏塔全塔物料衡算方程导入:在化工专业春季高考中,精馏的计算上非常重要的,特备上有关操作线方程的计算。
今天我们就来学习精馏段和提馏段操作线方程及其计算。
回答:总物料衡算:F=D+W易挥发组分衡算:Fx F=Dx D +Wx W讲授新知讲述:在精馏塔中,任意塔板(n 板)下降的液相组成x n与由其下一层塔板(n+1板)上升的蒸汽组成y n+1之间的关系称之为操作关系,描述它们之间关系的方程称为操作线方程。
操作线方程可通过塔板间的物料衡算求得。
在连续精馏塔中,因原料液不断从塔的中部加入,致使精馏段和提馏段具有不同的操作关系,现分别予以讨论。
学生聆听、记忆讲授新知讲述:1、精馏段操作线方程在图片虚线范围(包括精馏段的第n+1层板以上塔段及冷凝器)内作物料衡算,以单位时间为基准,可得:总物料衡算:V=L+D易挥发组分的物料衡算:V y n+1=Lx n+Dx D式中:V——精馏段内每块塔板上升的蒸汽摩尔流量,kmol/h;L——精馏段内每块塔板下降的液体摩尔流量,kmol/h;y n+1——从精馏段第n+1板上升的蒸汽组成,摩尔分率;x n——从精馏段第n板下降的液体组成,摩尔分率。
将以上两式联立后,有:聆听并看下图学生书写记忆:DnnxDLDxDLLy+++=+1111+++=+RxxRRy Dnn分析归纳:(小组发言)Dn n x D L Dx D L L y +++=+1令R =L /D ,R 称为回流比,于是上式可写作:111+++=+R x x R Ry Dn n以上两式均称为精馏段操作线方程。
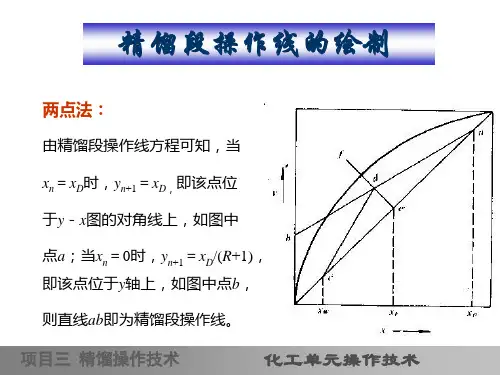
点评小组的发言:(略) 关于精馏段操作线方程的两点讨论(1)该方程表示在一定操作条件下,从任意板下降的液体组成x n 和与其相邻的下一层板上升的蒸汽组成y n +1 之间的关系。
(2)该方程为一直线方程,该直线过对角线上a (x D ,x D )点,以R /(R +1)为斜率,或在y 轴上的截距为x D /(R +1)。

提馏段操作线方程式哎呀,这个题目听起来就挺让人头大的,提馏段操作线方程式,听起来就像是化学课本里那些让人眼花缭乱的公式。
不过,既然要写这个,那就让我来试试,用咱们平时聊天的方式,把它写得不那么枯燥。
首先,咱们得先说说提馏是个啥玩意儿。
提馏,就是把混合物里的不同成分给分开,比如,你把酒精和水混在一起,然后加热,酒精就先跑出来了,因为酒精的沸点比水低。
这就像是你在厨房里炒菜,先放油,再放菜,最后放调料,顺序乱了,味道就变了。
那么,提馏段操作线方程式,其实就是一种用来描述这个过程的数学公式。
就像你做菜的时候,要控制火候,放多少盐,放多少糖,放多少酱油,这些都需要一定的比例,才能做出好吃的菜。
提馏也是,你得控制好各种参数,才能把混合物里的不同成分分离得干净。
记得有一次,我在学校实验室里做实验,老师让我们用提馏的方法分离两种液体。
我还记得,那两种液体是乙酸乙酯和水,它们混在一起,看起来就像是牛奶和水混在一起,有点浑浊。
老师给我们的实验步骤是:先把混合物加热,然后通过一个特殊的装置,让蒸汽上升,再冷却,最后收集到两种不同的液体。
我那时候特别紧张,因为我知道,如果操作不当,乙酸乙酯和水就分不开,实验就失败了。
我小心翼翼地加热,眼睛紧紧盯着那个温度计,生怕它跳得太快。
然后,我看着那些蒸汽慢慢上升,心里默念:“快分,快分,快分!”最后,当我看到两种液体分别滴入两个不同的瓶子里,心里那叫一个高兴啊!就像是你打游戏终于过了一个难关,或者你做了一道数学题,答案终于对了。
那一刻,我感觉自己就像是个魔术师,把两种液体变回了它们原来的样子。
所以,提馏段操作线方程式,虽然听起来很复杂,但其实它就像是我们生活中的调料配方,只要掌握了正确的比例和步骤,就能得到我们想要的结果。
就像做菜一样,只要掌握了火候和调料的比例,就能做出美味的菜肴。
这就是提馏,一个听起来很高大上,其实就像是我们日常生活中的烹饪技巧。
而提馏段操作线方程式,就是那个让你能够精确控制火候和调料的秘方。

化工原理提馏段操作线方程
嘿,朋友!咱今天来聊聊化工原理里的提馏段操作线方程。
你说这提馏段操作线方程,就像咱们生活中的一条神秘路线图。
想
象一下,你要去一个陌生的地方旅行,没有清晰的路线规划,那得多
迷茫,多容易走岔路啊!这提馏段操作线方程在化工生产里,那就是
指明方向的宝贝。
它可不是随随便便就能弄明白的,得下点功夫。
就像你学骑自行车,一开始摇摇晃晃,掌握不好平衡,但多练练,就能顺溜地骑起来啦。
这方程里的各种参数,就像一个个性格各异的小伙伴。
有的活跃,
有的安静,你得摸清它们的脾气,才能让它们乖乖地为你服务。
比如说,回流比这个参数,它要是变大,就好像给整个系统注入了一股强
大的力量,能让分离效果变得更好。
但要是控制不好,也可能会带来
一些麻烦,是不是有点像给孩子吃补药,吃多了也不行?
再看看汽液流量,这就好比是水流的大小。
流量大了,系统的负荷
就加重;流量小了,又达不到理想的效果。
这不就跟咱做饭时加水一
样嘛,水多了粥稀,水少了饭干。
而且啊,在实际应用中,可不能死搬硬套这个方程。
每个化工生产
的情况都不一样,就像每个人的指纹独一无二。
得根据具体的条件灵
活调整,不然可就闹笑话啦。
这提馏段操作线方程,虽然复杂,但只要咱有耐心,有决心,就一定能把它拿下。
你想想,当你熟练掌握了它,就像拥有了一把神奇的钥匙,能打开化工生产高效、优质的大门,那得多有成就感!
总之,提馏段操作线方程是化工原理里的重要一环,咱得重视它,钻研它,让它为我们的化工生产服务,创造出更多的价值!。

化工原理学习指导 第6章 蒸馏 计算题答案6-31 某二元混合物蒸汽,其中轻、重组分的摩尔分数分别为0.75和0.25,在总压为300kPa 条件下被冷凝至40℃,所得的汽、液两相到达平衡。
求其汽相摩尔数和液相摩尔数之比。
轻、重组分在40℃时的蒸汽压分别为370kPa 和120kPa 。
解:两相中,720.01203701203000B0A 0B =--=--=p p p p x 888.0300720.03700A A =⨯===x p p p p y设汽相摩尔量为V ,液相摩尔量为L ,总量为F ,那么L V F +=Lx Vy Fx F +=由以上两式可得:217.075.0888.072.075.0F F =--=--=x y x x L V 事实上,汽液平衡体系中,两相的摩尔量比值服从杆杠定律。
6-32 苯和甲苯组成的理想溶液送入精馏塔中进行别离,进料状态为汽液共存,其两相组成分别如下:5077.0F =x ,7201.0F =y 。
用于计算苯和甲苯的蒸汽压方程如下:8.2201211031.6lg 0A +-=t p5.2191345080.6lg 0B +-=t p其中压强的单位为Pa ,温度的单位为℃。
试求:〔1〕该进料中两组份的相对挥发度为多少?〔2〕进料的压强和温度各是多少?〔提示:设进料温度为92℃〕 解:〔1〕混合物中两组分的相对挥发度:49.25077.015077.07201.017201.011F F F F=--=--=x x y y α 〔2〕设进料温度为92℃,那么16.28.220921211031.6lg 0A =+-=pkPa 38.1440A =p 762.15.219921345080.6lg 0B =+-=pkPa 83.570B =p由此求得体系的相对挥发度为:496.283.5738.144'0B0A ===p p α 其值与〔1〕中所求相对挥发度足够接近,故可认为进料温度为92℃。