实验1天平的称量练习
- 格式:ppt
- 大小:680.00 KB
- 文档页数:26

分析化学实验报告
实验一: 分析天平称量练习
班级: 姓名: 日期:
Ⅰ、实验目的
1.观察分析天平的结构, 知道天平的主要部件的名称和作用。
2.学会使用分析天平
3.会用直接称量法和减量称量法称取物质的质量。
Ⅱ、实验仪器与试剂
仪器: 万分之一分析天平、称量瓶、干燥器、烧杯
试剂: 氯化钠
Ⅲ、实验内容与步骤
直接称量法:
称空称量瓶的质量。
(1)准备:
(2)一般性检查:
(3)检查并调节天平的零点:
(4)称量:
1、读数及记录:
减重称量法:
称量三份一定质量的氯化钠样品
将各项数据填入下表。

基础化学实验Ⅰ(下)实验一、分析天平的称量练习1. 用分析天平称量的方法有哪几种?指定质量称样法和递减称样法各有何优缺点?在什么情况下选用这两种方法?答:称量有三种方法:直接称量法,指定质量称量法,递减称量法。
指定质量称量法:此方法称量操作的速度很慢,适于称量不易吸潮,在空气中能稳定存在的粉末状或小颗粒(最小颗粒应小于0.1mg )样品,以便容易调节其质量。
在直接配制标准溶液和试样分析时经常使用指定质量称样法。
递减称量法:此称量操作比较繁琐。
主要用于称量过程中样品易吸水、易氧化或易与空气中的CO 2发生反应的试样。
2. 使用称量瓶时,如何操作才能保证试样不致损失?答:将称量瓶取出,在接收器的上方,倾斜瓶身,用称量瓶盖轻敲瓶口上部使试样慢慢落入容器中。
当顷出的试样接近所需量时,一边继续用瓶盖轻敲瓶口,一边逐渐将瓶身竖直,使粘附在瓶口上的试样全部进入称量瓶中,然后再盖好瓶盖,称量。
实验二、滴定分析基本操作练习1.HCl 溶液与NaOH 溶液定量反应完全后,生成NaCl 和水,为什么用HCl 滴定NaOH 时采用甲基橙作为指示剂,而用NaOH 滴定HCl 溶液时却使用酚酞作为指示剂?答:HCl 溶液与NaOH 溶液,相互滴定两种指示剂均可采用,但是考虑到终点颜色的观察敏锐性一般黄色到橙色,无色到红色容易观察,因此采用上述方法。
2.滴定读数的起点为什么每次最好调到0.00刻度处?答:因为滴定管在制作过程中会出现管内刻度不完全均匀的现象,每次滴定都从0.00刻度开始,能消除系统误差。
实验三、混碱分析1. 双指示剂法的测定原理是什么?答:用HCl 溶液滴定Na 2CO 3 为例。
H 2CO 3 为二元酸,离解常数分别为p K a1=6.38; p K a2=10.25,用HCl 溶液滴定Na 2CO 3 溶液时c K b1>10-9 ,c K b2=10-8.62 > 10-9,且K b1/K b2=10-3.75/10-7.62=103.87 ≈104,能分步进行:第一步反应:Na 2CO 3+HCl =NaHCO 3+NaCl ,第二步的反应产物为CO 2 ,其饱和溶液的浓度为0.04 mol·L -13.8)25.1036.6(21)p p (21pH :11a a 1=+=+=K K 第一化学计量点 9.3)40.136.6(21)p p (21pH :1a 2=+=+=c K O H CO .............................................CO H NaCl HCl NaHCO 22323+↑+=+a 第二化学计量点用HCl 溶液滴定Na 2CO 3有2个滴定突跃:第一个突跃在化学计量点pH=8.3的附近,可用酚酞作指示剂;第二个突跃在化学计量点pH=3.9的附近,可用甲基橙作指示剂。

实验1 分析天平的称量练习分析天平是定量分析中重要而又常用的精密仪器之一。
常用的分析天平最大负载为200g ,分度值(感量)为0.1mg 。
实验室常用的是半自动电光天平(例如,TG-328B 型半自动电光天平)。
电光天平可直接读取0.1mg ,故又称万分之一分析天平。
一、实验目的掌握电光天平的结构、使用规则和称量方法。
二、称量时的基本要求1. 称量前应使用天平箱内部清洁、环码挂在固定的钩上、天平保持水平等,否则需用软毛刷清扫和做必要的调节。
然后测定天平零点。
2. 加重或加重时,必须先把天平梁托起(天平休止)。
3. 砝码必须用砝码镊子夹取,且要轻拿轻放。
砝码放在右侧天平盘上。
加减环码时应一档一档地转动环码旋钮,防止跳落或串位。
4. 称量和读取数值时,必须关上天平门。
5. 化学试剂或是的物体必须放入小烧瓶或称量瓶中称重。
放在左侧天平盘上。
过热或过冷的物体应在天平室内干燥器中放置15~30min 后再称量。
吸湿性或挥发性的物质,须放在密闭容器中称量。
6. 天平遇有故障时必须及时报告指导老师,不得擅自修理。
三、实验内容直接准确称取Na 2CO 3质量(准确至0.0001g )。
(一) 差减法(或减量法)易于吸水、易于氧化或易于与CO 2反应的试样,必须采用差减法。
1. 用台式小天平称出两个洁净干燥的小烧杯,然后再分析天平上准确至0.1mg 。
记录1空W 和2空W 。
2. 另取一清洁干燥的称量瓶,称出粗重后,加入约1gNa 2CO 3,再在分析天平上精确称量,记录1W ;从其中移取约0.3~0.4g (1/3左右)于第一个小烧杯中后,精确称量剩余质量,记录2W ;从中再移取约0.3~0.4g 于第二个小烧杯中,精确称量剩余质量,记录3W 。
3. 再分别称量已装有Na 2CO 3样品的小烧杯的质量,记录1样W 和2样W 。
4. 结果的检验(1) 检查小烧杯的增重是否等于称量瓶之减重,即2121--W W W W =样样?3222--W W W W =空样?若不相等,求出称量的偏差。

实验一分析天平的称量练习分析天平是定量分析中重要而又常用的精密仪器之一。
常用的分析天平最大负载为200g,分度值(感量)为0.lmg,故又称万分之一分析天平。
一、实验目的掌握电光天平的结构、使用规则和称量方法。
二、仪器和试样DT—100A单盘天平,台秤和砝码,250mL锥形瓶3个,称量瓶1只,干燥后的Na2CO37g左右,药匙,纸条,镊子等。
三、称量前天平的状态(1)保持天平箱内部清洁:否则需用软毛刷清扫。
(2)保持水平:否则旋转两个调整脚,是圆水准仪内气泡位于圆圈之内,向上拧紧两个锁紧螺母以防水平改变。
(3)零位状态:三个减码数字窗口及微读数字窗口全部显示“0”位。
(4)转换开关向上,开天平灯亮。
四、实验内容(一)天平零点和稳定性测定(1)首先检查天平圆水准仪内的气泡是否位于圆圈内,轻轻打开停动手钮,检查显示屏和标尺摆动是否正常。
(2)测定天平零点:打开停动手钮,待标尺稳定后,调节零调手钮,使标尺上“00”刻线处于投影屏夹线正中,即为零点。
若使用零调手钮也不能使标尺“00”刻线调到投影屏夹线正中时,根据标尺“00”刻线的位置,转动平衡铊使“00”刻线位于夹线内。
(3)天平变动性的测定:打开停动手钮,空载时测零点5次,记录结果。
天平示值变动性(格)=最大值-最小值。
示值变动性一般不超过天平刻度标尺的1格。
(二)差减法(或减量法)准确称取Na2CO3质量(准确至0.000lg)易于吸水、易于氧化或易与CO2反应的试样,必须采用差减法。
(1)用台式小天平称出两个清洁干燥并编有号码的250mL锥形瓶,然后在分析天平上称准至0.1mg。
记录W空1和W空2。
(2)从干燥器中取一内装Na2CO3(已干燥冷却)的称量瓶,称出粗重后,再在分析天平上精确称量,记录Wl;从天平中取出称量瓶,从其中移取约1g Na2CO3于第一个锥形瓶中后,精确称量剩余质量,记录W2;从中再移取约1g于第二个锥形瓶中,精确称量剩余质量,记录W3。

一、天平称量练习1、分析天平的灵敏度愈高,是不是称量的准确度也愈高?为什么?答:不是,因为如存在仪器误差,即使是灵敏度高,称量的准确度也不会高。
2、什么情况下选用指定质量称量法?什么情况下选用差减称量法?用这两种方法称量试样过程中,为什么可以不必在每次称量前测定天平的零点?答:当准确称量一确定质量的药品时,用指定质量称量法;当称量某一范围内的药品时,可选用差减称量法;因为零点在称量前后波动很小,试样质量由前后两次质量差求得,所以不必在每次称量前测定天平的零点。
3、用差减法称取试样的过程中,若称量瓶内的试样吸湿,对称量有何影响?若试样倾入坩埚后再吸湿,对称量有无影响?为什么?答:有影响。
若样品吸湿,可使倾出样品质量测定值大于真实值。
无影响。
倾出后再吸湿,对称量无影响,因为质量已确定。
4、在称量的记录和计算中,如何正确运用有效数字?答:记录及计算结果的准确度应与天平的准确程度一致:计算过程中,可按照结果要求对有效数字进行取舍。
二、酸碱标准溶液的配制和比较滴定1、滴定管在装标准溶液前为什么要用标准溶液润洗三次?滴定用的锥形瓶要不要润洗?答:防止标准溶液被残余的蒸馏水稀释而引入误差。
锥形瓶不能用待装液润洗。
2、如何配制不含C02的NaOH标准溶液?答:(1)用新煮沸并冷却的蒸馏水:以驱除C02(2)吸取饱和NaOH上层清液稀释至所需要的浓度。
3、C02的存在对酸碱滴定有无影响?如何消除它的影响?答:C02的影响视滴定终点而定。
pH<5时,可忽略;pH>5时.有影响。
消除:(1)配制不含C02的NaOH:(2)标定和测定用同一个指示剂。
三、HCl、NaOH标准溶液的标定1、用基准物质配成标准溶液来标定和直接称取基准物质来标定,各有什么优缺点?答:前者称量误差较后者小,但存在定容及量取误差:后者不存在定容误差和移取误差,但称量误差较前者大。
2、基准物质称取的质量是怎样计算出来的?答:根据基准物质的摩尔质量、标准溶液的近似浓度及滴定时消耗的体积计算而求得。

实验一分析天平称量练习思考题:1.加减砝码、圈码和称量物时,为什么必须关闭天平?答:天平的灵敏度在很大程度上取决于三个玛瑙刀口的质量。
若刀口不锋利或缺损,将会影响称量的灵敏度,因此,在加减砝码、取放物体时,必须关闭天平,使玛瑙刀和刀承分开,以保护玛瑙刀口。
2.分析天平的灵敏度越高,是否称量的准确度就越高?答:分析天平的灵敏度越高,并非称量的准确度就越高。
因为太灵敏,则达到平衡较为困难,不便于称量。
3.递减称量法称量过程中能否用小勺取样,为什么?答:递减称量法称量过程中不能用小勺取样,因为称量物有部分要沾在小勺上,影响称量的准确度。
4.在称量过程中,从投影屏上观察到标线已移至100分度的右边,此时说明左盘重还是右盘重?答:在称量过程中,从投影屏上观察到标线已移至100分度的右边,此时说明右盘重。
实验二滴定分析基本操作练习思考题:1.HCl和NaOH标准溶液能否用直接配制法配制?为什么?答:由于NaOH固体易吸收空气中的CO2和水分,浓HCl的浓度不确定,固配制HCl 和NaOH标准溶液时不能用直接法。
2.配制酸碱标准溶液时,为什么用量筒量取HCl,用台秤称取NaOH(S)、而不用吸量管和分析天平?答:因吸量管用于标准量取需不同体积的量器,分析天平是用于准确称取一定量的精密衡量仪器。
而HCl的浓度不定,NaOH易吸收CO2和水分,所以只需要用量筒量取,用台秤称取NaOH即可。
3.标准溶液装入滴定管之前,为什么要用该溶液润洗滴定管2~3次?而锥形瓶是否也需用该溶液润洗或烘干,为什么?答:为了避免装入后的标准溶液被稀释,所以应用该标准溶液润洗滴管2~3次。
而锥形瓶中有水也不会影响被测物质量的变化,所以锥形瓶不需先用标准溶液润洗或烘干。
4.滴定至临近终点时加入半滴的操作是怎样进行的?答:加入半滴的操作是:将酸式滴定管的旋塞稍稍转动或碱式滴定管的乳胶管稍微松动,使半滴溶液悬于管口,将锥形瓶内壁与管口接触,使液滴流出,并用洗瓶以纯水冲下。

实验一分析天平称量练习及标准溶液的配制一、实验目的与要求1. 了解电子天平的构造及利用规那么,学会正确利用分析天平。
2. 把握直接称量法和减量称量法的操作方式,学会称量瓶与干燥器的利用。
3. 注意有效数字的正确利用,培育准确、整齐、简明记录实验原始数据的适应。
二、实验原理分析天平是依照杠杆原理设计而成的,每一项定量分析工作都直接或间接地需要利用分析天平,经常使用的分析天平有阻尼天平、半自动电光天平、全自动电光天平、单盘电光天平、微量天平和电子天平等。
电子天平依照电磁力平稳原理直接称量。
其特点是性能稳固、操作简便、称量速度快、灵敏度高。
能进行自动校正、去皮及质量电信号输出。
电子天平的利用方式:水平调剂水泡应位于水平仪中心。
⑴ 接通电源,预热 30 分钟。
⑵ 打开关 ON ,使显示器亮,并显示称量模式 0.0000g。
⑶ 称量按 TAR 键,显示为零后。
将称量样品放入盘中央,待读数稳固后,该数字即为称物体的质量。
⑷ 去皮称量按 TAR 键清零,将空容器放在盘中央,按TAR键显示零,即去皮。
将称量样品放入空容器中,待读数稳固后,现在天平所示读数即为所称样品的质量。
三、仪器与药品CaCO3(固体),电子天平,称量瓶,坩埚或小烧杯。
四、实验步骤1.利用分析天平称量前的预备工作:⑴ 取下天平罩,叠好后平放在天平箱的右后方台面上或天平箱的顶上。
⑵ 称量时,操作者面对天平端坐,记录本放在胸前的台面上,寄存和同意称量样品的器皿放在天平箱左侧,砝码盒放在右边。
⑶ 称量开始前应作如下检查和调整:① 了解所称样品的湿度与天平箱里的温度是不是相同。
若是待测样品曾经加热或冷却过,必需将该样品放置在天平箱近旁相那时刻,待该样品的温度与天平箱里的湿度相同后再进行称量。
盛放称量样品的器皿应维持清洁干燥。
② 观察天平秤盘和底板是不是清洁。
秤盘上如有粉尘,可用软毛刷轻轻扫净,底板如不干净,可用毛笔轻轻地拂扫,也可用细布擦拭。
③ 假设气泡式水准器的气泡不在圆圈的中心,用手旋转天平底板下的两个垫脚螺丝,以调剂天平双侧的高度直至达到水平为止。

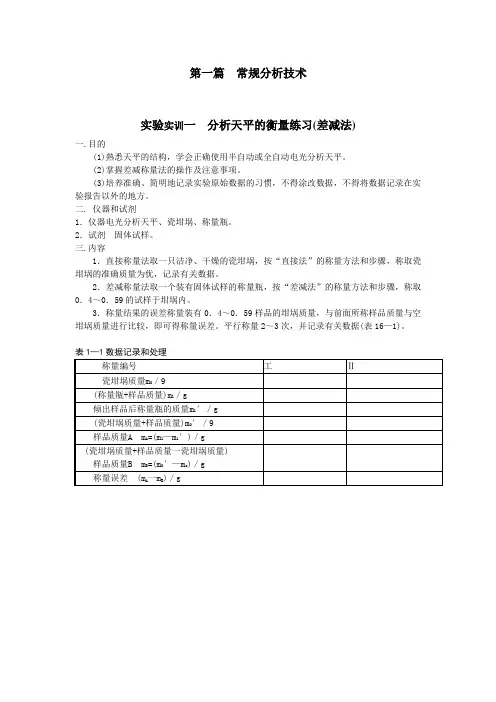
第一篇常规分析技术实验实训一分析天平的衡量练习(差减法)一.目的(1)熟悉天平的结构,学会正确使用半自动或全自动电光分析天平。
(2)掌握差减称量法的操作及注意事项。
(3)培养准确、简明地记录实验原始数据的习惯,不得涂改数据,不得将数据记录在实验报告以外的地方。
二. 仪器和试剂1.仪器电光分析天平、瓷坩埚、称量瓶。
2.试剂固体试样。
三.内容1.直接称量法取一只洁净、干燥的瓷坩埚,按“直接法”的称量方法和步骤,称取瓷坩埚的准确质量为优,记录有关数据。
2.差减称量法取一个装有固体试样的称量瓶,按“差减法”的称量方法和步骤,称取0.4~0.59的试样于坩埚内。
3.称量结果的误差称量装有0.4~0.59样品的坩埚质量,与前面所称样品质量与空坩埚质量进行比较,即可得称量误差。
平行称量2~3次,并记录有关数据(表16—1)。
表1—1数据记录和处理实验实训二滴定分析操作练习(酸碱比较滴定)一.目的(1)了解并掌握滴定管、锥形瓶等滴定分析常用仪器的洗涤方法和使用方法。
(2)反复练习酸碱滴定的基本操作,做到能利用指示剂正确地判断滴定终点。
二.原理一定浓度的HCl溶液和NaOH溶液相互滴定至终点时,所消耗的体积之比V(HCl)/V(NaOH)应是一定的。
0.1 mol/LHCl溶液和0.1 mol/LNaOH溶液相互滴定时,化学计量点的pH为7.00,pH突跃范围为4.30~9.70。
可选用甲基橙、甲基红、酚酞作指示剂。
本实验采用甲基橙作指示剂,用0.1 mol/L_1 Ha溶液滴定0.1 mol/LNaOH溶液,滴定终点颜色由黄色突变为橙色。
通过反复练习此滴定操作,其所消耗的体积之比V(HCl)/V(NaOH)应基本不变,由此可以检验滴定操作技术和判断滴定终点。
三.仪器和试剂1.仪器酸式滴定管(50 mL)、碱式滴定管(50 mL)、烧杯(250 mL)、锥形瓶(250 mL)、量筒、洗瓶、滴定管架、试剂瓶、台秤。

实验一、分析天平的称量练习训练目标(1)掌握分析天平的使用方法。
(2)学会用差减法称取试样。
(3)学会用固定质量称量法称取试样。
实验用品半自动或全自动电光天平、托盘天平、电子天平、称量瓶、小烧杯、碳酸钠(固体)、表面皿(直径6cm)、氯化钠(固体)等。
操作步骤(1)差减法称取试样①手戴细纱手套或用纸带取一洁净干燥的称量瓶,放在已处理干净的托盘天平的称盘上,称其质量,精确至0.1g,然后用药勺加入约1g固体Na2CO3粉末,再放在托盘天平上粗称其质量。
②将盛有样品Na2CO3的称量瓶移至分析天平上精确称其质量,精确至0.1mg。
③按减量法操作程序将样品Na2CO3分为3份分别倾入3个洁净的小烧杯中,测定倾出样品的质量,并将数据及时记录。
原始记录和数据(2) 固定质量称量法称取试样①在托盘天平上粗称表面皿的质量,精确至0.1g。
②在分析天平上精确称出表面皿的质量,精确至0.1mg。
③在分析天平右盘增加50mg环码,按固定质量称量法操作程序,用药勺将NaCl样品慢慢加入表面皿中,直到天平的平衡点与称量表面皿的平衡点一致。
此时,称取NaCl的质量为500ng。
④将称好的试样无损地直接转入接受容器中。
思考题(1)在什么情况下选用差减法称量?在什么情况下选用固定质量称量法称样?(2)用差减法称取试样时,为什么可以不测天平的零点?(3)用托盘天平粗称试样的质量时,为什么必须将称盘处理干净?(4)用固定质量称量法称取试样时应注意哪些问题?实验二、滴定分析基本操作训练目标1、掌握盐酸和氢氧化钠溶液的配制方法。
2、学会用甲基橙和酚酞指示剂判断滴定终点。
3、进一步掌握滴定管的滴定操作技术和读数方法。
实验原理将一种物质的溶液,从滴定管滴加到锥形瓶或烧杯的另一种物质溶液中的过程称为滴定。
滴定到两物质按照化学计量关系恰好反应完全时称为化学计量点。
为了正确确定化学计量点,常在被测溶液中加入一种指示剂,它在化学计量点附近发生颜色变化,其颜色变化的转折点称为“滴定终点”,简称“终点”。

实验一分析天平称量练习一、实验预习要点阅读实验教材中有关分析天平和称量练习实验的内容,重点是“称量方法”。
◆电子天平:构造原理、使用方法。
◆称量方法:直接称量法、指定质量称量法和差减称量法。
(重点是差减法)(1)直接称量法~一般指直接将待称物置于称盘或容器称出质量的称量方法。
此法仅适于称量洁净干燥的不易潮解或升华的非粉状固体物品,如小烧杯、表面皿、坩埚、珠宝等。
此法要求零点为0.0000g。
(2)指定质量称量法~称取某一指定质量的试剂或试样的称量方法。
此法的操作速度慢,耗时较多,仅适用于称取不易吸潮、在空气中性质稳定的小颗粒样品,如重铬酸钾、矿样等。
操作步骤:将表面皿置于天平盘上(显示皿重),清零去皮重,用样品铲将试样慢慢加到表皿中央,加入的试样差不多(差10mg左右)时,用食指轻轻弹击样品铲柄,使试样慢慢地抖落到表皿中,直到天平显示的读数为指定的质量数(如0.5000g)为止。
(3)差减称量法(减量法)~由两次称量之差得到试样质量的称量方法。
减量法可用于称取称量过程中易吸潮、易氧化或与二氧化碳反应等的小颗粒样品,如碳酸钠、邻苯二甲酸氢钾等。
称量步骤:加入适量试样(约为每份试样量的整数倍)于洁净干燥的称量瓶中(盖好),称出其质量m l,然后敲出一定量的试样(于盛器)后,再称出其质量m2。
前后两次质量之差就是试样的质量。
减量法可连续称取多份试样,其中第一份试样重m s1=m l-m2,第二份试样重m s2=m2-m3。
◆称瓶转样操作:左手拿纸条套住称量瓶并移至接受容器上方,右手拿小纸片夹住瓶盖,向下稍倾称瓶口,用瓶盖轻轻敲击瓶口右上(内)缘,使样品慢慢落入容器中。
估计敲出的样品差不多时,边轻敲瓶口,边慢慢竖起称量瓶,使粘附在瓶口的样品全部落回称量瓶内,盖好瓶盖。
◆注意几点:①开关天平门、取放物品等,动作须轻慢;②用减量法称取每份试样,最好转移1~2次就能完成(多次转移,易引起试样吸湿或损失);③原始数据应及时准确、规范记录在专用本上;④实验用完天平,应清扫、整理好天平(登记天平的使用情况),并请指导教师检查、签字。
第一篇常规分析技术实验实训一分析天平的衡量练习(差减法)一.目的(1)熟悉天平的结构,学会正确使用半自动或全自动电光分析天平。
(2)掌握差减称量法的操作及注意事项。
(3)培养准确、简明地记录实验原始数据的习惯,不得涂改数据,不得将数据记录在实验报告以外的地方。
二. 仪器和试剂1.仪器电光分析天平、瓷坩埚、称量瓶。
2.试剂固体试样。
三.内容1.直接称量法取一只洁净、干燥的瓷坩埚,按“直接法”的称量方法和步骤,称取瓷坩埚的准确质量为优,记录有关数据。
2.差减称量法取一个装有固体试样的称量瓶,按“差减法”的称量方法和步骤,称取0.4~0.59的试样于坩埚内。
3.称量结果的误差称量装有0.4~0.59样品的坩埚质量,与前面所称样品质量与空坩埚质量进行比较,即可得称量误差。
平行称量2~3次,并记录有关数据(表16—1)。
表1—1数据记录和处理实验实训二滴定分析操作练习(酸碱比较滴定)一.目的(1)了解并掌握滴定管、锥形瓶等滴定分析常用仪器的洗涤方法和使用方法。
(2)反复练习酸碱滴定的基本操作,做到能利用指示剂正确地判断滴定终点。
二.原理一定浓度的HCl溶液和NaOH溶液相互滴定至终点时,所消耗的体积之比V(HCl)/V(NaOH)应是一定的。
0.1 mol/LHCl溶液和0.1 mol/LNaOH溶液相互滴定时,化学计量点的pH为7.00,pH突跃范围为4.30~9.70。
可选用甲基橙、甲基红、酚酞作指示剂。
本实验采用甲基橙作指示剂,用0.1 mol/L_1 Ha溶液滴定0.1 mol/LNaOH溶液,滴定终点颜色由黄色突变为橙色。
通过反复练习此滴定操作,其所消耗的体积之比V(HCl)/V(NaOH)应基本不变,由此可以检验滴定操作技术和判断滴定终点。
三.仪器和试剂1.仪器酸式滴定管(50 mL)、碱式滴定管(50 mL)、烧杯(250 mL)、锥形瓶(250 mL)、量筒、洗瓶、滴定管架、试剂瓶、台秤。