铝及其化合物转化关系化学方程式
- 格式:doc
- 大小:21.00 KB
- 文档页数:1

铝及其化合物的化学方程式和离子方程式一、铝1、铝在氧气中燃烧:4Al+3O22Al2O32、铝在氯气中燃烧:2Al+3Cl22AlCl33、铝和硫共热:2Al+3S Al2S34、铝与稀硫酸反应:2Al+3H2SO4Al2(SO4)3+3H2↑2Al+6H+2Al3++3H2↑5、铝和氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑6、铝和浓硫酸共热:2Al+6H2SO4Al2(SO4)3+3SO2↑+6H2O7、铝和浓硝酸共热:Al+6HNO3Al(NO3)3+3NO2↑+3H2OAl+6H++3NO3-Al3++3NO2↑+3H2O8、铝和稀硝酸反应:Al+4HNO3Al(NO3)3+NO ↑+2H2OAl+4H++NO3-Al3++NO ↑+2H2O8、铝和硝酸银溶液反应:Al+3AgNO3Al(NO3)3+3AgAl+3Ag+Al3++3Ag9、铝与硫酸铜溶液反应:2Al+3CuSO4Al2(SO4)3+3Cu2Al+3Cu2+2Al3++3Cu10、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe11、铝和四氧化三铁高温共热:8Al+3Fe3O44Al2O3+9Fe12、铝和氧化铜高温共热:2Al+3CuO Al2O3+3Cu13、铝和二氧化锰高温共热:4Al+3MnO22Al2O3+3Mn二、氧化铝1、氧化铝与稀硫酸反应:Al 2O 3+3H 2SO4Al 2(SO 4)3 +3H 2O Al 2O 3+6H+2Al 3++3H 2O2、氧化铝与氢氧化钠溶液反应:Al 2O 3+2NaOH2NaAlO 2+H 2O Al 2O 3+2OH-2AlO 2-+H 2O3、电解氧化铝的熔融液:2Al 2O34Al +3O 2↑三、氢氧化铝1、氢氧化铝与稀硫酸反应:2Al(OH)3 +3H 2SO 4Al 2(SO 4)3 +6H 2O Al(OH)3 +3H +Al 3++3H 2O2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 +NaOH NaAlO 2+2H 2OAl(OH)3 +OH-AlO 2-+2H 2O3、加热氢氧化铝:2Al(OH)3Al 2O 3+3H 2O四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:Al 2(SO 4)3 +3BaCl 22AlCl 3+3BaSO 4↓SO 42-+Ba 2+BaSO 4↓2、硫酸铝的水溶液呈酸性:Al 2(SO 4)3+6H 2O 2Al(OH)3 +3H 2SO 4 Al 3++3H 2O Al(OH)3 +3H +3、硫酸铝溶液中加入少量的氢氧化钠溶液:Al 2(SO 4)3 +6NaOH 3Na 2SO 4+2Al(OH)3↓Al 3++3OH-Al(OH)3↓4、向硫酸铝溶液中加足量的氢氧化钠溶液: Al 2(SO 4)3 +8NaOH 2NaAlO 2+3Na 2SO 4+4H 2OAl 3++4OH-AlO 2-+2H 2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液: Al 2(SO 4)3 +3Ba(OH)22Al(OH)3↓+3BaSO 4↓2Al 3++3SO 42-+3Ba 2++6OH-2Al(OH)3↓+3BaSO 4↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液:冰晶石电解Al2(SO4)3+4Ba(OH)2Ba(AlO2)2+3BaSO4↓+4H2O2Al3++3SO42-+3Ba2++8OH-2AlO2-+3BaSO4↓+4H2O7、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2+2KAl(SO4)22Al(OH)3↓+3BaSO4↓+K2SO43Ba2++6OH-+2Al3++3SO42-3BaSO4↓+2Al(OH)3↓8、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2OAl3++2SO42-+2Ba2++4OH-AlO2-+2BaSO4↓+2H2O9、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4Al3++3NH3·H2O Al(OH)3↓+3NH4+10、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O2Al(OH)3↓+3Na2SO4+3CO2↑2Al3++3CO32-+3H2O2Al(OH)3↓+3CO2↑11、向硫酸铝溶液中加入碳酸氢钠溶液:Al2(SO4)3+6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑Al3++3HCO3-Al(OH)3↓+3CO2↑12、向硫酸铝溶液中加入硫化钠溶液:Al2(SO4)3+3Na2S+6H2O2Al(OH)3↓+3Na2SO4+3H2S ↑2Al3++3S2-+6H2O2Al(OH)3↓+3H2S ↑13、向硫酸铝溶液中加入硫氢化钠溶液:Al2(SO4)3+6NaHS+6H2O2Al(OH)3↓+3Na2SO4+6H2S ↑Al3++3HS-+3H2O Al(OH)3↓+3H2S ↑14、向硫酸铝溶液中加入硅酸钠溶液:Al2(SO4)3+3Na2SiO3+6H2O2Al(OH)3↓+3Na2SO4+3H2SiO3↓2Al3++3SiO32-+6H2O2Al(OH)3↓+3H2SiO3↓15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O AI(OH)3+NaOHAlO2-+2H2O Al(OH)3+OH-2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaClAlO2-+H++H2O Al(OH)3↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2OAlO 2-+4H+Al3++2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO3AlO2-+CO2+2H2O Al(OH)3+HCO3-6、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+NH4Cl+H2O Al(OH)3↓+NaCl+NH3↑AlO2-+NH4++H2O Al(OH)3↓+NH3↑8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO2+FeCl3+6H2O3Al(OH)3↓+Fe(OH)3↓+3NaCl3AlO2-+Fe3++6H2O3Al(OH)3↓+Fe(OH)3↓。
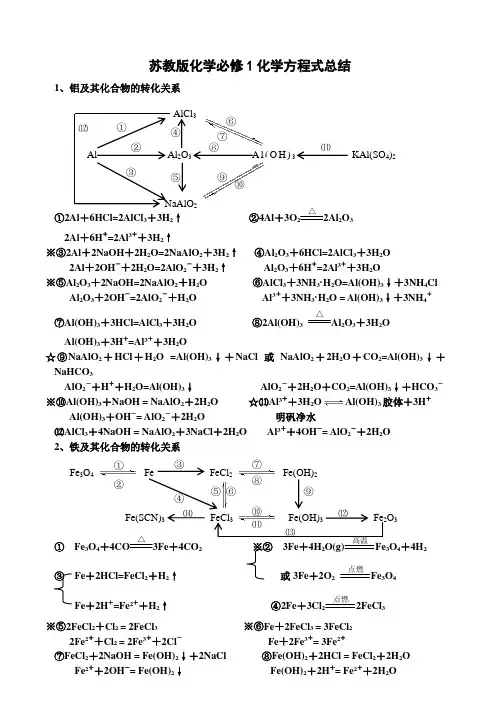
苏教版化学必修1化学方程式总结1、铝及其化合物的转化关系①2Al +6HCl=2AlCl 3+3H 2↑ ②4Al +3O 2 △2Al 2O 32Al +6H +=2Al 3++3H 2↑※③2Al +2NaOH +2H 2O=2NaAlO 2+3H 2↑ ④Al 2O 3+6HCl=2AlCl 3+3H 2O2Al +2OH -+2H 2O=2AlO 2-+3H 2↑ Al 2O 3+6H +=2Al 3++3H 2O ※⑤Al 2O 3+2NaOH=2NaAlO 2+H 2O ⑥AlCl 3+3NH 3·H 2O=Al(OH)3↓+3NH 4ClAl 2O 3+2OH -=2AlO 2-+H 2O Al 3++3NH 3·H 2O = Al(OH)3↓+3NH 4+⑦Al(OH)3+3HCl=AlCl 3+3H 2O ⑧2Al(OH)3△Al 2O 3+3H 2OAl(OH)3+3H +=Al 3++3H 2O☆⑨NaAlO 2+HCl +H 2O =Al(OH)3↓+NaCl 或NaAlO 2+2H 2O +CO 2=Al(OH)3↓+NaHCO 3AlO 2-+H ++H 2O=Al(OH)3↓ AlO 2-+2H 2O +CO 2=Al(OH)3↓+HCO 3-※⑩Al(OH)3+NaOH = NaAlO 2+2H 2O ☆⑾Al 3++3H 2O Al(OH)3胶体+3H +Al(OH)3+OH -= AlO 2-+2H 2O 明矾净水⑿AlCl 3+4NaOH = NaAlO 2+3NaCl +2H 2O Al 3++4OH -= AlO 2-+2H 2O 2、铁及其化合物的转化关系 ① Fe 3O 4+4CO △ 3Fe +4CO 2 ※② 3Fe +4H 2O(g) Fe 3O 4+4H 2 ③ Fe +2HCl=FeCl 2+H 2↑ 或3Fe +2O 2点燃Fe 3O 4Fe +2H +=Fe 2++H 2↑④2Fe +3Cl 2点燃2FeCl 3※⑤2FeCl 2+Cl 2 = 2FeCl 3 ※⑥Fe +2FeCl 3 = 3FeCl 22Fe 2++Cl 2 = 2Fe 3++2Cl - Fe +2Fe 3+= 3Fe 2+⑦FeCl 2+2NaOH = Fe(OH)2↓+2NaCl ⑧Fe(OH)2+2HCl = FeCl 2+2H 2OFe 2++2OH -= Fe(OH)2↓ Fe(OH)2+2H += Fe 2++2H 2OFe 3O 4 Fe FeCl 2 Fe(OH)2 Fe(SCN)3 O 3 ①② ③ ④⑤ ⑥ ⑦ ⑧ ⑨⑩ ⒁ 2O 3 A l (O H )3 KAl(SO 4)22AlCl 3 ④ ⑤ ⑥⑦⑧ ⑨⑩⑾※⑨4Fe(OH)2+O 2+2H 2O = 4Fe(OH)3 ⑩FeCl 3+3NaOH = Fe(OH)3↓+3NaCl白色沉淀迅速变成灰绿色,最后变成红褐色 Fe 3++3OH -= Fe(OH)3↓⑾Fe(OH)3+3HCl = FeCl 3+3H 2O Fe 3++3H 2O Fe(OH)3胶体+3H +(净水) Fe(OH)3+3H += Fe 3++3H 2O ⑿2Fe(OH)3△Fe 2O 3+3H 2O⒀Fe 2O 3+6HCl = 2FeCl 3+3H 2O ※⒁FeCl 3+3KSCN = Fe(SCN)3+3KClFe 2O 3+6H += 2Fe 3++3H 2O Fe 3++3SCN -= Fe(SCN)3 3、钠及其化合物的转化关系①Na 2O +2HCl=2NaCl +H 2O ②2Na +2HCl=2NaCl +H 2↑Na 2O +2H +=2Na ++H 2O 2Na +2H +=2Na ++H 2↑ ③2Na 2O 2+4HCl=4NaCl +O 2↑+2H 2O ④4Na +O 2=2Na 2O2Na 2O 2+4H +=4Na ++O 2↑+2H 2O ※⑥2Na +2H 2O=2NaOH +H 2↑ ※⑤2Na +O 2△Na 2O 2 2Na +2H 2O=2Na ++2OH -+H 2↑⑦Na 2O +H 2O=2NaOH ※⑧2Na 2O 2+2H 2O=4NaOH +O 2↑Na 2O +H 2O=2Na ++2OH - 2Na 2O 2+2H 2O=4Na ++4OH -+O 2↑ ⑨Na 2O +CO 2=Na 2CO 3 ※⑩2Na 2O 2+2CO 2=2Na 2CO 3+O 2⑾2NaOH +CO 2=Na 2CO 3+H 2O ⑿Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH2OH -+CO 2=CO 32-+H 2O CO 32-+Ca 2+=CaCO 3↓⒀NaOH +CO 2=NaHCO 3 ※⒁Na 2CO 3+H 2O +CO 2=2NaHCO 3OH -+CO 2=HCO 3- CO 32-+H 2O +CO 2=2HCO 3-※⒂2NaHCO 3△2CO 3+H 2O +CO 2↑ 或 ※NaHCO 3+NaOH=Na 2CO 3+H 2OHCO 3-+OH -=CO 32-+H 2O⒃Na 2CO 3+2HCl=2NaCl +H 2O +CO 2↑ ⒄NaHCO 3+HCl=NaCl +H 2O +CO 2↑CO 32-+2H +=H 2O +CO 2↑ HCO 3-+H +=H 2O +CO 2↑补充:①石灰水中加入少量NaHCO 3 : Ca(OH)2+NaHCO 3=CaCO 3↓+NaOH +H 2OCa 2++OH -+HCO 3-=CaCO 3↓+H 2O②石灰水中加入过量NaHCO 3 : Ca(OH)2+2NaHCO 3=CaCO 3↓+Na 2CO 3+2H 2OCa 2++2OH -+2HCO 3-=CaCO 3↓+CO 32-+2H 2O 4、硫及其化合物的转化关系①S +O 2 点燃SO 2 ②2H 2S +SO 2=3S +2H 2O ※③SO 2+O 2 催化剂加热 2SO 3NaCl Na NaOH NaHCO Na 2Na 2① ② ③ ⑤⑾ ⑿ ⒁ ⒂④① S 4 ②④SO 3+H 2O = H 2SO 4 ⑤SO 2+CaO△CaSO 3 或 SO 2+Ca(OH)2 = CaSO 3↓+H 2O⑥SO 3+CaO = CaSO 4 SO 2+Ca 2++2OH -=CaSO 3↓+H 2O SO 3+Ca(OH)2 = CaSO 4+H 2O ⑦2CaSO 3+O 2 △2CaSO 4※⑧SO 2+Cl 2+2H 2O = H 2SO 4+2HCl ※⑨Cu +2H 2SO 4(浓)△CuSO 4+SO 2↑+2H 2OSO 2+Cl 2+2H 2O = 4H ++SO 42-+2Cl -Cu +2H 2SO 4(浓) △2++SO 42-+SO 2↑+2H 2O※⑩C +2H 2SO 4(浓)△CO 2↑+2SO 2↑+2H 2O5、氯及其化合物的转化关系①2Fe +3Cl 2 点燃2FeCl 3 ②Cu +Cl 2 点燃CuCl 2 ③2FeCl 3+Cu = 2FeCl 2+CuCl 22Fe 3++Cu = 2Fe 2++Cu 2+④H 2+Cl 2 2HCl※⑤MnO 2+4HCl(浓) △MnCl 2+Cl 2↑+2H 2OMnO 2+4H ++2Cl - △Mn 2++Cl 2↑+2H 2O ※⑥Cl 2+H 2O = HCl +HClO ※⑦2HClO 2HCl +O 2↑Cl 2+H 2O = H ++Cl -+HClO 2HClO 2H ++2Cl -+O 2↑※⑧Cl 2+2NaOH = NaCl +NaClO +H 2O ※⑨2Cl 2+2Ca(OH)2 = CaCl 2+Ca(ClO)2+2H 2OCl 2+2OH -= Cl -+ClO -+H 2O 工业制漂白粉※⑩Ca(ClO)2+H 2O +CO 2 = CaCO 3↓+2HClO 或Ca(ClO)2+2HCl = CaCl 2+2HClOCa 2++2ClO -+H 2O +CO 2= CaCO 3↓+2HClO 或ClO -+H += HClO 漂白粉的漂白原理向漂白粉溶液中通入过量的CO 2:Ca(ClO)2+2H 2O +2CO 2 = Ca(HCO 3)2+2HClOClO -+H 2O +CO 2 = HCO 3-+HClO6、氮及其化合物的转化关系 ※①N 2+O 2 2NO ※②2NO +O 2 = 2NO 2※③3NO 2+H 2O = 2HNO 3+NO 3NO 2+H 2O =2H ++2NO 3-+NO以上三个反应为“雷雨发庄稼”原理 扩展反应有:4NO 2+O 2+2H 2O = 4HNO 3 4NO +3O 2+2H 2O = 4HNO 3 ※④Cu +4HNO 3(浓) = Cu(NO 3)2+2NO 2↑+2H 2O 上面两个反应主要用于气体溶于水时的计算Cu +4H ++2NO 3-=Cu 2++2NO 2↑+2H 2O 或 4HNO 3 4NO 2↑+ O 2↑+ 2H 2OC +4HNO 3(浓)△2↑+2NO 2↑+2H 2O 浓硝酸见光易变黄的原因CuCl 2 HClO HCl Cl 2 FeCl 3NaClO Ca(ClO)2① ② ③ ④⑤ ⑥ ⑦⑧ ⑨ ⑩ ① ⑨ ⑧⑦ ⑥ N 2 NH 3 NH 4Cl NO NO HNO 3 ② ③ 点燃或光照 光照光照 高温或放电 光照※⑤3Cu +8HNO 3(稀) = 3Cu(NO 3)2+2NO ↑+4H 2O ⑥N 2+3H 2催化剂 高温高压2NH 33Cu +8H ++2NO 3-=3Cu 2++2NO ↑+4H 2O 合成氨反应是人工固氮的主要途径 ⑦NH 3+HCl = NH 4Cl ⑧NH 4Cl△NH 3↑+HCl ↑NH 3+H += NH 4+(水溶液中) 补充:NH 4HCO 3 △NH 3↑+H 2O+CO 2↑氨气与酸均能反应生成铵盐,且与挥发性酸 铵盐受热都易分解,但并不是所有的铵盐 (如浓HCl 、浓HNO 3)相遇时空气中有白烟 都分解出氨气,如NH 4NO 3、(NH 4)2SO 4※⑧NH 4Cl +NaOH△NaCl +NH 3↑+H 2O NH 4++OH-△NH 3↑+H 2O所有的铵盐都能与碱作用放出氨气,可利用此反应鉴别铵离子。

铝及其化合物的化学方程式和离子方程式一、铝1、铝在氧气中燃烧:4Al+3O22Al2O32、铝在氯气中燃烧:2Al+3Cl22AlCl33、铝和硫共热:2Al+3S Al2S34、铝与稀硫酸反应:2Al+3H2SO4Al2(SO4)3+3H2↑2Al+6H+2Al3++3H2↑5、铝和氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑6、铝和浓硫酸共热:2Al+6H2SO4Al2(SO4)3+3SO2↑+6H2O7、铝和浓硝酸共热:Al+6HNO3Al(NO3)3+3NO2↑+3H2OAl+6H++3NO3-Al3++3NO2↑+3H2O 8、铝和稀硝酸反应:Al+4HNO3Al(NO3)3+NO ↑+2H2OAl+4H++NO3-Al3++NO ↑+2H2O8、铝和硝酸银溶液反应:Al+3AgNO3Al(NO3)3+3AgAl+3Ag+Al3++3Ag9、铝与硫酸铜溶液反应:2Al+3CuSO4Al2(SO4)3+3Cu2Al+3Cu2+2Al3++3Cu10、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe11、铝和四氧化三铁高温共热:8Al+3Fe3O44Al2O3+9Fe12、铝和氧化铜高温共热:2Al+3CuO Al2O3+3Cu13、铝和二氧化锰高温共热:4Al+3MnO22Al2O3+3Mn二、氧化铝1、氧化铝与稀硫酸反应:Al 2O 3+3H 2SO 4Al 2(SO 4)3 +3H 2O Al 2O 3+6H+2Al 3++3H 2O2、氧化铝与氢氧化钠溶液反应:Al 2O 3+2NaOH2NaAlO 2+H 2O Al 2O 3+2OH-2AlO 2-+H 2O3、电解氧化铝的熔融液:2Al 2O 34Al +3O 2 ↑三、氢氧化铝1、氢氧化铝与稀硫酸反应:2Al(OH)3 +3H 2SO 4Al 2(SO 4)3 +6H 2O Al(OH)3 +3H +Al 3++3H 2O2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 +NaOH NaAlO 2+2H 2O Al(OH)3 +OH -AlO 2-+2H 2O3、加热氢氧化铝:2Al(OH)3 Al 2O 3+3H 2O四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:Al 2(SO 4)3 +3BaCl 22AlCl 3+3BaSO 4 ↓SO 42-+Ba 2+BaSO 4 ↓2、硫酸铝的水溶液呈酸性:Al 2(SO 4)3+6H 2O 2Al(OH)3 +3H 2SO 4 Al 3++3H 2O Al(OH)3 +3H +3、硫酸铝溶液中加入少量的氢氧化钠溶液:Al 2(SO 4)3 +6NaOH3Na 2SO 4+2Al(OH)3 ↓Al 3++3OH-Al(OH)3 ↓4、向硫酸铝溶液中加足量的氢氧化钠溶液: Al 2(SO 4)3 +8NaOH 2NaAlO 2+3Na 2SO 4+4H 2OAl 3++4OH-AlO 2-+2H 2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液: Al 2(SO 4)3 +3Ba(OH)22Al(OH)3 ↓+3BaSO 4 ↓2Al 3++3SO 42-+3Ba 2++6OH -2Al(OH)3 ↓+3BaSO 4 ↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液:冰晶石电解Al2(SO4)3+4Ba(OH)2Ba(AlO2)2+3BaSO4↓+4H2O2Al3++3SO42-+3Ba2++8OH-2AlO2-+3BaSO4↓+4H2O7、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2+2KAl(SO4)22Al(OH)3↓+3BaSO4↓+K2SO43Ba2++6OH-+2Al3++3SO42-3BaSO4↓+2Al(OH)3↓8、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2OAl3++2SO42-+2Ba2++4OH-AlO2-+2BaSO4↓+2H2O9、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4Al3++3NH3·H2O Al(OH)3↓+3NH4+10、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O2Al(OH)3↓+3Na2SO4+3CO2↑2Al3++3CO32-+3H2O2Al(OH)3↓+3CO2↑11、向硫酸铝溶液中加入碳酸氢钠溶液:Al2(SO4)3+6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑Al3++3HCO3-Al(OH)3↓+3CO2↑12、向硫酸铝溶液中加入硫化钠溶液:Al2(SO4)3+3Na2S+6H2O2Al(OH)3↓+3Na2SO4+3H2S ↑2Al3++3S2-+6H2O2Al(OH)3↓+3H2S ↑13、向硫酸铝溶液中加入硫氢化钠溶液:Al2(SO4)3+6NaHS+6H2O2Al(OH)3↓+3Na2SO4+6H2S ↑Al3++3HS-+3H2O Al(OH)3↓+3H2S ↑14、向硫酸铝溶液中加入硅酸钠溶液:Al2(SO4)3+3Na2SiO3+6H2O2Al(OH)3↓+3Na2SO4+3H2SiO3↓2Al3++3SiO32-+6H2O2Al(OH)3↓+3H2SiO3↓15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O AI(OH)3+NaOHAlO2-+2H2O Al(OH)3+OH-2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaClAlO2-+H++H2O Al(OH)3↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2OAlO2-+4H+Al3++2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO3AlO2-+CO2+2H2O Al(OH)3+HCO3-6、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+NH4Cl+H2O Al(OH)3↓+NaCl+NH3↑AlO2-+NH4++H2O Al(OH)3↓+NH3↑8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO2+FeCl3+6H2O3Al(OH)3↓+Fe(OH)3↓+3NaCl3AlO2-+Fe3++6H2O3Al(OH)3↓+Fe(OH)3↓最新文件仅供参考已改成word文本。

铝及其化合物的化学方程式和离子方程式一、铝1、铝在氧气中燃烧:4Al +3O 22Al 2O 32、铝在氯气中燃烧:2Al +3Cl 22AlCl 34、铝与稀硫酸反应:2Al +3H 2SO 4Al 2(SO 4)3 +3H 2 ↑ 2Al +6H+2Al 3++3H 2 ↑5、铝和氢氧化钠溶液反应:2Al +2NaOH +2H 2O 2NaAlO 2+3H 2 ↑ 2Al +2OH -+2H 2O 2AlO 2-+3H 2 ↑8、铝和稀硝酸反应:Al +4HNO 3Al(NO 3)3 +NO ↑+2H 2OAl +4H ++NO 3-Al 3++NO ↑+2H 2O 12、铝和氧化铜高温共热:2Al +3CuO Al 2O 3+3Cu二、氧化铝1、氧化铝与稀硫酸反应:Al 2O 3+3H 2SO 4Al 2(SO 4)3 +3H 2O Al 2O 3+6H+2Al 3++3H 2O2、氧化铝与氢氧化钠溶液反应:Al 2O 3+2NaOH2NaAlO 2+H 2O Al 2O 3+2OH-2AlO 2-+H 2O3、电解氧化铝的熔融液:2Al 2O 34Al +3O 2 ↑三、氢氧化铝1、氢氧化铝与稀硫酸反应:2Al(OH)3 +3H 2SO 4Al 2(SO 4)3 +6H 2O Al(OH)3 +3H +Al 3++3H 2O2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 +NaOH NaAlO 2+2H 2O Al(OH)3 +OH -AlO 2-+2H 2O3、加热氢氧化铝:2Al(OH)3 Al 2O 3+3H 2O四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:Al 2(SO 4)3 +3BaCl 22AlCl 3+3BaSO 4 ↓冰晶石电解SO42-+Ba2+BaSO4↓2、硫酸铝的水溶液呈酸性:Al 2(SO4)3+6H2O2Al(OH)3+3H2SO4Al3++3H 2O Al(OH)3+3H+3、硫酸铝溶液中加入少量的氢氧化钠溶液:Al2(SO4)3+6NaOH3Na2SO4+2Al(OH)3↓Al3++3OH-Al(OH)3↓4、向硫酸铝溶液中加足量的氢氧化钠溶液:Al2(SO4)3+8NaOH2NaAlO2+3Na2SO4+4H2OAl3++4OH-AlO2-+2H2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液:Al2(SO4)3+3Ba(OH)22Al(OH)3↓+3BaSO4↓2Al3++3SO42-+3Ba2++6OH-2Al(OH)3↓+3BaSO4↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液:Al2(SO4)3+4Ba(OH)2Ba(AlO2)2+3BaSO4↓+4H2O2Al3++3SO42-+3Ba2++8OH-2AlO2-+3BaSO4↓+4H2O7、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2+2KAl(SO4)22Al(OH)3↓+3BaSO4↓+K2SO43Ba2++6OH-+2Al3++3SO42-3BaSO4↓+2Al(OH)3↓8、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2OAl3++2SO42-+2Ba2++4OH-AlO2-+2BaSO4↓+2H2O9、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4Al3++3NH3·H2O Al(OH)3↓+3NH4+10、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O2Al(OH)3↓+3Na2SO4+3CO2↑2Al3++3CO32-+3H2O2Al(OH)3↓+3CO2↑11、向硫酸铝溶液中加入碳酸氢钠溶液:Al2(SO4)3+6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑Al3++3HCO3-Al(OH)3↓+3CO2↑15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO 2+2H2O AI(OH)3+NaOHAlO 2-+2H2O Al(OH)3+OH-2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaClAlO2-+H++H2O Al(OH)3↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2OAlO2-+4H+Al3++2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO3AlO2-+CO2+2H2O Al(OH)3+HCO3-6、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+NH4Cl+H2O Al(OH)3↓+NaCl+NH3↑AlO2-+NH4++H2O Al(OH)3↓+NH3↑8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO2+FeCl3+6H2O3Al(OH)3↓+Fe(OH)3↓+3NaCl3AlO2-+Fe3++6H2O3Al(OH)3↓+Fe(OH)3↓金属钠的有关化学方程式1、钠在空气中放置 4Na + O2 === 2 Na2O2、钠在空气中点燃 2Na + O2 ===== Na2O23、钠和硫反应 2Na + S === Na2S4、钠和水反应 2Na + 2H2O === 2NaOH + H2↑5、钠和硫酸铜溶液反应 2Na + CuSO4 + 2H2O === Cu(OH)2 ↓+ Na2SO4 + H2 ↑6、钠和乙醇反应 2Na + 2CH3CH2OH === 2CH3CH2ONa +H2↑7、氧化钠和水反应 Na2O + H2O === 2NaOH8、氧化钠和二氧化碳反应 Na2O + CO2 === Na2CO39、氧化钠和盐酸反应 Na2O + 2HCl === 2NaCl + H2O10、过氧化钠和水反应 2Na2O2 + 2H2O === 4NaOH + O2↑11、过氧化钠和二氧化碳反应2Na2O2 + 2CO2 === 2Na2CO3 + O2 12、12、过氧化钠和盐酸反应 2Na2O2 + 4HCl === 4NaCl + 2H2O + O2↑13、碳酸氢钠受热分解 2NaHCO3 ==== Na2CO3 + CO2↑+ H2O14、碳酸钠和盐酸反应 Na2CO3 +2HCl === 2NaCl + CO2↑ +H2ONa2CO3 + HCl ==== NaCl + NaHCO315、碳酸氢钠和盐酸反应 NaHCO3 + HCl === NaCl + CO2↑ +H2O16、碳酸钠和氢氧化钙反应 Na2CO3 + Ca(OH)2 === CaCO3 ↓+ 2NaOH17、碳酸氢钠和氢氧化钠反应 NaHCO3 + NaOH === Na2CO3 + H2O18、足量的碳酸氢钠和氢氧化钙反应 2NaHCO3 + Ca(OH)2 === CaCO3↓+ Na2CO3 + 2H2O19、少量的碳酸氢钠和氢氧化钙反应 NaHCO3 + Ca(OH)2 === CaCO3↓+ NaOH + H2O。


al及其化合物的化学方程式aluminum (Al)是一种常见的金属元素,化学符号为Al,原子序数为13。
它是一种轻质、耐腐蚀和导电性能良好的金属,广泛应用于工业和日常生活中。
在化学方程式中,Al通常以离子的形式存在,即Al3+。
Al3+是一种具有3个正电荷的阳离子,它与其他阴离子或分子结合形成化合物。
其中,最常见的化合物是氧化铝(aluminum oxide,Al2O3)。
氧化铝是一种白色固体,具有高熔点和高硬度,被广泛用作陶瓷材料、砂纸和研磨剂等。
氧化铝的化学方程式为:2Al + 3O2 → 2Al2O3这个方程式表示了氧化铝的合成反应,其中2个Al原子与3个O2分子反应生成2个Al2O3分子。
这个反应是一个氧化反应,Al原子失去电子形成Al3+离子,而氧气分子接受电子形成氧化物离子(O2-)。
Al2O3是一种离子化合物,其中Al3+离子和O2-离子通过离子键结合在一起。
Al还可以与非金属元素形成其他化合物,如与氯(Cl)形成氯化铝(aluminum chloride,AlCl3)。
氯化铝是一种白色晶体,具有强烈的吸湿性,可用作催化剂和制造其他化学品的原料。
氯化铝的化学方程式为:2Al + 3Cl2 → 2AlCl3这个方程式表示了氯化铝的合成反应,其中2个Al原子与3个Cl2分子反应生成2个AlCl3分子。
这个反应是一个氧化还原反应,Al 原子失去电子形成Al3+离子,而氯气分子接受电子形成氯离子(Cl-)。
AlCl3是一种离子化合物,其中Al3+离子和Cl-离子通过离子键结合在一起。
Al还可以与氧气和盐酸等物质反应生成不同的化合物。
例如,当Al 与氧气反应时,可以生成氧化铝(Al2O3),而当Al与盐酸反应时,可以生成氯化铝(AlCl3)。
这些化合物在工业生产和实验室研究中都有广泛的应用。
总结起来,Al及其化合物的化学方程式描述了Al原子与其他元素或化合物之间的反应过程,通过失去或接受电子形成不同的离子化合物。

铝及其化合物的化学方程式和离子方程式一、铝1、铝在氧气中燃烧:4Al+3O22Al2O32、铝在氯气中燃烧:2Al+3Cl22AlCl33、铝和硫共热:2Al+3S Al2S34、铝与稀硫酸反应:2Al+3H2SO4Al2(SO4)3+3H2↑2Al+6H+2Al3++3H2↑5、铝和氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑ 2Al+2OH-+2H2O2AlO2-+3H2↑6、铝和浓硫酸共热:2Al+6H2SO4Al2(SO4)3+3SO2↑+6H2O7、铝和浓硝酸共热:Al+6HNO3Al(NO3)3+3NO2↑+3H2OAl+6H++3NO3-Al3++3NO2↑+3H2O 8、铝和稀硝酸反应:Al+4HNO3Al(NO3)3+NO ↑+2H2OAl+4H++NO3-Al3++NO ↑+2H2O8、铝和硝酸银溶液反应:Al+3AgNO3Al(NO3)3+3AgAl+3Ag+Al3++3Ag9、铝与硫酸铜溶液反应:2Al+3CuSO4Al2(SO4)3+3Cu2Al+3Cu2+2Al3++3Cu10、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe11、铝和四氧化三铁高温共热:8Al+3Fe3O44Al2O3+9Fe12、铝和二氧化锰高温共热:4Al+3MnO22Al2O3+3Mn二、氧化铝1、氧化铝与稀硫酸反应:Al2O3+3H2SO4Al2(SO4)3+3H2OAl2O3+6H+2Al3++3H2O2、氧化铝与氢氧化钠溶液反应:Al 2O 3+2NaOH2NaAlO 2+H 2O Al 2O 3+2OH-2AlO 2-+H 2O3、电解氧化铝的熔融液:2Al 2O 34Al +3O 2 ↑ 三、氢氧化铝1、氢氧化铝与稀硫酸反应:2Al(OH )3 +3H 2SO 4Al 2(SO 4)3 +6H 2OAl(OH)3 +3H +Al 3++3H 2O2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 +NaOHNaAlO 2+2H 2O Al (OH)3 +OH-AlO 2-+2H 2O3、加热氢氧化铝:2Al(OH )3 Al 2O 3+3H 2O四、硫酸铝1、硫酸铝的水溶液呈酸性:Al 2(SO 4)3+6H 2O2Al(OH )3 +3H 2SO 4Al 3++3H 2OAl(OH)3 +3H +2、硫酸铝溶液中加入少量的氢氧化钠溶液:Al 2(SO 4)3 +6NaOH 3Na 2SO 4+2Al(OH )3 ↓Al 3++3OH-Al(OH)3 ↓3、向硫酸铝溶液中加足量的氢氧化钠溶液:Al 2(SO 4)3 +8NaOH 2NaAlO 2+3Na 2SO 4+4H 2OAl 3++4OH-AlO 2-+2H 2O4、向硫酸铝溶液中加入少量的氢氧化钡溶液:Al 2(SO 4)3 +3Ba(OH)2 2Al (OH )3 ↓+3BaSO 4 ↓2Al 3++3SO 42-+3Ba 2++6OH-2Al (OH)3 ↓+3BaSO 4 ↓5、向硫酸铝溶液中加入足量的氢氧化钡溶液:Al 2(SO 4)3 +4Ba(OH)2Ba(AlO 2)2 +3BaSO 4 ↓+4H 2O冰晶石电解2Al3++3SO42-+3Ba2++8OH-2AlO2-+3BaSO4↓+4H2O6、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4Al3++3NH3·H2O Al(OH)3↓+3NH4+7、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O2Al(OH)3↓+3Na2SO4+3CO2↑2Al3++3CO32-+3H2O2Al(OH)3↓+3CO2↑8、向硫酸铝溶液中加入碳酸氢钠溶液(灭火器原理):Al2(SO4)3+6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑Al3++3HCO3-Al(OH)3↓+3CO2↑9、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O AI(OH)3+NaOHAlO2-+2H2O Al(OH)3+OH-2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaClAlO2-+H++H2O Al(OH)3↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2OAlO2-+4H+Al3++2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO3AlO2-+CO2+2H2O Al(OH)3+HCO3-6、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓六、明矾1、明矾净水:Al3++3H2O Al(OH)3(胶体)+3H+2、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2+2KAl(SO4)22Al(OH)3↓+3BaSO4↓+K2SO4 3Ba2++6OH-+2Al3++3SO42-3BaSO4↓+2Al(OH)3↓3、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2O Al3++2SO42-+2Ba2++4OH-AlO2-+2BaSO4↓+2H2O。

铝及其化合物的化学方程式和离子方程式一、铝?1、铝在氧气中燃烧:4Al+3O2=2Al2O3?2、铝在氯气中燃烧:2Al+3Cl2=2AlCl3?3、铝和硫共热:2Al+3S=Al2S3?4、铝与稀硫酸反应:2Al+3H2SO4=Al2(SO4)3?+3H2?↑?2Al+6H+=2Al3++3H2?↑?5、铝和氢氧化钠溶液反应:2Al+2NaOH+2H2O=2NaAlO2+3H2?↑?????????????????????????6、铝和浓硫酸共热:2Al+6H2SO4=Al2(SO4)3?+3SO2?↑+6H2O?7、铝和浓硝酸共热:Al+6HNO3=Al(NO3)3?+3NO2?↑+3H2O?8、铝和稀硝酸反应:Al+4HNO3=Al(NO3)3?+NO?↑+2H2O??9、铝和硝酸银溶液反应:Al+3AgNO3=Al(NO3)3?+3Ag?Al+3Ag10、铝与硫酸铜溶液反应:2Al+3CuSO4=Al2(SO4)3?+3Cu?2Al+3Cu2?11、铝和氧化铁高温下反应:2Al+Fe2O3=Al2O3+2Fe?12、铝和四氧化三铁高温共热:8Al+3Fe3O4=4Al2O3+9Fe?13、铝和氧化铜高温共热:2Al+3CuO=Al2O3+3Cu?14、铝和二氧化锰高温共热:4Al+3MnO2=2Al2O3+3Mn?二、氧化铝?1、氧化铝与稀硫酸反应:Al2O3+3H2SO4=Al2(SO4)3?+3H2O?Al2O3+6H2、氧化铝与氢氧化钠溶液反应:Al2O3+2NaOH=2NaAlO2+H2O?Al2O3+2OH3、电解氧化铝的熔融液:2Al2O3=4Al+3O2?↑?三、氢氧化铝?1、氢氧化铝与稀硫酸反应:2Al(OH)3?+3H2SO4=Al2(SO4)3?+6H2O?2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3?+NaOH=NaAlO2+2H2O????????????????????????????3、加热氢氧化铝:2Al(OH)3=?Al2O3+3H2O?四、硫酸铝?1、硫酸铝溶液与氯化钡溶液混合:Al2(SO4)3?+3BaCl2=2AlCl3+3BaSO4?↓??2、硫酸铝的水溶液呈酸性:Al2(SO4)3+6H2O=2Al(OH)3?+3H2SO4??3、硫酸铝溶液中加入少量的氢氧化钠溶液:Al2(SO4)3?+6NaOH=3Na2SO4+2Al(OH)3?↓?4、向硫酸铝溶液中加足量的氢氧化钠溶液?Al2(SO4)3?+8NaOH=2NaAlO2+3Na2SO4+4H2O?5、向硫酸铝溶液中加入少量的氢氧化钡溶液:?Al2(SO4)3?+3Ba(OH)2?=2Al(OH)3?↓+3BaSO4?↓?6、向硫酸铝溶液中加入足量的氢氧化钡溶液:??冰晶石??电解?Al2(SO4)3?+4Ba(OH)2?=Ba(AlO2)2?+3BaSO4?↓+4H2O?7、向明矾溶液中加入少量的氢氧化钡溶液:?3Ba(OH)2?+2KAl(SO4)2?=2Al(OH)3?↓+3BaSO4?↓+K2SO4?? 8、向明矾溶液中加入足量的氢氧化钡溶液:?????KAl(SO4)2?+2Ba(OH)2?=KAlO2+2BaSO4?↓+2H2O?9、向硫酸铝溶液中加入氨水:Al2(SO4)3?+6NH3·H2O=2Al(OH)3?↓+3(NH4)2SO4?10、向硫酸铝溶液中加入碳酸钠溶液:?Al2(SO4)3?+3Na2CO3+3H2O=2Al(OH)3?↓+3Na2SO4+3CO2?↑?11、向硫酸铝溶液中加入碳酸氢钠溶液:?Al2(SO4)3?+6NaHCO3=2Al(OH)3?↓+3Na2SO4+6CO2?↑?12、向硫酸铝溶液中加入硫化钠溶液:?Al2(SO4)3?+3Na2S+6H2O=2Al(OH)3?↓+3Na2SO4+3H2S?↑?13、向硫酸铝溶液中加入硫氢化钠溶液:?Al2(SO4)3?+6NaHS+6H2O=2Al(OH)3?↓+3Na2SO4+6H2S?↑?14、向硫酸铝溶液中加入硅酸钠溶液:?Al2(SO4)3?+3Na2SiO3+6H2O=2Al(OH)3?↓+3Na2SO4+3H2SiO3?↓?15、向硫酸铝溶液中加入偏铝酸钠溶液:?Al2(SO4)3?+6NaAlO2+12H2O=3Na2SO4+8Al(OH)3?↓?五、偏铝酸钠?1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O=AI(OH)3?+NaOH??2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O=Al(OH)3?↓+NaCl??3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl=NaCl+AlCl3+2H2O?4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O=2Al(OH)3?↓+Na2CO3?5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O=Al(OH)3?+NaHCO36、向偏铝酸钠溶液中加入硫酸铝溶液:?Al2(SO4)3?+6NaAlO2+12H2O=3Na2SO4+8Al(OH)3?↓?7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+NH4Cl+H2O=Al(OH)3?↓+NaCl+NH3?↑?????????????????????????????8、向偏铝酸钠溶液中加入氯化铁溶液:?3NaAlO2+FeCl3+6H2O=3Al(OH)3?↓+Fe(OH)3?↓+3NaCl?。

铝及其化合物的化学方程式和离子方程式文件编码(008-TTIG-UTITD-GKBTT-PUUTI-WYTUI-8256)铝及其化合物的化学方程式和离子方程式一、铝1、铝在氧气中燃烧:4Al+3O2=2Al2O32、铝在氯气中燃烧:2Al+3Cl2=2AlCl33、铝和硫共热:2Al+3S=Al2S34、铝与稀硫酸反应:2Al+3H2SO4=Al2(SO4)3+3H2↑2Al+6H+=2Al3++3H2↑5、铝和氢氧化钠溶液反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑6、铝和浓硫酸共热:2Al+6H2SO4=Al2(SO4)3+3SO2↑+6H2O7、铝和浓硝酸共热:Al+6HNO3=Al(NO3)3+3NO2↑+3H2O8、铝和稀硝酸反应:Al+4HNO3=Al(NO3)3+NO↑+2H2O9、铝和硝酸银溶液反应:Al+3AgNO3=Al(NO3)3+3AgAl+3Ag10、铝与硫酸铜溶液反应:2Al+3CuSO4=Al2(SO4)3+3Cu2Al+3Cu211、铝和氧化铁高温下反应:2Al+Fe2O3=Al2O3+2Fe12、铝和四氧化三铁高温共热:8Al+3Fe3O4=4Al2O3+9Fe13、铝和氧化铜高温共热:2Al+3CuO=Al2O3+3Cu14、铝和二氧化锰高温共热:4Al+3MnO2=2Al2O3+3Mn二、氧化铝1、氧化铝与稀硫酸反应:Al2O3+3H2SO4=Al2(SO4)3+3H2OAl2O3+6H2、氧化铝与氢氧化钠溶液反应:Al2O3+2NaOH=2NaAlO2+H2OAl2O3+2OH3、电解氧化铝的熔融液:2Al2O3=4Al+3O2↑三、氢氧化铝1、氢氧化铝与稀硫酸反应:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3+NaOH=NaAlO2+2H2O3、加热氢氧化铝:2Al(OH)3=Al2O3+3H2O四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:Al2(SO4)3+3BaCl2=2AlCl3+3BaSO4↓2、硫酸铝的水溶液呈酸性:Al2(SO4)3+6H2O=2Al(OH)3+3H2SO43、硫酸铝溶液中加入少量的氢氧化钠溶液:Al2(SO4)3+6NaOH=3Na2SO4+2Al(OH)3↓4、向硫酸铝溶液中加足量的氢氧化钠溶液Al2(SO4)3+8NaOH=2NaAlO2+3Na2SO4+4H2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液:Al2(SO4)3+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液:冰晶石电解Al2(SO4)3+4Ba(OH)2=Ba(AlO2)2+3BaSO4↓+4H2O7、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2+2KAl(SO4)2=2Al(OH)3↓+3BaSO4↓+K2SO48、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2=KAlO2+2BaSO4↓+2H2O9、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO410、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O=2Al(OH)3↓+3Na2SO4+3CO2↑Al2(SO4)3+6NaHCO3=2Al(OH)3↓+3Na2SO4+6CO2↑12、向硫酸铝溶液中加入硫化钠溶液:Al2(SO4)3+3Na2S+6H2O=2Al(OH)3↓+3Na2SO4+3H2S↑13、向硫酸铝溶液中加入硫氢化钠溶液:Al2(SO4)3+6NaHS+6H2O=2Al(OH)3↓+3Na2SO4+6H2S↑14、向硫酸铝溶液中加入硅酸钠溶液:Al2(SO4)3+3Na2SiO3+6H2O=2Al(OH)3↓+3Na2SO4+3H2SiO3↓15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O=3Na2SO4+8Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O=AI(OH)3+NaOH2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl=NaCl+AlCl3+2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO35、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O=Al(OH)3+NaHCO36、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O=3Na2SO4+8Al(OH)3↓7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+NH4Cl+H2O=Al(OH)3↓+NaCl+NH3↑3NaAlO2+FeCl3+6H2O=3Al(OH)3↓+Fe(OH)3↓+3NaCl。

铝及其化合物的化学方程式和离子方程式1、铝和硫共热:2Al+3S Al2S32、铝与稀硫酸反应:2Al+3H2SO 4Al2(SO4)3+3H2↑2Al+6H +2Al3++3H2↑3、铝和氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑4、铝与硫酸铜溶液反应:2Al+3CuSO 4Al2(SO4)3+3Cu2Al+3Cu2+2Al3++3Cu5、铝和氧化铁高温下反应:2Al+Fe2O 3Al2O3+2Fe6、铝和二氧化锰高温共热:4Al+3MnO 22Al2O3+3Mn7、氧化铝与氢氧化钠溶液反应:Al2O3+2NaOH2NaAlO2+H2OAl2O3+2OH -2AlO2-+H2O8、电解氧化铝的熔融液:2Al2O 34Al+3O2↑9、氢氧化铝与氢氧化钠溶液反应:Al(OH)3+NaOH NaAlO2+2H2OAl(OH)3+OH-AlO2-+2H2O10、加热氢氧化铝:2Al(OH)3Al2O3+3H2O11、硫酸铝溶液中加入少量的氢氧化钠溶液:Al2(SO4)3+6NaOH3Na2SO4+2Al(OH)3↓Al3++3OH-Al(OH)3↓12、向硫酸铝溶液中加足量的氢氧化钠溶液:Al2(SO4)3+8NaOH2NaAlO2+3Na2SO4+4H2OAl3++4OH-AlO2-+2H2O 13、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2+2KAl(SO4)22Al(OH)3↓+3BaSO4↓+K2SO43Ba2++6OH-+2Al3++3SO42-3BaSO4↓+2Al(OH)3↓14、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2OAl3++2SO42-+2Ba2++4OH-AlO2-+2BaSO4↓+2H2O15、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4Al3++3NH3·H2O Al(OH)3↓+3NH4+16、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓17、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaClAlO2-+H++H2O Al(OH)3↓18、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2OAlO2-+4H+Al3++2H2O19、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-20、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO3AlO2-+CO2+2H2O Al(OH)3+HCO3-冰晶石电解铝及其化合物的化学方程式和离子方程式1、铝和硫共热:2、铝与稀硫酸反应:3、铝和氢氧化钠溶液反应:4、铝与硫酸铜溶液反应:5、铝和氧化铁高温下反应:6、铝和二氧化锰高温共热:7氧化铝与氢氧化钠溶液反应:8、电解氧化铝的熔融液:9、氢氧化铝与氢氧化钠溶液反应:10、加热氢氧化铝:11、硫酸铝溶液中加入少量的氢氧化钠溶液:12、向硫酸铝溶液中加足量的氢氧化钠溶液:13、向明矾溶液中加入少量的氢氧化钡溶液:14、向明矾溶液中加入足量的氢氧化钡溶液:15、向硫酸铝溶液中加入氨水:16、向硫酸铝溶液中加入偏铝酸钠溶液:17、偏铝酸钠溶液滴入少量盐酸:18、向偏铝酸钠溶液加入足量盐酸:19、向偏铝酸钠溶液通入少量二氧化碳气体:20、向偏铝酸钠溶液通入足量二氧化碳气体:铝及其化合物的化学方程式和离子方程式1、铝和硫共热:2、铝与稀硫酸反应:3、铝和氢氧化钠溶液反应:4、铝与硫酸铜溶液反应:5、铝和氧化铁高温下反应:6、铝和二氧化锰高温共热:7氧化铝与氢氧化钠溶液反应:8、电解氧化铝的熔融液:9、氢氧化铝与氢氧化钠溶液反应:10、加热氢氧化铝:11、硫酸铝溶液中加入少量的氢氧化钠溶液:12、向硫酸铝溶液中加足量的氢氧化钠溶液:13、向明矾溶液中加入少量的氢氧化钡溶液:14、向明矾溶液中加入足量的氢氧化钡溶液:15、向硫酸铝溶液中加入氨水:16、向硫酸铝溶液中加入偏铝酸钠溶液:17、偏铝酸钠溶液滴入少量盐酸:18、向偏铝酸钠溶液加入足量盐酸:19、向偏铝酸钠溶液通入少量二氧化碳气体:20、向偏铝酸钠溶液通入足量二氧化碳气体:。

铝及其化合物的化学方程式和离子方程式一、铝1、铝在氧气中燃烧:4Al+3O22Al2O32、铝在氯气中燃烧:2Al+3Cl22AlCl33、铝和硫共热:2Al+3S Al2S34、铝与稀硫酸反应:2Al+3H2SO4Al2(SO4)3+3H2↑2Al+6H+2Al3++3H2↑5、铝和氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑6、铝和浓硫酸共热:2Al+6H2SO4Al2(SO4)3+3SO2↑+6H2O7、铝和浓硝酸共热:Al+6HNO3Al(NO3)3+3NO2↑+3H2OAl+6H++3NO3-Al3++3NO2↑+3H2O8、铝和稀硝酸反应:Al+4HNO3Al(NO3)3+NO ↑+2H2OAl+4H++NO3-Al3++NO ↑+2H2O8、铝和硝酸银溶液反应:Al+3AgNO3Al(NO3)3+3AgAl+3Ag+Al3++3Ag9、铝与硫酸铜溶液反应:2Al+3CuSO4Al2(SO4)3+3Cu2Al+3Cu2+2Al3++3Cu10、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe11、铝和四氧化三铁高温共热:8Al+3Fe3O44Al2O3+9Fe12、铝和氧化铜高温共热:2Al+3CuO Al2O3+3Cu13、铝和二氧化锰高温共热:4Al+3MnO22Al2O3+3Mn二、氧化铝1、氧化铝与稀硫酸反应:Al 2O 3+3H 2SO4Al 2(SO 4)3 +3H 2O Al 2O 3+6H+2Al 3++3H 2O2、氧化铝与氢氧化钠溶液反应:Al 2O 3+2NaOH2NaAlO 2+H 2O Al 2O 3+2OH-2AlO 2-+H 2O3、电解氧化铝的熔融液:2Al 2O34Al +3O 2 ↑三、氢氧化铝1、氢氧化铝与稀硫酸反应:2Al(OH)3 +3H 2SO 4Al 2(SO 4)3 +6H 2O Al(OH)3 +3H +Al 3++3H 2O2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 +NaOH NaAlO 2+2H 2O Al(OH)3 +OH -AlO 2-+2H 2O3、加热氢氧化铝:2Al(OH)3 Al 2O 3+3H 2O四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:Al 2(SO 4)3 +3BaCl 22AlCl 3+3BaSO 4 ↓SO 42-+Ba 2+BaSO 4 ↓2、硫酸铝的水溶液呈酸性:Al 2(SO 4)3+6H 2O 2Al(OH)3 +3H 2SO 4 Al 3++3H 2O Al(OH)3 +3H +3、硫酸铝溶液中加入少量的氢氧化钠溶液:Al 2(SO 4)3 +6NaOH3Na 2SO 4+2Al(OH)3 ↓Al 3++3OH-Al(OH)3 ↓4、向硫酸铝溶液中加足量的氢氧化钠溶液: Al 2(SO 4)3 +8NaOH 2NaAlO 2+3Na 2SO 4+4H 2OAl 3++4OH-AlO 2-+2H 2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液: Al 2(SO 4)3 +3Ba(OH)22Al(OH)3 ↓+3BaSO 4 ↓2Al 3++3SO 42-+3Ba 2++6OH-2Al(OH)3 ↓+3BaSO 4 ↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液:冰晶石电解Al2(SO4)3+4Ba(OH)2Ba(AlO2)2+3BaSO4↓+4H2O2Al3++3SO42-+3Ba2++8OH-2AlO2-+3BaSO4↓+4H2O7、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2+2KAl(SO4)22Al(OH)3↓+3BaSO4↓+K2SO43Ba2++6OH-+2Al3++3SO42-3BaSO4↓+2Al(OH)3↓8、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2OAl3++2SO42-+2Ba2++4OH-AlO2-+2BaSO4↓+2H2O9、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4Al3++3NH3·H2O Al(OH)3↓+3NH4+10、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O2Al(OH)3↓+3Na2SO4+3CO2↑2Al3++3CO32-+3H2O2Al(OH)3↓+3CO2↑11、向硫酸铝溶液中加入碳酸氢钠溶液:Al2(SO4)3+6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑Al3++3HCO3-Al(OH)3↓+3CO2↑12、向硫酸铝溶液中加入硫化钠溶液:Al2(SO4)3+3Na2S+6H2O2Al(OH)3↓+3Na2SO4+3H2S ↑2Al3++3S2-+6H2O2Al(OH)3↓+3H2S ↑13、向硫酸铝溶液中加入硫氢化钠溶液:Al2(SO4)3+6NaHS+6H2O2Al(OH)3↓+3Na2SO4+6H2S ↑Al3++3HS-+3H2O Al(OH)3↓+3H2S ↑14、向硫酸铝溶液中加入硅酸钠溶液:Al2(SO4)3+3Na2SiO3+6H2O2Al(OH)3↓+3Na2SO4+3H2SiO3↓2Al3++3SiO32-+6H2O2Al(OH)3↓+3H2SiO3↓15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O AI(OH)3+NaOHAlO2-+2H2O Al(OH)3+OH-2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaClAlO2-+H++H2O Al(OH)3↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2OAlO2-+4H+Al3++2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO3AlO2-+CO2+2H2O Al(OH)3+HCO3-6、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+NH4Cl+H2O Al(OH)3↓+NaCl+NH3↑AlO2-+NH4++H2O Al(OH)3↓+NH3↑8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO2+FeCl3+6H2O3Al(OH)3↓+Fe(OH)3↓+3NaCl3AlO2-+Fe3++6H2O3Al(OH)3↓+Fe(OH)3↓。
铝及其化合物的化学方程式和离子方程式一、铝1、铝在氧气中燃烧:4Al+3O22Al2O32、铝在氯气中燃烧:2Al+3Cl22AlCl33、铝和硫共热:2Al+3SAl2S34、铝与稀硫酸反应:2Al+3H2SO4Al2(SO4)3+3H2 ↑2Al+6H+2Al3++3H2 ↑5、铝和氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2 ↑2Al+2OH-+2H2O2AlO2-+3H2 ↑6、铝和浓硫酸共热:2Al+6H2SO4Al2(SO4)3+3SO2 ↑+6H2O7、铝和浓硝酸共热:Al+6HNO3Al(NO3)3+3NO2 ↑+3H2OAl+6H++3NO3-Al3++3NO2 ↑+3H2O8、铝和稀硝酸反应:Al+4HNO3Al(NO3)3+NO ↑+2H2OAl+4H++NO3-Al3++NO ↑+2H2O8、铝和硝酸银溶液反应:Al+3AgNO3Al(NO3)3+3AgAl+3Ag+Al3++3Ag9、铝与硫酸铜溶液反应:2Al+3CuSO4Al2(SO4)3+3Cu2Al+3Cu2+2Al3++3Cu10、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe11、铝和四氧化三铁高温共热:8Al+3Fe3O44Al2O3+9Fe12、铝和氧化铜高温共热:2Al+3CuOAl2O3+3Cu13、铝和二氧化锰高温共热:4Al+3MnO22Al2O3+3Mn二、氧化铝1、氧化铝与稀硫酸反应:Al2O3+3H2SO4Al2(SO4)3+3H2OAl2O3+6H+2Al3++3H2O2、氧化铝与氢氧化钠溶液反应:Al2O3+2NaOH2NaAlO2+H2OAl2O3+2OH-2AlO2-+H2O3、电解氧化铝的熔融液:2Al2O34Al+3O2 ↑冰晶石电解三、氢氧化铝1、氢氧化铝与稀硫酸反应:2Al(OH)3+3H2SO4Al2(SO4)3+6H2OAl(OH)3+3H+Al3++3H2O2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3+NaOHNaAlO2+2H2OAl(OH)3+OH-AlO2-+2H2O3、加热氢氧化铝:2Al(OH)3Al2O3+3H2O四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:Al2(SO4)3+3BaCl22AlCl3+3BaSO4 ↓SO42-+Ba2+BaSO4 ↓2、硫酸铝的水溶液呈酸性:Al2(SO4)3+6H2O2Al(OH)3+3H2SO4Al3++3H2OAl(OH)3+3H+3、硫酸铝溶液中加入少量的氢氧化钠溶液:Al2(SO4)3+6NaOH3Na2SO4+2Al(OH)3 ↓Al3++3OH-Al(OH)3 ↓4、向硫酸铝溶液中加足量的氢氧化钠溶液:Al2(SO4)3+8NaOH2NaAlO2+3Na2SO4+4H2OAl3++4OH-AlO2-+2H2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液:Al2(SO4)3+3Ba(OH)22Al(OH)3 ↓+3BaSO4 ↓2Al3++3SO42-+3Ba2++6OH-2Al(OH)3 ↓+3BaSO4 ↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液:Al2(SO4)3+4Ba(OH)2Ba(AlO2)2+3BaSO4 ↓+4H2O2Al3++3SO42-+3Ba2++8OH-2AlO2-+3BaSO4 ↓+4H2O7、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2+2KAl(SO4)22Al(OH)3 ↓+3BaSO4 ↓+K2SO43Ba2++6OH-+2Al3++3SO42-3BaSO4 ↓+2Al(OH)3 ↓8、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4 ↓+2H2OAl3++2SO42-+2Ba2++4OH-AlO2-+2BaSO4 ↓+2H2O9、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3 ↓+3(NH4)2SO4Al3++3NH3·H2OAl(OH)3 ↓+3NH4+10、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O2Al(OH)3 ↓+3Na2SO4+3CO2 ↑2Al3++3CO32-+3H2O2Al(OH)3 ↓+3CO2 ↑11、向硫酸铝溶液中加入碳酸氢钠溶液:Al2(SO4)3+6NaHCO32Al(OH)3 ↓+3Na2SO4+6CO2 ↑Al3++3HCO3-Al(OH)3 ↓+3CO2 ↑12、向硫酸铝溶液中加入硫化钠溶液:Al2(SO4)3+3Na2S+6H2O2Al(OH)3 ↓+3Na2SO4+3H2S ↑2Al3++3S2-+6H2O2Al(OH)3 ↓+3H2S ↑13、向硫酸铝溶液中加入硫氢化钠溶液:Al2(SO4)3+6NaHS+6H2O2Al(OH)3 ↓+3Na2SO4+6H2S ↑Al3++3HS-+3H2OAl(OH)3 ↓+3H2S ↑14、向硫酸铝溶液中加入硅酸钠溶液:Al2(SO4)3+3Na2SiO3+6H2O2Al(OH)3 ↓+3Na2SO4+3H2SiO3 ↓2Al3++3SiO32-+6H2O2Al(OH)3 ↓+3H2SiO3 ↓15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3 ↓Al3++AlO2-+6H2O4Al(OH)3 ↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+2H2OAI(OH)3+NaOHAlO2-+2H2OAl(OH)3+OH-2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2OAl(OH)3 ↓+NaClAlO2-+H++H2OAl(OH)3 ↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HClNaCl+AlCl3+2H2OAlO2-+4H+Al3++2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3 ↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3 ↓+CO32-5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2OAl(OH)3+NaHCO3AlO2-+CO2+2H2OAl(OH)3+HCO3-6、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3 ↓Al3++AlO2-+6H2O4Al(OH)3 ↓7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+NH4Cl+H2OAl(OH)3 ↓+NaCl+NH3 ↑AlO2-+NH4++H2OAl(OH)3 ↓+NH3 ↑8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO2+FeCl3+6H2O3Al(OH)3 ↓+Fe(OH)3 ↓+3NaCl3AlO2-+Fe3++6H2O3Al(OH)3 ↓+Fe(OH)3 ↓。
铝及其化合物的化学方程式和离子方程式一、铝1、铝在氧气中燃烧:4Al +3O 22Al 2O 3 2、铝在氯气中燃烧:2Al +3Cl 22AlCl 3 3、铝和硫共热:2Al +3SAl 2S 3 4、铝与稀硫酸反应:2Al +3H 2SO4Al 2(SO 4)3 +3H 2 ↑2Al +6H+2Al 3++3H 2 ↑ 5、铝和氢氧化钠溶液反应:2Al +2NaOH +2H 2O 2NaAlO 2+3H 2 ↑ 2Al +2OH -+2H 2O2AlO 2-+3H 2 ↑ 6、铝和浓硫酸共热:2Al +6H 2SO 4Al 2(SO 4)3 +3SO 2 ↑+6H 2O 7、铝和浓硝酸共热:Al +6HNO 3Al(NO 3)3 +3NO 2 ↑+3H 2O Al +6H ++3NO 3-Al 3++3NO 2 ↑+3H 2O 8、铝和稀硝酸反应:Al +4HNO3Al(NO 3)3 +NO ↑+2H 2O Al +4H ++NO 3-Al 3++NO ↑+2H 2O 8、铝和硝酸银溶液反应:Al +3AgNO3Al(NO 3)3 +3AgAl +3Ag+Al 3++3Ag 9、铝与硫酸铜溶液反应:2Al +3CuSO4Al 2(SO 4)3 +3Cu2Al +3Cu 2+2Al 3++3Cu 10、铝和氧化铁高温下反应:2Al +Fe 2O 3Al 2O 3+2Fe11、铝和四氧化三铁高温共热:8Al +3Fe 3O 44Al 2O 3+9Fe12、铝和氧化铜高温共热:2Al +3CuO Al 2O 3+3Cu13、铝和二氧化锰高温共热:4Al +3MnO 22Al 2O 3+3Mn二、氧化铝 1、氧化铝与稀硫酸反应:Al 2O 3+3H 2SO4Al 2(SO 4)3 +3H 2OAl 2O 3+6H +2Al 3++3H 2O 2、氧化铝与氢氧化钠溶液反应:Al 2O 3+2NaOH 2NaAlO 2+H 2O Al 2O 3+2OH-2AlO 2-+H 2O3、电解氧化铝的熔融液:2Al 2O34Al +3O 2 ↑三、氢氧化铝1、氢氧化铝与稀硫酸反应:2Al(OH)3 +3H 2SO 4Al 2(SO 4)3 +6H 2O Al(OH)3 +3H +Al 3++3H 2O2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 +NaOHNaAlO 2+2H 2O Al(OH)3 +OH-AlO 2-+2H 2O 3、加热氢氧化铝:2Al(OH)3Al 2O 3+3H 2O 四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:Al 2(SO 4)3 +3BaCl 22AlCl 3+3BaSO 4 ↓ SO 42-+Ba 2+BaSO 4 ↓冰晶石 电解2、硫酸铝的水溶液呈酸性:Al2(SO4)3+6H2O2Al(OH)3+3H2SO4Al3++3H2O Al(OH)3+3H+3、硫酸铝溶液中加入少量的氢氧化钠溶液:Al2(SO4)3+6NaOH3Na2SO4+2Al(OH)3↓Al3++3OH-Al(OH)3↓4、向硫酸铝溶液中加足量的氢氧化钠溶液:Al2(SO4)3+8NaOH2NaAlO2+3Na2SO4+4H2OAl3++4OH-AlO2-+2H2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液:Al2(SO4)3+3Ba(OH)22Al(OH)3↓+3BaSO4↓2Al3++3SO42-+3Ba2++6OH-2Al(OH)3↓+3BaSO4↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液:Al2(SO4)3+4Ba(OH)2Ba(AlO2)2+3BaSO4↓+4H2O2Al3++3SO42-+3Ba2++8OH-2AlO2-+3BaSO4↓+4H2O7、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2+2KAl(SO4)22Al(OH)3↓+3BaSO4↓+K2SO43Ba2++6OH-+2Al3++3SO42-3BaSO4↓+2Al(OH)3↓8、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2OAl3++2SO42-+2Ba2++4OH-AlO2-+2BaSO4↓+2H2O9、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4Al3++3NH3·H2O Al(OH)3↓+3NH4+10、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O2Al(OH)3↓+3Na2SO4+3CO2↑2Al3++3CO32-+3H2O2Al(OH)3↓+3CO2↑11、向硫酸铝溶液中加入碳酸氢钠溶液:Al2(SO4)3+6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑Al3++3HCO3-Al(OH)3↓+3CO2↑12、向硫酸铝溶液中加入硫化钠溶液:Al2(SO4)3+3Na2S+6H2O2Al(OH)3↓+3Na2SO4+3H2S ↑2Al3++3S2-+6H2O2Al(OH)3↓+3H2S ↑13、向硫酸铝溶液中加入硫氢化钠溶液:Al2(SO4)3+6NaHS+6H2O2Al(OH)3↓+3Na2SO4+6H2S ↑Al3++3HS-+3H2O Al(OH)3↓+3H2S ↑14、向硫酸铝溶液中加入硅酸钠溶液:Al2(SO4)3+3Na2SiO3+6H2O2Al(OH)3↓+3Na2SO4+3H2SiO3↓2Al3++3SiO32-+6H2O2Al(OH)3↓+3H2SiO3↓15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O AI(OH)3+NaOHAlO2-+2H2O Al(OH)3+OH-2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaClAlO2-+H++H2O Al(OH)3↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2OAlO2-+4H+Al3++2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO3AlO2-+CO2+2H2O Al(OH)3+HCO3-6、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+NH4Cl+H2O Al(OH)3↓+NaCl+NH3↑AlO2-+NH4++H2O Al(OH)3↓+NH3↑8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO2+FeCl3+6H2O3Al(OH)3↓+Fe(OH)3↓+3NaCl3AlO2-+Fe3++6H2O3Al(OH)3↓+Fe(OH)3↓。
铝及其化合物的化学方程式和离子方程式一、铝1、铝在氧气中燃烧:4Al +3O 22Al 2O 32、铝在氯气中燃烧:2Al +3Cl 22AlCl 33、铝和硫共热:2Al +3S Al 2S 34、铝与稀硫酸反应:2Al +3H 2SO 4Al 2(SO 4)3 +3H 2 ↑2Al +6H+2Al 3++3H 2 ↑5、铝和氢氧化钠溶液反应:2Al +2NaOH +2H 2O 2NaAlO 2+3H 2 ↑2Al +2OH -+2H 2O 2AlO 2-+3H 2 ↑6、铝和浓硫酸共热:2Al +6H 2SO 4Al 2(SO 4)3 +3SO 2 ↑+6H 2O7、铝和浓硝酸共热:Al +6HNO 3Al(NO 3)3 +3NO 2 ↑+3H 2OAl +6H ++3NO 3-Al 3++3NO 2 ↑+3H 2O8、铝和稀硝酸反应:Al +4HNO 3Al(NO 3)3 +NO ↑+2H 2OAl +4H ++NO 3-Al 3++NO ↑+2H 2O8、铝和硝酸银溶液反应:Al +3AgNO 3Al(NO 3)3 +3Ag Al +3Ag+Al 3++3Ag9、铝与硫酸铜溶液反应:2Al +3CuSO 4Al 2(SO 4)3 +3Cu2Al +3Cu 2+2Al 3++3Cu10、铝和氧化铁高温下反应:2Al +Fe 2O 3Al 2O 3+2Fe 11、铝和四氧化三铁高温共热:8Al +3Fe 3O 44Al 2O 3+9Fe 12、铝和氧化铜高温共热:2Al +3CuO Al 2O 3+3Cu13、铝和二氧化锰高温共热:4Al +3MnO 22Al 2O 3+3Mn 二、氧化铝1、氧化铝与稀硫酸反应:Al 2O 3+3H 2SO 4Al 2(SO 4)3 +3H 2OAl 2O 3+6H+2Al 3++3H 2O2、氧化铝与氢氧化钠溶液反应:Al 2O 3+2NaOH 2NaAlO 2+H 2OAl 2O 3+2OH-2AlO 2-+H 2O3、电解氧化铝的熔融液:2Al 2O 34Al +3O 2 ↑三、氢氧化铝1、氢氧化铝与稀硫酸反应:2Al(OH)3 +3H 2SO 4Al 2(SO 4)3 +6H 2OAl(OH)3 +3H +Al 3++3H 2O 2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 +NaOH NaAlO 2+2H 2OAl(OH)3 +OH -AlO 2-+2H 2O 3、加热氢氧化铝:2Al(OH)3 Al 2O 3+3H 2O冰晶石电解四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:Al2(SO4)3+3BaCl22AlCl3+3BaSO4↓SO42-+Ba2+BaSO4↓2、硫酸铝的水溶液呈酸性:Al 2(SO4)3+6H2O2Al(OH)3+3H2SO4Al3++3H 2O Al(OH)3+3H+3、硫酸铝溶液中加入少量的氢氧化钠溶液:Al2(SO4)3+6NaOH3Na2SO4+2Al(OH)3↓Al3++3OH-Al(OH)3↓4、向硫酸铝溶液中加足量的氢氧化钠溶液:Al2(SO4)3+8NaOH2NaAlO2+3Na2SO4+4H2OAl3++4OH-AlO2-+2H2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液:Al2(SO4)3+3Ba(OH)22Al(OH)3↓+3BaSO4↓2Al3++3SO42-+3Ba2++6OH-2Al(OH)3↓+3BaSO4↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液:Al2(SO4)3+4Ba(OH)2Ba(AlO2)2+3BaSO4↓+4H2O2Al3++3SO42-+3Ba2++8OH-2AlO2-+3BaSO4↓+4H2O7、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2+2KAl(SO4)22Al(OH)3↓+3BaSO4↓+K2SO43Ba2++6OH-+2Al3++3SO42-3BaSO4↓+2Al(OH)3↓8、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2OAl3++2SO42-+2Ba2++4OH-AlO2-+2BaSO4↓+2H2O9、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4Al3++3NH3·H2O Al(OH)3↓+3NH4+10、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O2Al(OH)3↓+3Na2SO4+3CO2↑2Al3++3CO32-+3H2O2Al(OH)3↓+3CO2↑11、向硫酸铝溶液中加入碳酸氢钠溶液:Al2(SO4)3+6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑Al3++3HCO3-Al(OH)3↓+3CO2↑12、向硫酸铝溶液中加入硫化钠溶液:Al2(SO4)3+3Na2S+6H2O2Al(OH)3↓+3Na2SO4+3H2S ↑2Al3++3S2-+6H2O2Al(OH)3↓+3H2S ↑13、向硫酸铝溶液中加入硫氢化钠溶液:Al2(SO4)3+6NaHS+6H2O2Al(OH)3↓+3Na2SO4+6H2S ↑Al3++3HS-+3H2O Al(OH)3↓+3H2S ↑14、向硫酸铝溶液中加入硅酸钠溶液:Al2(SO4)3+3Na2SiO3+6H2O2Al(OH)3↓+3Na2SO4+3H2SiO3↓2Al3++3SiO32-+6H2O2Al(OH)3↓+3H2SiO3↓15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO 2+2H2O AI(OH)3+NaOHAlO 2-+2H2O Al(OH)3+OH-2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaClAlO2-+H++H2O Al(OH)3↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2OAlO2-+4H+Al3++2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO3 AlO2-+CO2+2H2O Al(OH)3+HCO3-6、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+NH4Cl+H2O Al(OH)3↓+NaCl+NH3↑AlO2-+NH4++H2O Al(OH)3↓+NH3↑8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO2+FeCl3+6H2O3Al(OH)3↓+Fe(OH)3↓+3NaCl3AlO2-+Fe3++6H2O3Al(OH)3↓+Fe(OH)3↓。
铝的化学方程式总结
一、铝的性质
铝是一种银白色的轻金属,具有较高的导电性和导热性。
在常温下,铝与空气中的氧气反应生成致密的氧化铝薄膜,从而阻止内部的铝继续被氧化。
氧化铝薄膜形成:4Al + 3O2 → 2Al2O3
二、铝单质
铝与氧气的反应
在常温下,铝与氧气反应生成氧化铝:4Al + 3O2 →
2Al2O3
在加热条件下,铝与氧气反应生成三氧化二铝:4Al + 3O2 → 2Al2O3
铝与酸的反应
铝与稀硫酸反应生成硫酸铝和氢气:2Al + 3H2SO4 →
Al2(SO4)3 + 3H2
铝与稀盐酸反应生成氯化铝和氢气:2Al + 6HCl → 2AlCl3 + 3H2
铝与碱的反应
铝与氢氧化钠溶液反应生成偏铝酸钠和氢气:2Al +
2NaOH + 2H2O → 2NaAlO2 + 3H2
三、铝化合物
铝盐
硫酸铝:Al2(SO4)3
氯化铝:AlCl3
硝酸铝:[Al(NO3)3]
明矾:[KAl(SO4)2]·12H2O
铝酸盐
偏铝酸钾:KAl(OH)4]
偏铝酸钠:NaAlO2
其他铝化合物
氧化铝:Al2O3
氢氧化铝:[Al(OH)3]
四、铝的应用
建筑业
由于其轻便和耐腐蚀的特性,铝广泛应用于建筑业,如建筑材料、门窗框架等。
航空航天
由于其高强度和轻便性,铝在航空航天领域有广泛应用,如飞机机身、火箭结构等。
包装材料
由于其良好的阻隔性能和轻便性,铝被用作包装材料,如食品包装、饮料罐等。
铝及其化合物转化关系相关化学或离子方程式
姓名
1、铝与稀硫酸反应
2、铝与稀硝酸反应
3、铝与氢氧化钾溶液反应
4、铝与四氧化三铁混合加热
5、铝与氯化铜溶液反应
6、氧化铝与硫酸反应
7、氧化铝与氢氧化钾溶液反应
8、电解熔融的氧化铝
9、氢氧化铝与稀硝酸反应
10、氢氧化铝与氢氧化钾溶液反应
11、氢氧化铝加热分解
12、氯化铝溶液中通入过量氨水
13、氯化铝溶液中加入少量氢氧化钾溶液
14、氯化铝溶液中加入过量氢氧化钾溶液
15、氯化铝溶液中加入偏铝酸钠溶液
16、氯化铝溶液和碳酸钠溶液混合
17、氯化铝溶液和硫化钠溶液混合
18、氯化铝溶液和碳酸氢钠溶液混合
19、偏铝酸钠溶液与少量盐酸混合
20、偏铝酸钠溶液与过量盐酸混合
21、偏铝酸钠溶液中通入少量二氧化碳
22、偏铝酸钠溶液中通入过量二氧化碳。