高考化学二轮复习(讲解+典型例题分析)4.3常见无机气体的鉴别
- 格式:doc
- 大小:101.01 KB
- 文档页数:5


常见无机阴离子的辨别氯溴碘和磷酸根,加酸再加硝酸银。
欲想辨别硝酸根,浓硫酸铜热定音。
亚硫酸根碳酸根,用酸酸化即可分。
硫酸钡水酸难溶,硫根加酸气难闻。
偏铝酸根硅酸根,滴增强酸可定论。
说明:一、亚硫酸根碳酸根,用酸酸化即可分:意思是说用酸酸化溶液,假设生成二氧化硫气体的那么是SO32-,假设生成二氧化碳的,那么是CO32-[联想:二氧化硫和二氧化碳的辨别]。
二、硫根加酸气难闻:“硫根”指S2-。
意思是说用酸酸化含S2-的溶液,那么生成难闻的气体——硫化氢[联想:硫化氢的辨别]。
3、偏铝酸根硅酸根,滴增强酸可定论:这句说的是AIO2-和SiO32-的辨别方式。
在溶液中加入强酸,假设生成白色絮状沉淀,继续加酸沉淀又溶解者,那么是AIO2-,假设仅生成白色絮状沉淀,酸过量后沉淀不溶解那么是SiO32-。
离子反映式为:AIO2-+H++H2O=AI(OH)3↓AI(OH)3 +3H+=AI3++3H2OSiO32-+2H++H2O=H4SiO4↓【典型例题1】辨别碳酸根离子最简单的方式是()A.加热产生二氧化碳B.滴入紫色石蕊试液变红色C.通入CO2,产生白色沉淀D.加入稀盐酸,产生的气体能使燃着的木条熄灭【考点】证明碳酸盐【分析】能够依照碳酸盐的性质方面进行分析、判定,含碳酸根离子的盐能与盐酸反映生成二氧化碳气体,二氧化碳不支持燃烧【解析】碳酸根离子能和盐酸反映生成二氧化碳,故查验碳酸根离子的方式是:将样品与足量的盐酸反映,使生成的气体进入澄清的石灰水中,假设显现浑浊现象,该样品中含有碳酸根离子,也能够用燃着的木条查验生成的气体,若是燃着的木条熄灭,证明该气体是二氧化碳。
应选:D。
【点评】解答此题的关键是要把握碳酸盐的性质,只有把握了碳酸盐的性质才能正确的判定查验碳酸根离子的方式.【典型例题2】辨别Cl-、Br-、I-三种离子,不宜选用的试剂组是()A.溴水和淀粉溶液B.AgNO3溶液和稀HNO3C.氯水和CCl4溶液D.氯水和淀粉溶液【考点】氯、溴、碘及其化合物的综合应用;常见阴离子的查验【分析】已知还原性:I->Br->Cl-,辨别三种离子可利用氯水别离加入到三种溶液中,能生成I2、Br2,二者颜色不同,还可加入AgNO3溶液和稀HNO3,可别离生成不同颜色的沉淀.【解析】A.溴水不能辨别Cl-和Br-,故A错误;B.加入AgNO3溶液和稀HNO3,别离生成白色的AgCl、浅黄色的AgBr和黄色的AgI沉淀,三者颜色不同,可辨别,故B正确;C.加入氯水和CCl4溶液,能生成I2、Br2,二者颜色不同,可辨别,故C正确;D.加入氯水和淀粉溶液,无现象的是Cl-,溶液呈橙黄色的是Br-,呈蓝色的是I-,可辨别,故D正确.应选A。

高三化学二轮专题复习——无机推断知识总结无机推断知识总结一、解题思路和步骤:无机推断题解题思路和步骤:阅读题目一挖掘信息f选择信息一查找突破口一推断整理f得出结论一规范书写★阅读题目:注意限制性语句,专门隐含的条件,找准找全。
★选择信息:将试题信息与大脑或教材知识相比较,进行加工、选择,找岀有用信息。
★查找突破口:突破口这是解题的关键。
突破口能够是反应条件、反应现象、也可能是专门性质(如气体的生成、沉淀的生成、颜色的变化、溶解度、专门反应等)★规范书写的内容:物质的拿称、化学式、结构式、结构简式、电子式、表示物质形成过程的电子表达式、化学方程式、离子方程式、电离方程式。
二、査找突破口需巩固的知识1、物质的特点现象:(1)物质的颜色:有色气体单质:F:、Cl=、03苴他有色单质:Br:(深红色液体,蒸气为红棕色)、L (紫黑色固体)、S (淡黄色固体)、 Cu (紫红色固体)、P(白磷是白色固体,红磷是暗红色固体)、Si (灰黑色晶体)、C (黑色粉未)无色气体单质:%、0:、比有色气体化合物:N0:(红棕色)黄色固体:S、Na©、AgBr (浅黄)、Agl、AgaPOj (黄色)黑色固体:FeO、Fe』:、MnO:、C、CuS、PbS、Ag=S、CuO红色固体:Fe(OH),(红褐色)、FeO (红棕色)、CucO (红色)、Cu (红色)、红磷(暗红〕蓝色固体:五水合硫酸铜(胆矶或蓝矶)CuSO. ・5H:0、Cu(OH)s;绿色固体:七水合硫酸亚铁(绿矶〕FeSO.・7比0:紫黑色固体:KMnOi、碘单质。
有色离子(溶液):Cf (蓝色或绿色)、F』(浅绿)、Fe”(棕黄)、MnO:(紫红色)、Fe(SCN)54(血红色〕、(淀粉遇碘单质(IJ水溶液呈蓝色、 Fe"与苯酚呈紫色)不溶于稀酸的白色沉淀:AgCl、BaSO:、Ag:SO.不溶于稀酸的黄色沉淀:S、AgBr. Agl焰色反应显黄色的是钠元素,显紫色的钾元素(透过蓝色钻玻璃观看)(2)气体特点:常见的气体有:单质:比、Cl=、0=氢化物:讯、H$、HC1.氧化物:CO:、SO:、NO、NO:、CO有机物:CHt、沁 C-Hi. HCHO如能使品红溶液褪色加热又复原红色的气体是S0=; CL能使品红溶液褪色加热不能复原红色:滴有石裁试液的C0:(或SOJ溶液加热后红色变紫色;滴有甲基橙溶液的C0=(或SOJ溶液加热后红色变橙色或黄色等。
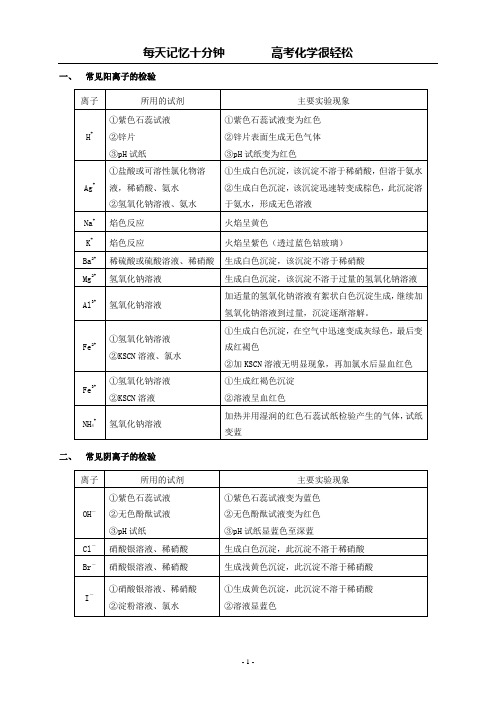
一、常见阳离子的检验
二、常见阴离子的检验
三、气体检验方法
氢气(H2):无色、无味有还原性。
在空气中燃烧火焰呈浅蓝色,有爆鸣声,生成物只有水。
氧气(O2):无色、无味,用带火星的木条检验,使木条复燃。
氯气(Cl2):黄绿色、有刺激性气味,溶于水,漂白性、氧化性。
和O3,NO2一样使湿润的碘化钾淀粉试纸变蓝
氯化氢气体(HCl):无色、有刺激性气味的气体,在潮湿的空气中形成白雾。
①可使沾有浓氨水的玻璃棒产生白烟。
②可使湿润的蓝色石蕊试纸变红。
③将少量硝酸银
和稀硝酸加入集气瓶,产生白色沉淀。
二氧化硫(SO2):无色有刺激性气味,通入品红溶液红色退去,再加热。
又出现红色,能使酸性高猛酸钾溶液褪色。
氨气(NH3):无色有刺激性气味,①可使沾有浓盐酸的玻璃棒产生白烟。
②可使湿润的红色石蕊试纸变蓝。
一氧化氮(NO):无色气体,打开瓶口与空气接触,立即变为红棕色气体。
二氧化氮(NO2):红棕色、刺激性气味,易溶于水并反应。
①溶于水,溶液无色但能使紫色石蕊试液变红。
②可使湿润的淀粉KI试纸变蓝。
其他气体的干扰:
1、不是只有氢气才产生爆鸣声,可点燃的气体不一定是氢气
2、Cl2,O3,NO2都能使湿润的KI淀粉试纸变蓝
3、注意SO2和Cl2的区别。

年级高三学科化学版本苏教版内容标题无机非金属元素及其化合物【本讲教化信息】一. 教学内容:无机非金属元素及其化合物二. 教学目标驾驭氯、氧、硫、氮、磷、碳、硅所在主族元素性质的相像性、递变规律和特别性;重点驾驭几种常见典型物质的物理性质和化学性质;驾驭硫酸、硝酸的化学性质;驾驭氯气、二氧化硫、一氧化氮、二氧化氮、二氧化碳、氨气、氢气的试验室制法和气体的收集与尾气的汲取。
三. 教学重点、难点常见非金属元素的性质及相互关系四. 教学过程:元素化合物是中学化学的主体,这部分内容与基本概念、基本理论相互渗透,与化学试验、化学计算联系紧密。
复习元素化合物,要运用规律、把握关键、抓住重点、联系实际、编织元素化合物的科学体系。
元素化合物学问复习中要留意相像、相近内容的总结归纳。
如SO2、CO2、SO3、P2O5、SiO2等都是酸性氧化物,它们的性质有相像之处也有相异点。
高考命题时常会把这种关系编入试题中。
近几年的高考试题中这种趋向比较明显,值得大家重视。
说明:1. 氯元素的学问网络2. 次氯酸、漂白粉的性质HClO分子的结构式为H-O-Cl(氧处于中心),所以电子式为。
次氯酸、次氯酸钙等有多方面的性质,常常用到以下几方面性质:(1)HClO是一种弱酸,与碳酸比较电离实力有如下关系:H2CO3>HClO>HCO3-,请分析下列反应:少量二氧化碳通入NaClO溶液中:NaClO + CO2+H2O=NaHCO3+HClO氯气通入碳酸氢钠溶液中:Cl2+NaHCO3=NaCl+CO2↑+HClO(2)ClO-是一种弱酸的酸根离子,能发生水解反应:ClO-+H2O HClO+OH-,所以次氯酸钙溶液显碱性。
若遇到铁盐、铝盐易发生双水解:3ClO-+Fe3++3H2O=Fe(OH)3↓+3HClO(3)HClO和ClO-都具有强氧化性,无论酸性、碱性条件下都可以跟亚铁盐、碘化物、硫化物等发生氧化还原反应,但不能使品红溶液褪色。

高考化学无机推断知识点高考化学无机推断是高考化学考试中的一个重要内容,也是考生需要重点关注和掌握的知识点之一。
本文将通过介绍无机推断的基本概念、常见方法、应用和注意事项,来帮助考生全面了解并有效备考化学无机推断。
一、基本概念无机推断是通过一系列实验方法和化学反应,根据物质在反应过程中的特点,推断出物质的组成成分、性质或结构的一种方法。
它是根据指定化合物在特定条件下的物理和化学性质,通过与未知物质的反应,确定未知物质的成分和性质,从而推断出未知物质的特征。
二、常见方法1. 滴定法:滴定法是通过反应物容量的测定来推断未知物质的化学组成。
常见的滴定法包括酸碱滴定法、氧化还原滴定法和络合滴定法等。
2. 沉淀法:沉淀法是通过沉淀形成与溶液中某些离子形成不溶性沉淀物,来推断未知物质中的离子组成。
常见的沉淀法包括硫化沉淀法、氯化沉淀法和碳酸盐沉淀法等。
3. 反应法:反应法是通过观察未知物质与其他物质发生反应的结果,来推断出未知物质的性质和成分。
常见的反应法包括酸碱中和反应、氧化还原反应和络合反应等。
三、应用无机推断在实际应用中具有广泛的用途,主要体现在以下几个方面:1. 化学分析:无机推断可以应用于分析化学领域,通过对样品中各种离子的推断,来判断样品的组成和性质。
这对于环境监测、食品检测和医药分析等具有重要意义。
2. 金属材料检验:无机推断可以帮助检验人员快速准确地判断金属材料的成分和品质。
例如,通过检测金属材料中的杂质元素,可以评估其纯度和可用性。
3. 矿物鉴定:无机推断在地质学和矿物学中有着重要的应用,可以帮助研究人员确定矿物样品的成分和结构,从而进一步探索矿产资源和地质活动。
四、注意事项在进行无机推断的过程中,考生应注意以下几点:1. 实验操作的准确性:化学实验操作的准确性对于推断结果的准确性至关重要,因此考生需要熟练掌握实验操作技巧,并注意实验条件和反应时间等关键因素。
2. 化学反应的基本原理:在进行无机推断时,考生需要了解化学反应的基本原理,掌握不同反应类型的特点和规律,从而能够准确判断未知物质的性质和成分。
高考化学常见考点解析无机化学篇高考化学常见考点解析——无机化学篇一、氢氧化物和氧化物氢氧化物和氧化物是无机化学中的重要概念和考点。
氢氧化物是指含有氧化氢(OH)基团的化合物,例如氢氧化钠(NaOH),氢氧化铜(Cu(OH)2)等。
氧化物是指含有氧元素的化合物,例如二氧化碳(CO2),三氧化硫(SO3)等。
1. 氢氧化物的性质和应用氢氧化物的性质取决于其阳离子和氢氧化根离子的特性。
氢氧化钠是一种强碱,可以与酸进行中和反应;氢氧化铜具有一定的盐基性,可与酸反应但不完全中和。
氢氧化物在实际应用中广泛存在。
例如,氢氧化钠是一种重要的工业碱,用于制备皂基、玻璃、纸张等;氢氧化铝是一种重要的消炎药物,可用于治疗胃溃疡等胃肠道疾病。
2. 氧化物的性质和应用氧化物通常表现出酸性、碱性或中性。
例如,二氧化碳是一种酸性氧化物,可溶于水形成碳酸,导致水溶液呈酸性;三氧化硫是一种酸性氧化物,可与碱反应生成硫酸。
氧化物在工业生产和日常生活中具有广泛的应用。
例如,二氧化硅是玻璃、陶瓷等材料的重要组成部分;二氧化锆是一种高温材料,用于制造耐火材料和陶瓷颗粒;氧化铁常用于制备磁性材料。
二、离子反应与电解离子反应和电解是高考化学中较为复杂的内容,但也是常见的考点。
1. 离子反应离子反应是指发生氧化还原反应时,离子之间发生转移或交换的反应。
例如,铁与硫酸铜溶液反应产生铜和硫酸亚铁,反应式为Fe + CuSO4 -> Cu + FeSO4。
离子反应中需要掌握离子的价态和电荷等信息,以确定反应类型和化学方程式。
2. 电解电解是指利用外加电源将电能转化为化学能,使物质发生氧化还原反应。
电解涉及到电解质溶液、电解槽和电解过程等概念。
电解质溶液是指能导电的溶液,通过电解质溶液通电,可以观察到正负极生成气体、析出金属等现象。
电解槽是进行电解实验时所使用的容器,通常由两个电极(阴极和阳极)和一个电解质溶液组成。
电解过程是指在电解槽中,离子在电解质溶液中移动、氧化还原的过程。
常见无机阳离子的鉴别特色离子记心中。
加入碱液自分明。
活泼金属阳离子,烟色反应分别清。
锌铝液中加强碱,先出沉淀后无踪。
铜铁锌铝注氨水,铵中加碱氨气生。
银遇盐酸出沉淀,再加氨水沉淀溶。
亚铁盐中加碱液,白色灰绿又褐棕。
硫氰鉴别三价铁,硫酸钡水酸难溶。
钾钠钡钙四离子,紫黄黄绿和砖红。
说明:在该诗中所有的金属名称都指金属离子。
解释:1、特色离子记心中,加入碱液自分明,活泼金属阳离子,烟色反应分别清:这四句简述了鉴别阳离子的方法。
“特色离子”在此指在水溶液中有特别颜色的离子,在目前的中学阶段,只要记住常见的三种离子就行了:Cu2+蓝色、Fe2+绿色;Fe3+随着浓度的增大颜色由黄变到棕黄,由棕黄变到棕红。
意思是说,在鉴别阳离子的时候,必须首先注意溶液的颜色,根据颜色判定是否存在“特色离子”;加入碱液后,一些阳离子就会产生了独特的现象;活泼的金属阳离子与碱不反应,但可通过烟色反应鉴别。
2、锌铝液中加强碱,先出沉淀后无踪:意思是说在Zn2+或AI3+的溶液中加入强碱,则首先出现白色沉淀,继续加入强碱则白色沉淀又溶解,离子反应式为:Zn2++2OH-=Zn(OH)2↓Zn(OH)2 +2OH-=ZnO22++H2OAI3++3OH-=AI(OH)3↓AI(OH)3 +OH-=AIO2-+2H2O3、铜铁锌铝注氨水:在Cu2+、Fe3+、Zn2+、AI3+中加入氨水,则产生不同的现象:①加入氨水生成蓝色沉淀,继续加入,若蓝色沉淀又溶解呈深蓝色溶液,则证明是铜离子。
离子反应式为:Cu2++2NH3·H2O =Cu(OH)2↓+2NH4+Cu(OH)2+4NH3·H2O =[Cu(NH3)4]2++2OH-+4H2O②若加入氨水有红棕色沉淀生成,过量后沉淀不消失者,则为Fe3+,离子反应式为:Fe3++3NH3·H2O =Fe(OH)3↓+3NH4+③加入氨水生成白色絮状沉淀,继续加入氨水,沉淀又溶解,则证明是Zn2+,离子反应式为:Zn2++2NH3·H2O =Zn(OH)2↓+2NH4+Zn(OH)2+4NH3·H2O =[Zn(NH3)4]2++2OH-+4H2O④加入氨水仅生成白色沉淀,继续加入氨水沉淀不溶解者,则为AI3+,离子反应式为:AI3++3NH3·H2O =AI(OH)3↓+3NH4+4、铵中加碱氨气生:意思是说在溶液中加入碱加热,若有氨气逸出[联想:氨气的鉴别],则证明溶液中有NH4+,离子反应式为:NH4++OH-NH3↑+H2O5、银遇盐酸出沉淀,再加氨水沉淀溶:意思是说Ag+溶液中加入盐酸,则出现白色沉淀,加入氨水沉淀又溶解。
高考化学无机化学反应题型总结与知识点清单 2024无机化学是高考化学中的重要内容之一,涉及到的反应种类众多且知识点繁杂。
为了帮助同学们更好地备考和应对高考化学无机化学反应题型,本文将对常见的无机化学反应题型进行总结,并给出相应的知识点清单。
一、氧化还原反应氧化还原反应是无机化学中的重要反应类型,涉及到电子的转移和氧化态的变化。
在高考中,常见的氧化还原反应题型有:平衡方程式的书写、氧化态的确定、氧化剂和还原剂的鉴定等。
下面是一些常见的知识点:1. 氧化态的确定方法:根据元素的共价电子对和离子电荷数来确定氧化态,需熟悉元素的氧化态变化规律,如氧元素的氧化态通常为-2,氢元素的氧化态通常为+1等。
2. 氧化剂和还原剂的鉴定:需要了解常见的氧化剂和还原剂的特点和性质,如氧化剂通常具有高的氧化能力、易还原和自身被氧化等特点;还原剂通常具有高的还原能力、易氧化和自身被还原等特点。
3. 平衡方程式的书写:需掌握平衡方程式的规则和方法,平衡方程式中应确保质量守恒、电荷守恒和原子数守恒。
二、酸碱中和反应酸碱中和反应是无机化学中较为常见的反应类型,涉及到酸和碱的反应。
在高考中,常见的酸碱中和反应题型有:酸碱的滴定计算、中和反应的平衡方程式等。
以下是一些常见的知识点:1. 酸碱的性质和定义:需要了解酸的性质和定义、碱的性质和定义,如酸呈酸性、可溶于水生成氢离子,碱呈碱性、可溶于水生成氢氧根离子等。
2. 酸碱中和反应的平衡方程式:需根据酸碱的化学式和反应特点书写平衡方程式,并确保质量守恒、电荷守恒和原子数守恒。
3. 酸碱滴定计算:需熟悉酸碱滴定的计算方法,包括滴定反应的化学计量关系、滴定过程中溶液浓度的计算等。
三、沉淀反应沉淀反应是无机化学中常见的反应类型,涉及到溶液中离子之间的交换。
在高考中,常见的沉淀反应题型有:沉淀生成物的识别、沉淀反应的平衡方程式等。
以下是一些常见的知识点:1. 沉淀生成物的识别:需要熟悉常见沉淀生成物的外观和性质,如氯化银生成白色沉淀、碳酸钙生成白色沉淀等。
高三化学二轮专题复习——无机推断知识总结doc高中化学无机推断知识总结一、解题思路和步骤:无机推断题解题思路和步骤:阅读题目一挖掘信息f选择信息一查找突破口一推断整理一得出结论一规范书写★阅读题目:注意限制性语句,专门隐含的条件,找准找全。
★选择信息:将试题信息与大脑或教材知识相比较,进行加工、选择,找出有用信息。
★查找突破口:突破口这是解题的关键。
突破口能够是反应条件、反应现象、也可能是专门性质(如气体的生成、沉淀的生成、颜色的变化、溶解度、专门反应等)★规范书写的内容:物质的名称、化学式、结构式、结构简式、电子式、表示物质形成过程的电子表达式、化学方程式、离子方程式、电离方程式。
二、査找突破口需巩固的知识1、物质的特点现象:(1)物质的颜色:有色气体单质:F:、C1:、03苴他有色单质:B“(深红色液体,蒸气为红棕色)、L (紫黑色固体)、S (淡黄色固体)、Cu (紫红色固体)、P (白磷是白色固体,红磷是暗红色固体)、Si (灰黑色晶体)、C (黑色粉未)无色气体单质:N:、0=、比有色气体化合物:NO:(红棕色)黄色固体:S^ Na:0:% AgBr (浅黄)、Agl、AgjPOi (黄色)黑色固体:FeO、Fe』:、MnO:、C、CuS、PbS、Ag=S、CuO红色固体:Fe(OH),(红褐色)、Fe20,(红棕色)、Cu=0 (红色)、Cu (红色)、红磷(暗红〕蓝色固体:五水合硫酸铜〔胆矶或蓝矶)CuSO, ・5H:0、C U(OH)3;绿色固体:七水合硫酸亚铁(绿矶〕FeSO. - 7H:0:紫黑色固体:KMnO。
、碘单质。
有色离子(溶液1 :Cf (蓝色或绿色)、Ff (浅绿)、Fe”(棕黄)、MnO:(紫红色)、Fe(SC『(血红色〕、〔淀粉遇碘单质(IJ水溶液呈蓝色、Fe”与苯酚呈紫色〕不溶于稀酸的白色沉淀:AgCl、BaSO:、Ag=SO.不溶于稀酸的黄色沉淀:S、AgBr. Agl焰色反应显黄色的是钠元素,显紫色的钾元素(透过蓝色钻玻璃观看)(2)气体特点:常见的气体有:单质:H:、CL、0=氢化物:NH»、H:S、HC1.氧化物:CO:、SO:、NO、NO:、CO有机物:CHt、GHs、CH、HCHO如能使品红溶液褪色加热又复原红色的气体是so:; Cl:能使品红溶液褪色加热不能复原红色:滴有石裁试液的CO:(或SOJ溶液加热后红色变紫色;滴有甲基橙溶液的co=(或SOJ溶液加热后红色变橙色或黄色等。
常见无机气体的鉴别
两酸遇氨冒白烟,
氨遇酚酞即变红。
氧使烬木重再燃,
一氧化氮变红踪。
臭蛋气味硫化氢,
硝酸铅纸黑物生。
二氧化氮溴蒸气,
硝酸银中自分清。
二氧硫碳石灰水,
品红退色热复红。
黄绿氯气可漂白,
淀粉碘化钾纸蓝。
硫氢甲烷一氧碳,
五者燃烧火焰蓝。
然后再加石灰水,
现象明显不难辨。
解释:
1、氨遇酚酞即变红:意思是说氨气能使湿润的酚酞试纸变红色。
2、一氧化氮变红踪:意思是说无色的一氧化氮在空气中迅速氧化变为红棕色(生成了二氧化氮)。
3、臭蛋气味硫化氢,硝酸铅纸黑物生:意思是说硫化氢具有腐败的臭鸡蛋气味,还能使湿润的硝酸铅试纸变黑色(因生成了硫化铅)。
4、二氧化氮溴蒸气,硝酸银中自分清:意思是说二氧化氮和溴蒸气都是红棕色气体,而且都能使湿润的淀粉碘化钾试纸变蓝色,但加入硝酸银溶液,能产生黄色沉淀者则是溴蒸气。
5、二氧硫碳石灰水,品红退色热复红:“二氧硫碳”意指二氧化硫和二氧化碳。
意思是说二氧化硫和二氧化碳都能使澄清的石灰水变混浊,但是二氧化硫还有漂白作用,使品红溶液退色,加热后又恢复红色。
6、黄绿氯气可漂白,淀粉碘化钾纸蓝:意思是说黄绿色的氯气具有漂白作用(使品红溶液退色,加热后不复原),而且可使湿润的淀粉碘化钾试纸变蓝色。
【典型例题1】鉴别二氧化碳的正确方法是()
A.将气体通入紫色的石蕊试液
B.使人感到气喘、头疼
C.将燃着的木条伸入集气瓶中,火焰熄灭
D.将气体通入澄清石灰水中
【考点】二氧化碳的检验和验满.
【分析】二氧化碳的验满和检验方法和操作都不相同.检验二氧化碳是将气体通入澄清的石灰水,观察到石灰水变浑浊,即可证明该气体是二氧化碳;而检验二氧化碳气体是否收集满的方法是将燃着的木条放在瓶口,观察到木条熄灭,证明已满.
【解析】A、将气体通入紫色石蕊试液充分震荡,石蕊溶液变红只能证明瓶内有酸性气体,而酸性气体不一定是二氧化碳,此项错误;B、使人感到气喘、头疼的气体可能还是其它有毒气体,如一氧化碳,故此项错误;C、把燃着的木条放入瓶内,出现木条熄灭现象也只能证明瓶内有不支持燃烧的气体,不能证明是二氧化碳气体,还可能是氮气,此项错误;D、加入石灰水后震荡石灰水变浑浊,说明瓶内气体是二氧化碳,此项正确.故选D.
【点评】本题重点考查二氧化碳的检验方法,要根据实验目的不同进行对比记忆.
【典型例题2】鉴别空气、氧气、二氧化碳的最好方法是()
A.带火星的木条
B.燃着的木条
C.紫色石蕊试液
D.澄清的石灰水
【考点】常见气体的检验与除杂方法.
【分析】A、带火星的木条只能鉴别出氧气和非氧气两种气体;B、用燃着的木条检验时可能会出现四种不同的现象,分别是:木条燃烧更旺、木条燃烧无明显变化、木条熄灭、气体燃烧等,因此可用燃着的木条鉴别多种气体;C、紫色的石蕊试液能鉴别出溶于水后溶液显酸性、碱性、中性的气体;D、澄清的石灰水只能鉴别出二氧化碳和非二氧化碳两种气体
【解析】A、氧气能使带火星的木条复燃,用带火星的木条只能鉴别出氧气,空气和二氧化碳无法鉴别,故错;B、把燃着的木条分别伸入三个集气瓶中,若木条燃烧无明显变化,则是空气;若木条熄灭,则是二氧化碳;若木条燃烧更旺,则是氧气,故正确;C、把二氧化碳通入紫色的石蕊试液中,紫色的石蕊试液会变红,紫色的石蕊试液只能鉴别出二氧化碳,空气和氧气无法鉴别,故错;D、二氧化碳能使澄清的石灰水变浑浊,用澄清的石灰水只能鉴别出二氧化碳,氧气和空气无法鉴别,故错.故选:B。
【点评】鉴别三种或三种以上的气体应当首选燃着的木条.
【典型例题3】不能用于鉴别二氧化碳和氧气的是()
A.燃着的木条B.颜色、气味C.紫色石蕊溶液D.澄清石灰水
【考点】二氧化碳的检验和验满;常见气体的检验与除杂方法;氧气的检验和验满.
【分析】区分氧气和二氧化碳时利用氧气和二氧化碳的化学性质就可以了.如可利用氧气的助燃的性质.也可利用二氧化碳的灭火的性质.或利用二氧化碳能使澄清的石灰水变浑浊的性质.
【解析】A、燃着的木条放入两集气瓶内时,木条燃烧更旺的是氧气,木条熄灭的是二氧化碳.可区分二者,故不可选;B、二氧化碳和氧气都是无色无味的气体,所以用闻气味、看颜色的方法不能将两者区分开来.不可区分二者,故可选;C、将紫色石蕊溶液分别倒入气体中,使紫色石蕊溶液变红色的是二氧化碳气体,不变化的是氧气.可区分二者,故不可选;
D、将澄清的石灰水分别倒入气体中,使澄清的石灰水变浑浊的气体是二氧化碳,不变化的是氧气.可区分二者,故不可选.故选B。
【点评】在区分两种不同的物质时,选择的药品与这两种物质反应,出现两个不同的现象,利用这两个不同的现象,将这两种物质分开.
【典型例题4】下列鉴别物质的方法不正确的是()
A.根据气味不同区分水和酒精
B.根据颜色的差异区分氧化铜和木炭
C.用石蕊试液鉴别盐酸和氢氧化钠溶液
D.用燃着的木条鉴别氧气和二氧化碳
【考点】物质的鉴别、推断;常见气体的检验与除杂方法;酸、碱、盐的鉴别;化学性质与物理性质的差别及应用
【分析】A、依据水与酒精的气味不同分析判断;B、根据氧化铜与木炭的颜色判断该鉴别方法是否相同;C、根据石蕊试液在酸碱溶液中变色的情况分析判断;D、依据氧气能助燃二氧化碳不燃烧也不支持燃烧分析判断;
【解析】A、水是无味液体而酒精能会发出特殊的香味,因此能根据气味不同区分水和酒精;
B、氧化铜与木炭的颜色都是黑色的,所以不能根据颜色的差异区分氧化铜和木炭;
C、石蕊试液在盐酸溶液中能变红,在氢氧化钠溶液中会变蓝,所以可用石蕊试液鉴别盐酸和氢氧化钠溶液;
D、氧气能使燃着的木条燃烧更旺,二氧化碳能使燃着的木条熄灭,现象不同,可以鉴别;故选B。
【点评】本题考查了常见物质的鉴别,完成此题,可以依据物质的性质差异进行,要求选择的鉴别方法要有不同的实验现象出现.
【典型例题5】下列物质鉴别的方法错误的是()
A.木炭和二氧化锰--在空气中灼烧,观察现象
B.酒精和蒸馏水--闻气味
C.红磷与白磷--点燃,观察火焰颜色
D.二氧化碳、氧气和空气--分别将燃着的木条伸人瓶中,观察现象
【考点】物质的鉴别、推断
【分析】根据物质的性质差异进行分析,木炭能燃烧,而二氧化锰不能燃烧,酒精有特殊的香味,而蒸馏水无味,红磷和白磷燃烧都生成五氧化二磷固体,二氧化碳不支持燃烧,氧气能使燃着的木条燃烧更旺,空气能支持燃烧
【解析】A、木炭能燃烧,而二氧化锰不能燃烧,在空气中灼烧现象不同,可以鉴别,故A正确;B、酒精有特殊的香味,而蒸馏水无味,闻气味可以鉴别,故B正确;C、红磷和白磷燃烧都发出黄光,现象相同,无法鉴别,故C错误;D、二氧化碳能使燃着的木条熄灭,氧气能使燃着的木条燃烧更旺,在空气中燃着的木条燃烧现象不变,现象不同,可以鉴别,故D正确;故选C。
【点评】本题考查了常见物质的鉴别,完成此题,可以依据物质的性质差异进行,要求同学们熟练掌握常见物质的性质,以便灵活应用.。