18 19 专题1 第1单元 第2课时 元素周期律
- 格式:doc
- 大小:38.49 KB
- 文档页数:5



第2课时元素周期律[明确学习目标] 1.能说出元素电离能、电负性的含义。
2.掌握元素原子半径、电离能、电负性周期性变化的规律。
3.能应用元素的电离能、电负性说明元素的某些性质。
学生自主学习一、原子半径1.影响原子半径大小的因素2.变化规律05逐渐减小;同主族元素,从上到下,原子半径□06逐同周期主族元素,从左到右原子半径□渐增大。
二、电离能1.第一电离能03最低(1)定义:□01气态电中性基态原子失去□02一个电子转化为气态基态正离子所需要的□能量叫做第一电离能,常用符号I1表示,常用单位是kJ·mol-1。
(2)变化规律:如下图所示04增大趋势(有例外)。
①同周期:从左往右,第一电离能呈□05减小趋势。
②同主族:从上到下,第一电离能呈□2.逐级电离能(1)定义:原子的+1价气态基态离子再失去1个电子所需要的最低能量叫做第二电离能,以此类推。
可以表示为M(g)===M +(g)+e -I 1(第一电离能) M +(g)===M 2+(g)+e -I 2(第二电离能) M 2+(g)===M 3+(g)+e -I 3(第三电离能) (2)变化规律同一元素的逐级电离能是逐渐增大的,即I 1<I 2<I 3<…,这是由于原子失去一个电子变成+1价阳离子后,半径变小,核电荷数未变而电子数目变少,核对外层电子的吸引作用增强,因而第二个电子比第一个电子难失去,失去第二个电子比失去第一个电子需要更多的能量。
同理,I 3>I 2、I 4>I 3…I n +1>I n 。
三、电负性与对角线规则 1.电负性2.对角线规则在元素周期表中,某些主族元素与其□06右下方的主族元素的电负性接近,性质□07相似,被称为“对角线规则”。
如:1.“对于元素周期表中的一切元素,均满足同周期从左到右原子半径逐渐减小,同族从上到下原子半径逐渐增大”这句话是否正确?为什么?提示:不正确。
此规律仅适用于主族元素,而对于副族元素、第Ⅷ族元素、0族元素原子半径大小须另作研究。
元素周期律(第2课时)大单元-高中化学必修1第四章第一单元1.认识原子核外电子排布、元素化合价、原子半径随原子序数递增而呈现周期性变化的规律。
2.了解元素周期表的结构,认识原子结构与元素在周期表中位置间的关系。
3.能运用比较、归纳等方法对信息进行加工。
随着人类对原子结构认识的逐渐深入,元素之间的周期性变化规律逐渐被一些科学家发现。
1829年,德国的德贝赖纳在研究元素的相对原子质量与化学性质的关系时,发现有几个相似的元素组:①锂、钠、钾;②钙、锶、钡;③氯、溴、碘;④硫、硒、碲;⑤锰、铬、铁。
19世纪60年代,俄国著名化学家门捷列夫和德国化学家迈尔等分别根据相对原子质量的大小,将元素进行分类排队,发现元素性质随相对原子质量的递增呈明显的周期性变化规律。
经过多年的艰苦探索,门捷列夫发现了自然界中一个极其重要的规律——元素周期律,并于1869年发表了元素周期表。
元素之间到底有什么样的周期性变化规律?元素周期表到底是按照什么标准制定的?它的价值何在?【任务六】元素周期律具体体现在哪些方面【任务七】比较元素性质强弱的依据【任务八】元素周期表的制定依据和结构【任务六】元素周期律具体体现在哪些方面1.原子最外层电子排布呈周期性变化【活动设计】问题1:什么是原子序数?它与核电荷数、质子数有何关系?问题2:前18号元素原子核外电子排布有何规人们按核电荷数由小到大的顺序给元素编号,这种编号叫作。
核电荷数= = 。
学习目标情境导入学习任务学习活动律?结论:随着原子序数的递增,元素原子的最外层电子排布呈现变化。
【设计意图】让学生自己依据事实,总结归纳原子核外电子排布的规律,训练其总结归纳能力,形成量变引起质变的辩证唯物主义观念,并为下一活动的开展做好准备。
2.原子半径、元素主要化合价呈周期性变化【活动设计】原子半径与原子序数的关系:元素主要化合价:微粒半径大小比较规律(一般情况下):1.看电子层数:电子层数越多,半径越大(层多径大)。
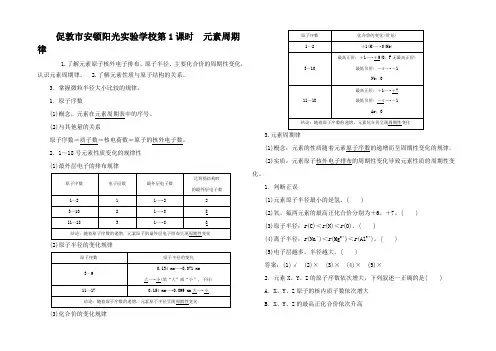
促敦市安顿阳光实验学校第1课时元素周期律1.了解元素原子核外电子排布、原子半径、主要化合价的周期性变化,认识元素周期律。
2.了解元素性质与原子结构的关系。
3.掌握微粒半径大小比较的规律。
1.原子序数(1)概念:元素在元素周期表中的序号。
(2)与其他量的关系原子序数=质子数=核电荷数=原子的核外电子数。
2.1~18号元素性质变化的规律性(1)最外层电子的排布规律原子序数电子层数最外层电子数达到稳结构时的最外层电子数1~2 1 1―→2 23~10 2 1―→8811~18 3 1―→88结论:随着原子序数的递增,元素原子的最外层电子排布呈现周期性变化(2)原子半径的变化规律原子序数原子半径的变化3~90.134 nm―→0.071 nm大―→小(填“大”或“小”,下同)11~17 0.154 nm―→0.099 nm大―→小结论:随着原子序数的递增,元素原子半径呈现周期性变化(3)化合价的变化规律原子序数化合价的变化(常见)1~2 +1(H)―→0(He)3~10最高正价:+1―→+5(O、F无最高正价)最低负价:-4―→-1Ne:011~18最高正价:+1―→+7最低负价:-4―→-1Ar:0结论:随着原子序数的递增,元素化合价呈现周期性变化3.元素周期律(1)概念:元素的性质随着元素原子序数的递增而呈周期性变化的规律。
(2)实质:元素原子核外电子排布的周期性变化导致元素性质的周期性变化。
1.判断正误(1)元素原子半径最小的是氢。
( )(2)氧、氟两元素的最高正化合价分别为+6、+7。
( )(3)原子半径:r(C)<r(N)<r(O)。
( )(4)离子半径:r(Na+)<r(Mg2+)<r(Al3+)。
( )(5)电子层越多,半径越大。
( )答案:(1)√(2)×(3)×(4)×(5)×2.元素X、Y、Z的原子序数依次增大,下列叙述一正确的是( )A.X、Y、Z原子的核内质子数依次增大B.X、Y、Z的最高正化合价依次升高C.X、Y、Z原子的原子半径依次增大D.X、Y、Z单质的金属活动性依次增强解析:选A。






第2课时元素周期律学习目标导航学习任务1 探究原子半径大小规律NO.1自主学习·夯实基础1.影响因素2.递变规律(1)同周期:从左至右,核电荷数越大,半径越小。
(2)同主族:从上到下,能层越多,半径越大。
微点拨:因为稀有气体元素与其他元素的原子半径的判定依据不同,一般不将其原子半径与其他原子的半径相比较。
NO.2互动探究·提升能力已知短周期元素,a A2+、b B+、c C2-、d D-具有相同的电子层结构。
探究微粒半径大小比较的方法规律问题1:A、B、C、D四种元素的原子序数之间有何关系?提示:由于四种离子具有相同的电子层结构,所以四种离子电子数相等,即a-2=b-1=c+2=d+1。
问题2:A、B、C、D四种元素在同一周期吗?试推测四种元素在周期表中的位置。
提示:A、B、C、D不在同一周期。
A应位于第三周期第ⅡA族,B应位于第三周期第ⅠA族,C应位于第二周期第ⅥA族,D应位于第二周期第ⅦA族。
问题3:阴、阳离子具有相同电子层结构的元素在周期表中的分布一般有什么规律?提示:一般上一周期后面的非金属元素形成的阴离子与下一周期靠前的金属元素形成的阳离子具有相同的电子层结构。
问题4:A、B、C、D的原子半径大小顺序是怎样的?A2+、B+、C2-、D-的离子半径是怎么样?提示:原子半径B>A>C>D;离子半径C2->D->B+>A2+。
问题5:微粒半径大小比较应注意哪些问题?提示:①不同周期不同主族元素原子半径比较,先看周期再看主族。
②对于离子的半径比较,要借助于电子层结构相同的离子半径变化规律和元素周期律进行判断。
③同一元素的阳离子半径小于原子半径;阴离子半径大于原子半径。
微粒半径大小比较的方法NO.3应用体验·形成素养1.判断下列说法是否正确:(1)能层数少的元素原子半径一定小于能层数多的元素的原子半径。
( )(2)核外能层结构相同的单核粒子,半径相同。
专题一 第一单元教学案 原子核外电子排布与元素周期律元素周期律(第二课时)课程学习目标:(1)了解同一周期和同一主族元素性质的递变规律。
(2)掌握元素金属性和非金属性的变化规律、比较方法。
(3)掌握理解元素原子结构对元素性质的影响,并能尝试运用这一规律预测元素的性质。
(4)运用元素周期表,理解位置、结构、性质三者的关系,培养分析和推理能力。
(5)通过对元素周期表的学习,了解相关的实际应用,树立爱科学、用科学、为科学努力学习的高贵品质。
知识体系梳理:原子的最外层 原子半径 元素性质随 电子数从1个 主要化合价 原子序数的 增加到饱和 原子得失电子能力 递增而呈现 (2个或8个) 金属性和非金属性 周期性变化 的稳定结构 课前预习:一、我们以第三周期为例,通过实验探究元素的金属性和非金属性的递变规律。
科学探究:钠、镁、铝与水(或酸)的反应 金属镁与沸水的反应:(填表)镁、铝与盐酸的反应此处留白,学生填写预习中不明白的课前检测:1、同周期从左到右,金属性逐渐,非金属性逐渐。
2、11—17号元素最高化合价和最低化合价的变化规律是:。
3、元素周期律(1)定义:。
(2)实质:。
课程达标检测:1、X、Y、Z三种非金属元素具有相同的电子层数,它们的气态氢化物的稳定性强弱顺序是:HZ> H2Y >H3X,下列说法中正确的是()A、原子序数: X>Y>ZB、非金属性:X<Y<ZC、原子半径: X<Y<ZD、离子半径:X3-<Y2-< Z-2、已知HNO3的酸性强于H3PO4,则N元素的非金属性于P元素的非金属性。
3、已知:Ca(OH)2的碱性强于Mg(OH)2,则Ca 元素的金属性强于镁元素的金属性。
4、元素的以下性质,随着原子序数的递增不呈现周期性变化的是()A、化合价B、原子半径C、元素的得电子能力和失电子能力D、相对原子质量课后练习:1.下列递变规律正确的是 ( ) A.O、S、Na、K原子半径依次增大B.Na、Mg、A1、Si的还原性依次增强 C.HF、HCl、H2S、PH3的稳定性依次增强D.KOH、Ca(OH)2、Mg(OH)2、A1(OH)3的碱性依次增强2.下列叙述中,能肯定A金属比B金属活泼性强的是 ( )A.A原子的最外层电子数比B原子的最外层电子数少B.A原子的电子层数比B原子的电子层数多C.1 mol A从酸中置换出的H2比1 mol B从酸中置换出的H2多D.常温时,A能从水中置换出H2,而B不能.3.下列关于元素周期表和元素周期律的说法错误的是 ( )A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多B.第二周期元素从Li到F,非金属性逐渐增强C.因为Na比K容易失去电子,所以Na比K的还原性强D.O与S为同主族元素,且O比S的非金属性强4.下列叙述正确的是( )A.同周期元素中,第ⅦA族元素的原子半径最大 B.现已发现的零族元素的单质在常温常压下都是气体C.第ⅥA族元素的原子,其半径越大,越容易得到电子D.所有的主族元素的简单离子的化合价与其族序数相等。
第2课时元素周期律1.2.3学习目标:周期元素为例,说认识原子结构的周期性变化。
能够以第()3.重点体会元素周期律在学习元素化合物知识明同周期元素性质的递变情况。
与科学研究中的重要作用。
[ ·]知探自习主新预一、原子结构的周期性变化1原子序数.(1) 概念:按核电荷数由小到大的顺序给元素编号。
(2)数量关系:原子序数=核电荷数=质子数=核外电子数。
2 元素原子最外层电子数的变化规律.结论:随着元素原子序数的递增,元素原子最外层电子数呈周期性变化。
3 原子半径的周期性变化.电子层数相同的元素,随着原子序数的递增,原子半径呈现由大到小的周期性变化。
二、元素周期律1 .元素化合价的周期性变化2 化合价变化规律.[1→+每周期:随着原子序数的递增,元素的化合价呈周期性变化最高正价:7(25)410] 。
+→-第,负价:-周期为+→(OF)微点拨:,最低负化合、除外主族元素最高正化合价=最外层电子数8||||8。
最高正化合价=+价=最外层电子数-最低负化合价,3 金属性和非金属性.(1)金属性强弱比较①按表中实实验操作实验现象实验结论Na>Mg>Al 。
②钠、镁、铝的最高价氧化物对应的水化物的碱性由强到弱的顺序为NaOH>Mg(OH)>Al(OH) 。
32Na>Mg>Al 。
③钠、镁、铝的金属性由强到弱的顺序为④结论:元素金属性越强,单质越易从水或酸中置换出氢,该元素最高价氧化物的元素Si P S Cl解件由易到难的顺序为②硅、磷、硫、氯最高价氧化物对应水化物的酸性由强到弱的顺序为HClO>HSO>HPO>HSiO 。
3442342Cl>S>P>Si。
硫、氯元素非金属性由强到弱的顺序为③硅、磷、H反应形成气态氢化物,气态氢化④结论:元素金属性越强,单质越易与2物越稳定,该元素最高价氧化物的水化物的酸性越强。
4元素周期律.(1)概念:元素的性质随着元素核电荷数的递增呈周期性变化的规律。
(2)实质:元素周期律是元素原子核外电子排布随着元素核电荷数的递增呈周期性变化的必然结果。
[]基础自测1() 正确的打“√”,错误的打“×”.判断正误(1)18个电随着原子序数的递增,最外层电子排布均呈现由个电子递增至() 子的周期性变化。
(2)() 原子序数越大,原子半径一定越小。
()(3)任何元素均有正价和负价。
(4)()其氧化物对应的水化物酸性越强。
元素非金属性越强,(1)(2)(3)(4)××××【答案】2() .下列说法中不正确的是A.非金属元素呈现的最高化合价不超过该元素的最外层电子数B.非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数C .金属元素在化合物中只显正价D8(OF)除外.同种元素的最高正价和最低负价的绝对值之和为、[8B电子稳定结构所需的元素的最低负化合价的绝对值等于使原子达到]电子数。
.3NaMgAl() 的有关性质的叙述正确的是.对、、Mg(OH)Al(OH)ANaOH>.碱性:>32 AlBNaMg<.原子半径:<NaMgAlC <.金属性:<DAlMgNa>.单质的还原性:>[NaOH A>同周期元素从左到右最高价氧化物对应的水化物碱性减弱:Mg(OH)Al(OH)Na>Mg>AlA正确;同周期元素从左到右原子半径减小:,>故,32BNa>Mg>AlC错误;同周期元错误;同周期元素从左到右金属性减弱:,故故Al<Mg<NaD] 错误。
,故素从左到右单质的还原性减弱:] [ ·难究合作重探攻判断粒子半径的大小[]背景材料391117号元素的原子半径:~~号和下表为原子序数为Li Be B C N O F9473586 93号元素~() () () () () () () 氟铍碳硼锂氧氮/pm 原子半径15211188777066641711号元~ClSiSNaPMgAl17141215161113() () () () () () () 氯镁硅铝硫磷钠素/pm原子半径186160 143 117 110 10499][思考交流(1)分析上表数据,总结电子层数相同的原子,随核电荷数增多,原子半径有何变化规律?为什么?【提示】电子层数相同时,核电荷数越多,原子核对核外电子的吸引越强,原子半径越小。
(2)分析上表数据,总结最外层电子数相同的原子,原子半径的大小与什么因素有关?【提示】最外层电子数相同时,电子层数越多,原子半径越大。
(3)分析上表数据,判断原子序数越大,原子半径越大;原子半径一定越大吗?【提示】不一定。
电子层数相同的原子,原子序数越大,最外层电子数相等的原子,原子序数越大,原子半径越大。
电子层数不同,最外层电子数也不同的原子,原子序数越大,原子半径不一定越大。
(4)()半径的大小?原子或离子根据上述问题总结怎样比较微粒【提示】微粒半径比较要三看:一看电子层,二看最外层电子数,三看电子层排布,根据不同情况及相应规律进行分析。
微粒半径大小比较微粒半径大小主要由电子层数、核电荷数和核外电子数决定。
(1) 核电荷数相同,核外电子数越多,微粒半径越大。
(H)(H)>r(r)>r()r①;阴离子原子:-r(H)r()r(H)>r()>②;原子:阳离子+23)(Fe)>()r(Fe r r()>r③。
高价阳离子:低价阳离子++(2) 电子层数相同,核电荷数越大,原子半径越小。
r(F)r(N)>r(O)>(B)>r(Li)>r(Be)>rr(C)>;r(Na)>r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl)。
(3)最外层电子数相同,电子层数越多,原子或离子半径越大:r(Li)<r(Na)r(F)<r(Cl) 。
;22-++-)(O(S )<r(Li r)<r(Na)r。
;(4) 核外电子数相同,核电荷数越多,离子半径越小。
22322+----++++弱[] 背景材料[]思考交流(1)在化学反应中,金属原子失电子越多,该金属的金属性越强,这句话正确吗?试举例说明。
.【提示】不正确。
金属性强弱的比较,是比较原子失去电子的难易,而不AlNa 失去三个电子,但是失去电子的多少。
如化学反应中,失去一个电子,而NaAl 的。
的金属性强于SHClH(2)的强的事实推断氯的非金属性比硫的强?能否根据的酸性比2【提示】因为非金属性应根据最高价氧化物对应水化物的酸性强弱不能。
判断,或者根据氢化物稳定性判断。
4 个误区判断元素非金属性强弱的(1)比较元素金属性、非金属性强弱不能根据最外层电子数的多少或电子层数的多少,而应根据得失电子的难易程度。
(2)不能通过物质的物理性质,如熔沸点、溶解性等方面比较元素金属性或非金属性强弱。
(3)氢化物的稳定性越强或还原性越弱,则元素的非金属性越强,不能认为氢化物的酸性越强,元素的非金属性越强。
(4)最高价氧化物的水化物酸性越强,元素非金属性越强,不能认为某元素氧化物的水化物酸性越强,元素的非金属性越强。
] ·[ 基标双当固堂达1粒子半径大小的比较题组1().下列粒子半径大小比较正确的是AF>Cl .原子半径:B>>氯硫.原子半径:钠22++--<CaC<K<ClS .离子半径:D 3周期元素的离子半径从左到右逐渐减小.第[FCl B原子最外层电子数相同,随着原子序数的递增原子半径逐原子与ClA错;钠、硫、氯是具有相同电子层数的元素,的原子半径大,渐增大,所以.B正确;电子层结构相同的离子,核随着原子序数的递增,原子半径逐渐减小,3C周期元素的阳离子半径从左到右逐渐减小,错;第电荷数越大,半径越小,]D错。
但阴离子半径大于阳离子半径,)(2.下列各组元素中按微粒半径递增顺序排列的是222+++MgKALiNa BaCaB..2-++FNCl CCaDKO..DN>O>F[C错;同主族同周期元素从左到右原子半径依次减小,即:,222A>MgBa>Ca()Li<Na<K、半径依次增大,即:元素从上到下原子,离子,+++] BC半径越小,核外电子排布相同的离子,对。
错;核电荷数越大,1.比较原子半径的方法如下:(1)具有相同电子层数的原子,随原子序数的递增,原子半径逐渐减小。
(2)具有相同最外层电子数的原子,随着电子层数的增加,原子半径逐渐增大。
(3)比较电子层数和最外层电子数都不同的原子半径找对照原子比较。
2离子半径比较时,先确定相关离子是属于哪种情况,再依据相关规律比.较。
(1)离子所带电荷相同、电子层数不同:电子层数越多半径越大;(2)核电荷数越大半径越小;离子电子层结构相同、核电荷数不同:(3)离子所带电荷、电子层结构均不相同:找对照离子进行比较。
2 元素化合价题组3() .以下有关元素化合价的说法不正确的是A.元素的化合价主要取决于元素原子的最外层电子数B.非金属元素的最高正价等于原子所能失去或偏移的最外层电子数C.稀有气体元素化学性质很不活泼,很难与其他物质反应,通常把它们的化合价看作零.174231D→-、→+.第周期元素的化合价中都是正价从+,负价从-]6F[2O D 元素无正价。
第元素的最高正价不是+周期中的价,而44,则该元素原子的最外层电.某元素的最高正价与最低负价的代数和为) (子数为13572019】【导学号:7 D C6 A4 B5 ....?4xy=+??yx[xy6C,=设该元素的最高正价为,最低负价为解得,则8y|x|?=+? ]26。
,因此该原子的最外层电子数为=-元素化合价小结011 (1)H价。
、-、元素的化合价有+(2)F 元素只有负价无正价。
(3)O 元素有正价但无最高正价。
(4)金属元素只有正价无负价。
)(F (5)。
非金属元素既有正价又有负价除外0(6)。
稀有气体元素的化合价看作3元素金属性、非金属性强弱的判断题组5>< ”回答下列问题:.用“”或“13572019】【导学号:(1)HSO______HSiOHSiO______HPO ;,酸性:43444244______Al(OH)(2)Ca(OH)______Mg(OH);碱性:322(3)HS______PHHS______HCl;气态氢化物稳定性:,232 (4)HO________HSHS________HCl 。
还原性:,222从以上答案中可以归纳出:________;①元素的非金属性越强,其最高价氧化物对应水化物的酸性越________;②元素的金属性越强,其最高价氧化物对应水化物的碱性越________;③元素的非金属性越强,其对应气态氢化物的稳定性越________。