物理化学-第4章 相平衡
- 格式:pdf
- 大小:2.07 MB
- 文档页数:85
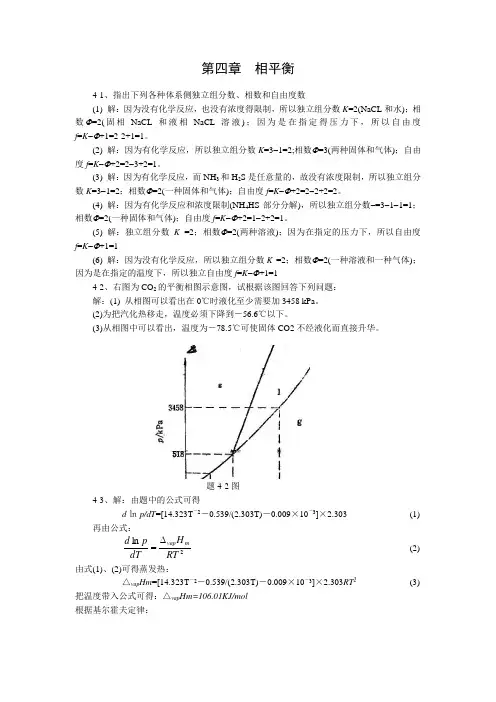
第四章 相平衡4-1、指出下列各种体系侧独立组分数、相数和自由度数(1) 解:因为没有化学反应,也没有浓度得限制,所以独立组分数K =2(NaCL 和水);相数Φ=2(固相NaCL 和液相NaCL 溶液);因为是在指定得压力下,所以自由度f =K -Φ+1=2-2+1=1。
(2) 解:因为有化学反应,所以独立组分数K =3-1=2;相数Φ=3(两种固体和气体);自由度f =K -Φ+2=2-3+2=1。
(3) 解:因为有化学反应,而NH 3和H 2S 是任意量的,故没有浓度限制,所以独立组分数K =3-1=2;相数Φ=2(一种固体和气体);自由度f =K -Φ+2=2-2+2=2。
(4) 解:因为有化学反应和浓度限制(NH 4HS 部分分解),所以独立组分数-=3-1-1=1;相数Φ=2(一种固体和气体);自由度f =K -Φ+2=1-2+2=1。
(5) 解:独立组分数K =2;相数Φ=2(两种溶液);因为在指定的压力下,所以自由度f =K -Φ+1=1(6) 解:因为没有化学反应,所以独立组分数K =2;相数Φ=2(一种溶液和一种气体);因为是在指定的温度下,所以独立自由度f =K -Φ+1=14-2、右图为CO 2的平衡相图示意图,试根据该图回答下列问题:解:(1) 从相图可以看出在0℃时液化至少需要加3458 kPa 。
(2)为把汽化热移走,温度必须下降到-56.6℃以下。
(3)78.5℃可使固体CO2不经液化而直接升华。
题4-2图4-3、解:由题中的公式可得d ㏑p/dT =[14.323T -2-0.539/(2.303T)-0.009×10-3]×2.303 (1) 再由公式:2ln RTH dT p d m vap ∆= (2) 由式(1)、(2)可得蒸发热: △vap Hm =[14.323T -2-0.539/(2.303T)-0.009×10-3]×2.303RT 2 (3) 把温度带入公式可得:△vap Hm=106.01KJ/mol根据基尔霍夫定律:︒︒∆=⎥⎥⎦⎤⎢⎢⎣⎡∂∆∂p C T H )( … (4) ∴△C p =(-0.539T/2.303-0.009×10-3×2T)×R … (5) 把温度带入式(5)可得热熔差:△C p =-7.694J.mol -1K -14-4、解:V T H dT dp ∆∆=,两边进行定积分得:△=P VH ∆∆12T T Ln △=P mg/s=4104490-⨯=1.225×106Pa , V H ∆∆ =12311104.334ρρ-⨯=-3.01×1094kJ ·kg -1·m -3T1=273K, ∴T2=272K,温度要低于零下1度4-5、解:由已知条件:T 1=398.15K , P 1=101.325Kpa , P 2=233KPa再由公式: ⎪⎪⎭⎫ ⎝⎛-∆=211211ln T T R H p p m vap 得T 2=399K 此时水得沸点:t=299℃4-6、解:△=P V H ∆∆12T T Ln ,△=P =gh ρ10×9.8×14.6×103=1430.8×103Pa ∴T2=247.32K4-7、解:(2) 从图中作垂线可知泡点温度为110.2℃(3) 从图中作垂线可知露点温度为112.8℃(4) 经过105.0︒C 点作平行线,可知组成为y B =0.417, x B =0.544(5) 此体系中X B =0.769,由杆杆规则可得w (g )×(X B -y B )= w (l )×(x B -X B )而w (g)+w (l)= 39kg ,∴w (g )=12.31kg, w (l )=26.69kg (6) 从理论上说应该降低醋酸溶液得温度4-8解:线abc是三相平衡线,此时的相数为3,独立组分数为2,自由度为0区域1:熔液,此时的相数为2,独立组分数为2,自由度为1区域2:熔液和固体Pb,相数为3,自由度为2区域3:熔液和固体Sb,相数为3,自由度为2区域4:固体Pb和固体Sb,相数为2,自由度为14-9、解:从图中可以知道,这是形成稳定化合物体系。

物理化学相平衡知识点相平衡一、主要概念组分数,自由度,相图,相点,露点,泡点,共熔点,(连)结线,三相线,步冷(冷却)曲线,低共熔混合物(固相完全不互溶)二、重要定律与公式本章主要要求掌握相律的使用条件和应用,单组分和双组分系统的各类典型相图特征、绘制方法和应用,利用杠杆规则进行有关计算。
1、相律: F = C - P + n, 其中:C=S-R-R’(1) 强度因素T,p可变时n=2(2) 对单组分系统:C=1, F=3-P(3) 对双组分系统:C=2,F=4-P;应用于平面相图时恒温或恒压,F=3-P。
2、相图(1)相图:相态与T,p,x的关系图,通常将有关的相变点联结而成。
(2)实验方法:实验主要是测定系统的相变点。
常用如下四种方法得到。
12对于气液平衡系统,常用方法蒸气压法和沸点法;液固(凝聚)系统,通常用热分析法和溶解度法。
3、单组分系统的典型相图对于单组分系统C =1,F =C -P +2=3-P 。
当相数P =1时,自由度数F =2最大,即为双变量系统,通常绘制蒸气压-温度(p-T )相图,见下图。
pTlBC AOsgC 'pTlBCA Os gFGD单斜硫pT液体硫BCAO正交硫硫蒸气(a) 正常相图 (b) 水的相图(c) 硫的相图图6-1 常见的单组分系统相图4、二组分系统的相图类型:恒压的t -x (y )和恒温的p -x (y )相图。
相态:气液相图和液-固(凝聚系统)相图。
(1)气液相图根据液态的互溶性分为完全互溶(细分为形3成理想混合物、最大正偏差和最大负偏差)、部分互溶(细分为有一低共溶点和有一转变温度的系统)和完全不溶(溶液完全分层)的相图。
可以作恒温下的p -x (压力-组成)图或恒压下的t -x (温度-组成)图,见图5-2和图5-3。
t = 常数液相线气相线g + llgB Apx B (y B )t = 常数g + l液相线气相线g + llgB Apx B (y B )g + lg + lt = 常数液相线气相线lgBApx B (y B )(a) 理想混合物 (b) 最大负偏差的混合物 (c) 最大正偏差的混合物 图6-2 二组分系统恒温下的典型气液p -x 相图p = 常数液相线或泡点线气相线或露点线g + llgBAtx B (y B )p = 常数g + l液相线或泡点线气相线或露点线g + llg BAtx B (y B )g + lp = 常数液相线或泡点线气相线或露点线g + llgBAtx B (y B )(a) 理想或偏差不大的混合物 (b) 具有最高恒沸点(大负偏差) (c) 具有最低恒沸点(大正偏差)B在A液层中的溶解度线A在B液层中的溶解度线最高会溶点l 1 + l 2p = 常数lBAtx B最低会溶点B在A液层中的溶解度线A在B液层中的溶解度线最高会溶点l 1 + l 2p = 常数lBAtx B DCGFOgg + l g + ll 1 + l 2p = 常数lBAtx B (y B )(d) 有最高会溶点的部分互溶系统 (e)有最高和最低会溶点的部分互溶系统 (f) 沸点与会溶点分离4x B (y B )三相线COD ( l 1 +g + l 2)l 1DC GFOgg + lg + l l 1 + l 2p = 常数l 2B Atx B (y B )三相线COD ( g + l 1 + l 2)g + l 1l 1DC GFOgg + l 2l 1 + l 2p = 常数l 2BAtg + B(l )三相线COD [ A(l ) +g + B(l ) ]DCGFOgg + A(l )A(l ) + B( l )p = 常数BAtx B (y B )(g) 液相部分互溶的典型系统 (h)液相有转沸点的部分互溶系统 (i) 液相完全不互溶的系统图6-3 二组分系统恒压下的典型气液相图(2)液-固系统相图: 通常忽略压力的影响而只考虑t -x 图。

第4章相平衡复习题1.水和盐B可以形成两种水合盐B·H2O和B·2H2O,恒压下与冰和盐水溶液平衡共存的固体水合盐为。
A. B·H2OB. B·2H2OC. B·H2O和B·2H2OD. 无法判定2.H2SO4与H2O 可形成H2SO4·H2O(s)、, H2SO4·2H2O(s)、 H2SO4·4H2O(s)三种水合物,在p0下,能与硫酸水溶液和冰达平衡的硫酸水合物最多可有几种 A. 3 B. 2 C. 1 D.03.25℃,NH4HCO3(s)在恒容真空容器中分解达平衡:NH4HCO3(s) = NH3(g) + H2O(g) + CO2(g),该体系的组分数C = ,F* = 。
4.在描述恒沸混合物时,下列各点中哪一条不正确()A、恒沸点的F=0,是一个无变量点B、不具有确定的组成C、平衡时气相和液相组成相同D、其沸点随外压的改变而改变5. 关于三相点, 下面的说法中正确的是()A. 纯物质和多组分系统均有三相点B. 三相点就是三条两相平衡线的交点C. 三相点的温度可随压力改变D.三相点是纯物质的三个相平衡共存时的温度和压力所决定的相点6. 在一定压力下,在A、B二组分的温度-组成图的最高(或最低)恒沸点处,气-液两相组成的关系为y B()x B,y B和x B分别为气、液两相组分B的摩尔分数。
A.大于B.小于C.等于D.变小二组分气-液平衡体系,若在某溶液中加入组分B,溶液的沸点将下降,则A在气相中的浓度和液相中的浓度谁大__和30℃时有100g由60﹪H2O及40﹪C6H5OH的所组成的体系形成上下两层溶液,在C6H5OH层中含有70﹪的C6H5OH,在H2O层中含有92﹪的H2O,试求两层的质量。
水层为_g,酚层为_____g.系统的相图如图所示。
①Ag3Sn是一种__ __化合物;②E点温度称为__ _,在此温度时对总组成位于EK间的某系统加热,则发生的变化为__③若由一定量的熔液冷却来制取纯Ag3Sn固体,则应使熔液的初始组成处于_ __之间;初始组成越接近__ ____,冷却温度越接近___ ____,可获得的纯Ag3Sn固体就越多。




第四章相平衡思考题1.什么叫自由度?相律的内容是什么?它能够解决什么问题?答:在不引起旧相消失和新相形成的前提下,可以在一定范围内独立变动的强度性质称为系统的自由度。
相律就是在平衡系统中,系统内相数、组分数、自由度数及影响物质性质的外界因素(如温度、压力、重力场、磁场、表面能等)之间关系的规律。
相律是一个定性规律,可以指示相平衡体系中有几个相,可以指导如何去识别由实验绘制的相图。
2.水的三相点与冰点是否相同?答:不相同。
纯水的三相点是气-液-固三相共存,其温度和压力由水本身性质决定,这时的压力为610.62Pa,温度为273.16K。
热力学温标1K就是取水的三相点温度的1/273.16K。
水的冰点是在大气压力下,水的三相共存点的温度。
由于冰点受外界压力影响,在105Pa压力下,温度下降0.00747K,由于水中溶解了空气,温度又下降0.0024K,所以在大气压力为105Pa时,水的冰点为273.15K 。
3.相点与物系点有什么区别?答:相点是相图中表示某平衡相组成的点。
从相点位置可看出该相的状态、组成、温度、压力等。
相点位置可随压力、温度的改变而改变。
在单组分系统的相图上,所有点全部是相点。
物系点是在多组分系统的相图上表示系统总组成的点,在单相区,物系点可与相点重合,而在两相区内只有物系点。
该物系所对应的两个相组成由两个相点表示。
在T-x图上,物系点可沿着与温度坐标平行的直线上下移动;在水盐系统图上,随着水的含量不同,物系点可沿着与组成坐标平行的直线左右移动。
4.单组分系统的三相点与低共熔点有何异同点?答:共同点:都是三相共存。
不同点:单组分系统的三相点是气-液-固三相共存,这时的自由度为零,它的压力、温度由系统自身性质决定,不受外界因素影响。
而二组分系统的低共熔点在等压的条件下自由度为零。
外压改变,低共熔点的温度和组成也会随之而改变。
5.米粉和面粉混合得十分均匀。
再也无法彼此分开,这时混合体系有几相?答:两相6.金粉和银粉混合后加热,使之熔融后冷却,得到的固体是一相还是两相?答:一相7.低共熔物能不能看作是化合物?答:不能。

