3第三章 沉淀法
- 格式:ppt
- 大小:695.50 KB
- 文档页数:43
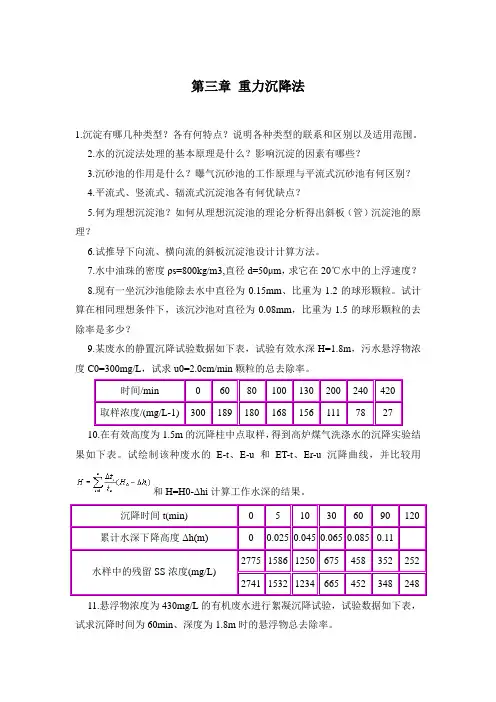
第三章重力沉降法1.沉淀有哪几种类型?各有何特点?说明各种类型的联系和区别以及适用范围。
2.水的沉淀法处理的基本原理是什么?影响沉淀的因素有哪些?3.沉砂池的作用是什么?曝气沉砂池的工作原理与平流式沉砂池有何区别?4.平流式、竖流式、辐流式沉淀池各有何优缺点?5.何为理想沉淀池?如何从理想沉淀池的理论分析得出斜板(管)沉淀池的原理?6.试推导下向流、横向流的斜板沉淀池设计计算方法。
7.水中油珠的密度ρs=800kg/m3,直径d=50μm,求它在20℃水中的上浮速度?8.现有一坐沉沙池能除去水中直径为0.15mm、比重为1.2的球形颗粒。
试计算在相同理想条件下,该沉沙池对直径为0.08mm,比重为1.5的球形颗粒的去除率是多少?9.某废水的静置沉降试验数据如下表,试验有效水深H=1.8m,污水悬浮物浓度C0=300mg/L,试求u0=2.0cm/min颗粒的总去除率。
时间/min 0 60 80 100 130 200 240 420 取样浓度/(mg/L-1) 300 189 180 168 156 111 78 2710.在有效高度为1.5m的沉降柱中点取样,得到高炉煤气洗涤水的沉降实验结果如下表。
试绘制该种废水的E-t、E-u和ET-t、Er-u沉降曲线,并比较用和H=H0-Δhi计算工作水深的结果。
沉降时间t(min) 0 5 10 30 60 90 120 累计水深下降高度Δh(m)0 0.025 0.045 0.065 0.085 0.112775 1586 1250 675 458 352 252 水样中的残留SS浓度(mg/L)2741 1532 1234 665 452 348 24811.悬浮物浓度为430mg/L的有机废水进行絮凝沉降试验,试验数据如下表,试求沉降时间为60min、深度为1.8m时的悬浮物总去除率。
12.由原始水深为1.5m的沉降柱中点,得到沉降实验的结果如上表。


实验活动4用化学沉淀法去除粗盐中的杂质离子实验目的1.用化学沉淀法去除粗盐中的Ca2+、Mg2+和SO2-4。
2.熟练掌握溶解、过滤、蒸发等操作,认识化学方法在物质分离和提纯中的重要作用。
实验药品粗盐、蒸馏水、0.1 mol·L-1氯化钡溶液(其作用是除去SO2-4)、20%的氢氧化钠溶液(其作用是除去Mg2+)、饱和碳酸钠溶液(其作用是除去Ca2+、Ba2+)、6 mol·L-1盐酸、pH试纸。
实验步骤实验步骤实验操作①溶解用天平称取5 g粗盐放入100 mL烧杯中,然后加入20 mL蒸馏水,用玻璃棒搅拌,使粗盐全部溶解,得到粗盐水②沉淀向粗盐水中依次滴加过量的氯化钡溶液、氢氧化钠溶液、饱和碳酸钠溶液,使SO2-4、Mg2+、Ca2+、Ba2+完全沉淀析出③过滤将烧杯静置后过滤,除去生成的沉淀和不溶性杂质,过滤中玻璃棒的作用是引流,滤液呈碱性④中和向滤液中滴加盐酸,用玻璃棒搅拌,直到无气泡冒出,并用pH试纸检验,使滤液呈中性或微酸性⑤蒸发将滤液倒入蒸发皿中,用酒精灯加热,同时用玻璃棒不断搅拌。
当蒸发皿中出现较多固体时,停止加热。
利用蒸发皿的余热使滤液蒸干。
冷却后,得到去除了杂质离子的精盐问题讨论1.本实验中加入试剂的顺序是什么?按照其他顺序加入试剂能否达到同样的目的?提示本实验中加入试剂的顺序是BaCl2溶液→NaOH溶液→Na2CO3溶液→盐酸。
按下列顺序加入试剂也可达到实验目的:①NaOH溶液→BaCl2溶液→Na2CO3溶液→盐酸;②BaCl2溶液→Na2CO3溶液→NaOH溶液→盐酸。
2.在实验操作②中为什么依次加入的试剂都要略微过量?实验操作④中加入盐酸的目的是什么?提示实验操作②中所加试剂过量是为了将杂质离子完全沉淀而除去。
实验操作④中加入盐酸是为了除去滤液中过量的OH-和CO2-3。
3.粗盐水中加入氯化钡溶液使SO2-4沉淀而除去,如何检验SO2-4是否沉淀完全?提示静置后,沿烧杯壁向上层清液中继续滴加2~3滴氯化钡溶液,若溶液不出现浑浊,说明SO2-4已沉淀完全。


催化剂沉淀法
催化剂沉淀法是一种制备催化剂的常见方法之一,其原理涉及将所需的金属离子与其他化合物沉淀到载体上,形成催化剂的活性部分。
这个方法通常包括以下步骤:
1.前驱物溶液制备:首先,需要准备含有金属离子和催化剂所需成分的溶液。
这些溶液中可以含有金属盐类或有机金属化合物,通常以水或有机溶剂为溶剂。
2.载体处理:选择合适的催化剂载体,通常是高比表面积的材料,如活性炭、氧化铝或硅胶等。
载体必须具有一定的表面活性,便于金属离子或化合物的吸附和沉积。
3.浸渍和沉淀:将所制备的金属离子或有机金属化合物的溶液与载体进行浸渍,让金属物质与载体表面相互作用。
然后,通过化学反应或物理过程使金属离子或化合物沉淀到载体表面,形成催化剂活性部分。
4.干燥和煅烧:完成沉淀后的催化剂通常需要进行干燥和煅烧过程,以去除残余的溶剂、有机物或使金属沉淀物更牢固地结合到载体表面上。
5.催化剂测试和评估:最后,制备好的催化剂需要进行性能测试和评估,以确认其催化活性、选择性和稳定性。
催化剂沉淀法是一种相对简单且常用的制备催化剂的方法。
其优点在于操作相对容易、适用于大规模生产,并且可以控制催化剂的活性物质在载体上的分布。
但它也需要严格控制反应条件,以确保沉淀到载体上的活性成分分布均匀,并且需要对催化剂进行详细的性能测
试和表征。

沉淀法合成四氧化三铁四氧化三铁是一种重要的无机化合物,化学式为Fe3O4。
它是一种黑色结晶固体,也被称为磁铁矿。
四氧化三铁具有多种应用,因此合成该化合物的方法备受关注。
沉淀法是一种常用的制备四氧化三铁的方法。
这种方法基于溶液中的离子反应,通过添加适量的碱性溶液,可以使反应离子产生沉淀,从而得到所需的四氧化三铁。
在制备四氧化三铁的沉淀法中,常用的原料是氯化亚铁和氢氧化钠。
首先,将适量的氯化亚铁溶解在纯水中,得到一个含有铁离子的溶液。
然后,通过滴加适量的氢氧化钠溶液,将其中的氢氧化铁沉淀出来。
在反应过程中,需要控制反应的温度和pH值,以保证得到高纯度的四氧化三铁。
制备四氧化三铁的沉淀法过程需要注意以下几点:首先,反应溶液中的温度要保持适宜,一般控制在50-70℃之间。
过高的温度可能导致反应剧烈,产生杂质物质。
其次,反应过程中要适当调节pH值,一般在9-11之间。
过高或过低的pH值都会对沉淀的形成产生负面影响。
此外,反应过程要充分搅拌,以促进反应的进行和沉淀的形成。
四氧化三铁在许多领域都有广泛的应用。
首先,它是一种良好的磁性材料,在磁记忆、磁记录等方面有重要的应用。
其次,四氧化三铁还可以用作催化剂,在有机反应、氧化反应等方面具有催化作用。
此外,四氧化三铁还被广泛应用于染料、电子材料、医药等领域。
综上所述,四氧化三铁是一种重要的无机化合物,通过沉淀法可以有效地合成。
在合成过程中,需要注意反应温度、pH值和搅拌等因素。
合成得到的四氧化三铁具有多种应用,为各个领域的科学研究和工程应用提供了可靠的材料基础。




沉淀法抽提RNA
1.取适量组织(不超过黄豆大小),加入液氮碾磨至粉末状。
2.趁冷加入1ml trizol 碾磨覆盖所有组织粉末,室温待其彻底融化后吸入ep管中。
3.加入200ml氯仿剧烈震荡20 sec,12000 rpm离心8分钟,吸出上清到新ep管中。
4.加入等体积异丙醇,混匀后-20度沉淀半小时以上或沉淀过夜。
5.12000 rpm 4度离心10 min,倒去上清。
6.加入300 ul 75%乙醇,vortex 10 sec 至沉淀飘起。
7.12000 rpm 离心3分钟倒去上清蘸干,离心1~2分钟用移液枪吸干上清。
8.加入50~100 ul Rnase free H2O,vortex 溶解沉淀。
9.测定浓度后,用磁珠纯化以去除杂质。
磁珠法纯化RNA
1. 加入1倍体积混匀后的beads和2倍体积的无水乙醇,vortex混匀,室温放置3分钟。
3. 5000rpm离心1分钟,置于磁力架上1分钟,吸去上清。
4. 加入加入100 ul 80%乙醇,vortex混匀,静置1分钟,5000rpm离心30s。
5. 磁力架上放置1分钟,吸去上清,重复一次。
6. 尽量吸干残余液体,室温放置5分钟晾干。
7. 加入30ul 水,vortex混匀,室温放置2分钟,12000rpm离心1分钟。
8. 磁力架上放置1分钟,尽量吸出上清到新ep管中即得RNA,注意不要吸进beads。
9. 混匀后最大转速离心1分钟,测定浓度,跑电泳。

初中化学沉淀原理教案
一、教学目标:
1. 了解化学沉淀的基本原理;
2. 掌握化学沉淀实验的步骤和注意事项;
3. 能够正确解释化学沉淀反应的发生过程。
二、教学重点:
1. 化学沉淀的定义及原理;
2. 化学沉淀反应的实验步骤和注意事项。
三、教学难点:
1. 不同溶液混合时发生沉淀的条件;
2. 如何正确识别化学沉淀反应。
四、教学准备:
1. 实验器材:试管、试管夹、试管架、滴管等;
2. 实验药品:氯化铅溶液、硫化氢气体、盐酸溶液等;
3. 实验记录表格。
五、教学过程:
1. 导入:通过示意图或实验现象引导学生思考,介绍化学沉淀的概念;
2. 理论学习:讲解化学沉淀反应的原理和条件,引导学生理解为什么会发生沉淀反应;
3. 实验演示:进行化学沉淀反应实验,让学生观察和记录实验现象;
4. 实验讨论:让学生分享实验结果,并讨论发生沉淀的原因和如何识别沉淀反应;
5. 总结归纳:总结化学沉淀的原理和实验步骤,强化学生的理解。
六、教学延伸:
1. 鼓励学生在实验中尝试不同溶液混合条件下的沉淀反应;
2. 引导学生探索其他化学反应的原理及实验方法。
七、课堂小结:
通过本节课的学习,希望同学们掌握化学沉淀的基本原理,能够通过实验观察和分析,正确解释化学沉淀反应的发生过程。
愿大家在化学学习中取得更好的成绩!。
化学沉淀法的原理
化学沉淀法是利用化学反应产生的沉淀生成物来实现固液分离的方法。
其原理是根据溶液中某些物质在特定条件下形成较为稳定的固态沉淀,从而实现对该物质的分离和提取。
在化学沉淀法中,通常会控制溶液中特定物质的浓度和pH值。
调节溶液中特定物质的浓度可以改变其在反应中的活性,从而影响沉淀生成物的形成速度和量。
同时,通过调节溶液的pH 值,可以改变溶液中离子的电荷状态,促使离子在溶液中发生相互作用,形成稳定的沉淀。
化学沉淀法的具体步骤一般包括以下几个方面:首先是选择适当的反应物,这些反应物在反应条件下能够产生稳定的固态沉淀;其次是加入合适的溶剂,使反应物能够充分溶解,形成均匀的溶液;然后是控制溶液中特定物质的浓度和pH值,通过
改变反应条件来促进反应物的生成;最后是通过过滤或离心等操作将固态沉淀与溶液分离。
化学沉淀法广泛应用于实验室中的化学分离技术和工业生产中的固液分离过程。
根据不同的反应物和反应条件,化学沉淀法可以用于分离和提取各种不同物质,具有较高的选择性和效率。
第三章酶的提取与分离纯化第三章酶的提取与分离纯化第三章酶的提取与分离纯化◆酶的提取与分离纯化是指将酶从细胞或其它含酶原料中提取出来,再与杂质分开,而获得所要求的酶制品的过程。
◆主要内容包括细胞破碎,酶的提取,离心分离,过滤与膜分离,沉淀分离,层析分离,电泳分离,萃取分离,浓缩,干燥、结晶等。
1.细胞破碎细胞破碎方法可以分为机械破碎法,物理破碎法,化学破碎法和酶促破碎法等,如表3-1所示。
表1细胞破碎方法及其原理1.1 机械破碎法通过机械运动所产生的剪切力的作用,使细胞破碎的方法称为机械破碎法。
常用的破碎机械有组织捣碎机,细胞研磨器,匀浆器等。
机械破碎法分为3种:捣碎法,研磨法和匀浆法。
1.2物理破碎法通过温度、压力、声波等各种物理因素的作用,使组织细胞破碎的方法,称为物理破碎法。
物理破碎法多用于微生物细胞的破碎。
常用的物理破碎法方法有温度差破碎法、压力差破碎法、超声波破碎法等,现简介如下:(1)温度差破碎法:利用温度的突然变化,由于热胀冷缩的作用而使细胞破碎的方法称为温度差破碎法。
(2)压力差破碎法:通过压力的突然变化,使细胞破碎的方法称为压力差破碎法。
常用的有高压冲击法、突然降压法、及渗透压变化法等。
(3)超声波破碎法:利用超声波发生器所发出的声波或超声波的作用,使细胞膜产生空穴作用( cavitation)而使细胞破碎的方法称为超声波破碎法。
1.3化学破碎法通过各种化学试剂对细胞膜的作用,而使细胞破碎的方法称为化学破碎法。
常用的化学试剂有甲苯、丙酮、丁醇、氯仿等有机溶剂,和特里顿(Triton)、吐温(Tween)等表面活性剂。
有机溶剂可以使细胞膜的磷脂结构破坏,从而改变细胞膜的透过性,使胞内酶等细胞内物质释放到细胞外。
表面活性剂可以和细胞膜中的磷脂以及脂蛋白相互作用,使细胞膜结构破坏,从而增加细胞膜的透过性。
1.4酶促破碎法通过细胞本身的酶系或外加酶制剂的催化作用,使细胞外层结构受到破坏,而达到细胞破碎的方法称为酶促破碎法,或称为酶学破碎法。