西南大学2020年春季[0094]化学实验教学研究课程考试参考答案
- 格式:docx
- 大小:12.59 KB
- 文档页数:2

一、单项选择题(本大题共15小题,每道题3.0分,共45.0分)1.以下溶液稀释10倍pH 改变最大的是A.0.1mol·L -1 NH4AcB.0.1mol·L -1 NaAcC.0.1mol·L -1 HAcD.0.1mol·L -1 HCl2.某些金属离子(如Ba 2+、 Mg 2+、Ca 2+等)能生成难溶的草酸盐沉淀,将沉淀滤出,洗涤后除去剩余的C 2O 42-后,用稀硫酸溶解,用KMnO4标准溶液滴定与金属离子相当的C 2O 42-,由此测定金属离子的含量。
此滴定方式为( )。
A.直接滴定法B.返滴定法C.间接滴定法D.置换滴定法3.用EDTA 滴定金属离子时,一般要使用缓冲溶液,原因是()A.EDTA与金属离子作用后释放出氢离子B.酸效应C.共存离子效应D.副反应系数4.用吸附指示剂法测定Cl-时,应选用的指示剂为A.二甲基二碘荧光黄B.荧光黄C.甲基紫D.曙红5.在氧化还原反应的任一瞬间,氧化态和还原态都能迅速地建立平衡,其电极电位符合能斯特方程的电对称为()A.可逆电对B.不可逆电对C.对称电对D.不对称电对6.下列违反无定形沉淀的生成条件的是( )A.沉淀作用宜在较浓的溶液中进行B.沉淀作用宜在热溶液中进行C.在不断搅拌下,迅速加入沉淀剂D.沉淀宜放置过夜,使沉淀陈化7.在置信度为95%时,测得Al2O3的平均值的置信区间为35.21±0.10,其意是( )A.在所测定的数据中有95%的数据在此区间内B.若再进行测定系列数据,将有95%落入此区间C.总体平均值μ落入此区间的概率为95%D.在此区间内包括总体平均值μ的把握有95%8.下列哪种情况不属于系统误差A.滴定管未经校正B.所用试剂中含有干扰离子C.天平两臂不等长D.砝码读错9.偏差是衡量( )A.精密度B.置信度C.准确度D.精确度10.浓度为c mol·L-1的Na2CO3溶液的物料平衡是()A.2[Na+]+[CO32-]=cB.[H2CO3]+ [HCO3-]+[CO32-]=cC.[Na+]=cD.2[Na+]=[CO32-]= c11.下面结果应以几位有效数字报出0.1010x(25.00-24.80)/1.00000 ( )A.5位B.3位C.4位D.2位12.用已知浓度的NaOH溶液滴定相同浓度的不同弱酸时,若弱酸的Ka越小,则( )A.消耗的NaOH越多B.滴定突跃越大C.滴定突跃越小D.指示剂颜色变化越不明显13.EDTA滴定金属离子,准确滴定(TE<0.1%)的条件是( )A.lgK MY≥6B.lgK MY'≥6C.lg(cKMY)≥6D.lg(cK MY')≥614.标定硫代硫酸钠溶液的基准物质是( )A.NaOHB.K2Cr2O7C.HAcD.KHC8H4O415.有一组平行测定所得的分析数据,要判断其中是否有可疑值,应采用( )A.t检验法B.G-检验法C.F检验法D.F检验法加t检验法二、判断题(本大题共10小题,每道题2.0分,共20.0分)1.共轭碱得到质子形成共轭酸,故HPO42-的共轭酸是H3PO4。

初中化学实验教学中如何培养学生的核心素养——以“二氧化碳实验室制法探究”为例摘要:化学是一门基于实验的科学,通过实验教学可以有效培养学生对化学的兴趣,培养学生的化学思维,使其掌握化学知识、掌握化学知识、掌握实验技术,培养学生的观察、实验能力。
初中化学教师要通过实验教学激发学生的学习兴趣和好奇心,充分发挥他们“敢于思考,敢于实验,敢于创新”的积极性,提高学生的科学探索能力、创造能力、证明推理和模式认知能力。
基于此,本文将从以下几个方面出发,详细阐述在初中化学实验教学中培养学生核心素养的有效策略,以期能够为相关教育工作者提供一些必要的参考。
关键词:初中化学;核心素养;二氧化碳;教学设计在新课程改革背景下,学科核心素养已成为当今课程改革的重要内容。
化学学科的核心素养有:“宏观识别和微观分析”、“变化观念和平衡思维”、“证据推理和模式认知”、“科学探究和创新意识”、“科学精神和社会责任”。
在初中教育阶段,化学教学处于起步状态,大多数学生都是出于好奇心和兴趣而对其进行学习。
《九年义务教育全日制初级中学化学教学大纲(试用)》指出,化学是一门以实验为主的课程。
教师要通过实验教学,激发学生对化学的兴趣,使他们形成自己的化学观念,掌握化学知识和技巧,并自主进行实验与观察【1】。
这对培养学生实事求是、严谨的科学态度和学习方式有很大的帮助。
二氧化碳实验室制法是初中化学教材中的重要内容,教师可以通过实验、讨论、阅读、实验方案设计等方式,发现(提出)问题——提出假设和猜测——设计实验——对收集到的信息进行分析、解释、得出结论。
通过实验和讨论,使学生逐渐了解科学探究的方式,并建立起科学探究的模式,有效提高学生的科学探索能力、创造能力、证明推理和模式认知能力【2】。
一、教学流程和情景设计笔者从所在学校抽取学习成绩相当的2个班级分别进行教学试验,这些学生未学过此内容,对“二氧化碳实验室制法”的现象及要探讨的问题是陌生的,能比较真实的反映出在给定学习条件下对该实验的现象及要探讨的问题的学习心理过程【3】。
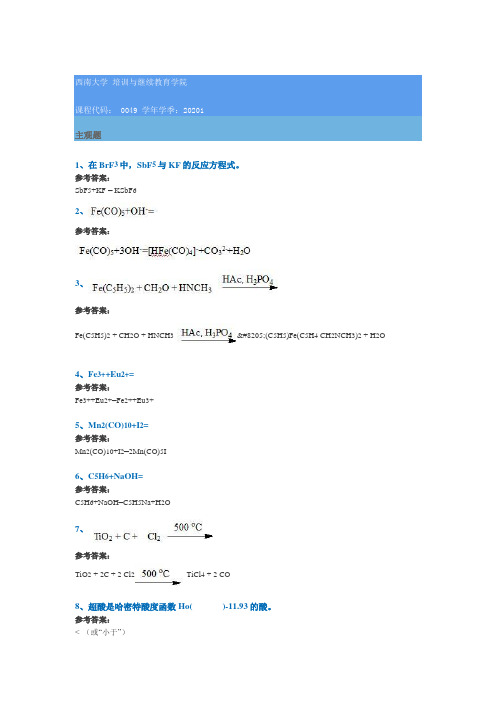
0049 20201主观题1、在BrF3中,SbF5与KF的反应方程式。
参考答案:SbF5+KF = KSbF62、参考答案:3、参考答案:Fe(C5H5)2 + CH2O + HNCH3‍(C5H5)Fe(C5H4 CH2NCH3)2 + H2O4、Fe3++Eu2+=参考答案:Fe3++Eu2+=Fe2++Eu3+5、Mn2(CO)10+I2=参考答案:Mn2(CO)10+I2=2Mn(CO)5I6、C5H6+NaOH=参考答案:C5H6+NaOH=C5H5Na+H2O7、参考答案:TiO2 + 2C + 2 Cl2TiCl4 + 2 CO8、超酸是哈密特酸度函数Ho()-11.93的酸。
参考答案:< (或“小于”)9、配合物四氢合铝(III)酸锂的化学式为()。
参考答案:Li(AlH4)10、K4[Fe(CN)6]为低自旋配合物,根据晶体场理论,中心离子的电子排布为()。
参考答案:t2g6 e g011、造成第三过渡元素原子半径和第二过渡元素原子半径相接近的原因是()。
参考答案:镧系收缩12、金属酶是能执行催化功能的()蛋白。
参考答案:金属13、根据鲍林规则,估计HOCl的p K a 值为()。
参考答案:≥ 714、[Fe(H2O)6]Cl3为高自旋配合物,根据晶体场理论,中心离子的电子排布为()。
参考答案:t2g3 e g215、二、三过渡系,称为()过渡元素。
参考答案:重单项选择题16、下列物种中,属于N2H5+的共轭碱是()。
.NH3.N2H4.N2H62+.N2H5OH17、按酸碱质子理论,下列分子或离子中为碱的是()。
.SbF5.NaAc.AlCl3.Ac -18、在[Co(NH3)4Cl2]中,Co的氧化数为()。
.0.+1.+2.+319、已知配合物[Pt(NH3)2(NO2) Cl]的空间构型为平面正方形,它的几何异构体数目为()。
. 1. 2. 3. 520、下列不是π-酸配体的是()。

解释"场效应"1.是由于取代基的大小和形状引起分子中特殊的张力或阻力的一种效应。
2.由于原子或集团电负性的影响沿着分子中键传导,引起分子中电子云按一定方向转移或键的极性通过键链依次诱导传递的效应。
3.分子中原子之间相互影响的电子效应,不是通过键链而是通过空间传递的效应4.分子中原子或原子团相互联接的方式和次序。
2、解释"空间效应"1.由于原子或集团电负性的影响沿着分子中键传导,引起分子中电子云按一定方向转移或键的极性通过键链依次诱导传递的效应。
2.是由于取代基的大小和形状引起分子中特殊的张力或阻力的一种效应。
3.分子中原子之间相互影响的电子效应,不是通过键链而是通过空间传递的的效应。
4.分子中原子或原子团相互连接的方式和次序。
3、解释"诱导效应":1.是由于取代基的大小和形状引起分子中特殊的张力或阻力的一种效应。
2.分子中原子或原子团相互连接的方式和次序。
3.在分子构造、构型确定的基础上因为单键的旋转而产生的分子中原子或原子团在空间的排列。
4.由于原子或集团电负性的影响沿着分子中键传导,引起分子中电子云按一定方向转移或键的极性通过键链依次诱导传递的效应。
判断题4、C=C不能发生亲核加成1. A.√2. B.×5、烯烃的硼氢化反应得到反Markovnikov(马氏)规则的产物。
1. A.√2. B.×6、在烯烃与卤化氢的加成反应中,卤化氢的活性顺序为:HI > HBr > HCl。
1. A.√2. B.×7、自由基是一类含有一个或多个未配对电子的中性物种1. A.√2. B.×8、典型的E2反应,新键的生成和旧键的断裂是协同进行的1. A.√2. B.×9、内消旋体是混合物1. A.√2. B.×10、亲电试剂是提供电子的反应物。
1. A.√2. B.×11、“邻基参与”是在亲核取代反应中,取代基能够与反应中心形成过渡态或中间体,从而影响反应的进行。

西南大学附中2024届高二化学第一学期期中学业质量监测试题注意事项1.考试结束后,请将本试卷和答题卡一并交回.2.答题前,请务必将自己的姓名、准考证号用0.5毫米黑色墨水的签字笔填写在试卷及答题卡的规定位置.3.请认真核对监考员在答题卡上所粘贴的条形码上的姓名、准考证号与本人是否相符.4.作答选择题,必须用2B铅笔将答题卡上对应选项的方框涂满、涂黑;如需改动,请用橡皮擦干净后,再选涂其他答案.作答非选择题,必须用05毫米黑色墨水的签字笔在答题卡上的指定位置作答,在其他位置作答一律无效.5.如需作图,须用2B铅笔绘、写清楚,线条、符号等须加黑、加粗.一、选择题(每题只有一个选项符合题意)1、已知某溶液中仅存在OH-、H+ 、NH4+、Cl-四种离子,其浓度大小有如下关系,其中一定不正确的是A.c(NH4+)<c(Cl-)<c(H+)<c(OH-)B.c(NH4+)=c(Cl-),且c(H+)=c(OH-)C.c(Cl-)>c(NH4+)>c(H+)>c(OH-)D.c(OH-)<c(NH4+)<c(H+)<c(Cl-)2、使反应4NH3(g)+3O2(g)=2N2(g)+6H2O(g)在2L的密闭容器中进行,半分钟后N2的物质的量增加了0.6mol。
此反应的平均速率υ(X)为A.υ(NH3)═0.04mol·L﹣1·s﹣1B.υ(O2)═0.015mol·L﹣1·s﹣1C.υ(N2)═0.02mol·L﹣1·s﹣1D.υ(H2O)═0.02mol·L﹣1·s﹣13、某些装饰材料会缓慢释放出某种化学物质,影响健康,这种化学物质可能是A.甲醛B.O2C.N2D.CO24、从下列实验事实所引出的相应结论正确的是A.A B.B C.C D.D5、下列第ⅦA族元素中,非金属性最强的是()A.氟B.氯C.溴D.碘6、关于化学式为[TiCl(H2O)5]Cl2·H2O的配合物,下列说法中正确的是()A.配体是Cl-和H2O,配位数是9B.中心离子是Ti4+,配离子是[TiCl(H2O)5]2+C.内界和外界中Cl-的数目比是1∶2D.加入足量AgNO3溶液,所有Cl-均被完全沉淀7、如图所示原电池,盐桥中装有含琼胶的KCl饱和溶液,相关的叙述中,不正确的是A.盐桥中的K+向Cu片移动B.电子沿导线由Cu片流向Ag片C.正极的电极反应是Ag++e-=AgD.Cu片上发生氧化反应,Ag片上发生还原反应8、下列化学用语中,正确的是A.氯化氢分子的形成过程可用电子式表示为:B.16O与18O的中子数和核外电子排布均不同C.稳定性:CH4>SiH4;还原性:HCl>H2SD.K+、Ca2+、Mg2+的离子半径依次减小9、某有机物的结构简式如下:,其可能具有的性质是:( )①能发生加成反应②能使酸性高锰酸钾溶液褪色③能发生取代反应④能发生中和反应⑤能发生氧化反应A.全部B.能发生①③④C.除⑤外都能D.除④⑤外都能10、下列物质属于混合物的是()A.氨水B.冰醋酸C.液氯D.碳酸钠11、.在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N—N键的键能为160kJ·mol-1(N2的键能为942kJ·mol-1),晶体片段结构如右图所示。

第 1页,共 6页2020-2021《化学实验》(四)期末课程考试试卷A适用专业: 考试日期:试卷所需时间:120分钟 闭卷 试卷总分100分 一、 选择题(单项选择,每小题2分,共20分) 1、以下可以用于正确表示滴定管读数的是( )A 21mLB 21.1mLC 21.10mL2、在装操作液之前,不宜用该操作液淌(润)洗的是( )。
A 滴定管B 移液管C 容量瓶 3、 用已知滴定分许操作中,下列操作中不正确的是 ( )。
A 滴定管用蒸馏水洗净后,直接加入滴定溶液B 滴定时,应将滴定管溶液的初读数调至0.00-1.00之间。
C 滴定临近终点,应用少量蒸馏水淋洗锥形瓶。
4、标定NaOH 常用的基准物是( )。
A 邻苯二甲酸氢钾B K 2Cr 2O 7C HCl 5、测水样钙含量时,应选的指示剂是( )。
A 酚酞B 铬黑TC 钙指示剂 6、NaOH 滴定HCl 时以酚酞为指示剂时,若NaOH 吸收了空气中的CO 2时,测定结果将( )A 增大B 减小C 不变7、利用分光光度计测定标准溶液吸光度时,正确的操作程序为( )。
A 由浓到稀B 由稀到浓C 无所谓8、在利用KMnO 4标准溶液测定H 2O 2含量时,H 2O 2需加入的酸是( )。
A H 2SO 4B HClC HNO 3 9、下列分析天平计数正确的是( )A 1.5234gB 1.53gC 1.5g10、分光光度法中,若试剂有颜色,样品没有颜色,应采用( )做参比。
A 试剂空白B 样品空白C 溶剂空白 二、填空题(每空2分,共10分)1、用重铬酸钾测定亚铁盐中铁含量时,需加入 作为指示剂。
2、测定标准溶液吸光度时,需使用 来测定吸光度。
3、测定食醋中总酸量时,若蒸馏水未经煮沸,结果会 (选偏高或偏低)。
4、在CuSO 4溶液中逐渐滴加氨水,现象是先 ,后 。
三、 判断题(每小题2分,共16分,对的打√,错的打 )( )1、加有H 2SO 4的Fe 2+待测溶液需立刻滴定,否则会对测定结果产生影响。
一、单项选择题(本大题共15小题,每道题3.0分,共45.0分)1.以下溶液稀释10倍pH 改变最大的是A.0.1mol·L -1 NH4AcB.0.1mol·L -1 NaAcC.0.1mol·L -1 HAcD.0.1mol·L -1 HCl2.某些金属离子(如Ba 2+、 Mg 2+、Ca 2+等)能生成难溶的草酸盐沉淀,将沉淀滤出,洗涤后除去剩余的C 2O 42-后,用稀硫酸溶解,用KMnO4标准溶液滴定与金属离子相当的C 2O 42-,由此测定金属离子的含量。
此滴定方式为( )。
A.直接滴定法B.返滴定法C.间接滴定法D.置换滴定法3.用EDTA 滴定金属离子时,一般要使用缓冲溶液,原因是()A.EDTA与金属离子作用后释放出氢离子B.酸效应C.共存离子效应D.副反应系数4.用吸附指示剂法测定Cl-时,应选用的指示剂为A.二甲基二碘荧光黄B.荧光黄C.甲基紫D.曙红5.在氧化还原反应的任一瞬间,氧化态和还原态都能迅速地建立平衡,其电极电位符合能斯特方程的电对称为()A.可逆电对B.不可逆电对C.对称电对D.不对称电对6.下列违反无定形沉淀的生成条件的是( )A.沉淀作用宜在较浓的溶液中进行B.沉淀作用宜在热溶液中进行C.在不断搅拌下,迅速加入沉淀剂D.沉淀宜放置过夜,使沉淀陈化7.在置信度为95%时,测得Al2O3的平均值的置信区间为35.21±0.10,其意是( )A.在所测定的数据中有95%的数据在此区间内B.若再进行测定系列数据,将有95%落入此区间C.总体平均值μ落入此区间的概率为95%D.在此区间内包括总体平均值μ的把握有95%8.下列哪种情况不属于系统误差A.滴定管未经校正B.所用试剂中含有干扰离子C.天平两臂不等长D.砝码读错9.偏差是衡量( )A.精密度B.置信度C.准确度D.精确度10.浓度为c mol·L-1的Na2CO3溶液的物料平衡是()A.2[Na+]+[CO32-]=cB.[H2CO3]+ [HCO3-]+[CO32-]=cC.[Na+]=cD.2[Na+]=[CO32-]= c11.下面结果应以几位有效数字报出0.1010x(25.00-24.80)/1.00000 ( )A.5位B.3位C.4位D.2位12.用已知浓度的NaOH溶液滴定相同浓度的不同弱酸时,若弱酸的Ka越小,则( )A.消耗的NaOH越多B.滴定突跃越大C.滴定突跃越小D.指示剂颜色变化越不明显13.EDTA滴定金属离子,准确滴定(TE<0.1%)的条件是( )A.lgK MY≥6B.lgK MY'≥6C.lg(cKMY)≥6D.lg(cK MY')≥614.标定硫代硫酸钠溶液的基准物质是( )A.NaOHB.K2Cr2O7C.HAcD.KHC8H4O415.有一组平行测定所得的分析数据,要判断其中是否有可疑值,应采用( )A.t检验法B.G-检验法C.F检验法D.F检验法加t检验法二、判断题(本大题共10小题,每道题2.0分,共20.0分)1.共轭碱得到质子形成共轭酸,故HPO42-的共轭酸是H3PO4。
2020年化学课程标准测试题一、选择题(每个2分,共20分)1、高中化学课程目标中的化学课程目标共有几个层次A : 3B : 4C : 5D : 62 、化学新课程教学应运用以什么为主的多样化教学方式A:启发式教学B:讲授式C:讨论式D:探究式3、只以实验类活动为主的模块是A: 化学1 B: 化学2 C: 化学与生活D: 化学与技术4、《课标》中对减少污染使用的是哪个词A: 防止B: 预防C: 治理D: 防治5、科学探究的核心是A: 问题B: 解释C: 证据D: 假设6、STS教育中,STS三个字母不包括那一项A: 科学B: 技术C: 社会D: 生活7、化学实验设计的首要原则是A: 简约性原则B: 安全性原则C: 科学性原则D: 绿色化原则8、属于体验性学习目标中领悟水平的行为动词是A:感受 B:关注 C:珍惜 D:养成9、下列行为动词,哪一个属于认知性学习目标中掌握水平的A:知道 B:辨认 C:解释 D:证明10、下列哪一项不属于认知性目标的水平划分A:了解水平 B:理解水平 C:应用水平 D:反应水平二、判断题(共20分)1、化学是在原子、分子水平上研究物质的组成、结构、性质及其应用的一门基础自然科学,其特征是研究分子和创造分子。
()2、化学课程标准是普通高校招生化学科考试的命题依据。
学生在高中阶段学完化学1、化学2之后,可达到高中化学课程学习的毕业要求。
()3、体验性目标是指用学生的心理感悟、活动感受来陈述的目标。
这类目标所采用的行为动词往往是体验性的、过程性的、表现性的,主要用于“过程与方法”、“情感态度与价值观”目标的陈述。
()4、教学是一个极具创造性的过程,教师只有把《高中化学课程标准》的目标、理念和要求,把教科书的教学内容和所体现的教学方法,转化为符合自身特点的教学设计,才能有效地达到课程目标。
()5、做实验未必是科学的探究,只有在已有经验(包括事实经验和探究模型经验)和相关理解指导下的科学活动才算是高质量的科学探究。
西南大学网络与继续教育学院课程考试试题卷
类别:网教2020年5月
课程名称【编号】:化学实验教学研究【0094】
A卷大作业满分:100 分
要答案:wangjiaofudao
一、简答题(40分,共5题选做4题,每题10分)
1、演示实验是化学教学重要的方式之一,教师进行演示实验安装仪器时有什么要求?
2、请绘制启普发生器的图,并对照图简述其结构和各个部件的作用。
3、请简述正交表L4(23)表示什么意思?
4、简述容量瓶的使用方法。
5、请简述化学教学中,化学实验观察的内容有哪些?
二、设计与论述题(60分,共3题选做2题,每题30分)
1、图1是高中教材中氨喷泉实验的装置,请你用生活用品设计一套该实验的替代品。
(1)请写出实验装置设计的方案和思路(阐明材料选取的依据);(2)画出你设计的装置图(指明所用材料名称);(3)简述用你设计的装置进行实验的操作步骤;(4)使用该装置进行实验的注意事项。
(注:设计的装置,能够看到喷泉产生、且持续时间长,并能够说明氨极易溶于水、显碱性的性质;选取的材料要注意能够直观观察到现象、能够承受一定的压力。
)
2、图2和3分别是“二氧化碳与氢氧化钠反应”实验的装置。
(1)写出实验的原理;(2)分别写出用两种装置的操作方法和实验现象;(3)简述图3的优点
3、研究物质受热分解情况,高中化学教材中是将Na2CO3 和NaHCO3分别在试管中加热(见图4),由于实验是分两次进行的,学生可能会提出“两次实验试管不同、酒精灯的温度也可能不同”的异议。
请你重新设计一套实验装置,使Na2CO3 和NaHCO3的热稳定性对比实验在同一条件下进行,既节约实验时间,而且使结
论更具有说服力。
(1)请写明设计思路;
(2)画出你所设计的实验装置图(标明仪器和药品);(3)写出用你设计的实验装置进行实验的操作步骤及现象;(4)改进后装置的优点。