【新步步高】2014-2015学年高二化学人教版选修4课后作业:第一章第一节 第2课时 热化学方程式
- 格式:doc
- 大小:346.00 KB
- 文档页数:5

第一章化学反应与能量第一节化学反应与能量的变化第1课时焓变反应热[目标要求] 1.了解反应热的概念,知道化学反应、热效应与反应的焓变之间的关系。
2.知道反应热与化学键的关系。
3.知道反应热与反应物、生成物总能量的关系。
焓变反应热在化学反应过程中,不仅有物质的变化,同时还伴有能量变化。
1.焓和焓变焓是与物质内能有关的物理量。
单位:kJ·mol-1,符号:H。
焓变是在恒压条件下,反应的热效应。
单位:kJ·mol-1,符号:ΔH。
2.化学反应中能量变化的原因化学反应的本质是反应物分子中旧化学键断裂和生成物生成时新化学键形成的过程。
任何化学反应都有反应热,这是由于在化学反应过程中,当反应物分子间的化学键断裂时,需要克服原子间的相互作用,这需要吸收能量;当原子重新结合成生成物分子,即新化学键形成时,又要释放能量。
ΔH=反应物分子的总键能-生成物分子的总键能。
3.放热反应与吸热反应当反应完成时,生成物释放的总能量与反应物吸收的总能量的相对大小,决定化学反应是吸热反应还是放热反应。
(1)当ΔH为“-”或ΔH<0时,为放热反应,反应体系能量降低。
(2)当ΔH为“+”或ΔH>0时,为吸热反应,反应体系能量升高。
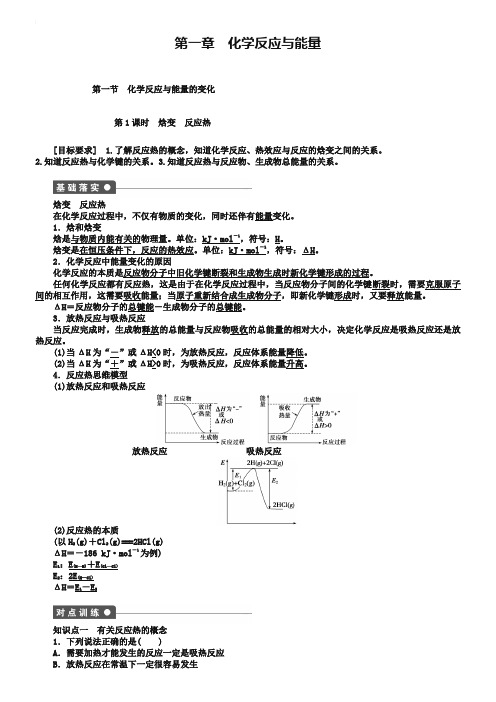
4.反应热思维模型(1)放热反应和吸热反应放热反应吸热反应(2)反应热的本质(以H2(g)+Cl2(g)===2HCl(g)ΔH=-186 kJ·mol-1为例)E1:E(H—H)+E(Cl—Cl)E2:2E(H—Cl)ΔH =E 1-E 2知识点一 有关反应热的概念1.下列说法正确的是( )A .需要加热才能发生的反应一定是吸热反应B .放热反应在常温下一定很容易发生C .吸热反应在一定的条件下也能发生D .焓变的符号是ΔH ,单位是kJ·mol -1,反应热的单位是kJ答案 C2.已知在相同状况下,要使同一化学键断裂需要吸收的能量等于形成该化学键放出的能量。

新课标高中化学课后习题答案【选修 4 课后答】『必修 1 部分答案』第一章 (2)第一节化学反应与能量的变化 (2)第二节燃烧热能源 (3)第三节化学反应热的计算 (4)第二章 (7)第一节化学反应速率 (7)第二节影响化学反应速率的因素 (7)第三节化学平衡 (8)第四节化学反应进行的方向 (9)第三章 (9)第一节弱电解质的电离 (9)第二节水的电离和溶液的酸碱性 (10)第三节盐类的水解 (11)第四节难溶电解质的溶解平衡 (12)人教版新教材--高中化学必修 1 课后习题答案 (14)第一章从实验学化学 (14)第一节化学实验基本方法 (14)化学计量在试验中的应用 (14)第一章习题 (15)化学物质及其变化 (15)物质的分类 (15)离子反应 (16)氧化还原反应 (17)金属及其化合物 (18)金属的化学性质 (18)几种重要的金属化合物 (18)用途广泛的金属材料 (19)第一章第一节化学反应与能量的变化四、习题参考(一)参考答案1. 化学反应过程中所释放或吸收的能量,叫做反应热,在恒压条件下,它等于反应前后物质的焓变,符号是H,单位是kJ/mol 。
例如 1 mol H 2 (g) 燃烧,生成 1 mol H 2 O(g) ,其反应热H=-241.8 kJ/mol。
2. 化学反应的实质就是反应物分子中化学键断裂,形成新的化学键,重新组合成生成物的分子。
旧键断裂需要吸收能量,新键形成需要放出能量。
当反应完成时,若生成物释放的能量比反应物吸收的能量大,则此反应为放热反应;若生成物释放的能量比反应物吸收的能量小,反应物需要吸收能量才能转化为生成物,则此反应为吸热反应。
(二)补充习题1 .下列说法不正确的是()。
A.放热反应不需加热即可发生B.化学反应过程中的能量变化除了热能外,也可以是光能、电能等C.需要加热才能进行的化学反应不一定是吸热反应D.化学反应热效应数值与参加反应的物质多少有关2.将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。

人教版高中化学选修四——《化学反应原理》课本习题参考答案第一单元第一节化学反应与能量的变化1. 化学反应过程中所释放或吸收的能量,叫做反应热,在恒压条件下,它等于反应前后物质的焓变,符号是ΔH,单位是kJ/mol。
例如1 mol H2(g)燃烧,生成1 mol H2O(g),其反应热ΔH=-241.8 kJ/mol。
2. 化学反应的实质就是反应物分子中化学键断裂,形成新的化学键,重新组合成生成物的分子。
旧键断裂需要吸收能量,新键形成需要放出能量。
当反应完成时,若生成物释放的能量比反应物吸收的能量大,则此反应为放热反应;若生成物释放的能量比反应物吸收的能量小,反应物需要吸收能量才能转化为生成物,则此反应为吸热反应。
第二节第三节燃烧热能源1. 在生产和生活中,可以根据燃烧热的数据选择燃料。
如甲烷、乙烷、丙烷、甲醇、乙醇、氢气的燃烧热值均很高,它们都是良好的燃料。
2. 化石燃料蕴藏量有限,不能再生,最终将会枯竭,因此现在就应该寻求应对措施。
措施之一就是用甲醇、乙醇代替汽油,农牧业废料、高产作物(如甘蔗、高粱、甘薯、玉米等)、速生树木(如赤杨、刺槐、桉树等),经过发酵或高温热分解就可以制造甲醇或乙醇。
由于上述制造甲醇、乙醇的原料是生物质,可以再生,因此用甲醇、乙醇代替汽油是应对能源危机的一种有效措施。
3. 氢气是最轻的燃料,而且单位质量的燃烧热值最高,因此它是优异的火箭燃料,再加上无污染,氢气自然也是别的运输工具的优秀燃料。
在当前,用氢气作燃料尚有困难,一是氢气易燃、易爆,极易泄漏,不便于贮存、运输;二是制造氢气尚需电力或别的化石燃料,成本高。
如果用太阳能和水廉价地制取氢气的技术能够突破,则氢气能源将具有广阔的发展前景。
4. 甲烷是一种优质的燃料,它存在于天然气之中。
但探明的天然气矿藏有限,这是人们所担心的。
现已发现海底存在大量水合甲烷,其储量约是已探明的化石燃料的2倍。
如果找到了适用的开采技术,将大大缓解能源危机。

第一节化学反应与能量的变化一、选择题1.根据键能数据估算CH4(g)+4F2(g)CF4(g)+4HF(g)的反应热ΔH为()。
化学键C—H C—F H—F F—F键能/(kJ·mol-1)414489565155A.-485 kJ·mol-1B.+485 kJ·mol-1C.+1940 kJ·mol-1D.-1940 kJ·mol-12.下列说法不正确的是()A.干冰升华需要吸收大量的热,属于吸热反应B.酒精常被用作酒精灯和内燃机的燃料,说明酒精燃烧是放热反应C.木炭虽然要在加热条件下才能燃烧,但木炭燃烧是放热反应D.人们用氢氧焰焊接或切割金属,主要利用了氢气和氧气化合时所放出的热量3.对于化学反应:2Na+2H2O===2NaOH+H2↑的有关叙述错误的是()A.该反应中既有旧化学键的断裂,也有新化学键的形成B.该反应中每消耗1 mol Na,则同时消耗18 g H2O,产生1 mol NaOH和11.2 L H2(标准状况下)C.尽管该反应常温下能自发进行,但该反应是吸热反应D.由于该反应是放热反应,所以断裂旧化学键所吸收的能量一定比形成新化学键所放出的能量少4.如图表示A2和B2反应的历程,其中虚线表示的是使用催化剂的反应历程,下列说法正确的是()A.正反应为吸热反应B.正反应为放热反应C.加入催化剂,该化学反应的反应热增大D.从图中可以看出,该反应的反应热与反应途径有关5.下列有关中和热的说法正确的是 ()A.中和热的热化学方程式:H+(l)+OH-(l)===H2O(l)ΔH=-57.3 kJ·mol-1B.准确测量中和热的实验过程中,至少需测定温度4次C.环形玻璃搅拌棒材料若用铜代替,则测量出的中和热数值偏小D.若稀酸溶液中H+与稀碱溶液中OH的物质的量相等,则所测中和热数值更准确6.完全燃烧m g液态乙醇得到液态水时放出的热量为a kJ,经测定m g液态乙醇与Na反应时最多可生成0.5 g H 2,则液态乙醇完全燃烧的热化学方程式为 ( )A .C 2H 5OH(l)+3O 2(g)===2CO 2(g)+3H 2O(l) ΔH =-a kJ·mol -1 B .C 2H 5OH(l)+3O 2(g)===2CO 2(g)+3H 2O(l)ΔH =+12a kJ·mol -1 C.12C 2H 5OH(l)+32O 2(g)===CO 2(g)+32H 2O(l)ΔH =+a kJ·mol -1 D .C 2H 5OH(l)+3O 2(g)===2CO 2(g)+3H 2O(l)ΔH =-2a kJ·mol -1 7.下列过程中ΔH 小于零的是 ( )A .氯酸钾分解制氧气B .氯化铵受热分解C .氮气还原氧化铜D .实验窒用锌和稀硫酸反应制氢气8.下列物质放入水中,会显著放热的是 ( )A .食盐B .蔗糖C .酒精D .生石灰9.下列说法中正确的是( )A .中和热的测定实验中需要用的主要玻璃仪器有两只大小相同的烧杯、两个大小相同的量筒、温度计、环形玻璃搅拌棒B .可以用保温杯代替烧杯做有关中和热测定的实验C .在测定中和热的实验中,至少需要测定并记录的温度是3次D .测定中和热实验中,若所使用的稀NaOH 溶液的物质的量稍大于稀盐酸,则会导致所测得的中和热数值偏高10.某反应的能量关系如图所示,下列有关说法正确的是( )A .C(金刚石,s)===C(石墨,s) ΔH <0B .金刚石比石墨稳定C .1 mol C(石墨,s)转化为1 mol C(金刚石,s)的ΔH =E 2-E 1D .断开1 mol 石墨中的化学键所吸收的能量小于断开1 mol 金刚石中化学键所吸收的能量11.如图所示,有关化学反应和能量变化的说法不正确的是( )A .图a 表示的是放热反应的能量变化B.图b表示反应物的键能总和高于生成物的键能总和C.图b可以表示氯化铵固体与氢氧化钡晶体反应的能量变化D.图a表示的反应不需要加热就一定能发生,图b表示的反应一定需要加热才能发生12.已知H—H键键能(化学键断裂时吸收或形成时释放的能量)为436 kJ·mol-1,N—H键键能为391 kJ·mol-1,根据热化学方程式:N2(g)+3H2(g)===2NH3(g),ΔH=-92.4 kJ·mol-1,可知N≡N键的键能是()A.431 kJ·mol-1B.946 kJ·mol-1C.649 kJ·mol-1D.896 kJ·mol-1二、非选择题13.A(g)+B(g)C(g)+D(g)过程中的能量(kJ)变化如图所示,回答下列问题。
第一章化学反应与能量第一节化学反应与能量的变化第1课时焓变反应热[目标要求] 1.了解反应热的概念,知道化学反应、热效应与反应的焓变之间的关系。
2.知道反应热与化学键的关系。
3.知道反应热与反应物、生成物总能量的关系。
焓变反应热在化学反应过程中,不仅有物质的变化,同时还伴有能量变化。
1.焓和焓变焓是与物质内能有关的物理量。
单位:kJ·mol-1,符号:H。
焓变是在恒压条件下,反应的热效应。
单位:kJ·mol-1,符号:ΔH。
2.化学反应中能量变化的原因化学反应的本质是反应物分子中旧化学键断裂和生成物生成时新化学键形成的过程。
任何化学反应都有反应热,这是由于在化学反应过程中,当反应物分子间的化学键断裂时,需要克服原子间的相互作用,这需要吸收能量;当原子重新结合成生成物分子,即新化学键形成时,又要释放能量。
ΔH=反应物分子的总键能-生成物分子的总键能。
3.放热反应与吸热反应当反应完成时,生成物释放的总能量与反应物吸收的总能量的相对大小,决定化学反应是吸热反应还是放热反应。
(1)当ΔH为“-”或ΔH<0时,为放热反应,反应体系能量降低。
(2)当ΔH为“+”或ΔH>0时,为吸热反应,反应体系能量升高。
4.反应热思维模型(1)放热反应和吸热反应放热反应吸热反应(2)反应热的本质(以H2(g)+Cl2(g)===2HCl(g)ΔH=-186 kJ·mol-1为例)E1:E(H—H)+E(Cl—Cl)E2:2E(H—Cl)ΔH=E1-E2知识点一有关反应热的概念1.下列说法正确的是( )A.需要加热才能发生的反应一定是吸热反应B.放热反应在常温下一定很容易发生C .吸热反应在一定的条件下也能发生D .焓变的符号是ΔH ,单位是kJ·mol -1,反应热的单位是kJ 答案 C2.已知在相同状况下,要使同一化学键断裂需要吸收的能量等于形成该化学键放出的能量。
下列说法正确的是( )A .电解熔融的Al 2O 3可以制得金属铝和氧气,该反应是一个放出能量的反应B .水分解产生氢气和氧气时放出能量C .相同状况下,反应2SO 2+O 2===2SO 3是一个放热反应,则反应2SO 3===2SO 2+O 2是一个吸热反应D .氯化氢分解成氢气和氯气时放出能量 答案 C解析 由题意可以推测,如果一个反应过程放出能量,那么使该反应向反方向进行则需要吸收能量,所以C 正确;另外氢气和氧气反应、氢气和氯气反应、铝和氧气反应都是放出能量的反应,与它们相反的反应:水、氯化氢和Al 2O 3的分解都应该是吸收能量的反应,故A 、B 、D 错误。

第2课时 热化学方程式 中和热的测定[核心素养发展目标] 1.模型认知:建立从定性到定量描述化学反应中的能量变化的思维模型,会正确书写热化学方程式。
2.科学探究:理解反应热(中和热)测定的原理和方法,会分析产生误差的原因,不断完善和改进测定方法。
一、热化学方程式1.热化学方程式的概念及意义(1)热化学方程式是表示参加反应物质的量和反应热的关系的化学方程式。
(2)热化学方程式的意义:不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。
(3)实例:H 2(g)+12O 2(g)===H 2O(l) ΔH =-285.8 kJ·mol -1表示的意义是:在25 ℃、101 kPa下,1 mol 气态H 2与12 mol 气态O 2反应生成1 mol 液态水时,放出的热量是285.8 kJ 。
2.热化学方程式的书写方法(1)写出相应的化学方程式。
热化学方程式中各物质化学式前的化学计量数只表示其物质的量,可以是整数或分数。
(2)标注反应的温度和压强。
没有特殊说明是指25 ℃、101 kPa ,该条件可以不标注,但其他条件必须标注。
(3)标注各物质聚集状态。
在物质后面用括号标注各物质的聚集状态:气体用“g ”,液体用“l ”,固体用“s ”,溶液用“aq ”。
(4)标注ΔH 的正负。
化学方程式后面空一格标注ΔH ,若为放热反应,ΔH 为“-”;若为吸热反应,ΔH 为“+”。
(5)计算ΔH 的数值。
根据化学方程式中的化学计量数计算写出ΔH 的数值。
ΔH 单位是kJ·mol -1。
(1)热化学方程式书写的注意事项:①热化学方程式中不用标明反应条件(如“加热”“高温”“催化剂”等)。
②热化学方程式中不再用“↑”“↓”来标记气体生成物和难溶生成物。
③热化学方程式中一般用“===”(可逆反应中用“”),即便是有机反应的热化学方程式中也不用“―→”。
(2)热化学方程式中化学式前面的化学计量数必须与ΔH相对应,若化学计量数加倍,则ΔH 的数值也要加倍。
第2课时热化学方程式[目标要求] 1.知道热化学方程式的意义。
2.知道影响反应热大小的因素。
3.会写热化学方程式。
4.能熟练判断热化学方程式的正误。
5.了解中和热的含义及测定方法。
一、热化学方程式1.概念能表示参加反应的物质的量和反应热的关系的化学方程式叫做热化学方程式。
2.表示意义(1)热化学方程式不仅表明了化学反应中的物质变化,也表明了化学反应中的热量变化。
(2)热化学方程式中物质的化学计量数,表示实际参加反应的反应物的物质的量和实际生成的生成物的物质的量。
(3)热化学方程式中的反应热与反应物、生成物的物质的量相对应。
3.书写热化学方程式的注意事项(1)注明物质的聚集状态;(2)标出对应的反应热;(3)标明反应所处的外界条件(常温常压时,可不注明)。
二、中和热的测定1.实验原理在稀溶液中,强酸跟强碱发生中和反应生成1_mol_H2O,这时的反应热叫做中和热。
2.注意事项(1)碱液稍过量的目的是确保盐酸被完全中和。
(2)操作时动作要快目的是尽量减少热量的损失。
(3)实验中若使用了弱酸或弱碱,会使测得中和热的数值偏小。
知识点一热化学方程式的概念和意义1.下列说法正确的是()A.书写热化学方程式时,只要在化学方程式的右端写上热量的符号和数值即可B.凡是在加热或点燃条件下进行的反应都是吸热反应C.表明反应所放出或吸收热量的化学方程式叫做热化学方程式D.氢气在氧气中燃烧的热化学方程式是2H2(g)+O2(g)===2H2O(l)ΔH=-483.6 kJ答案 C解析A项,热化学方程式还应注明各物质的聚集状态;B项,放热反应有时在点燃或加热时才能发生;D项,ΔH的单位错误。
2.热化学方程式C(s)+H2O(g)===CO(g)+H2(g)ΔH=+131.3 kJ·mol-1表示() A.碳和水反应吸收131.3 kJ能量B.1 mol碳和1 mol水反应生成1 mol一氧化碳和1 mol氢气并吸收131.3 kJ热量C.1 mol固态碳和1 mol水蒸气反应生成1 mol一氧化碳气体和1 mol氢气并吸收131.3 kJ热量D.1个固态碳原子和1分子水蒸气反应吸热131.3 kJ答案 C解析依据反应热的概念,表示按照热化学方程式计量数的物质的量反应时吸收或放出的热量,单位是kJ·mol-1,该热化学方程式表示1 mol固态碳和1 mol水蒸气反应生成1 mol一氧化碳气体和1 mol 氢气并吸收131.3 kJ 的热量,特别要指明水的状态。
人教版化学选修4课后习题参考答案第一章第一节(P.6)1. 化学反应过程中所释放或吸收的能量,叫做反应热,在恒压条件下,它等于反应前后物质的焓变,符号是ΔH,单位是kJ/mol。
例如1 mol H2 (g)燃烧,生成1 mol H2O(g),其反应热ΔH=-241.8 kJ/mol。
2. 化学反应的实质就是反应物分子中化学键断裂,形成新的化学键,重新组合成生成物的分子。
旧键断裂需要吸收能量,新键形成需要放出能量。
当反应完成时,若生成物释放的能量比反应物吸收的能量大,则此反应为放热反应;若生成物释放的能量比反应物吸收的能量小,反应物需要吸收能量才能转化为生成物,则此反应为吸热反应。
第二节(P.10)1. 在生产和生活中,可以根据燃烧热的数据选择燃料。
如甲烷、乙烷、丙烷、甲醇、乙醇、氢气的燃烧热值均很高,它们都是良好的燃料。
2. 化石燃料蕴藏量有限,不能再生,最终将会枯竭,因此现在就应该寻求应对措施。
措施之一就是用甲醇、乙醇代替汽油,农牧业废料、高产作物(如甘蔗、高粱、甘薯、玉米等)、速生树木(如赤杨、刺槐、桉树等),经过发酵或高温热分解就可以制造甲醇或乙醇。
由于上述制造甲醇、乙醇的原料是生物质,可以再生,因此用甲醇、乙醇代替汽油是应对能源危机的一种有效措施。
3. 氢气是最轻的燃料,而且单位质量的燃烧热值最高,因此它是优异的火箭燃料,再加上无污染,氢气自然也是别的运输工具的优秀燃料。
在当前,用氢气作燃料尚有困难,一是氢气易燃、易爆,极易泄漏,不便于贮存、运输;二是制造氢气尚需电力或别的化石燃料,成本高。
如果用太阳能和水廉价地制取氢气的技术能够突破,则氢气能源将具有广阔的发展前景。
4. 甲烷是一种优质的燃料,它存在于天然气之中。
但探明的天然气矿藏有限,这是人们所担心的。
现已发现海底存在大量水合甲烷,其储量约是已探明的化石燃料的2倍。
如果找到了适用的开采技术,将大大缓解能源危机。
5. 柱状图略。
关于如何合理利用资源、能源,学生可以自由设想。
化学选修4课后习题答案第一章:化学平衡与溶液习题1:在500 mL 0.1 mol/L HCl 溶液中加入1 g KCl,求该溶液的pH值。
首先,计算KCl的摩尔量:摩尔质量(KCl) = 39.1 + 35.5 = 74.6 g/mol摩尔量(KCl) = 质量(KCl) / 摩尔质量(KCl) = 1g / 74.6g/mol = 0.0134 mol然后,计算盐酸(HCl)的摩尔量:摩尔质量(HCl) = 1.0 + 35.5 = 36.5 g/mol摩尔量(HCl) = 浓度(HCl) * 体积(HCl) = 0.1 mol/L * 0.5 L = 0.05 mol根据物质的摩尔量关系,可知盐酸(HCl)反应完全后的物质摩尔量:KCl:HCl = 1:1,所以 KCl 的摩尔量 = HCl 的摩尔量 = 0.0134 mol所以,盐酸(HCl)与KCl反应后,生成溶液中的氯离子的摩尔量为:氯离子(Cl-)的摩尔量 = 0.05 mol + 0.0134 mol = 0.0634 mol由此可得溶液中氯离子的浓度:浓度(Cl-) = 摩尔量(Cl-) / 体积溶液 = 0.0634 mol / 0.5 L = 0.1268 mol/ L根据氯离子的浓度求溶液的pH值:pH = -lg[Cl-] = -lg(0.1268) ≈ 0.9所以该溶液的pH值约为0.9。
习题2:若已知 0.1 mol/L HCl 和 0.05 mol/L NaOH 完全反应生成水和盐的化学方程式,求生成的氯化钠的质量。
化学方程式为:HCl + NaOH → NaCl + H2O根据方程式可知,1 mol HCl 反应生成 1 mol NaCl。
所以 0.1 mol/L HCl 反应生成的 NaCl 的摩尔质量:摩尔质量(NaCl) = 23.0 + 35.5 = 58.5 g/mol所以生成的 NaCl 的质量为:质量(NaCl) = 摩尔质量(NaCl) * 反应生成的 NaCl 的摩尔量= 58.5 g/mol * 0.1 mol/L * 1 L = 5.85 g所以生成的氯化钠的质量为 5.85 g。
第2课时热化学方程式[目标要求] 1.知道热化学方程式的意义。
2.知道影响反应热大小的因素。
3.会写热化学方程式。
4.能熟练判断热化学方程式的正误。
5.了解中和热的含义及测定方法。
一、热化学方程式1.概念能表示参加反应的物质的量和反应热的关系的化学方程式叫做热化学方程式。
2.表示意义(1)热化学方程式不仅表明了化学反应中的物质变化,也表明了化学反应中的热量变化。
(2)热化学方程式中物质的化学计量数,表示实际参加反应的反应物的物质的量和实际生成的生成物的物质的量。
(3)热化学方程式中的反应热与反应物、生成物的物质的量相对应。
3.书写热化学方程式的注意事项(1)注明物质的聚集状态;(2)标出对应的反应热;(3)标明反应所处的外界条件(常温常压时,可不注明)。
二、中和热的测定1.实验原理在稀溶液中,强酸跟强碱发生中和反应生成1_mol_H2O,这时的反应热叫做中和热。
2.注意事项(1)碱液稍过量的目的是确保盐酸被完全中和。
(2)操作时动作要快目的是尽量减少热量的损失。
(3)实验中若使用了弱酸或弱碱,会使测得中和热的数值偏小。
知识点一热化学方程式的概念和意义1.下列说法正确的是()A.书写热化学方程式时,只要在化学方程式的右端写上热量的符号和数值即可B.凡是在加热或点燃条件下进行的反应都是吸热反应C.表明反应所放出或吸收热量的化学方程式叫做热化学方程式D.氢气在氧气中燃烧的热化学方程式是2H2(g)+O2(g)===2H2O(l)ΔH=-483.6 kJ答案 C解析A项,热化学方程式还应注明各物质的聚集状态;B项,放热反应有时在点燃或加热时才能发生;D项,ΔH的单位错误。
2.热化学方程式C(s)+H2O(g)===CO(g)+H2(g)ΔH=+131.3 kJ·mol-1表示() A.碳和水反应吸收131.3 kJ能量B.1 mol碳和1 mol水反应生成1 mol一氧化碳和1 mol氢气并吸收131.3 kJ热量C.1 mol固态碳和1 mol水蒸气反应生成1 mol一氧化碳气体和1 mol氢气并吸收131.3 kJ热量D.1个固态碳原子和1分子水蒸气反应吸热131.3 kJ答案 C解析依据反应热的概念,表示按照热化学方程式计量数的物质的量反应时吸收或放出的热量,单位是kJ·mol-1,该热化学方程式表示1 mol固态碳和1 mol水蒸气反应生成1 mol一氧化碳气体和1 mol 氢气并吸收131.3 kJ 的热量,特别要指明水的状态。
知识点二 热化学方程式的书写及正误判断3.分析图中的能量变化情况,下列正确的是( )A .2A +B===2C ΔH <0B .2C===2A +B ΔH <0C .2A(g)+B(g)===2C(g) ΔH <0D .2A(g)+B(g)===2C(g) ΔH >0答案 D解析 A 、B 选项没注明物质状态,且ΔH 的符号错误,均不正确。
根据图象先确定物质总能量的相对关系,再确定放热:2C(g)===2A(g)+B(g) ΔH <0或吸热:2A(g)+B(g) ===2C(g) ΔH >0。
4.已知在1×105 Pa 、298 K 条件下,2 mol 氢气燃烧生成水蒸气放出484 kJ 热量,下列热化学方程式正确的是( )A .H 2O(g)===H 2(g)+12O 2(g) ΔH =+242 kJ·mol -1 B .2H 2(g)+O 2(g)===2H 2O(l) ΔH =-484 kJ·mol -1C .H 2(g)+12O 2(g)===H 2O(g) ΔH =+242 kJ·mol -1 D .2H 2(g)+O 2(g)===2H 2O(g) ΔH =+484 kJ·mol -1答案 A解析 氢气燃烧是放热反应,其ΔH 应为负值,故C 、D 错误;2 mol 氢气燃烧生成水蒸气放出484 kJ 热量,而B 是生成液态水,所以B 也是错误的;反应逆向进行,ΔH 符号相反,因此A 是正确的。
知识点三 中和热5.50 mL 0.50 mol·L -1盐酸与50 mL 0.55 mol·L -1NaOH 溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。
试回答下列问题:(1)大小烧杯间填满碎纸条的作用是________________________________________________________________________。
(2)大烧杯上如不盖硬纸板,求得的中和热数值将________(填“偏大”、“偏小”或“无影响”)。
结合日常生活的实际该实验在______中进行效果更好。
(3)实验中改用60 m L 0.50 mol·L -1盐酸与 50 m L 0.55 mol·L -1 NaOH 溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”),简述理由__________________________________________。
(4)用相同浓度和体积的氨水代替NaOH 溶液进行上述实验,测得的中和热的数值会________;用50 m L 0.5 mol·L -1 NaOH 溶液进行上述实验,测得的中和热的数值会________________________________________________________________________。
(均填“偏大”、“偏小”或“无影响”)答案 (1)减少实验过程中的热量损失 (2)偏小 保温杯 (3)不相等 相等 因中和热是在稀溶液中,1 mol H +和1 mol OH -发生中和反应生成1 mol H 2O 时所放出的热量,与酸碱的用量无关 (4)偏小 偏小解析 要掌握实验操作要点:①量热计保温效果要好;②酸碱溶液的浓度要小;③酸碱一方要过量;④操作迅速准确,减少热量损失;⑤及时准确记录数据。
中和热是在稀溶液中,1 mol H +和1 mol OH -发生中和反应生成1 mol H 2O 时所放出的热量,强酸与强碱反应的实质是H ++OH -===H 2O ,计算出来的中和热是相同的。
练基础落实1.已知热化学方程式:2H 2(g)+O 2(g)===2H 2O(l) ΔH 1=-571.6 kJ·mol -1,则关于热化学方程式:2H 2O(l)===2H 2(g)+O 2(g) ΔH 2=?的说法中正确的是( )A .热化学方程式中化学计量数表示分子数B .该反应ΔH 2大于零C .该反应的ΔH 2=-571.6 kJ·mol -1D .该反应可表示36 g 水分解时的热效应答案 B解析 ΔH 2与ΔH 1符号相反,数值相等,故ΔH 2=+571.6 kJ·mol -1;D 选项没有指明36g 水的状态,故D 项错误。
2.已知:H 2(g)+F 2(g)===2HF(g) ΔH =-270 kJ·mol -1,下列说法正确的是( )A .2 L 氟化氢气体分解成1 L 氢气与1 L 氟气吸收270 kJ 热量B .1 mol 氢气与1 mol 氟气反应生成2 mol 液态氟化氢放出的热量小于270 kJC .在相同条件下,1 mol 氢气与1 mol 氟气的能量总和大于2 mol 氟化氢气体的能量D .1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ 热量答案 C解析 A 项中用L 做单位是错误的,因为热化学方程式的化学计量数表示物质的量;B 项中放出热量小于270 kJ 是错误的,应大于270 kJ ;D 项中说几个分子间反应是错误的;C 项正确。
3.已知充分燃烧a g 乙炔气体时生成1 mol 二氧化碳气体和液态水,并放出热量b kJ ,则乙炔燃烧的热化学方程式正确的是( )A .2C 2H 2(g)+5O 2(g)===4CO 2(g)+2H 2O(l) ΔH =-4b kJ·mol -1B .C 2H 2(g)+52O 2(g)===2CO 2(g)+H 2O(l) ΔH =+2b kJ·mol -1 C .2C 2H 2(g)+5O 2(g)===4CO 2(g)+2H 2O(l) ΔH =-2b kJ·mol -1D .2C 2H 2(g)+5O 2(g)===4CO 2(g)+2H 2O(l) ΔH =+b kJ·mol -1答案 A解析 乙炔燃烧是放热反应,ΔH <0,则排除B 、D 两选项;又因反应生成1 mol 二氧化碳气体时,放出热量为b kJ ,则生成4 mol CO 2(g)应放出热量4b kJ ,故A 正确,C 不正确。
4.已知强酸与强碱在稀溶液里反应的中和热可表示为H +(aq)+OH -(aq)===H 2O(l) ΔH =-57.3 kJ·mol -1对下列反应:CH 3COOH(aq)+NaOH(aq)===CH 3COONa(aq)+H 2O(l) ΔH =-Q 1 kJ·mol -112H 2SO 4(浓)+NaOH(aq)===12Na 2SO 4(aq)+H 2O(l) ΔH =-Q 2 kJ·mol -1 HNO 3(aq)+NaOH(aq)===NaNO 3(aq)+H 2O(l)ΔH =-Q 3 kJ·mol -1上述反应均在溶液中进行,则下列Q 1、Q 2、Q 3的关系正确的是( )A .Q 2>Q 3>Q 1B .Q 2>Q 1>Q 3C .Q 1=Q 2=Q 3D .Q 2=Q 3>Q 1 答案 A解析 由题意知,HNO 3和NaOH 反应放出的热量为中和热,醋酸中存在电离平衡,其电离过程要吸收热量,故Q 1<Q 3,而浓H 2SO 4稀释放热,Q 2>Q 3,故Q 1<Q 3<Q 2。
5.已知:(1)H 2(g)+12O 2(g)===H 2O(g) ΔH 1=a kJ·mol -1 (2)2H 2(g)+O 2(g)===2H 2O(g) ΔH 2=b kJ·mol -1(3)H 2(g)+12O 2(g)===H 2O(l) ΔH 3=c kJ·mol -1 (4)2H 2(g)+O 2(g)===2H 2O(l) ΔH 4=d kJ·mol -1下列关系式中正确的是( )A .a <c <0B .b >d >0C .2a =b <0D .2c =d >0 答案 C解析 抓比较的关键。