物质熔沸点的比较doc资料
- 格式:doc
- 大小:48.00 KB
- 文档页数:5

高中化学物质熔沸点比较规律【最新版】目录1.物质熔沸点与物质类型之间的关系2.高中化学中有机物熔沸点的变化规律3.无机物熔沸点的比较规律4.熔沸点与分子结构、极性的关系5.实际应用中的熔沸点比较正文在高中化学中,物质的熔沸点是一个非常重要的概念,它能帮助我们了解物质的物理性质,更好地进行实验和应用。
在不同的化学物质中,熔沸点有着不同的表现和规律。
首先,我们来看一下物质熔沸点与物质类型之间的关系。
一般来说,原子晶体的熔沸点最高,离子晶体次之,分子晶体最低。
这是因为原子晶体的结构最为紧密,离子晶体次之,分子晶体则较为松散。
因此,原子晶体的熔沸点通常最高。
接下来,我们重点讨论一下高中化学中有机物熔沸点的变化规律。
有机物的熔沸点受到多个因素的影响,包括分子量、分子结构和分子极性等。
首先,分子量越大,熔沸点越高。
这是因为分子量越大,分子间的范德瓦尔斯力就越强,需要更高的能量才能使分子脱离彼此。
其次,直链的分子比支链的分子熔沸点高,这是因为直链分子的分子间作用力更强。
最后,极性越大,熔沸点越高。
这是因为极性分子间存在相互吸引的极性力,使得分子间作用力增强。
在无机物中,熔沸点的比较规律也具有一定的特点。
例如,金属晶体的熔沸点取决于金属键的强弱,金属离子半径越小、离子所带电荷越多,其金属键越强,金属熔沸点就越高。
此外,熔沸点还与分子结构、极性有关。
对于组成和结构相似的物质,相对分子质量越大,分子间作用力越强,物质的熔沸点越高。
对于组成和结构不相似的物质(相对分子质量相近),分子极性越大,其熔沸点就越高。
在实际应用中,熔沸点的比较能够帮助我们更好地选择和使用化学物质。
例如,在实验室中,我们需要根据实验要求选择合适的试剂,这就需要我们了解不同试剂的熔沸点,以便在实验过程中更好地控制温度和压力。
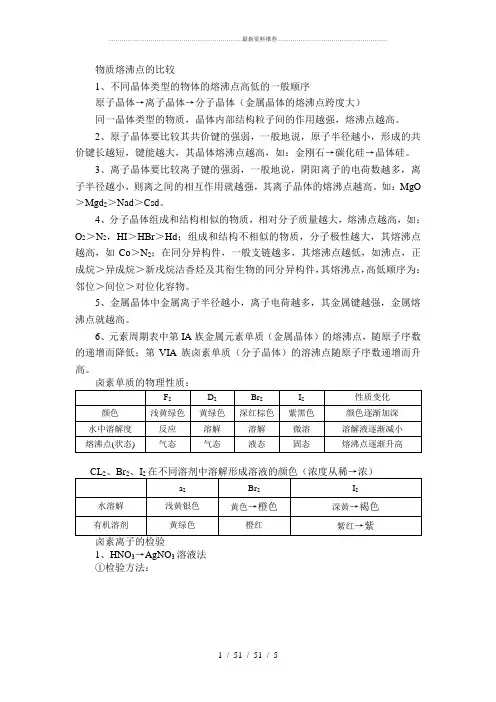
物质熔沸点的比较1、不同晶体类型的物体的熔沸点高低的一般顺序原子晶体→离子晶体→分子晶体(金属晶体的熔沸点跨度大)同一晶体类型的物质,晶体内部结构粒子间的作用越强,熔沸点越高。
2、原子晶体要比较其共价键的强弱,一般地说,原子半径越小,形成的共价键长越短,键能越大,其晶体熔沸点越高,如:金刚石→碳化硅→晶体硅。
3、离子晶体要比较离子键的强弱,一般地说,阴阳离子的电荷数越多,离子半径越小,则离之间的相互作用就越强,其离子晶体的熔沸点越高。
如:MgO >Mgd2>Nad>Csd。
4、分子晶体组成和结构相似的物质,相对分子质量越大,熔沸点越高,如:O2>N2,HI>HBr>Hd;组成和结构不相似的物质,分子极性越大,其熔沸点越高,如Co>N2;在同分异构件,一般支链越多,其熔沸点越低,如沸点,正成烷>异成烷>新戌烷洁香烃及其衔生物的同分异构件,其熔沸点,高低顺序为:邻位>间位>对位化容物。
5、金属晶体中金属离子半径越小,离子电荷越多,其金属键越强,金属熔沸点就越高。
6、元素周期表中第IA族金属元素单质(金属晶体)的熔沸点,随原子序数的递增而降低;第VIA族卤素单质(分子晶体)的溶沸点随原子序数递增而升高。
1、HNO3→AgNO3溶液法①检验方法:表明存在cl表明存在Br表明存在I②反应原理反应①:Ag+d-=Agd↓反应②:Ag+Br-=AgBr↓反应③:Ag+I-=AgI↓2、氯水—CdH法①检验方法加适量新朱子饱和氯水加Cll H 未知液混合液分层振荡振荡橙红色表明有Br-有机层紫红色表明有I-②原理:D2+2Br-=Br2+2a-d2+2I-=I2+2d-,因Br2、I2在ccl4中的溶解度大于在水中的溶解度。
3、检验食盐是否加碘(1:Io3)的方法①检验方法变蓝:加碘盐食盐未变蓝:无碘盐②反应原理:IO3-+SI-+6H+=3I2+3H2O(淀粉遇I2变蓝色)常见的放热反应与吸热反应一、放热反应(1)燃烧都是放热反应;(2)中和反应都是放热反应;(3)化合反应都是放热反应;(4)置换风应多为放热反应;(5)生石灰与水的反应、铝热反应等。

比较物质熔沸点的方法一、晶体类型是关键。
1.1 原子晶体。
原子晶体中原子间以共价键结合,这种键很强。
就像盖房子时用的钢筋混凝土一样结实。
像金刚石,那可是原子晶体中的典型代表。
碳原子之间形成很强的共价键,要想破坏这些键让它熔化或者沸腾,得需要非常高的温度。
所以原子晶体一般熔沸点都很高,这是它的“硬骨头”特性。
可以说原子晶体在熔沸点方面就像班级里的学霸,高高在上,很难被超越。
1.2 离子晶体。
离子晶体是由离子键构成的。
阴阳离子之间相互吸引,就像磁铁的两极一样。
不过离子键没有共价键那么强。
比如说氯化钠,钠离子和氯离子之间靠离子键结合。
离子晶体的熔沸点相对原子晶体来说要低一些。
但是也别小瞧它,要让离子晶体熔化或者沸腾,也得费不少劲呢。
就像打破一对紧紧相拥的舞伴一样,得施加一定的能量。
1.3 分子晶体。
分子晶体靠分子间作用力结合,这分子间作用力就像小朋友之间拉着的小手,比较脆弱。
像冰,水分子之间就是靠分子间作用力结合的。
分子晶体的熔沸点就比较低了。
在熔沸点的世界里,分子晶体就像小绵羊,比较温顺,很容易被改变状态。
二、影响熔沸点的其他因素。
2.1 对于同类晶体。
如果是原子晶体,原子半径越小,共价键越强,熔沸点越高。
就好比是身材瘦小的运动员,可能更加灵活,更能在比赛中发挥实力。
像碳化硅和硅晶体,碳化硅中的碳原子半径比硅原子小,所以碳化硅的熔沸点比硅晶体高。
这就像是小而精的东西往往更加耐用一样。
2.2 离子晶体中离子电荷与半径。
离子晶体里,离子所带电荷越多,离子半径越小,离子键就越强,熔沸点也就越高。
比如说氧化镁和氯化钠,镁离子带两个电荷,钠离子带一个电荷,而且镁离子半径比钠离子小,氧离子半径比氯离子小,所以氧化镁的离子键比氯化钠强,氧化镁的熔沸点就比氯化钠高。
这就像两个强者合作比两个弱者合作更加牢固的道理一样。
2.3 分子晶体的相对分子质量和氢键。
分子晶体中,相对分子质量越大,分子间作用力越强,熔沸点越高。
不过这里面有个特殊情况,就是氢键。
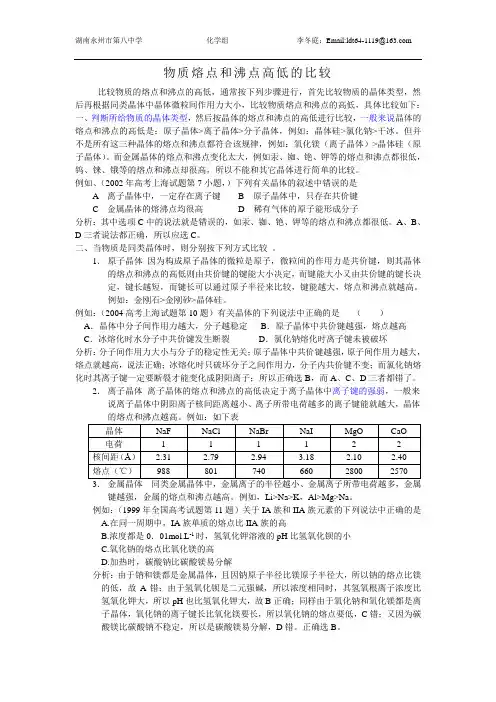
物质熔点和沸点高低的比较比较物质的熔点和沸点的高低,通常按下列步骤进行,首先比较物质的晶体类型,然后再根据同类晶体中晶体微粒间作用力大小,比较物质熔点和沸点的高低,具体比较如下:一、判断所给物质的晶体类型,然后按晶体的熔点和沸点的高低进行比较,一般来说晶体的熔点和沸点的高低是:原子晶体>离子晶体>分子晶体,例如:晶体硅>氯化钠>干冰。
但并不是所有这三种晶体的熔点和沸点都符合该规律,例如:氧化镁(离子晶体)>晶体硅(原子晶体)。
而金属晶体的熔点和沸点变化太大,例如汞、铷、铯、钾等的熔点和沸点都很低,钨、铼、锇等的熔点和沸点却很高,所以不能和其它晶体进行简单的比较。
例如、(2002年高考上海试题第7小题,)下列有关晶体的叙述中错误的是A离子晶体中,一定存在离子键 B 原子晶体中,只存在共价键C 金属晶体的熔沸点均很高D 稀有气体的原子能形成分子分析:其中选项C中的说法就是错误的,如汞、铷、铯、钾等的熔点和沸点都很低。
A、B、D三者说法都正确,所以应选C。
二、当物质是同类晶体时,则分别按下列方式比较。
1.原子晶体因为构成原子晶体的微粒是原子,微粒间的作用力是共价键,则其晶体的熔点和沸点的高低则由共价键的键能大小决定,而键能大小又由共价键的键长决定,键长越短,而键长可以通过原子半径来比较,键能越大,熔点和沸点就越高。
例如:金刚石>金刚砂>晶体硅。
例如:(2004高考上海试题第10题)有关晶体的下列说法中正确的是()A.晶体中分子间作用力越大,分子越稳定B.原子晶体中共价键越强,熔点越高C.冰熔化时水分子中共价键发生断裂D.氯化钠熔化时离子键未被破坏分析:分子间作用力大小与分子的稳定性无关;原子晶体中共价键越强,原子间作用力越大,熔点就越高,说法正确;冰熔化时只破坏分子之间作用力,分子内共价键不变;而氯化钠熔化时其离子键一定要断裂才能变化成阴阳离子;所以正确选B,而A、C、D三者都错了。

高中化学物质熔沸点比较规律
摘要:
1.物质熔沸点与物质类型之间的关系
2.高中化学中有机物熔沸点的变化规律
3.无机物熔沸点的比较规律
4.熔沸点与分子结构、相对分子质量的关系
正文:
在高中化学中,物质的熔沸点是一个非常重要的概念。
熔沸点是指物质从固态转变为液态或气态所需要的温度。
不同类型的物质其熔沸点有着显著的差异。
一般来说,原子晶体的熔沸点最高,离子晶体次之,分子晶体最低。
对于有机物,其熔沸点的变化规律可以从以下几个方面进行总结。
首先,相对分子质量越大,熔沸点越高。
这是因为分子质量的增加会导致分子间的范德瓦尔斯力增强,从而使熔沸点升高。
其次,直链的分子比支链的分子熔沸点高。
这是因为直链分子的分子间作用力更大,需要更高的温度才能使其熔化。
最后,极性越大,熔沸点越高。
极性分子由于分子间存在静电作用力,因此其熔沸点会相对较高。
对于无机物,熔沸点的比较规律则主要取决于晶体类型和结构。
例如,金属晶体的熔沸点取决于金属键的强弱,金属离子半径越小、离子所带电荷越多,其金属键越强,金属熔沸点就越高。
总的来说,在高中化学中,熔沸点与分子结构、相对分子质量有着密切的关系。
对于组成和结构相似的物质,相对分子质量越大,熔沸点越高;对于组成和结构不相似的物质,分子极性越大,熔沸点越高。

物质熔沸点高低的比较及应用河北省宣化县第一中学栾春武如何比较物质的熔、沸点的高低,首先分析物质所属的晶体类型,其次抓住同一类型晶体熔、沸点高低的决定因素,现总结如下供同学们参考:一、不同类型晶体熔沸点高低的比较一般来说,原子晶体>离子晶体>分子晶体;金属晶体(除少数外)>分子晶体。
例如:SiO2>NaCL>CO2(干冰)金属晶体的熔沸点有的很高,如钨、铂等;有的则很低,如汞、镓、铯等。
二、同类型晶体熔沸点高低的比较同一晶体类型的物质,需要比较晶体内部结构粒子间的作用力,作用力越大,熔沸点越高。
影响分子晶体熔沸点的是晶体分子中分子间的作用力,包括范德华力和氢键。
1.同属分子晶体①组成和结构相似的分子晶体,一般来说相对分子质量越大,分子间作用力越强,熔沸点越高。
例如:I2>Br2>Cl2>F2。
②组成和结构相似的分子晶体,如果分子之间存在氢键,则分子之间作用力增大,熔沸点出现反常。
有氢键的熔沸点较高。
例如,熔点:HI>HBr>HF>HCl;沸点:HF>HI>HBr>HCl。
③相对分子质量相同的同分异构体,一般是支链越多,熔沸点越低。
例如:正戊烷>异戊烷>新戊烷;互为同分异构体的芳香烃及其衍生物,其熔沸点高低的顺序是邻>间>对位化合物。
④组成和结构不相似的分子晶体,分子的极性越大,熔沸点越高。
例如:CO>N2。
⑤还可以根据物质在相同的条件下状态的不同,熔沸点:固体>液体>气体。
例如:S >Hg>O2。
2.同属原子晶体原子晶体熔沸点的高低与共价键的强弱有关。
一般来说,半径越小形成共价键的键长越短,键能就越大,晶体的熔沸点也就越高。
例如:金刚石(C-C)>二氧化硅(Si-O)>碳化硅(Si-C)晶体硅(Si-Si)。
3.同属离子晶体离子的半径越小,所带的电荷越多,则离子键越强,熔沸点越高。
例如:MgO>MgCl2,NaCl>CsCl。
4.同属金属晶体金属阳离子所带的电荷越多,离子半径越小,则金属键越强,高沸点越高。

物质沸点高低是由构成物质质点间作用力大小决定的。
物质质点间作用力包括分子间作用力和各种化学键。
以下从两大方面谈几点比较物质沸点高低的方法。
一. 从分子间作用力大小比较物质沸点高低1. 据碳原子数判断对于有机同系物来说,因结构相似,碳原子数越多,分子越大,范德瓦尔斯力就越大,沸点也就越高。
如:;2. 根据支链数目判断在有机同分异构体中,支链越多,分子就越近于球形,分子间接触面积就越小,沸点就越低。
如:正戊烷>异戊烷>新戊烷。
3. 根据取代基的位置判断例如,二甲苯有三种同分异构体:邻二甲苯、间二甲苯、对二甲苯。
我们可以这样理解,把这些分子看作一个球体,这三种分子的体积依次增大,分子间的距离也增大,因而分子间作用力减小,熔沸点就降低。
因此它们的沸点依次降低。
4. 根据相对分子质量判断对于一些结构相似的物质,因此相对分子质量大小与分子大小成正比,故相对分子质量越大,分子间作用力就越大,沸点就越高。
如:。
5. 据分子极性判断对于分子大小与相对分子质量大小都相近的共价化合物来说,分子极性越大,分子间作用力就越大,沸点就越高。
如:CO>N2。
6. 根据氢键判断因为氢键>范德瓦尔斯力,所以由氢键构成的物质沸点高于由范德瓦尔斯力构成的物质。
如:乙醇>氯乙烷;HF>HI>HBr>HCl。
一般情况下,HF、H2O、NH3等分子间存在氢键。
二. 从化学键的强弱比较物质沸点高低对于原子晶体、离子晶体和分子晶体来说,构成这些晶体的化学键强弱,不仅能帮助判断物质熔点、硬度大小,还能用来判断物质沸点高低。
1. 根据晶体类型判断一般来说,不同类型晶体的熔沸点的高低顺序为:原子晶体>离子晶体>分子晶体,而金属晶体的溶沸点有高有低。
这是由于不同类型晶体的微粒间作用不同,其熔沸点也不相同。
原子晶体间靠共价键结合,一般熔沸点最高;离子晶体阴、阳离子间靠离子键结合,一般熔沸点较高;分子晶体分子间靠范德瓦尔斯力结合,一般熔沸点较低;金属晶体中金属键的键能有大有小,因而金属晶体熔沸点有高有低。

高中化学熔沸点的比较根据物质在相同条件下的状态不同1.一般熔、沸点:固>液>气,如:碘单质>汞>CO22. 由周期表看主族单质的熔、沸点同一主族单质的熔点基本上是越向下金属熔点渐低;而非金属单质熔点、沸点渐高。
但碳族元素特殊,即C,Si,Ge,Sn越向下,熔点越低,与金属族相似;还有ⅢA族的镓熔点比铟、铊低;ⅣA族的锡熔点比铅低。
3. 从晶体类型看熔、沸点规律晶体纯物质有固定熔点;不纯物质凝固点与成分有关(凝固点不固定)。
非晶体物质,如玻璃、水泥、石蜡、塑料等,受热变软,渐变流动性(软化过程)直至液体,没有熔点。
①原子晶体的熔、沸点高于离子晶体,又高于分子晶体。
在原子晶体中成键元素之间共价键越短的键能越大,则熔点越高。
判断时可由原子半径推导出键长、键能再比较。
如键长:金刚石(C—C)>碳化硅(Si—C)>晶体硅(Si—Si)。
熔点:金刚石>碳化硅>晶体硅②在离子晶体中,化学式与结构相似时,阴阳离子半径之和越小,离子键越强,熔沸点越高。
反之越低。
如KF>KCl>KBr>KI,ca*>KCl。
③分子晶体的熔沸点由分子间作用力而定,分子晶体分子间作用力越大物质的熔沸点越高,反之越低。
(具有氢键的分子晶体,熔沸点反常地高,如:H2O>H2Te>H2Se>H2S)。
对于分子晶体而言又与极性大小有关,其判断思路大体是:ⅰ组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,物质的熔沸点越高。
如:CH4<SiH4<GeH4<SnH4。
ⅱ组成和结构不相似的物质(相对分子质量相近),分子极性越大,其熔沸点就越高。
如: CO>N2,CH3OH>CH3—CH3。
ⅲ在高级脂肪酸形成的油脂中,不饱和程度越大,熔沸点越低。
如: C17H35COOH(硬脂酸)>C17H33COOH(油酸);ⅳ烃、卤代烃、醇、醛、羧酸等有机物一般随着分子里碳原子数增加,熔沸点升高,如C2H6>CH4,C2H5Cl>CH3Cl,CH3COOH>HCOOH。

熔点和沸点熔点和沸点是物理化学中重要的概念,它们涉及到物质的量子性质和物质之间相互作用的规律。
熔点和沸点的区别是物质以什么形式从固体到液体,以及液体到气体的转变。
相反,沸点是液体转变为气体的过程,熔点是固体转变为液体的过程。
熔点是指物质从固体状态变为液体状态的温度,也称为凝固点,因为它描述的是物质从固体到液体的转变过程。
它的发现是由欧洲著名物理学家费希特发明的。
大多数固体物质的熔点都比它们的沸点低,而液体中的分子结构越松散,它们的熔点也越低。
有些物质,如石蜡,其熔点比沸点高,所以它们不能直接从固体到气体,而要经历固体到液体再到气体的过程,这称为三态转变。
沸点是液体变成气体的温度,又被称为汽化点,它描述的是物质从液体变为气体的过程。
沸点的量化可以用沸点的温度描述,它的变化受到压力的影响。
沸点是由欧洲著名物理学家西洛贝尔发现的。
一般来说,比相同温度的熔点高,但也有例外。
当温度升高时,沸点也会随之升高,但当温度超过一定程度时,沸点就不再变化。
熔点和沸点的本质是熔解和汽化的过程。
熔解是将冷却的固体变为液体的过程,它涉及到物质组成部分的量子性质,是物质微观世界和宏观世界的桥梁。
当温度超过熔点时,分子的运动能或振动能超过了由分子间键合力产生的结合能,分子之间的弱键断裂,固体物质就熔融了。
汽化是液体转变为气体的过程,它涉及到分子之间作用力的断裂和释放压力的减少,从而使液体变为气体。
这两个概念不仅对化学家和物理学家有重要的意义,而且在日常生活中也有一定的作用和应用。
比如,在制造工业中,熔点是金属熔接的基本指标。
熔点越高,金属的可熔接性越好,工艺性也越好。
而在医药行业中,液体的沸点也被用于测定其质量。
例如,醋酸乙烯的沸点,也称为馏程,对于其质量的检测也起着重要作用。
因此,熔点和沸点都是物理化学中重要的概念,它们反映了物质量子特性和物质之间相互作用的规律,在日常生活中也有一定的应用,因此深入研究它们的特性和应用是非常有必要的。

熔沸点的比较————————————————————————————————作者:————————————————————————————————日期:物质熔沸点高低的比较及应用河北省宣化县第一中学栾春武如何比较物质的熔、沸点的高低,首先分析物质所属的晶体类型,其次抓住同一类型晶体熔、沸点高低的决定因素,现总结如下供同学们参考:一、不同类型晶体熔沸点高低的比较一般来说,原子晶体>离子晶体>分子晶体;金属晶体(除少数外)>分子晶体。
例如:SiO2>NaCL>CO2(干冰)金属晶体的熔沸点有的很高,如钨、铂等;有的则很低,如汞、镓、铯等。
二、同类型晶体熔沸点高低的比较同一晶体类型的物质,需要比较晶体内部结构粒子间的作用力,作用力越大,熔沸点越高。
影响分子晶体熔沸点的是晶体分子中分子间的作用力,包括范德华力和氢键。
1.同属分子晶体①组成和结构相似的分子晶体,一般来说相对分子质量越大,分子间作用力越强,熔沸点越高。
例如:I2>Br2>Cl2>F2。
②组成和结构相似的分子晶体,如果分子之间存在氢键,则分子之间作用力增大,熔沸点出现反常。
有氢键的熔沸点较高。
例如,熔点:HI>HBr>HF>HCl;沸点:HF>HI>HBr>HCl。
③相对分子质量相同的同分异构体,一般是支链越多,熔沸点越低。
例如:正戊烷>异戊烷>新戊烷;互为同分异构体的芳香烃及其衍生物,其熔沸点高低的顺序是邻>间>对位化合物。
④组成和结构不相似的分子晶体,分子的极性越大,熔沸点越高。
例如:CO>N2。
⑤还可以根据物质在相同的条件下状态的不同,熔沸点:固体>液体>气体。
例如:S>Hg>O2。
2.同属原子晶体原子晶体熔沸点的高低与共价键的强弱有关。
一般来说,半径越小形成共价键的键长越短,键能就越大,晶体的熔沸点也就越高。
例如:金刚石(C-C)>二氧化硅(Si-O)>碳化硅(Si-C)晶体硅(Si-Si)。

熔点与沸点
1.熔点是指物质从固态转变为液态时所需要的温度。
2.沸点则是指物质从液态转变为气态时所需要的温度。
3.用途:这两个物理性质是物质的重要特征,可以用来确定物质的纯度和识别物质的种类。
通常情况下,随着环境温度的升高,物质的熔点和沸点也会相应升高。
4.不同点:不同物质的熔点和沸点是不同的,这是由于它们的分子结构、化学键的类型和强度等因素的不同所引起的。
对于同一种纯物质而言,其熔点和沸点是固定的,并且在常温常压下也是稳定的。
因此,利用物质的熔点和沸点可以对物质进行鉴别和分离,这在化学和材料科学等领域中具有重要的应用价值。
高中化学物质熔沸点比较规律摘要:一、引言二、熔沸点的定义及影响因素三、金属晶体熔沸点规律四、分子晶体熔沸点规律五、有机物熔沸点规律六、总结正文:一、引言熔沸点是物质由固态或液态转变为气态的温度,是化学中一个重要的物理性质。
对于不同类型的物质,熔沸点的高低有不同的比较规律。
本文将针对高中化学中常见的物质类型,探讨其熔沸点比较规律。
二、熔沸点的定义及影响因素熔沸点是指物质在一定的压力下,由固态或液态转变为气态的温度。
它的大小取决于物质分子间的作用力,如范德华力、氢键等。
此外,物质的熔沸点还受到分子结构、分子量、溶剂和压力等因素的影响。
三、金属晶体熔沸点规律金属晶体的熔沸点主要取决于金属键的强弱。
一般来说,金属离子半径越小,离子所带电荷越多,其金属键越强,金属熔沸点就越高。
例如,钠(Na)和钾(K)的离子半径相近,但钠的金属键更强,所以钠的熔沸点高于钾。
四、分子晶体熔沸点规律分子晶体的熔沸点主要取决于分子间作用力,包括范德华力和氢键。
在分子晶体中,相对分子质量越大,分子间作用力越强,物质的熔沸点越高。
对于组成和结构相似的分子晶体,分子极性越大,其熔沸点就越高。
例如,在有机同系物中,碳原子数越多,分子越大,范德华力就越大,沸点也就越高。
五、有机物熔沸点规律有机物的熔沸点受多种因素影响,包括分子结构、分子量、分子间作用力以及溶剂等。
在有机同分异构体中,支链越多,分子就越近于球形,分子间接触面积就越小,沸点就越低。
此外,有机物中的氢键也会影响其熔沸点。
六、总结本文主要探讨了高中化学中物质熔沸点的比较规律,包括金属晶体、分子晶体和有机物的熔沸点规律。
物质熔沸点高低的比较方法之蔡仲巾千创作陕西吴亚南主编物质熔沸点的大小比较通常出现在高考试题中,而关于物质熔沸点的大小比较方法介绍的却又较少,且不集中。
现将有关规律一并总结如下。
一、先将物质分类:从物质的晶体类型上一般分为分子晶体,离子晶体,原子晶体和金属晶体。
分歧物质类别熔沸点的比较方法分歧。
一般情况下:原子晶体﹥离子晶体﹥分子晶体1、对于分子晶体:a、结构相似时,相对分子质量越大分子间作用力越强其熔沸点越高。
如:CH4﹤SiH4﹤GeH4; CH4﹤C2H6﹤C3H8﹤C4H10b、能形成分子间氢键时熔沸点陡然增高。
如:H2O﹥H2Te﹥H2Se﹥H2S(能形成氢键的元素有N,O,F)c、当形成分子内氢键时熔沸点降低。
如:邻羟基甲苯的熔沸点低于对羟基甲苯d、对于烃类物质碳原子数相同时支链越多熔沸点越低。
e、都能形成氢键时要比氢键的数目和强弱。
如:H2O﹥NH3﹥HFf、组成和结构不相同但相对分子质量相同或相近时极性越大熔沸点越高。
如:CO﹥N2;CH3OH﹥C2H6g、芳香烃中临﹥间﹥对2、对于离子晶体:a、要看离子半径的大小和离子所带电荷的多少,离子半径越小,离子所带电荷越多则离子键越强晶格能越大熔沸点越高。
如:NaCl﹤ MgCl2<MgO3、原子晶体:要看原子半径的大小,原子半径越小作用力越大,熔沸点越高。
如:金刚石﹥二氧化硅﹥碳化硅﹥单晶硅4、金属晶体:比金属离子的半径和离子所带电荷的多少。
如Na﹤Mg﹤Al二、也可从物质在常温常压下的状态去分析。
常温常压下固体﹥液体﹥气体(熔沸点)如:碘单质﹥水﹥硫化氢三、易液化的气体沸点较高。
四、注意:1、熔点高纷歧定沸点也高。
如I2和Hg2、MgO和Al2O3由于晶格类型分歧,氧化镁的熔沸点高于氧化铝。
3、同主族元素形成的单质熔沸点的变更不克不及一言概论。
(一般是金属部分从上至下熔沸点降低,非金属部分从上至下升高,但都有特例)。
物质熔沸点的比较
物质的熔沸点是指物质从固体相变为液体相的过程中,温度恒定时,物质从固态及液态之间穿越温度究竟是多少。
熔沸点有助于区分不同物质:它们之间的化学性质不同,其熔沸点也会存在所不同。
以常用物质的熔沸点来比较,青铜的熔沸点为1083℃,汞的熔沸点为234.3℃,海水的熔沸点则为100.0℃,乙醇的熔沸点为78.3℃。
青铜的熔沸点比汞高,汞的熔沸点比海水高,海水的熔沸点比乙醇高。
青铜具有良好的耐腐蚀性,它可以用于制造热压机,熔炼机械以及发动机零件,它所具有的良好导电性和耐热性加上高熔沸点可以使其使用于电子元件。
汞的熔沸点很低,它可以用作低温冷却剂,也可以用作制冷机的工作液。
而海水的熔沸点是100.0℃,所以它可以作为温度调节器,高温的蒸汽可以用它冷却,以调节温度。
乙醇具有较低的熔点,它可以作为润滑剂和化学试剂,这在日常生活中可以看到它的应用。
总之,不同物质的熔沸点是它们之间的区别,并有其特定的用途。
不用熔沸点,我们就无法分辨物质的类别及它们的用途。
一般来说,熔沸点原子晶体>离子晶体>分子晶体(金属晶体较复杂)
原子晶体熔沸点:
结构相似时,原子半径之和越大,共价键键长越长,键能越小,熔沸点越低,硬度越小。
离子晶体熔沸点:
阴阳离子电荷数越多,离子半径越小,离子键越强,熔沸点越高。
分子晶体熔沸点:
组成和结构相似时,相对分子质量越大,熔沸点越高(含有氢键时,熔沸点反常高);
组成和结构不相似时,分子极性越大,熔沸点越高;
为同分异构体时,支链越多,熔沸点越低。
金属晶体熔沸点:
金属原子最外层电子数越大,金属键越强,熔沸点越高;
最外层电子数相同时,金属原子半径越小,金属键越强,熔沸点越高。
物质熔沸点高低的比较及应用一、不同类型晶体熔沸点高低的比较一般来说,原子晶体>离子晶体>分子晶体;金属晶体除少数外>分子晶体;例如:SiO2>NaCL>CO2干冰金属晶体的熔沸点有的很高,如钨、铂等;有的则很低,如汞、镓、铯等;二、同类型晶体熔沸点高低的比较同一晶体类型的物质,需要比较晶体内部结构粒子间的作用力,作用力越大,熔沸点越高;影响分子晶体熔沸点的是晶体分子中分子间的作用力,包括范德华力和氢键;1.同属分子晶体①组成和结构相似的分子晶体,一般来说相对分子质量越大,分子间作用力越强,熔沸点越高;例如:I2>Br2>Cl2>F2;②组成和结构相似的分子晶体,如果分子之间存在氢键,则分子之间作用力增大,熔沸点出现反常;有氢键的熔沸点较高;例如,熔点:HI>HBr>HF>HCl;沸点:HF >HI>HBr>HCl;③相对分子质量相同的同分异构体,一般是支链越多,熔沸点越低;例如:正戊烷>异戊烷>新戊烷;互为同分异构体的芳香烃及其衍生物,其熔沸点高低的顺序是邻>间>对位化合物;④组成和结构不相似的分子晶体,分子的极性越大,熔沸点越高;例如:CO>N2;⑤还可以根据物质在相同的条件下状态的不同,熔沸点:固体>液体>气体;例如:S>Hg>O2;2.同属原子晶体原子晶体熔沸点的高低与共价键的强弱有关;一般来说,半径越小形成共价键的键长越短,键能就越大,晶体的熔沸点也就越高;例如:金刚石C-C>二氧化硅Si-O >碳化硅Si-C晶体硅Si-Si;3.同属离子晶体离子的半径越小,所带的电荷越多,则离子键越强,熔沸点越高;例如:MgO>MgCl2,NaCl>CsCl;4.同属金属晶体金属阳离子所带的电荷越多,离子半径越小,则金属键越强,高沸点越高;例如:Al>Mg>Na;三、例题分析例题1.下列各组物质熔点高低的比较,正确的是:A. 晶体硅>金刚石>碳化硅B. CsCl>KCl>NaClC. SiO2>CO2>HeD. I2>Br2>He解析:A中三种物质都是原子晶体半径C<Si,则熔点:金刚石>碳化硅>晶体硅,B 中应为:NaCl>KCl>CsCl,因为离子的半径越小,离子键越强,熔沸点就越高;因此C、D正确;答案:C、D例题2.下列物质性质的变化规律,与共价键的键能大小有关的是:、Cl2、Br2、I2的熔点、沸点逐渐升高、HCl、HBr、HI的热稳定性依次减弱C.金刚石的硬度、熔点、沸点都高于晶体硅、NaCl、NaBr、NaI的熔点依次降低解析:F2、Cl2、Br2、I2形成的晶体属于分子晶体;它们的熔沸点高低决定于分子间的作·力,与共价键的键能无关,A错;HF、HCl、HBr、HI的分子内存在共价键,它们的热稳定性与它们内部存在的共价键的强弱有关,B正确;金刚石和晶体硅都是原子间通过共价键结合而成的原子晶体,其熔沸点的高低决定于共价键的键能,C正确;NaF、NaCl、NaBr、NaI都是由离子键形成的离子晶体,其内部没有共价键,D错;答案:B、C例题3.下图中每条折线表示周期表ⅥA~ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是:A. H2SB. HClC. PH3D. SiH4解析:NH3、H2O、HF分子间存在氢键,它们的沸点较高,即沸点高低关系为:NH3>PH3、H2O>H2S、HF>HCl,对应图中上三条折线;所以a点所在折线对应第IVA 族元素的气态氢化物,且a点对应第三周期,所以a表示SiH4;答案:D例题4.下列各组物质中,按熔点由低到高顺序排列正确的是:A. O2 I2 HgB. CO KCl SiO2C. Na K RbD. SiC NaCl SO2解析:选项A中的O2是气体,I2是固体,Hg是液体,所以熔点由低到高的顺序是:O2 <Hg <I2 ;选项B中的CO固态时是分子晶体,KCl属于离子晶体, SiO2属于原子晶体,所以熔点由低到高的顺序是:CO<KCl<SiO2;选项C中的Na、K、Rb 都是金属晶体,原子半径不断增大,金属键不断减弱,所以熔点不断降低;选项D中的SiC属于原子晶体,NaCl属于离子晶体,SO2形成分子晶体,因此熔点不断降低; 答案: B例题5.09全国卷I 29已知周期表中,元素Q、R、W、Y与元素X相邻;Y的最高化合价氧化物的水化物是强酸;回答下列问题:1W与Q可以形成一种高温结构陶瓷材料;W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是_______________;2Q的具有相同化合价且可以相互转变的氧化物是_______________;3R和Y形成的二元化合物中,R呈现最高化合价的化合物是化学式是_________;4这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是填化学式____________,其原因是_______________;②电子总数相同的氢化物的化学式和立体结构分别是_______________;5W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物WQH24和HCl气体;WQH24在高温下分解生成Q的氢化物和该陶瓷材料;上述相关反应的化学方程式各物质用化学式表示是_______________; 解析:本题可结合问题作答;W的氯化物为正四体型,则应为SiCl4或CCl4,又W与Q形成高温陶瓷,故可推断W为Si;1SiO2为原子晶体;2高温陶瓷可联想到Si3N4,Q 为N,则有NO2与N2O4之间的相互转化关系;3Y的最高价氧化的的水化物为强酸,且与Si、N等相邻,则只能是S;Y为O,所以R为As元素;4显然X为P元素;①氢化物沸点顺序为NH3>AsH3>PH3,因为NH3分子间存在氢键,所以沸点最高;相对分子质量AsH3>PH3,分子间的作用力AsH3>PH3,故AsH3得沸点高于PH3;②SiH4、PH3和H2S的电子数均为18;结构分别为正四面体,三角锥和角形V形;5由题中所给出的含字母的化学式可以写出具体的物质,然后配平即可;答案:1原子晶体;2NO2和N2O43As2S5;4① NH3>AsH3>PH3,因为前者中含有氢键;② SiH4、PH3和H2S结构分别为正四面体,三角锥和角形V形;5SiCl4 + 4NH3 SiNH24 + 4HCl,3SiNH24 Si3N4 + 8NH3↑例题6.09山东卷32C和Si元素在化学中占有极其重要的地位;1写出Si的基态原子核外电子排布式;从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为; 2SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为,微粒间存在的作用力是;3氧化物MO的电子总数与SiC的相等,则M为填元素符号;MO是优良的耐高温材料,其晶体结构与NaCl晶体相似;MO的熔点比CaO的高,其原因是;4C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同;CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π健;从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π键;解析:1C、Si和O的电负性大小顺序为:O>C>Si;2晶体硅中一个硅原子周围与4个硅原子相连,呈正四面体结构,所以杂化方式是sp3 ;3SiC电子总数是20个,则氧化物为MgO;晶格能与所组成离子所带电荷成正比,与离子半径成反比,MgO与CaO的离子电荷数相同,Mg2+半径比Ca2+小,MgO晶格能大,熔点高;4Si的原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键;答案:11s22s22p63s23p2 O>C>Si 2 sp3 共价键 3Mg Mg2+半径比Ca2+小,MgO 晶格能大 4Si的原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键例题7.09福建卷30Q、R、X、Y、Z五种元素的原子序数依次递增;已知:①Z的原子序数为29,其余的均为短周期主族元素;②Y原子价电子外围电子排布msnmp n;③R原子核外L层电子数为奇数;④Q、X原子p轨道的电子数分别为2和4;请回答下列问题:1Z2+ 的核外电子排布式是 ;2在ZNH342+离子中,Z2+的空间轨道受NH3分子提供的形成配位键;3Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 ;a.稳定性:甲>乙,沸点:甲>乙b.稳定性:甲>乙,沸点:甲<乙c.稳定性:甲<乙,沸点:甲<乙d.稳定性:甲<乙,沸点:甲>乙4 Q、R、Y三种元素的第一电离能数值由小到大的顺序为用元素符号作答5Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为 ; 6五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于 ;答案:11s22s22p63s23p63d9 2孤对电子孤电子对3b 4Si < C <N 5 3:2 6原子晶体解析:由题给条件知Z的原子序数为29, 29号为Cu;Y价电子:ms nmpn中n只能取2,又为短周期,则Y可能为C或Si;R的核外L层为数,则可能为Li、B、N或F;Q、X的p轨道为2和4,则C或Si和O或S;因为五种元素原子序数依次递增;故可推出:Q为C,R为N,X为O,Y为Si;1Cu的价电子排布为3d104s1,失去两个电子,则为3d9;2Cu2+可以与NH3形成配合物,其中NH3中N提供孤对电子,Cu提供空轨道,而形成配位键;3Q、Y的氢化物分别为CH4和SiH4,由于C的非金属性强于Si,则稳定性CH4>SiH4;因为SiH4 的相对分子质量比CH4大,故分子间作用力大,沸点高;4C、N和Si中,C、Si位于同一主族,则上面的非金属性强,故第一电离能大,而N由于具有半充满状态,故第一电离能比相邻元素大,所以N>C>Si;5C、H形成的相对分子质量的物质为C2H2,结构式为H-C≡C-H,单键是σ键,叁键中有两个是σ键一个π键,所以σ键与π键数之比为3 : 2;6电负性最大的非元素是O,最小的非金属元素是Si,两者构成的SiO2,属于原子晶体;。
物质熔沸点高低比较方法
(1)不同类型的晶体:一般而言,原子晶体>离子晶体>分子晶体。
如:SiO2>NaCl>S
需要说明的是:不是所有的原子晶体都高于任意离子晶体,如:氧化铝高于SiO2,同样也不是所有的离子晶体都高于任意分子晶体。
(2)对于相同类型的晶体:
I、主要与半径有关的晶体
①离子晶体:组成相似的离子晶体,离子半径越小,电荷数越多,离子键就越强,晶体的熔沸点就越高;
②原子晶体:原子半径越小,键长就会越短,键能就越大,晶体的熔沸点就越高;
③金属晶体:原子半径越小,金属键键长越短,键能越大,晶体熔沸点越高;如Na<Mg<Al
II、主要与分子量有关的晶体:
分子晶体:分子间作用力越大,物质的熔沸点就越高。
a.组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,物质的溶沸点就越高。
如卤素单质I2>Br2>Cl2>F2;
b.能形成氢键的分子晶体,熔沸点会反常地高,如H2O>H2Te>H2Se>H2S。
物质熔沸点的比较
1、不同晶体类型的物体的熔沸点高低的一般顺序
原子晶体→离子晶体→分子晶体(金属晶体的熔沸点跨度大)
同一晶体类型的物质,晶体内部结构粒子间的作用越强,熔沸点越高。
2、原子晶体要比较其共价键的强弱,一般地说,原子半径越小,形成的共价键长越短,键能越大,其晶体熔沸点越高,如:金刚石→碳化硅→晶体硅。
3、离子晶体要比较离子键的强弱,一般地说,阴阳离子的电荷数越多,离子半径越小,则离之间的相互作用就越强,其离子晶体的熔沸点越高。
如:MgO >Mgd2>Nad>Csd。
4、分子晶体组成和结构相似的物质,相对分子质量越大,熔沸点越高,如:O2>N2,HI>HBr>Hd;组成和结构不相似的物质,分子极性越大,其熔沸点越高,如Co>N2;在同分异构件,一般支链越多,其熔沸点越低,如沸点,正成烷>异成烷>新戌烷洁香烃及其衔生物的同分异构件,其熔沸点,高低顺序为:邻位>间位>对位化容物。
5、金属晶体中金属离子半径越小,离子电荷越多,其金属键越强,金属熔沸点就越高。
6、元素周期表中第IA族金属元素单质(金属晶体)的熔沸点,随原子序数的递增而降低;第VIA族卤素单质(分子晶体)的溶沸点随原子序数递增而升高。
1、HNO3→AgNO3溶液法
①检验方法:
表明存在cl
表明存在Br
表明存在I
②反应原理
反应①:Ag+d-=Agd↓反应②:Ag+Br-=AgBr↓反应③:Ag+I-=AgI↓
2、氯水—CdH法
①检验方法
加适量新朱子饱和氯水加Cll H 未知液混合液分层
振荡振荡
橙红色表明有Br-
有机层
紫红色表明有I-
②原理:
D2+2Br-=Br2+2a-
d2+2I-=I2+2d-,因Br2、I2在ccl4中的溶解度大于在水中的溶解度。
3、检验食盐是否加碘(1:Io3)的方法
①检验方法
变蓝:加碘盐
食盐
未变蓝:无碘盐
②反应原理:IO3-+SI-+6H+=3I2+3H2O(淀粉遇I2变蓝色)
常见的放热反应与吸热反应
一、放热反应
(1)燃烧都是放热反应;(2)中和反应都是放热反应;(3)化合反应都是放热反应;(4)置换风应多为放热反应;(5)生石灰与水的反应、铝热反应等。
二、吸热反应
(1)盐类的水解反应都是吸热反应;(2)弱电*质的电荷一般是吸热反应;(3)大多数分解反应都是吸热反应;(4)需要持续加热的反应,如:NH4d与C a CoA2,制NA3,A2还原C a O,配制C2H4。
注意区别反应的热效应与反应的条件。
化学反应中的能量变化主要表现为放热和吸热,反应是放热还是吸热,主要取决于反应物,生成物所具有的总能量的相对大小,放热反应和吸热反应在一定条件下都能发生。
反应开始时需要持续加热的反应可能是吸热反应,也可能是放
热反应,反应的热量变化与反应发生是否需要加热,没有必然的联系。
盖斯定律
内容:化学反应的反应热只与反应体系的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关,如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成的反应热是相同的。
判断晶体类型的方法:
金属氧化物(如:2O,Na2O2等)强碱(如:NadH、LiOH等)和绝大多数的盐类是离子晶体,大多数非金属单质(除金刚石、石墨、晶体硅外)、气态氢化物、非金属氯化物(除Sio2外),酸、绝大多数有机物(除有机盐外)是分子晶体,常见的原子晶体单质有金刚石、晶体硅、晶体硼等,常见的原子晶体化合物有碳化硅、二氧化硅等金属单质(除汞外)与合金是金属晶体。
物质溶沸点高低的比较规律
(2)卤素类推规律中的若干“例外”
卤素是典型的非金属元素,其性质有一定的规律性,但由于结构的差异性,在某些方面有一些“例外”,如:
①AgX难溶于水,但AgF易溶于水;C a X2易溶于水,但C a F2(俗名萤石)不溶于水。
②AgX一般为浅黄色或黄色,但AgC1为白色(AgF黄色,AgBr浅黄色,
Ag1黄色);AgX有感光性;
2
,但AgF无感光性。
③X2跟水反应:X2+H2O HX+HXO,但F2例外:
2F2 +H2O=4HF+O2(水作还原剂)
④在卤素的化合物中,只有氟无正价,无含氧酸。
在氯的含氧酸中,高价的酸性强,低价的氧化性强,即:
酸性:HCIO4>HCIO3>HCIO2>HCIO;
氧化性:HCIO>HCIO2>HCIO3>HCIO4。
⑤HX随相对分子质量增大,分子间作用力增强,熔、沸点升高,但HF的熔、沸点反常(HF分子间易形成氢键)。
⑥在CI2、Br2、I2中,前都可把后者从它的非含氧酸盐溶液中置换出来,但F2例外,F2与CI2、Br2、I2的非含氧酸盐溶液作用时,会先与水发生剧烈反应。
⑦X2跟强碱反应:X2+2OH-X-+XO-+H2O,但F2例外;2F2+2OH-
2F-+OF2 +H2O。
⑧HX为强酸,且酸性:HI>HBr>HCI>HF,但HF是弱酸。
⑨X2及对应的氢卤酸不能与玻璃发生化学反应,但F2和氢氟酸例外,以腐蚀玻璃,因此制F2、HF时要在铅制器皿中进行,氢氟酸只能装在铅瓶或塑料瓶
中。
⑩X2可用对应的浓的氢卤酸与二氧化锰共热制取,但F2只能用电解法制取,
F2。
MnO2
MnX2+X2 +2H
2
O(X=CI、Br、I)
2KHF
22
+F2
制HCI:
NaCI(s)+H2SO4(浓)
NaHSO4+HCI
制HBr、HI不能用浓H2SO4,因HBr、HI皆易被浓硫酸氧化,故只能用非氧化性的浓磷酸与NaBr或NaI作用。
NaI+H3PO4(浓)NaH2PO4+HI
制:HF:CaF2+H2SO4(浓CaSO4+2HF (必须在铅制器皿中进行)
为什么制CO2时不能用稀H2SO4与CaCO3,制HF时却可用CaF2与浓H2SO4?两个反应均生成了微溶的CaSO4,为什么前者可阻止反应进行,后者却可以使反应进行呢?这是因为CaSO4溶于浓H2SO4生成Ca(HSO4)2,[CaSO4+ H2SO4(浓)Ca(HSO4)2]可使CaF2与浓H2SO4的反应继续进行。
CaSO4不与稀硫酸反应,生成的CaSO4会覆盖在CaCO3表面,使反应停止。
⑿CI2、Br2分别在对应的可溶性氯化物和溴化物溶液中的溶解度因同离子效应而变小(因此可用排饱和食盐水的方法来收集氯气)。
但碘例外,碘在碘化物中溶解度变大,这是因为有反应:I2+I- I3-(配制碘酒时加入KI以提高碘的溶解度)。
⒀卤素单质中,只有碘遇淀粉溶液变蓝。
但碘的四氯化碳溶液遇淀粉并不变蓝。
这是因为碘在四氯化碳中溶解度大,在水中溶解度小,四氯化碳中的碘不能被提取到淀粉溶液中,故不变蓝色。
⒁X2与变价金属铁反应生成FeX3,但I2例外:Fe+I2FeI2。
从反应:2 Fe3+ +21- 2 Fe2+2知,氧化性Fe3+>I2FeI3。
⒂NH4Cl 3 +HCI ,但NH4I例外:2 NH4 3 + H2 +I2 。
这是因为先生成的HI不稳定,继续分解所致。
例:比较各组热化学方程式中△H的大小关系。
A.S(s)+O2(g) SO2(g) △H1
S(g)+O2(g) SO2(g) △H2
△H1 △H2
B.CH4(g)+2O2(g) CO2(g)+2H2O(1) △H1
CH4(g)+2O2(g) CO2(g)+2H2O(g) △H2
△H1 △H2
C.4AI(s)+3O2(g) 2AI2O3(s) △H1
4Fe(s)+3O2(g) 2Fe2O3(s) △H2
△H1 △H2
D.煤作为燃料有2种途径:
途径1——直接燃烧:
C(s)+O2(g) CO2(g) △H1<0
途径2——先制水煤气:
C(s)+H2O (g) CO (g)+H2(g) △H2>0
再燃烧水煤气:
2CO(g)+O2(g) 2CO2(g) △H3<0
2H2(g)+O2(g) 2H2O (g) △H4<0
△H1、△H2、△H3、△H4的关系式是。
解析:A项中两式相减得:S(s) S(g);△H=△H1-△H2>0(固态硫变为硫蒸气是吸热过程),所以△H1>△H2(气态硫比固体硫燃烧放出的热量多);B项中两式相减得:2H2O(g) 2H2O(1);△H=△H1-△H2<0(水蒸气变为液态水是放热过程),所以△H1<△H2(生成液态水比生成水蒸气放出的热量多);C项中两式相减得:4AI(s)+2Fe2O3(s) 2AI2O3(s)+4Fe(s);△H=△H1-△H2<0(铝热反应很剧烈,是典型而熟悉的放热反应),所以△H1<△H2:D项中将途径2的后两个热化学方程式分别乘以1/2后与第一个热化学方程式相加得:C(s)+O2(g) CO2(g),△H2=1/2(△H3+△H4),即△H1=△H2+1/2(△H3+△H4),(两种途径的△H完全相同)。