《专题2质量守恒定律》
- 格式:pdf
- 大小:1.10 MB
- 文档页数:19




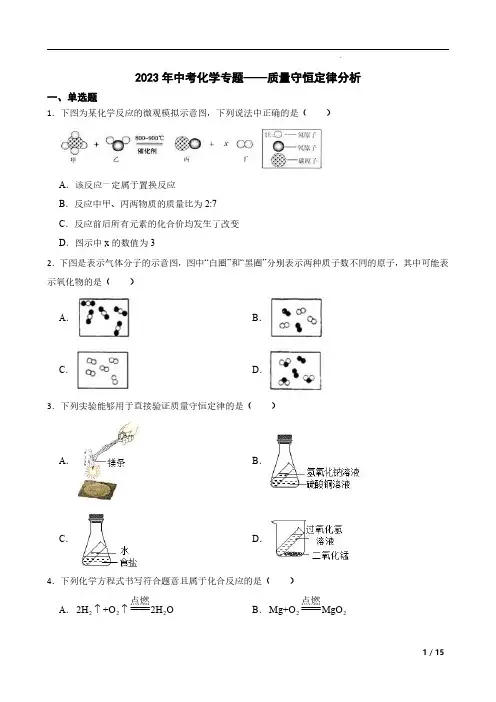
2023年中考化学专题——质量守恒定律分析一、单选题1.下图为某化学反应的微观模拟示意图,下列说法中正确的是()A .该反应一定属于置换反应B .反应中甲、丙两物质的质量比为2:7C .反应前后所有元素的化合价均发生了改变D .图示中x 的数值为32.下图是表示气体分子的示意图,图中“白圈”和“黑圈”分别表示两种质子数不同的原子,其中可能表示氧化物的是()A .B .C .D .3.下列实验能够用于直接验证质量守恒定律的是()A .B .C .D .4.下列化学方程式书写符合题意且属于化合反应的是()A .2222H +O 2H O ↑↑点燃B .22Mg+O MgO 点燃C .22S+O SO 点燃D .2234Fe+3O 2Fe O 点燃5.豆腐是人们喜爱的食物,营养丰富,能为人体提供所需的多种氨基酸,其中含量最多的是亮氨酸(C 6H 13NO 2),关于亮氨酸的说法正确的是()A .一个亮氨酸分子由22个原子构成B .亮氨酸中氢元素的质量分数最大C .亮氮酸是氧化物D .亮氨酸中碳、氢、氮、氧四种元素的质量比为6:13:1:26.将乙酸(CH 3COOH )和葡萄糖(C 6H 12O 6)溶于水得到混合溶液,测得溶液中氢元素的质量分数为10%,则溶液中碳元素的质量分数为()A .70%B .80%C .10%D .45%7.甲、乙、丙、丁4种物质在密闭容器中发生反应,一段时间后测得反应前后各物质的质量如下表所示。
下列说法正确的是()物质甲乙丙丁反应前质量/g 30368反应后质量/g16m424A .甲和丙两种物质中的元素种类与丁物质中元素种类相同B .乙一定是反应的催化剂C .参加反应的甲、丙的质量比是5:1D .甲、丙一定都是单质8.头孢类消炎药是日常生活中常用的一类抗菌药物,注射或口服头孢类药物后一段时间内不能饮酒,否则会出现心率加快、血压下降,严重者会出现心力衰竭导致死亡。
下列关于头孢氨苄(化学式:C 16H 17N 3O 4S )的说法错误的是()A .头孢氨苄属于有机化合物B .头孢氨苄完全燃烧时只生成二氧化碳和水C .头孢氨苄由C ,H ,N ,O ,S 五种元素组成D .头孢氨苄中氧元素和氢元素的质量比为64:179.下列图象能在确反映对应变化关系的是()A.表示向一定量硫酸铜溶液中加入一定量铁粉B.加热氯酸钾和二氧化锰混合物C.等质量且形状相同的铁和锌,分别加入到足量的同一种稀硫酸中D.足量红磷在装有空气的密闭容器中燃烧10.葡萄糖、乙酸(CH3COOH)和尿素[CO(NH2)2]组成的混合物240g,在一定条件下完全燃烧,生成水的质量是()A.48g B.72g C.144g D.无法计算二、填空题11.江西不仅山清水秀、景色迷人,特色美食更是遍布各地令各路“吃货”流连忘返.(1)南昌“藜蒿炒腊肉”风味独特,清香扑鼻.从分子角度解释“清香扑鼻”的原因是.(2)赣州“斋婆柚”汁多味美,齿颊生津.柚子皮还可以吸附室内异味,写出一种具有同样性质的化学物质名称.(3)吉安“安福火腿”营养丰富,历史悠久.“火腿”中能为人体提供能量的一种营养素是.(4)宜春“丰城冻米糖”松脆香甜,誉满江南.“冻米糖”中蔗糖的化学式为C12H22O11,其中氢元素和氧元素的质量比为.(5)九江“茶饼”酥香可口,茶食精点.“茶饼”中所含锌元素的部分信息如图.则下列说法中正确的是(填序号).A.锌的相对原子质量为65.8g B.锌原子结构示意图中X为8C.锌原子在反应中容易得到电子D.锌原子核内质子数为30.12.在天平两端各放等质量的两个锥形瓶(瓶口用单孔塞和导管连接起来,气球中装有等质量的大理石),如图所示.左盘锥形瓶中盛有M克水,右盘锥形瓶中盛有M克稀盐酸,天平平衡.(1)实验开始时,将气球中的大理石倒入锥形瓶中,观察到的现象是,天平的指针(填“偏左”“偏右”“在标尺中央”下同),原因是.(2)待上述实验的反应完成后,将锥形瓶瓶口上的单孔塞、导管和气球去掉,天平的指针;原因是.13.已知A、E、F是单质,B、C、D是化合物,它们分别是由碳、氢、氧三种元素中的一种或者几种组成。


质量守恒定律【学习目标】1.熟练掌握质量守恒定律的内容;记住化学反应前后“六不变、两变、两可能变”。
2.学会运用质量守恒定律解释和解决一些化学现象和问题。
3.通过具体化学反应分析,理解化学方程式的含义。
【要点梳理】要点一、质量守恒定律参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
这个规律就叫做质量守恒定律。
【要点诠释】1.质量守恒定律适用于一切化学反应。
运用这一定律时,特别要注意“参加化学反应”、“反应后生成”、“质量总和”等关键字词,不能遗漏任一反应物或生成物,尤其是气体。
2.在验证质量守恒定律时,对于有气体参加或有气体生成的反应,都必须在密闭容器中进行。
要点二、质量守恒定律的微观解释及运用(专题课堂《质量守恒定律》)1.质量守恒定律的微观解释:化学反应的实质就是参加反应的各物质中的原子重新组合生成新物质分子的过程,在化学反应前后,原子的种类没有改变、原子的数目没有增减、原子的质量也没有改变。
因此参加化学反应的各物质的质量总和与反应后生成的各物质的质量总和必然相等。
如下图所示:通电后水分子分解生成氢气分子和氧气分子,但是氢原子和氧原子的种类没变、数目没变、每个原子的质量也没变,因此物质的总质量也不变。
2.质量守恒定律的运用:(1)解释常见化学现象中的质量关系,如:铁生锈质量增加,木炭燃烧成灰质量减少等。
(2)利用质量守恒定律,根据化学方程式确定物质的化学式。
(3)利用质量守恒定律,根据化学方程式确定物质的相对分子质量。
(4)利用质量守恒定律,根据化学方程式求反应中某元素的质量。
(5)利用质量守恒定律,根据化学方程式求反应中某物质的质量。
【要点诠释】化学反应前后“六不变、两变、两可能变”:1.六个不变:宏观上①元素的种类不变,②元素的质量不变,③物质的总质量不变;微观上①原子的种类不变,②原子的数目不变,③原子的质量不变。
2.两个改变:宏观上物质的种类改变;微观上分子的种类改变。

2020年浙教版八年级下科学同步学习精讲精练第3章空气与生命第3章经典专题讲练2——质量守恒定律概念理解及专项计算目录 (1) (3) (4)一、质量守恒定律概念理解1.概念:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
【注】使用质量守恒定律时的注意事项①质量守恒定律,不适用于物理变化。
②概念中的“参加反应的各物质的质量”是指真正参加反应的那部分物质的质量.③概念中“各物质的质量总和”包括“各种状态的反应物及各种状态的生成物”。
④质量守恒定律不包括体积守恒。
2.微观解释化学反应的过程,实际上就是参加反应的各物质(反应物)的分子,分裂成原子,然后重新组合成新的分子而生成其他物质的过程,因此在反应的前后,原子的种类、个数、质量都没有改变,所以元素的种类和质量、物质的总质量在化学反应前后均保持不变。
3. 质量守恒定律中量的关系二、质量守恒定律的验证1.实验原理的选择:一切易操作、速率适中、便于称量、现象明显的化学实验都可用于进行验证质量守恒定律。
2.实验装置的选择:有气体参加(或生成)的实验在密闭装置中进行。
三、质量守恒定律的应用1. 解释反应前后物质的质量变化一些化学变化,反应前和反应后的物种总质量不相等,主要原因如下:增加——有空气中的氧气参加了反应反应后生成物质量减少——生成物中有气体放出没有变化——反应前后没有气体参加或者逸出2. 推断反应物或生成物的组成元素如,已知酒精在空气中燃烧生成二氧化碳和水,根据这一事实,推断出酒精中肯定含有什么元素?可能含有什么元素?则可根据质量守恒定律——化学反应前后元素种类不变,得到如下推断:酒精+O2 CO2+H2O,由生成物中的元素种类可知:酒精中一定含有的元素:C、H;可能含有的元素:O。
说明:若要确定是否含有氧元素,则需要定量才可计算(见本专题例题分析)。
3. 求反应物或生成物的质量如,在A+2B=C+D的反应中,5克A跟一定量的B恰好完全反应,生成3克C和10克D,则B的质量可直接根据质量守恒定律的定义——参加反应物质质量总和=反应生成物质质量总和,求得m(B)=3g+10g—5g=8g。

《质量守恒定律》教学设计12篇《质量守恒定律》教学设计1一、教学目标1、知识与技能(1)通过实验探究认识质量守恒定律,了解常见化学反应中的质量关系。
(2)从微观角度认识在一切化学反应中,反应前后原子的种类和原子没有增减。
2、过程与方法(1)通过简单的探究活动体会科学探究的基本过程。
(2)初步学会运用观察、试验等方法获取信息。
3、情感态度与价值观培养善于合作、勤于思考、严谨求实的科学精神。
二、教学重点对质量守恒定律含义的理解三、教学难点从微观角度认识质量守恒定律四、教学用具实验仪器、化学反应模板、教科书五、教学流程一、教学目标1、知识与技能(1)通过实验探究认识质量守恒定律,了解常见化学反应中的质量关系。
(2)从微观角度认识在一切化学反应中,反应前后原子的种类和原子没有增减。
2、过程与方法(1)通过简单的探究活动体会科学探究的基本过程。
(2)初步学会运用观察、试验等方法获取信息。
3、情感态度与价值观培养善于合作、勤于思考、严谨求实的科学精神。
二、教学重点对质量守恒定律含义的理解三、教学难点从微观角度认识质量守恒定律四、教学用具实验仪器、化学反应模板、教科书五、教学流程教师活动学生活动设计意图一、创设情境,导入新课【视频】《元芳的蜡烛》【提问】蜡烛燃烧、铁剑生锈都是化学变化,那究竟化学变化后物质的质量会如何变化呢?这节课我们就来探究这个问题。
学生认真观看视频、讨论并回答从视频入手,激发学生学习热情,为探究的问题做铺垫。
二、探究一红磷燃烧【提问】首先我们对红磷燃烧,铁定与硫酸铜溶液反应,这两个化学反应进行探究。
【展示】我们知道,进行探究都需要用到的仪器是天平。
【提问】我们先探究红磷燃烧,用的是这套装置。
可以看到,锥形瓶底部有细砂,套有玻璃管和气球。
这三者有什么作用【展示】细砂、玻璃管、气球的作用。
思考,回答问题(大部分学生能回答出细沙作用,但不知道玻璃管有何作用)引导学生思考问题。
【实验】1、先称取反应前的物质质量,为__g,记录在书本表格上(投影)。

质量守恒定律专题姓名_________________要点:1. 遵循质量守恒定律,即参加化学反应的各物质的质量总和,等于反应生成的各物质的质量总和。
其实在化学反应里体现了一变四不变。
四不变指:元素种类不变;原子种类不变;元素质量不变;原子数目不变。
2. 在应用质量守恒定律时应注意:(1)反应物是指完全参加化学反应的物质。
(2)质量守恒定律适用于质量守恒,而不是体积守恒。
(3)对化学变化有意义,对物理变化无意义。
例题:1.某化合物(用X 表示其化学式)燃烧时发生的反应为:X + 3O 2====2CO 2 + 3H 2O ,根据质量守恒定律,可判断出X 是----------------------------------------------------------------( )A .C 2H 6 B.C 2H 6O C.C 2H 4 D.C 2H 4O2.某有机化合物6克,在空气中完全燃烧后生成8.8克CO 2和3.6克水,若该化合物的式量为60,则它的化学式为_______________________。
专题练习:1.化学反应前后必定发生改变的是---------------------------------------------------------------( )A.元素种类B.原子种类C.物质质量之和D.分子种类2.煤、石油、天燃气、木材和作物秸杆等物质的燃烧,都会产生二气化碳。
由此推断以上物质中一定含有------------------------------------------------------------------------------------( )A .碳元素B .氧元素 C.氢元素 D.碳元和氧元素3.某反应:A+B=C+D,如果8克A 和32克B 恰好完全反应生成22克C,那么生成9克 D 时参加反应的B 的质量是-----------------------------------------------------------------( )A.4克B.11克C.16克D.18克4.在化学反应A + 2B === C + 2D 中,a 克A 物质与b 克B 物质刚好完全反应生成c 克C 物质,同时生成D 物质的克数是---------------------------------------------------------------( )A. a+1/2b+cB.a+2b-cC.a+b-2cD.a+b-c5.根据化学反应A + B === C + D ,已知A 、B 两种物质各9.8克,A 、B 充分反应后,生成C 为16.1克,生成D 为0.2克,B 物质完全反应,则A 与B 反应时的质量比为________________.6.在反应A + 3B === 2C + 2D 中,A 和B 的式量之比为7:8.已知2.8克A 与一定量的B 完全反应生成3.6克D.则在此反应中.B 和C 的质量比为----------------------------------------( )A.4:3B.3:4C.12:11D.11:127.根据化学方程式:3AB + C 2B 3 === 2C + 3X ,判断X 的分子式为-----------------( )A .A 3B 2 B.A 2B 3 C.AB 2 D.AB 38.绿色植物光合作用的反应式可表示为:6H 2O + 6CO 2 葡萄糖 + 6O 2,则葡萄糖是由________________元素组成的(填元素符号),其式量为_______________。

课题1 质量守恒定律一、教材分析本课的主要内容是质量守恒定律,是九年级化学第五单元课题1的内容。
本节课包括质量守恒定律的涵义、质重守恒的原因及其应用。
通过一系列探究活动,引导学生从量的方面去研究并得出化学反应的客观规律。
并从微观角度使学生充分理解化学反应中质量守恒的原因。
因此,质量守恒定律是初中化学的一个重要化学规律,是分析物质在化学反应中的质量关系的理论依据,是学生对化学反应的认识从“质”到“量”的过渡前提,也为化学方程式的书写和计算的教学做好理论准备,它的应用贯穿于整个中学化学。
所以本节内容在初中化学里有着承上启下的作用。
因此,本课内容不仅是本单元的一个重点,也是整个中学化学的教学重点之一。
二、学情分析初三刚开设化学课,学生情绪和心理都处于比较兴奋、好奇状态,学习化学的兴趣较高。
通过一阶段的学习,学生对分子和原子、元素、化学式,及对化学反应中物质发生了质的变化已经有了一定的认识,并初步掌握了一些简单的化学反应和简单的化学实验基本操作技能,而对化学反应的实质和化学探究学习的方法尚处于启蒙阶段。
针对这些情况,我采用小组实验探究的方法,鼓励学生动手、动脑,让每个学生参与到学习中来。
因此,在实验中观察,在观察中讨论,在讨论中形成共识,不仅使学生学到新的化学知识,也可使学生对化学知识的内在联系及化学反应的本质有更深的理解。
因为初中学生抽象思维能力较弱,特别是从分子原子角度去解释质量变化的能力还很有限,因此从微观角度解释质量守恒定律并能初步运用质量守恒定律确定为教学难点。
三、课时安排本课程共分为两课时:课时1 质量守恒定律课时2 化学方程式课时2 化学方程式一、教学目标1.知道化学方程式的定义,了解化学方程式表示的意义;2.会从质、量、数等方面读化学方程式,并能利用化学方程式求出化学反应中各物质的质量比。
二、教学重难点教学重点:化学方程式表示的意义。
教学难点:化学方程式表示的意义。
三、教学过程【提问】同学们还记得在化学反应中体现出来的“六不变、两改变、两可能变”吗?【展示】“六不变”指:反应前后物质的总质量、元素种类、元素总质量、原子种类、原子个数、原子质量一定不变;“两改变”指:反应前后物质种类、分子种类一定改变。
微专题2 质量守恒定律的应用判断依据:化学反应前后原子的种类和数目不变,这是解该类题的关键。
1.【2023湖南衡阳真题】 实验后试管中残留的硫,常用热的NaOH 溶液清洗,发生了如下反应:2323S 6NaOH 2X Na SO 3H O +=++,则X 的化学式为( )A. 2H SB. 2SOC. 2Na SD. 24Na SO1、一般先根据质量守恒定律计算出表格中未知数;2、确定反应物和生成物:根据反应后质量增加的属于生成物、质量减少的属于反应物(注意:质量不变可能是催化剂,也可能是与该物质反应无关的物质);3、根据反应物和生成物确定基本反应类型;4、判断反应中物质的质量比,一定要求物质反应前后的差值再作比。
1. 【2022云南昆明】将下列四种物质放入密闭容器中充分反应,测得反应前后各物质的质量如下表,下列说法错误的是( )B. 甲和乙为反应物C. 丙可能是催化剂D. 甲、乙、丁的相对分子质量之比为2:1:22. 【2023山东临沂真题】甲、乙、丙、丁四种物质在化学反应前后的质量关系如图所示,下列说法中错误的是A. 丙可能为该反应的催化剂B. 该反应是化合反应C. 反应中消耗甲和乙的质量比为5:9D. 该化学反应前后各元素的化合价不一定发生变化1、化学反应前后物质不变;元素不变;元素不变;2、基本公式:(1)化学式量(相对分子质量):化学式量=化学式中各原子的的总和。
(2)元素的质量分数:某化合物中某元素的质量分数=某元素原子的除以。
(3)化合物中某元素的质量:化合物中某元素的质量=元素的乘以。
1. 【2023河南真题】乙炔(化学式为C2H2)可用作燃料,当氧气不足时,乙炔燃烧会生成二氧化碳、一氧化碳和水,若一定质量的乙炔燃烧生成了3.3g二氧化碳、0.9g水和mg一氧化碳,则m的数值为_____。
2.【2023湖南益阳一模】现有8g某有机物与足量O2在一定条件下充分反应,生成22gCO2和18gH2O。
《 专题2 质量守恒定律》分享人:清华大学史家昕
A .
B .
C . D
.
(2018滨州)下列实验能够直接用于验证质量守恒定律的是( )
(2018娄底)某有机物在9.6g 氧气中恰好完全燃烧,生成8.8gCO 2和5.4gH 2O ,下列说法正确的是( )
A .该有机物只含碳、氢两种元素
B .该有机物中一定含有碳、氢元素,可能含有氧元素
C .该有机物中一定含有碳、氢、氧三种元素
D .无法确定
(2018菏泽节选)某化学兴趣小组为了测定鸡蛋壳中
碳酸钙的含量,进行了如下实验:取25.0g洗净、粉碎
后的鸡蛋壳样品放于烧杯中,向烧杯中滴加稀盐酸
(整个过程不考虑盐酸的挥发和气体的溶解),实验
测得烧杯中剩余物质的质量与加入盐酸的质量之间的
关系如图所示:求:产生CO2的总质量为 g。
(2018绥化)在一密闭容器中放入X、Y、Z、Q四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,则关于此反应的认识正确的是( )物质X Y Z Q
反应前质量/g202137
反应后质量/g15321未知A.物质Y一定是单质 B.反应后物质Q的质量为12g
C.反应过程中X、Q的质量比为9:4 D.物质Z一定的该反应的催化剂
质量守恒定律015种题型03
分享人:清华大学史家昕
本节要点小结
02
考点1:质量守恒定律
适用范围:化学反应
参加反应的物质的总质量=生成物的总质量
微观解释:反应前后原子的种类、数目及质量没有变化。
一定不变:原子种类、数目、质量、元素种类、质量、反应前后各物质的总质量
一定改变:分子种类、物质种类
可能改变:元素的化合价、分子数目
考点2:质量守恒定律的应用
每种应用的依据?
确定物质的化学式
确定物质的元素组成
确定物质的相对分子质量
推断反应中化学计量数及比值
确定物质的质量
题型一 质量守恒定律的验证
例1.(2018滨州)下列实验能够直接用于验证质量守恒
定律的是( )
总结:当有气体参与反应或有气体生成时,必须在密闭容
器内进行才能验证质量守恒定律。
A .
B .
C .
D .
C
例2.(2018苏州)高锰酸钾和浓盐酸发生如下应:2KMnO 4+16HCl=2KCl+2MnCl 2+5X↑+8H 2O ,根据质量守恒定律,推测X 应是( )A .HClO B .ClO 2 C .O 2D .Cl 2解析:由反应前后原子个数不变得X 的化学式是Cl 2。
D
例3.(2018娄底)某有机物在9.6g 氧气中恰好完全燃烧,生成
8.8gCO 2和5.4gH 2O ,下列说法正确的是( )A .该有机物只含碳、氢两种元素
B .该有机物中一定含有碳、氢元素,可能含有氧元素
C .该有机物中一定含有碳、氢、氧三种元素
D .无法确定
解析:由质量守恒定律,反应前后元素种类不变,该物质中一定含有碳元素和氢元素。
8.8gCO 2中含有氧元素的质量为:8.8g ×16*2/44×100%=6.4g ,
5.4gH 2O 中含有氧元素的质量为:5.4g ×16/18×100%=4.8g ,生成物
8.8g 二氧化碳和5.4g 水中所含氧元素的质量和=6.4g+4.8g=11.2g ,11.2g >9.6g ;该物质中含氧元素的质量为:11.2g ﹣9.6g=1.6g ,则该物质中一定含有碳、氢、氧三种元素。
C
题型三 确定物质质量
例4.(2018菏泽节选)某化学兴趣小组为了测定鸡蛋壳中碳酸钙的含量,进行了如下实验:取25.0g 洗净、粉碎后的鸡蛋壳样品放于烧杯中,向烧杯中滴加稀盐酸(整个过程不考虑盐酸的挥发和气体的溶解),实验测得烧杯中剩余物质的质量与加入盐酸的质量之间的关系如图所示:求:产生CO 2的总质量为 g。
解析:根据质量守恒定律可知反应前后减少的质量就是生成CO 2的质量,为
25g+150g ﹣165.1g =9.9g 。
9.9
题型三 确定物质质量
例5.(2019长清区一模)由Cu(OH)2和CuO 组成的混合物,测得其中含铜元素的质量分数为64%。
取该混合物10g ,将其投入适量的稀盐酸中恰好完全反应,所得溶液中溶质的质量为( )A .6.4g B .64g C .12.8g D .13.5 g 解析:盐酸与Cu(OH)2、CuO 反应生成均生成CuCl 2和H 2O ,混合物中的铜元素完全转化到生成物氯化铜中,则溶液中氯化铜质量为:10g ×64%÷(64/135)=13.5g 。
D
例6.(2018聊城)将宏观、微观及化学符号联系在一起是化学学科的特点。
某化学反应微观示意图如图所示,下列叙述正确的是()
D
A.反应前后各元素化合价不变
B.该化学变化中发生改变的微粒是原子C.该反应不符合质量守恒定律
D.参加反应的CO2和H2分子个数比为1:3
解题关键点:书写化学反应方程式
解析:由化学反应微观示意图可知该反应的化学方程式是:2CO 2+6H 2=== C 2H 4+4H 2O A 、该反应有单质氢气参加反应,生成了水,氢元素在反应前是0价,反应后是+1价,反应前后有元素化合价改变,错误;
B 、由微粒的变化可知,该化学变化中发生改变的微粒是分子,不是原子,错误;
C 、该反应是化学反应,符合质量守恒定律,错误;
D 、由方程式可知,参加反应的CO 2和H 2分子个数比为2:6=1:3,正确。
催化剂△
表格/柱状图/饼图/坐标系型
定反应物、生成物
反应后质量增加的为生成物,质量减少的为反应物,质量不变的可能为催化剂写反应表达式
根据反应物、生成物写反应表达式,判断反应类型(化合或分解)定变化量
增加量或减少量标在相应物质下面,并求出未知量分析判断判断物质种类、质量比、化学计量数之比等
解题思路:
例7.(2018绥化)在一密闭容器中放入X 、Y 、Z 、Q 四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,则关于此反应的认识正确的是( )物质
X Y Z Q 反应前质量/g
202137反应后质量/g
15321未知
A .物质Y 一定是单质
B .反应后物质Q 的质量为12g
C .反应过程中X 、Q 的质量比为9:4
D .物质Z 一定的该反应的催化剂
B
解析:由表中数据分析可知,反应前后X的质量减少了20g﹣15g=5g,为反应物;Y的质量增加了32g﹣2g=30g,为生成物;Z的质量不变,Z可能作该反应的催化剂,也可能没有参加反应;由质量守恒定律,Q应是反应物,且参加反应的Q的质量为30g﹣5g=25g,故未测的数值为37g﹣25g=12g。
A、该反应为:X+Q→Y,故物质Y一定是化合物,错误;
B、反应后物质Q的质量为12g,正确;
C、反应过程中X、Q的质量比5:25=1:5,错误;
D、Z的质量不变,Z可能作该反应的催化剂,也可能没有参加反应,错误。
例8.(2019锦江区模拟)在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下反应,测得反应前及反应过程中的两个时刻各物质的质量分数如图所示,图中a 、b 、c 分别表示相应物质的质
量分数。
下列说法正确的是( )A .a=54%
B .b=6%
C .以上发生的反应属于化合反应
D .丁物质一定是该反应的催化剂
C
解析:由四种物质反应前后各物质的质量分数可知,反应前后甲的质量分数减少了70%-42%=28%,甲是反应物;反应前乙的质量分数为14%,反应后乙的质量分数为1-42%-40%-10%=8%,乙的质量分数减少了14%-8%=6%,乙是反应物;反应前丙的质量分数为6%,丙的质量分数增加了40%-6%=34%,丙是生成物;丁的质量分数不变,可能作催化剂,也可能没有参加反应。
A、参加反应的甲和乙质量比为28%:6%,当乙的质量分数为11%时,减少了14%-11%=3%,则甲的质量分数应减少14%,则a=70%-14%=56%,错误;
B、反应后乙的质量分数为8%,b=8%,错误;
C、通过分析可知,甲、乙是反应物,丙是生成物,属于化合反应,正确;
D、丁物质可能是该反应的催化剂,错误。
化学反应遵循质量守恒定律
小结
分享人:清华大学史家昕
01
化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。