13间接碘量法测定铜盐中的铜
- 格式:doc
- 大小:57.50 KB
- 文档页数:4


碘量法测定铜合金中铜的含量一、试剂1+1HCl溶液、30%H2O2、1+1NH3·H2O溶液、1+1HAc溶液、20%NH4HF2溶液、20%KI溶液、10%NH4SCN溶液、0.5%淀粉溶液、0.1mol/LNa2S2O3标准溶液。
二、测定原理铜合金试样可用HCl-H2O2熔解,加热煮沸使过量的H2O2,分解,然后将溶液调节至酸性(pH=3~4),加KI、使之与Cu2+作用生成CuI沉淀,同析出与铜量相当的I2,(实际上以I3-形式存在)。
析出的I2以淀粉为指示剂,用Na2S2O3标准溶液滴定,其反应如下:2Cu2++4I-=2CuI+I2I2+2S2O3-=2I-+S4O32-根据Na2S2O3的用量计算试样中的铜的含量。
由于CuI沉淀强烈地吸附I3-,因此在近终点时加入硫氰酸盐以使CuI转化为溶解度更小的CuSCN沉淀,从而使被吸附的I3-释放出来参加反应。
Fe3+的干扰可用NH4HF2掩蔽加以消除。
三、测定步骤准确称取铜合金试样0.16g于250mL锥形瓶中,加入1+1HCl溶液10mL,并用滴管加30%H2O2约1mL,加盖,观察试样是否溶解完全,必要时再加些H2O2,加热助溶,煮沸至冒大气泡,冷却后加水10mL,滴加NH3H2O溶液至出现浑浊,再加入1+1HAc8mL,加NH4HF2溶液5mL、KI溶液10mL,摇匀。
稍放置后用Na2S2O3标准溶液滴定至溶液呈浅黄色,加入淀粉溶液5mL,继续滴定至溶液呈浅蓝灰色,再加入NH4SCN溶液10mL,充分摇动。
此时,溶液颜色变深,然后滴定至蓝灰色消失为止。
根据Na2S2O3标准溶液用量计算铜合金中铜的含量。
备注:1.本实验所用试剂种类较多,加入先后顺序不可颠倒,故对每种试剂应配备专用量杯。
2.淀粉指示剂应在临近终点时加入,不可加入过早。
否则,大量碘与淀粉生成蓝色配合物,终点难以观察。
3.NH4HF2对玻璃有腐蚀作用,测定结束后应立即在锥形瓶中溶液倒去并清洗。
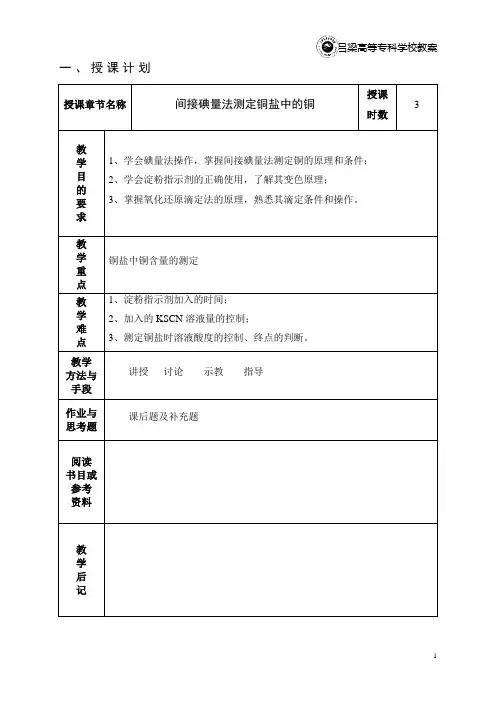
一、授课计划授课章节名称间接碘量法测定铜盐中的铜授课时数3教学目的要求1、学会碘量法操作,掌握间接碘量法测定铜的原理和条件;2、学会淀粉指示剂的正确使用,了解其变色原理;3、掌握氧化还原滴定法的原理,熟悉其滴定条件和操作。
教学重点铜盐中铜含量的测定教学难点1、淀粉指示剂加入的时间;2、加入的KSCN溶液量的控制;3、测定铜盐时溶液酸度的控制、终点的判断。
教学方法与手段讲授讨论示教指导作业与思考题课后题及补充题阅读书目或参考资料教学后记二、课时教学内容教学内容小结铜盐中铜含量的测定预习提要:1、本实验为什么不加NH4HF?2、哪些因素使测定结果偏高?偏低?3、回答P86思考题一、实验目的1、学会碘量法操作,掌握间接碘量法测定铜的原理和条件;2、学会淀粉指示剂的正确使用,了解其变色原理;3、掌握氧化还原滴定法的原理,熟悉其滴定条件和操作。
二、实验原理在弱酸性溶液中(pH=3~4),Cu2+与过量I-作用生成难溶性的CuI沉淀和I2。
其反应式为2Cu2++4I-=2CuI↓+I2生成的I2可用Na2S2O3标准溶液滴定,以淀粉溶液为指示剂,滴定至溶液的蓝色刚好消失即为终点。
滴定反应为:I2+2S2O32-= S4O62- + 2I-由所消耗的Na2S2O3标准溶液的体积及浓度即可求算出铜的含量。
由于CuI沉淀表面吸附I2致使分析结果偏低,为此可在大部分I2被Na2S2O3溶液滴定后,再加入NH4SCN或KSCN使CuI(K SP=1.1×10-12)沉淀转化为溶解度更小的CuSCN(K SP=4.8×10-15)沉淀,释放出被吸附的碘,从而提高测定结果的准确度。
由于结晶的Na2S2O3·5H2O一般都含有少量杂质,同时还易风化及潮解,所以Na2S2O3标准溶液不能用直接法配制,而应采用标定法配制。
配制时,使用新煮沸后冷却的蒸馏水并加入少量Na2CO3,以减少水中溶解的CO2,杀死水中的微生物,使溶液呈碱性,并放置暗处7~14天后标定,以减少由于Na2S2O3的分解带来的误差,得到较稳定的Na2S2O3溶液。

间接碘量法测定铜合金中的铜含量一、实验目的:1、掌握Na2S2O3溶液的配制及标定原理2、学习铜合金的溶解方法3、了解间接碘量法测定铜合金的原理及其方法二、实验原理:1、Na2S2O3溶液的配制及标定(1)、配制:Na2S2O3不是基准物质,不能用直接称量的方法配制标准溶液,配好的Na2S2O3溶液不稳定,容易分解,这是由于细菌的作用:Na2S2O3→Na2SO3+S;溶解在水中的CO2作用:S2O32-+CO2+H2O→HSO3-+HCO3-+S空气中的氧化作用:S2O32-+1/2O2→SO42-+S此外,水中微量的Cu2+、Fe3+也能促进Na2S2O3溶液的分解。
因此,要用新煮沸(除去CO2和杀死细菌)并冷却的蒸馏水配制Na2S2O3,加入少量Na2CO3使溶液呈碱性,抑制细菌生长,用时进行标定。
(2)、标定:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2OIO3-+5I-+6H+=3I2+3H2O析出的I2用Na2S2O3溶液滴定:I2+S2O32-=2I-+S4O62-(3)、标定反应条件:A、酸度:酸度愈大,反应速度越快,但酸度太大,I2易被空气中的O2氧化,所以酸度为宜。
B、K2Cr2O7充分反应,放于暗处5分钟。
C、所用KI不应含有KIO3或I2。
2、铜合金中铜的测定(1)、铜的溶解:试样可以用HNO3分解,但低价氮的氧化物能氧化I-干扰测定,故需用浓H2SO4蒸发将它们除去。
也可用H2O2和HCl分解样品Cu+2HCl+H2O2=CuCl2+2H2O。
分解完成后煮沸除去H 2O2(溶液冒大泡)。
(2)、调节酸度pH=,用HAC-NaAC,NH4HF2,或HAC-NH4AC。
(3)、加入过量KI析出I2。
2Cu2++4I-=2CuI↓+I2。
加入KI,在这里有三个用途:还原剂:将Cu2+还原为Cu+;沉淀剂:沉淀为CuI;络合剂:将I2络合I3-。
(4)、Fe3+能氧化I-,对测定有干扰,可加入NH4HF2掩蔽,NH4HF2也可作为缓冲液,控制pH值3-4。

间接碘量法测定铜盐中铜的含量
一、实验原理
碘在酸性环境中可以和铜离子反应生成一种蓝色络合物CuI2,因此可以利用该反应来测定铜盐中铜的含量。
二、实验材料
1、硫酸:质量浓度为1mol/L。
5、蒸馏水。
三、实验步骤
1、取10mL的铜盐溶液,加入20mL的硫酸中,轻轻加热至铜盐全部溶解,冷却至室温。
2、定量移出1mL的上清液,加入100mL试管中。
3、加入4ml的碘酸钾和2ml的碘化钾,振荡均匀。
4、蒸馏水定容至刻度线处,振荡均匀,放置10min。
5、取出4mL溶液,滴加0.01mol/L碘酸钾溶液标定至淡黄色为止。
6、测定每种试剂的比色系数,计算铜盐溶液中铜的质量浓度。
四、实验记录与分析
1、实验数据
标定数据:
初始体积(ml) 加入碘酸钾体积(ml) 结束体积(ml)
0 4 4.482
0 4 4.452
0 4 4.405
运动前温度(℃) 运动后
1.02 2
2.2 1.037
2、计算
铜盐溶液中的铜含量:
其中,V1为上清液体积,V2为总体积,C为标定氯酸钾溶液浓度,B为溶液比色系数。
铜的原子量为63.55。
五、实验注意事项
1、反应中避免过量添加试剂。
2、使用稀盐酸或其他酸性试剂时,加入时需缓慢,避免气泡产生。
3、标定时需注意每次加入量应当相同,且至少重复3次。
4、比色时应当使试管内溶液对于光的透明度最大,以便精确读取吸光度。

(推荐)分析化学实验碘量法测定铜盐中铜的含量本实验旨在通过分析化学实验中的碘量法测定铜盐中铜的含量,了解分析化学实验中常用的分析方法、分析仪器以及实验步骤,提高分析化学基本操作能力。
一、实验原理碘量法是利用含碘化合物与另一种化合物在一定条件下反应发生滴定,并根据计算数据计算出待测物质的含量的化学分析方法。
在本实验中,利用铜离子还原碘离子为碘来确定铜盐中铜的含量。
反应方程式如下:2Cu2+ + 4I- → 2CuI + I2其中I2是碘,反应中铜离子被还原成了无色的碘离子,碘离子又被铜盐还原成了深褐色的碘。
二、实验仪器和试剂1.天平:精度为0.001g。
3.注射器:0.5mL/1mL。
4.垂管:直径2mm。
6.石英坩埚:4mL。
7.电磁加热板。
8.蒸馏水、酸性过氧化氢。
9.氯化铜五水合物CuCl2·5H2O。
10.精制碘酒KI11.标准硫酸钠Na2S2O312.甲醇。
三、实验步骤1.测定样品的质量:取一定数量的样品,称重并记录其质量mn(mg)。
2.样品的溶解:将称量好的样品放入烧杯中,加去离子水,加热搅拌直至样品完全溶解,再用蒸馏水稀释至100mL。
3.制备实验溶液:将10mL样品溶液转移至250mL烧杯中,加入1mL1mol/L酸性过氧化氢,加蒸馏水稀释至150mL。
4.测定空白的滴定体积:取一定数量的Na2S2O3,称重并记录其质量,加入烧杯中,加入1mL1mol/L酸性过氧化氢,加蒸馏水稀释至150mL,滴定至终点。
终点是使溶液从红棕色变成黄色,有遗漏当作准确标准。
5.测定样品的滴定体积:向制备好的实验溶液中加入1mL精制碘酒和1mL甲醇,振荡混合,然后加入滴定垂管中进行滴定,滴入银絮指示剂,滴定至终点。
终点是使溶液从红棕色变成黄色,有遗漏当作准确标准。
6.数据处理:根据空白试验的滴定体积和样品的滴定体积,计算出样品的铜含量。
四、实验注意事项1.本实验中使用的精制碘酒是具有刺激性的有机物,操作过程要注意避免与皮肤接触,避免吸入粉尘。

间接碘量法测定铜合金中铜含量一、实验目的1. 掌握Na2S2O3溶液的配制及标定要点。
2. 了解淀粉指示剂的作用原理。
3. 了解间接碘量法测定铜的原理。
4. 学习铜合金试样的分解方法。
5. 掌握以碘量法测定铜的操作过程。
二、试验原理铜合金种类较多,主要有黄铜各种青铜。
铜合金中铜的测定,一般采用碘量法。
在弱酸溶液中,Cu2 +与过量的KI作用,生成CuI沉淀,同时析出I2,反应式如下:2Cu2 + + 4I- ⇌2CuI↓+I2或 2Cu2 + + 5I- ⇌2CuI↓+I3析出的I2以淀粉为指示剂,用Na2S2O3标准溶液滴定:I2 +2S2O32 - ⇌2I- + S4O62 –Cu2+与I-之间的反应是可逆的,任何引起Cu2+浓度减小(如形成络合物等)或引起CuI溶解度增加的因素均使反应不完全。
加入过量KI,可使Cu2+的还原趁于完全。
但是,CuI沉淀强烈吸附I3-,又会使结果偏低。
通常的办法是近终点时加入硫氰酸盐,将CuI(K SP = 1.1×10-12)转化为溶液度更小的CuSCN沉淀(K SP = 4.8×10-15),把吸附的碘释放出来,使反应更为完全。
即I2 +2S2O32 - ⇌2I- + S4O62 –KSCN应在接近终点时加入,否则SCN- 会还原大量存在的I2,致使测定结果偏低。
溶液的pH一般应控制在3.0~4.0之间。
酸度过低,Cu2 +易水解,使反应不完全,结果偏低,而且反应速率慢,终点拖长;酸度过高,则I-被空气中的氧氧化为I2(Cu2 +催化此反应),使结果偏高。
Fe3 +能氧化I-,对测定有干扰,但可加入NH4HF2掩蔽。
NH4HF2(即NH4F.HF)是一种很好的缓冲溶液,因HF的K a =6.6×10-4,故能使溶液的pH控制在3.0~4.0之间。
三、主要试剂和仪器1.KI 200 g。
L-1 。
2. Na2S2O3 0.1 mol。

上海应用技术大学实验报告课程名称分析化学实验B 实验项目间接碘量法测铜盐中铜的含量姓名班级(课程序号)组别同组者实验日期指导教师成绩 100间接碘量法测定铜样盐中铜含量实验目的1、掌握铜盐中铜的测定原理和碘量法的测定方法。
2、学习终点的判断和观察。
实验原理在乙酸酸性溶液中,Cu2+与过量的KI反应,析出的碘用Na2S2O3标准溶液滴定,用淀粉作指示剂,反应如下:2Cu2+ + 4I- ═ 2CuI↓+ I2I2 + 2S2O32- ═ 2I- + S4O62-反应需加入过量的KI,一方面可促使反应进行完全,另方面使形成I3-,以增加I2的溶解度。
为了避免CuI沉淀吸附I2,造成结果偏低,须在近终点(否则SCN-将直接还原Cu2+)时加入SCN-,使CuI转化成溶解度更小的CuSCN,释放出被吸附的I2。
CuI+SCN-═CuSCN↓+I-CuSCN吸附I2的倾向较小,因而可以提高测定结果的准确度。
硫代硫酸钠(Na2S2O3·5H2O)一般都含有少量杂质,如S、Na2SO3、Na2SO4、Na2CO3、NaCl等,还容易风化和潮解,须用间接法配制。
Na2S2O3易受水中溶解的CO2、O2和微生物的作用而分解,故应用新煮沸冷却的蒸馏水来配制;此外,Na2S2O3在日光下,酸性溶液中极不稳定,在pH=9~10时较为稳定,所以在配制时还需加入少量Na2CO3,配制好的标准溶液应贮存于棕色瓶中置于暗处保存。
长期使用的Na2S2O3标准溶液要定期标定。
通常用K2Cr2O7作基准物标定Na2S2O3的浓度,反应为:Cr2O72- + 6I- + 14H+ ═ 2Cr3+ + 3I2 + 7H2O析出的碘再用标准Na2S2O3溶液滴定。
试剂和仪器试剂:CuSO4·5H2O试剂、Na2S2O3标准溶液(0.1084mol/L)、1mol/LH2SO4、10%KI 溶液、0.5%淀粉溶液、10%KSCN溶液仪器:分析天平、酸式滴定管、烧杯、250mL碘量瓶实验步骤胆矾中铜的测定:准确称取CuSO4·5H2O试样0.5~0.6g于250mL碘量瓶中,加3mL 1mol/L H2SO4溶液和100mL水使其溶解,在加入10%KI溶液10mL。

实验名称间接碘量法测定铜盐中的铜
目的要求1、掌握Na2S2O3溶液的配制和标定。
2、掌握Na2S2O3溶液的配制和标定要点。
3、熟悉碘量法测定的特点,了解酸度对反应和测定结果的影响。
重点1、Na2S2O3溶液的配制和标定要点;
2、碘量法测定可溶性铜盐中铜含量的原理和方法。
难点
防止沉淀的转化和酸度的控制。
试剂及仪器
设备试剂:0.10mol/LNa2S2O3标准溶液;KI溶液100g/L,使用前配制;KSCN溶液100g/L;H2SO4溶液1mol/L;淀粉溶液5g/L;CuSO4·5H2O试样。
仪器:锥形瓶、电子天平、碱式滴定管、其他常规玻璃仪器
内容提要1、Na2S2O3溶液的配制和标定;
2、间接碘量法测定铜盐中的铜的含量。
操作要点1、Na2S2O3溶液的配制和标定:称量重铬酸钾—溶解—定溶—加碘化钾溶液-
-用Na2S2O3溶液滴定;
2、间接碘量法测定铜盐中的铜的含量:铜盐-KI-用Na2S2O3溶液滴定.
注意事项1、NH4SCN溶液只能在临近终点时加入,否则大量的I2的存在有
可能氧化SCN-,从而影响测定的准确度;
2、实验要在碘量瓶中进行。
思考题
1、本实验加入KI的作用是什么?
2、本实验为什么要加入NH4SCN?为什么不能过早地加入?
3、若试样中含有铁,则加入何种试剂以消除铁对测定铜的干扰并
控制溶液的PH为3-4.
讨论学习1、碘量法的主要误差来源有哪些?为什么碘量法不适易在高酸度
或高碱度介质中进行?
拓展学习设计一个分别测定混合溶液中AsO33- 和AsO43- 的分析方案(原理、简单步骤、计算公式)。


一、实验目的1. 掌握碘量法测定铜盐中铜含量的原理和方法。
2. 培养实验操作技能,提高实验数据处理和分析能力。
3. 了解化学分析在工农业生产和科研中的应用。
二、实验原理本实验采用碘量法测定铜盐中铜含量。
实验原理如下:1. 铜盐与碘化钾反应生成碘化亚铜和碘化钾:Cu2+ + 2I- → CuI2 + 2K+2. 氧化剂(如氯水、硝酸等)将碘化亚铜氧化为碘:2CuI2 + 2H2O + 2O2 → 2Cu(OH)2↓ + 4I-3. 生成的碘与硫代硫酸钠反应,生成无色的四硫酸钠和碘化钠:I2 + 2S2O32- → S4O62- + 2I-4. 根据硫代硫酸钠的消耗量,计算铜盐中铜的含量。
三、实验仪器与试剂1. 仪器:分析天平、滴定管、锥形瓶、烧杯、玻璃棒、移液管、滴定台等。
2. 试剂:硫酸铜(CuSO4)、碘化钾(KI)、硫代硫酸钠(Na2S2O3)、氯化钠(NaCl)、氢氧化钠(NaOH)、氯水、硝酸、蒸馏水等。
四、实验步骤1. 称取0.5g硫酸铜试样,放入锥形瓶中。
2. 加入10ml蒸馏水,溶解试样。
3. 加入5ml碘化钾溶液,摇匀。
4. 加入少量氯水,观察颜色变化,直至溶液变为浅黄色。
5. 加入适量氢氧化钠溶液,使溶液pH值在8-10之间。
6. 用硫代硫酸钠标准溶液滴定,观察颜色变化,直至溶液由蓝色变为无色。
7. 记录消耗的硫代硫酸钠标准溶液体积。
8. 重复实验,求平均值。
五、数据处理1. 根据实验数据,计算铜盐中铜的含量:铜含量(%)= (C × V × M)/ m × 100%其中,C为硫代硫酸钠标准溶液的浓度(mol/L),V为消耗的硫代硫酸钠标准溶液体积(L),M为铜的摩尔质量(63.55g/mol),m为硫酸铜试样质量(g)。
2. 计算实验结果的相对标准偏差:相对标准偏差 = (S / X)× 100%其中,S为标准偏差,X为平均值。
六、实验结果与分析1. 实验结果:铜含量(%)= (0.1 × 0.05 × 63.55)/ 0.5 × 100% = 6.3%相对标准偏差 = (0.01 / 6.3)× 100% = 1.59%2. 分析:本实验采用碘量法测定铜盐中铜含量,实验结果较为准确。
实验十二间接碘量法测定铜盐中的铜实验十二间接碘量法测定铜盐中的铜一、实验目的掌握用间接碘量法测定铜的原理和方法。
二、实验原理Cu2+离子在酸性溶液中与KI发生下列反应:2Cu2++4I- =2CuI↓+I2析出的I2再用Na2S2O3标准溶液滴定:I2+2S2O32-=S4O62-+2I-由此可以计算出铜的含量。
Cu2+与I-的反应是可逆的,为了促使反应趋于完全,必须加入过量的KI,但CuI沉淀强烈吸附I2,使测定结果偏低。
如果加入KSCN,使CuI(K SP=1.1?10-12)转化为溶解度更小的CuSCN(K SP=1.1?10-15),就可以使用较少的KI而能使反应进行得更完全,但是KSCN只能在接近终点时加入,否则较多的I2会明显地被KSCN所还原而使结果偏低:SCN-+4I2+4H2O =SO42-+7I-+ICN+8H+同时,为了防止铜盐水解,反应必须在酸性溶液中进行。
酸度过低,铜盐水解而使Cu2+离子氧化I-离子进行不完全,造成结果偏低,而且反应速度慢,终点拖长;酸度过高,则I-离子被空气氧化为I2(Cu2+离子催化下),使结果偏高。
因Cl-离子能与Cu2+离子络合,影响I-离子对络合物Cu(Ⅱ)的定量还原,所以最好用硫酸而不用盐酸调节测定用酸度。
三、实验仪器及试剂仪器:分析天平,滴定管,移液管,锥形瓶试剂:0.10 mol·L-1 Na2S2O3标准溶液,1 mol·L-1H2SO4,10%KI溶液,1%淀粉溶液,10%KSCN 溶液。
四、实验步骤准确称取硫酸铜试样(每份质量相当于20~30 mL 0.10 mol·L-1Na2S2O3标准溶液:0.5~0.7克)于250 mL锥形瓶中,加1 mol·L-1H2SO4溶液3 mL和水30 mL使之溶解。
加入10%KI 溶液7~8 mL,立即用Na2S2O3标准溶液滴定至呈浅黄色。
再加入1%淀粉溶液1 mL,继续滴定到呈浅蓝色。
间接碘量法测定铜合金中的铜含量一、实验目的:1、掌握Na2S2O3溶液的配制及标定原理2、学习铜合金的溶解方法3、了解间接碘量法测定铜合金的原理及其方法二、实验原理:1、Na2S2O3溶液的配制及标定(1)、配制:Na2S2O3不是基准物质,不能用直接称量的方法配制标准溶液,配好的Na2S2O3溶液不稳定,容易分解,这是由于细菌的作用:Na2S2O3→Na2SO3+S;溶解在水中的CO2作用:S2O32-+CO2+H2O→HSO3-+HCO3-+S空气中的氧化作用:S2O32-+1/2O2→SO42-+S此外,水中微量的Cu2+、Fe3+也能促进Na2S2O3溶液的分解。
因此,要用新煮沸(除去CO2和杀死细菌)并冷却的蒸馏水配制Na2S2O3,加入少量Na2CO3使溶液呈碱性,抑制细菌生长,用时进行标定。
(2)、标定:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2OIO3-+5I-+6H+=3I2+3H2O析出的I2用Na2S2O3溶液滴定:I2+S2O32-=2I-+S4O62-(3)、标定反应条件:A、酸度:酸度愈大,反应速度越快,但酸度太大,I2易被空气中的O2氧化,所以酸度为宜。
B、K2Cr2O7充分反应,放于暗处5分钟。
C、所用KI不应含有KIO3或I2。
2、铜合金中铜的测定(1)、铜的溶解:试样可以用HNO3分解,但低价氮的氧化物能氧化I-干扰测定,故需用浓H2SO4蒸发将它们除去。
也可用H2O2和HCl分解样品Cu+2HCl+H2O2=CuCl2+2H2O。
分解完成后煮沸除去H 2O2(溶液冒大泡)。
(2)、调节酸度pH=,用HAC-NaAC,NH4HF2,或HAC-NH4AC。
(3)、加入过量KI析出I2。
2Cu2++4I-=2CuI↓+I2。
加入KI,在这里有三个用途:还原剂:将Cu2+还原为Cu+;沉淀剂:沉淀为CuI;络合剂:将I2络合I3-。
(4)、Fe3+能氧化I-,对测定有干扰,可加入NH4HF2掩蔽,NH4HF2也可作为缓冲液,控制pH值3-4。
实验十二间接碘量法测定铜盐中的铜一、实验目的掌握用间接碘量法测定铜的原理和方法。
二、实验原理Cu2+离子在酸性溶液中与KI发生下列反应:2Cu2++4I- =2CuI↓+I2析出的I2再用Na2S2O3标准溶液滴定:I2+2S2O32-=S4O62-+2I-由此可以计算出铜的含量。
Cu2+与I-的反应是可逆的,为了促使反应趋于完全,必须加入过量的KI,但CuI沉淀强烈吸附I2,使测定结果偏低。
如果加入KSCN,使CuI(K SP=1.1⨯10-12)转化为溶解度更小的CuSCN(K SP=1.1⨯10-15),就可以使用较少的KI而能使反应进行得更完全,但是KSCN只能在接近终点时加入,否则较多的I2会明显地被KSCN所还原而使结果偏低:SCN-+4I2+4H2O =SO42-+7I-+ICN+8H+同时,为了防止铜盐水解,反应必须在酸性溶液中进行。
酸度过低,铜盐水解而使Cu2+离子氧化I-离子进行不完全,造成结果偏低,而且反应速度慢,终点拖长;酸度过高,则I-离子被空气氧化为I2(Cu2+离子催化下),使结果偏高。
因Cl-离子能与Cu2+离子络合,影响I-离子对络合物Cu(Ⅱ)的定量还原,所以最好用硫酸而不用盐酸调节测定用酸度。
三、实验仪器及试剂仪器:分析天平,滴定管,移液管,锥形瓶试剂:0.10 mol·L-1 Na2S2O3标准溶液,1 mol·L-1H2SO4,10%KI溶液,1%淀粉溶液,10%KSCN 溶液。
四、实验步骤准确称取硫酸铜试样(每份质量相当于20~30 mL 0.10 mol·L-1Na2S2O3标准溶液:0.5~0.7克)于250 mL锥形瓶中,加1 mol·L-1H2SO4溶液3 mL和水30 mL使之溶解。
加入10%KI 溶液7~8 mL,立即用Na2S2O3标准溶液滴定至呈浅黄色。
再加入1%淀粉溶液1 mL,继续滴定到呈浅蓝色。