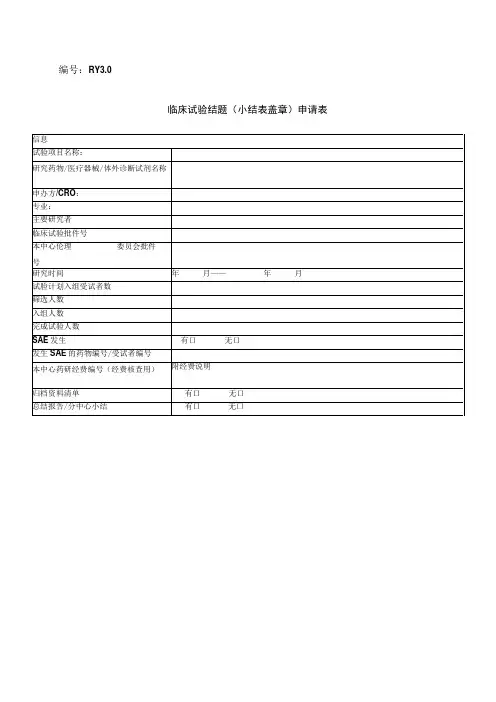
临床试验项目总结报告分中心小结表盖章申请表
- 格式:doc
- 大小:1.32 MB
- 文档页数:5

药物临床试验分中心小结表
附件1
参加试验人员信息
姓名职称所在科室研究分工
注:研究分工代码信息
1. 知情同意书获取
2. 病人入排标准确定
3. 体检/病史
4. CRF填写及更改
5. 签署原件CRF
6. 伦理联系
7. 病人联系/跟踪
8. 严重不良事件报告
9. 药物发放追踪管理
10. 试验用药指导
11. 样本管理
12. 中心实验室联系
13. IVRS/IWRS
14. 饮食和运动指导
15. 差异解决
附件2
分中心小结附表:受试者入选情况一览表
项目名称:研究中心方案号:药物名称:
第 4 页共7 页
附件3
实验室采集数据、正常值范围
第 5 页共7 页
附件4
重要不良事件
第 6 页共7 页
附件5
严重不良事件
第7 页共7 页。
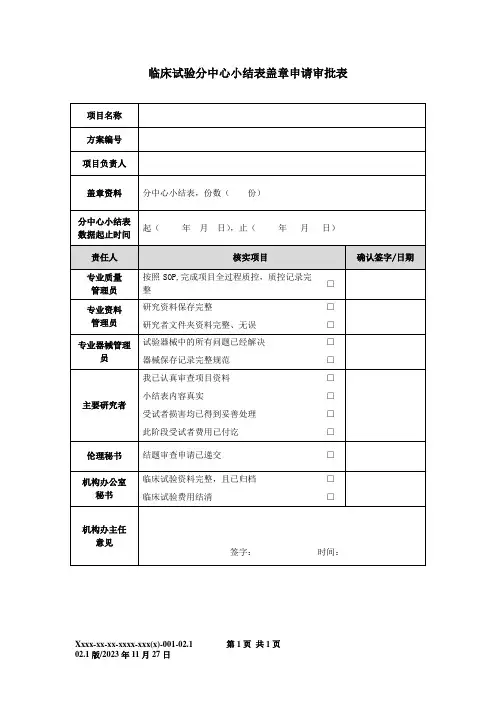

临床试验项目总结报告/分中心小结表盖章申请表
申请人上交申请表及总结报告后7个工作日联系机构办公室取回,联系人孟老师
27557209
松开的记忆,飘落的莫名的尘埃,像起伏的微风,拂过脑海,留下一份情愁。
一条街,没有那些人,那些身影,却能来回徘徊穿梭。
街,行走时,纵然漫长,漫长,有时只为听一颗流动的心的呓语。
沉默,倔强,回望,忘记,记住,一切像断了的弦,有时希望生活简单就好,有时却又莫名的颓废其中。
有些路,只能一个人走;有些事,只能一个人去经历。
粗读加缪、萨特的存在主义,它告诉我,人就是非理性的存在。
光秃秃的枝桠、清寂的清晨、流动的阳光,飘落于心,或快意,或寂寥,映照心境,然而,有时却只属于那一刻。
总之,一切只是心情。
人生的画面一幅幅地剪辑,最后拼凑出的是一张五彩斑斓的水彩画,有艳丽的火红色,凝重的墨黑以及一抹忧郁的天蓝色。
人的记忆很奇特,那些曾经的过往,就像一幅幅的背景图,只有一个瞬间,却没有以前或以后。
比如,只能记得某个瞬间的微笑,只能在记忆的痕迹寻觅某时刻骑着单车穿过路口拐角的瞬间,却都不知晓为何微笑,为何穿过街角。
一切,有时荒诞得像一场莫名情景剧。
然而,这就是生活。
曾经的梦,曾经的痛,曾经的歌,曾经的热情相拥,曾经的璀璨星空。

临床总结报告分中心小结表撰写及签章的标准操作规目录1. 目的 (3)2. 范围 (3)3. 责任人 (3)4. 依据 (3)5. 定义 (3)6. 内容 (2)临床总结报告分中心小结表撰写及签章的标准操作规1.目的明确药物临床试验临床总结报告分中心小结表撰写及签章的标准操作规程范围适用于药物临床试验。
2.责任人临床试验机构主任、临床试验机构办公室主任3.依据《药物临床试验质量管理规范(2003)》、ICH-GCP4.定义药物临床试验临床总结报告分中心小结表撰写及签章。
5.内容5.1多中心临床试验结束后,各中心应写出分总结报告并交负责单位,最后由试验负责单位写出总结报告。
5.2临床试验总结报告内容应与试验方案要求一致,包括:5.2.1随机进入各组的实际病例数,脱落和剔除的病例及其理由。
5.2.2不同组间的基线特征比较,以确定可比性。
5.2.3对所有疗效评价指标进行统计分析和临床意义分析.统计结果的解释应着重考虑其临床意义。
5.2.4 安全性性评价应有临床不良事件和实验室指标合理的统计分析,对严重不良事件应详细描述和评价。
5.2.5多中心试验中评价疗效,应考虑中心间存在的差异及其影响。
5.2.6 对试验药物的疗效和安全性以及风险和受益之间的关系作出简要概述和讨论。
5.3总结报告的主要项目5.3.1题目5.3.2摘要5.3.3目的5.3.4病例选择5.3.5试验方法5.3.6疗效判断5.3.7一般资料5.3.8试验结果5.3.9典型病例5.3.10对剔除、脱落或发生严重不良事件病例的分析和说明5.3.11讨论5.3.12疗效和安全性结论5.3.13试验设计者、试验总结者、各中心负责人员的姓名、专业、职称5.3.14试验主要研究者签字、日期、各中心盖章等。
5.4总结报告的主要内容5.4.l研究简介:言简意赅,让人了解整个临床试验的概况。
着重概述本次临床研究的目的、药物研制者、药物生产单位、药物临床试验批准文号、临床试验负责单位、临床试验起止时间及临床试验方法等。

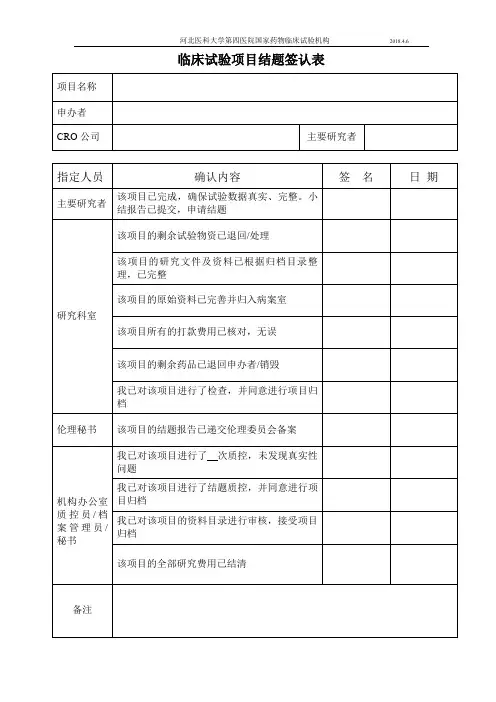
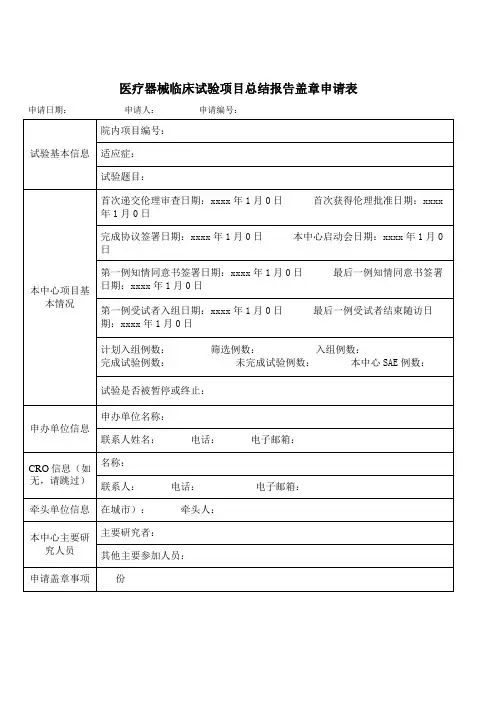
临床试验项目分中心小结/总结报告盖章信息确认表
试验项目名称:
申办者/CRO:
主要研究者:
试验用药品/医疗器械/体外诊断试剂已返还至申办者,相关文件记录已与项目组交接。
是☐否☐不适用☐
试验用药品/医疗器械/体外诊断试剂管理员签字/日期:
质控检查通过。
是☐否☐不适用☐机构质控员签字/日期:
本人承诺对本项临床试验数据的真实性、完整性负责并已仔细核对分中心小结/总结报告,确认内容准确无误。
主要研究者签字/日期:
分中心小结初审通过。
是☐否☐不适用☐机构质控员签字/日期:
分中心小结复核通过。
是☐否☐不适用☐机构办公室秘书签字/日期:
已完成费用结算,支付尾款。
是☐否☐不适用☐主要研究者签字/日期:
是☐否☐不适用☐机构办公室秘书签字/日期:
资料合格,已归档。
是☐否☐不适用☐档案管理员签字/日期:
同意分中心小结盖章。
是☐否☐不适用☐机构办公室主任签字/日期:
是☐否☐不适用☐机构副主任签字/日期:
临床试验总结报告审核通过。
是☐否☐不适用☐机构办公室主任签字/日期:
是☐否☐不适用☐机构副主任签字/日期:
同意临床试验总结报告盖。
是☐否☐不适用☐机构主任签字/日期:
注:选项选择请打“×”。
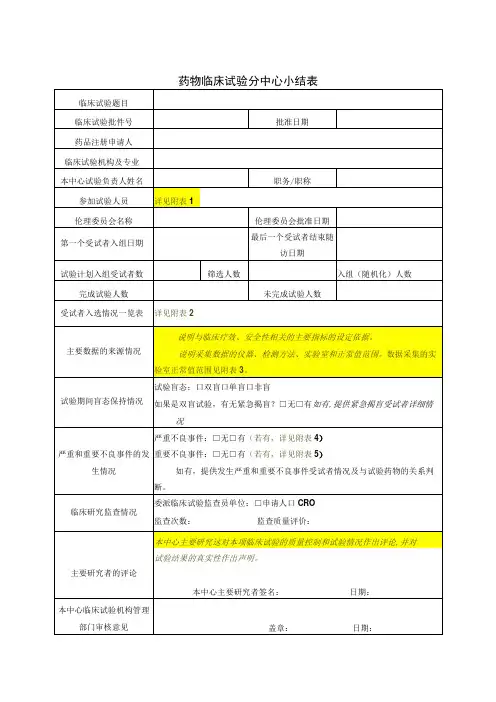
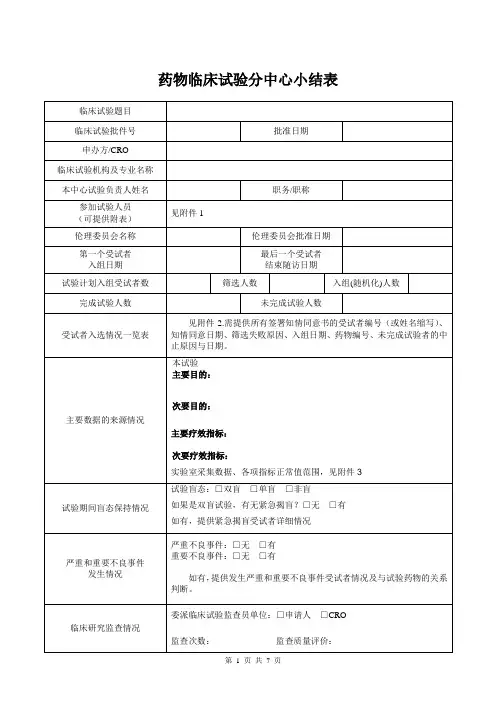
药物临床试验的分中心小结表临床试验题目临床试验批件号批准日期药品注册申请人临床试验机构及专业名称本中心试验负责人姓名职务/职称参加试验人员(可提供附表)参加试验人员姓名、职称、所在科室、研究中分工等信息详见附表1《参加试验人员列表》伦理委员会名称伦理委员会批准日期第一个受试者入组日期最后一个受试者结束随访日期试验计划入组受试者数筛选人数入组(随机化)人数完成试验人数未完成试验人数受试者入选情况一览表(可提供附表)详见:附表2《受试者入选情况一览表》和附表3《中止试验受试者一览表》主要数据的来源情况详见附表3《实验室采集数据仪器、检测方法正常值范围一览表》试验期间盲态保持情况试验盲态:□双盲□单盲□非盲如果是双盲试验,有无紧急揭盲?□无□有严重和重要不良事件发生情况严重不良事件:□无□有重要不良事件:□无□有如有,提供发生严重和重要不良事件受试者情况及与试验药物的关系判断。
临床研究监查情况委派临床试验监查员单位:□申办方□CRO 监查次数:次监查质量评价:主要研究者的评论本中心主要研究者签名:日期:本中心临床试验机构管理部门审核意见盖章:日期:附表1参加试验人员列表姓名职称科室研究中的职务研究中分工附表2受试者入选情况一览表受试者筛选号/姓知情同意日期筛选失败原因入组日期药物编号名缩写附表3中止试验受试者一览表药物编号中止日期中止原因附表4实验室采集数据仪器、检测方法正常值范围一览表检测项目单位正常值范围检测方法采集数据仪器血常规血红蛋白HGB g/L 115-150电阻法全自动五分类血球红细胞RBC ×1012/L 3.8-5.1白细胞WBC ×109/L 3.5-9.5血细胞压积HCT L/L 0.35-0.45血小板计数PLT ×109/L 125-350粒细胞分类数NEU 0.4-0.75尿常规葡萄糖GLUC 阴性试纸分析法全自动尿液分析仪蛋白质PRO 阴性尿白细胞ULEU 个/ul 0-25尿红细胞URBC 个/ul 0-20血生化白蛋白 ALB g/L 40.0-55.0终点法速率法全自动生化分析仪球蛋白 GLOB g/L 20.0-40.0丙氨酸氨基转移酶ALT IU/L 7-40天门冬氨酸氨基转移酶AST IU/L 13-35尿素氮UREA mmol/L 2.6-7.5肌酐CREA µmol/L41-81血糖GLU mmol/L 3.89-6.11钾K mmol/L 3.5-5.3钠 NA mmol/L 137.0-147.0氯 CL mmol/L 99.0-110.0总胆固醇CHO mmol/L 3-5.7甘油三酯TG mmol/L <1.70根据试验具体情况增补修改。
临床试验项目总结报告/分中心小结表盖章申请表
申请人上交申请表及总结报告后7个工作日联系机构办公室取回,联系人孟老师
27557209
梦中一道霓虹,化为亘古琴音。
相约午夜,缱绻风景,旖旎浪漫。
扯下一苑芳草,萋萋蔓绿,感怀飘然轮回。
登程人生,若即若离,云水禅心,未央别具一格。
岁月如斯,了然于胸,与你秉烛执手,问情生命。
编辑记忆,跋涉心灵轨迹,如梦鼾声,柔感情怀。
走出尘世喧嚣,缘结地老天荒。
待,小荷风情初窦,与天地之生灵,吟咏。
卷壁苍夜,浅笑一弯碧月。
谱一阙红尘神曲,载渡。
寄语晨时星光,盈照旭日,小鸟伊人,浮光霓裳,晓风过隙,情泻千里,凌霄悄然寄挂。
袅袅炊烟,一宛悠然,馨暖徜徉,花前月下徘徊,天涯无痕。
阡陌碧波,幸福瑶池,花枝摇曳,奏一曲天籁吟韵。
诗书充盈,短笛横吹,歌赋旖旎,坐拥,永恒岁月……。