(完整)医疗器械临床试验病例报告表
- 格式:docx
- 大小:30.95 KB
- 文档页数:14

受试者编号:□□□□XXXXXXXXXXX(此处输入课题名称)XXXXXXXXXXX病例报告表(Case Report Form)受试者姓名缩写:□□□□研究医师:所在科室:研究单位:研究开始日期:年月日研究结束日期:年月日填表说明在正式填表前,请认真阅读下列填表说明1.筛选合格者填写正式病例报告表。
2.病例报告表应用签字笔填写。
3病例填写务必准确、清晰,不得随意涂改,错误之处纠正时需用横线居中划出,并签署修改者姓名缩写及修改时间。
举例:58.6 56.8 LGW05-02-12。
4.患者姓名拼音缩写四格需填满,两字姓名填写两字拼音前两个字母;三字姓名填写三字首字母及第三字第二字母;四字姓名填写每一个字的首字母。
举例:张红5.所有选择项目的□内用√标注。
如:√。
表格中所有栏目均应填写相应的文字或数字,不得留空。
6.因故未查或漏查,请填写“ND”;具体用药剂量和时间不明,请填写“NK”;不适用请选“NA”。
7.期间应如实填写不良事件记录表。
记录不良事件的发生时间、严重程度、持续时间、采取的措施和转归。
如有严重不良事件发生(包括临床研究过程中发生需住院治疗、延长住院时间、伤残、影响工作能力、危及生命或死亡、导致先天畸形等事件),必须立即通知主要研究者及其单位伦理委员会。
临床研究流程表研究医师(签名):日期:20□□年□□月□□日基线情况研究医师(签名):日期:20□□年□□月□□日研究医师(签名):日期:20□□年□□月□□日开始禁食时间:□□□□年□□月□□日□□时□□分第一阶段记录□□□□年□□月□□日供试制剂:受试品T:□参比品R:□生命体征Vital Signs临床观察记录Clinical Observation实验室复查研究医师(签名):日期:20□□年□□月□□日开始禁食时间:□□□□年□□月□□日□□时□□分第二阶段记录□□□□年□□月□□日供试制剂:受试品T:□参比品R:□生命体征Vital Signs临床观察记录Clinical Observation研究医师(签名):日期:20□□年□□月□□日合并用药(CONCOMITANT MEDICATION)□无□有如有请填写下表注:*如研究结束后继续用药,请在□内划√研究医师(签名):日期:20□□年□□月□□日不良事件记录表不良事件与研究用药的相关性评价标准表肯定有关很可能有关可能有关可能无关肯定无关与药物有合理时间顺序++++—为已知的药物反应类型+++——停药后反应减轻或消失++±±—再次给药后反应复出现+???—无法用其他原因来解释++±±—研究医师(签名):日期:20□□年□□月□□日研究完成情况总结下列两项中,仅选一项□受试者完成本项研究(完成日期:20□□年□□月□□日)□受试者从本研究中退出(退出日期:20□□年□□月□□日)如果受试者退出研究,请在如下退出原因中选择一项主要原因:退出研究的原因(选择一个):□不良事件(请记录于不良事件页)□不符合入选/排除标准请注明:_________________________________________________ □体格检查和实验室异常(请记录于不良事件页)□违背方案请注明:_________________________________________________ □撤回知情同意□其它请注明:研究医师(签名):日期:20□□年□□月□□日病例报告表(CRF)审核声明主要研究者审核CRF声明。

肺功能仪有效性和安全性临床试验研究病历试验用医疗器械编号:□01肺功能仪(型号规格:MSPFT-B)□02肺功能仪(型号规格:MasterScreen)临床试验机构:□河南省人民医院□郑州市第六人民医院版本号和日期:MS2016082016年08月06日受试者姓名:联系方式:联系地址:受试者随机号:研究者姓名:试验开始时间:年月日随访结束日期:年月日申办者:河南迈松医用设备制造有限公司在正式填表前,请认真阅读下列填写说明研究病历填写说明1.参加本试验的研究者必须经过GCP培训,必须事先充分了解本试验方案及有关资料,严格按方案执行。
2.所有筛选者均需填写研究病历,研究病历用黑色签字笔填写。
3.病历填写务必准确、清晰,不得随意涂改,错误之处纠正时需用横线居中划出,并签署修改者姓名及修改时间。
举例:58.6 56.8ZS 2016.12.164.受试者姓名拼音缩写四格需填满,两字姓名填写两字拼音前两个字母;三字姓名填写三字首字母及第三字第二字母;四字姓名填写每一个字的首字母。
举例:张红李淑明欧阳小惠5字,多余空格以“0”填写完整,不得留空。
“ND”未查或漏查;“UK”不知道;“NA”不适用。
6.试验期间应如实填写不良事件记录表。
记录不良事件的发生时间、严重程度、持续时间、采取的措施和转归。
如有严重不良事件(包括临床试验过程中发生需住院治疗、延长住院时间、伤残、影响工作能力等)发生时,必须立即通知临床试验单位临床试验机构伦理委员会及该临床试验的申办者并上报国家食品药品监督管理总局。
7.临床试验应严格按照临床试验方案要求进行。
试验不同时期需完成的检查和需记录的项目要按照要求完成。
请对照试验流程表执行。
严重不良事件报告途径:试验流程图×= 该时间窗内需完成的项目。
6.接受的治疗方式(既往病史、用药和/或手术)患者既往是否有其他病史及手术史有□无□,如有请填写下表:研究者签名:日期:20| _ | _ |年| _ | _ |月| _ | _ |日7.入组前基础症状(如有):20| _ | _ |年| _ | _ |月| _ | _ |日二、符合入选/排除标准:如以上任何一项答案为“否”,此受试者不能参加本临床试验。

受试者编号:□□□□XXXXXXXXXXX(此处输入课题名称)XXXXXXXXXXX病例报告表(Case Report Form)受试者姓名缩写:□□□□研究医师:所在科室:研究单位:研究开始日期:年月日研究结束日期:年月日填表说明在正式填表前,请认真阅读下列填表说明1.筛选合格者填写正式病例报告表。
2.病例报告表应用签字笔填写。
3病例填写务必准确、清晰,不得随意涂改,错误之处纠正时需用横线居中划出,并签署修改者姓名缩写及修改时间。
举例:LGW05-02-12。
4.患者姓名拼音缩写四格需填满,两字姓名填写两字拼音前两个字母;三字姓名填写三字首字母及第三字第二字母;四字姓名填写每一个字的首字母。
举例:张红5.所有选择项目的□内用√标注。
如:√。
表格中所有栏目均应填写相应的文字或数字,不得留空。
6.因故未查或漏查,请填写“ND”;具体用药剂量和时间不明,请填写“NK”;不适用请选“NA”。
7.期间应如实填写不良事件记录表。
记录不良事件的发生时间、严重程度、持续时间、采取的措施和转归。
如有严重不良事件发生(包括临床研究过程中发生需住院治疗、延长住院时间、伤残、影响工作能力、危及生命或死亡、导致先天畸形等事件),必须立即通知主要研究者及其单位伦理委员会。
临床研究流程表研究医师(签名):日期:20□□年□□月□□日基线情况研究医师(签名):日期:20□□年□□月□□日研究医师(签名):日期:20□□年□□月□□日开始禁食时间:□□□□年□□月□□日□□时□□分第一阶段记录□□□□年□□月□□日供试制剂:受试品T :□ 参比品R : □生命体征Vital Signs临床观察记录Clinical Observation研究医师(签名):日期:20□□年□□月□□日开始禁食时间:□□□□年□□月□□日□□时□□分第二阶段记录□□□□年□□月□□日供试制剂:受试品T :□ 参比品R : □生命体征Vital Signs临床观察记录Clinical Observation研究医师(签名):日期:20□□年□□月□□日合并用药(CONCOMITANT MEDICATION)□无□有如有请填写下表注:*如研究结束后继续用药,请在□内划√研究医师(签名):日期:20□□年□□月□□日不良事件记录表*严重程度: 轻度(不处理,不停药),中度(停药,不处理),重度(停药,对症处理)。

病例报告表(Case Report Form)受试者姓名:家庭地址:联系电话:试验中心名称:申办单位:四川省妇幼保健院在正式填表前请认真阅读下列填表说明病例报告表填写说明:1.筛选合格者填写病例报告表。
2.病例报告表填写务必准确、清晰,不得任意涂改,错误之处纠正时需用横线居中化出,并签署修改者姓名缩写及修改时间。
3.填写记录一律用钢笔或碳素签字笔。
4.患者姓名拼音缩写四个需填满,两字姓名填写两字拼音前两个字母;三字姓名填写三字首字母及第三字第二字母;四字姓名填写每个字的首字母。
5.表中凡有“□”的项,请在符合的条目上划“√”。
表格中所有栏目均应填写相应的文字或数字,不得留空。
6.所有检验项目因故未查或漏查,请填写ND;具体合并用药剂量和时间不明,请先写NK。
7.试验期间应如实填写合并用药记录表、不良事件记录表。
记录不良事件的发生时间、严重程度、持续时间、采取的措施和转归。
如有严重不良事件发生(包括临床验证过程中发生需住院治疗、延长住院时间、伤残、影响工作能力危及生命或死亡、导致先天畸形等事件),必须立即通知主要研究单位伦理委员会及申办单位。
8.临床试验应严格按照临床试验方案要求进行。
试验不同时期需完成的检查和需记录的项目,请对照临床流程图执行。
受试者知情同意书敬爱的患者:我们现在正在进行一项临床研究,该项临床研究是经吉林省药品监督管理局备案的,研究的目的是评价物理治疗的高科技产品----温热电位治疗仪的疗效和安全性。
温热磁疗仪是XXX医疗器械有限公司根据韩国专利技术研制生产的医疗器械,本治疗仪是通过XXXXXXXXXXXXXXXXXXXXXXXXXXXXXX机理,主要用于XXXXXXXXXXXXX治疗。
具有平衡机体阴阳,增强脏腑机能,促进新陈代谢,调节植物神经,改善心脑血管血液供应,促进血液循环,调节血管张力,降低血液粘稠度,防治动脉粥样硬化,促进组织的再生修复功能,增强机体免疫功能及消炎止痛等作用。

XXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXX临床研究病例报告表(X日用药)受试者姓名缩写□□□□药物编号:□□□试验中心编号:□试验开始日期年月日填表说明1.请用签字笔填写,字迹应清晰,易于辨认。
2.受试者姓名按汉语拼音首字母缩写靠左对齐填写。
3.在所有选择项目中,请在相应的方框中划“×”;疼痛强度(PI)和疼痛缓解度等数字表示项目请在选择的相应数字上画圈“○”。
4.每项填写内容务必准确,不得随便涂改,如发现填写内容有误,应在原记录上划单横线,在旁边写明正确内容,并注名修改者及日期。
不要用任何方式(橡皮、涂改液等)涂抹原记录。
5.不要改变病例报告表的格式,如发现表中没有位置填写记录者希望记录的资料时,请将有关信息记录于后面的空白附页中,并保留以上记录副本。
6.知情同意书一般为患者签名。
如患者有特殊情况,可由患者法定代理人签名。
试验观察流程图入组筛选表1.受试者应为:♦年龄:18 -70岁癌症患者(一般情况尚好,可适当放宽)♦性别不限♦预计生存期2个月以上的住院患者♦疼痛强度为中到重度,评分≥4♦并符合一下条件之一(请在符合的项目上画圈)1)入选前1周内曾使用XX,日剂量为40-60mg,疼痛强度可缓解到≤2;2)入选前1周内曾使用其它镇痛药,其全日剂量相当于40-60mgXX剂量,疼痛强度可缓解到≤2♦非放疗期或疼痛部位为非照射部位♦间歇期的化疗者,应由主管医生确认化疗后无止痛作用♦该患者是否同意参加本试验,并已签署知情同意书如以上任何一个答案为“否”,此受试者不能参加2.受试者排除标准:♦本研究开始前4周内曾参加过其他临床试验♦正在服用或本试验开始前2周内曾服用MAO抑制剂者(如优降宁、苯乙肼等)♦24小时内用过XX类镇痛药,或5日内用过XXX♦癌痛骨转移患者,近4周内接受同位素内放疗或/和双磷酸盐类药物治疗♦呼吸抑制、(肺)气道阻塞或组织缺氧♦胆道疾病♦心脏疾患(即Ⅱ级和Ⅱ级以上心功能)♦血压高于正常值♦血液系统疾病♦肝、肾功能明显异常(即指标高于正常值一倍以上)♦脑部疾病,判定能力异常♦XX药耐受、过敏,或曾在使用时因不良反应停药♦药物及∕或酒精滥用♦孕妇或哺乳期妇女如以上任何一个答案为“是”,此受试者不能参加结论:该患者是否符合上述要求,同意入组是□□□□□□□□是□□□□□□□□□□□□□□□否□□□□□□□□否□□□□□□□□□□□□□□□医生签名:______日期____年___月___日病历简况1.1检查日期:年月日.2受试者病历号:2.1出生日期:年月.2性别:□1.男□2.女.3临床诊断:分期1. T□ 2. N□ 3. M□.4现接受的抗癌治疗:□1.放疗间歇期□2.化疗间歇期□3.中医药□4.手术□5.无□6.其他(请注明).50疼痛强度 : □1.轻(评分 ) □2.中(评分 ) □3.重(评分 ) .51疼痛性质: □1.急性疼痛□2.慢性持续性疼痛□3.间歇性(规律或无规律) □4.持续性痛伴一过性加剧□5.其他.52疼痛主要部位:□1.头面部□2.颈部□3.四肢□4.胸背部□5.腹部□6.骨关节□7.会阴□8.其他(请注明).53疼痛能否自行缓解:□1.能□2.有时能□3.不能.60入选前接受的镇痛治疗:□1.无□2. 吗啡、度冷丁、二氢埃托啡、美散痛、芬太尼等普通制剂□3. 缓控释吗啡、多瑞吉□4. 自控泵□5. 可待因及其复方制剂□6. 曲马多□7. 解热镇痛药□8. 其他如有,请回答:.61药品名称用药剂量:.62用药方式:□1.口服□2.静注□3.肌注□4.其他.63用药时间:□1.近四周内□2.近三天□3.其他3.0既往史.1药物过敏史□1.无□2.有 .2脑部疾患□1.无□2.有.3心脏疾患□1.无□2.有 .4哮喘□1.无□2.有.5胆道疾患□1.无□2.有 .6习惯性便秘□1.无□2.有.7肾脏疾患□1.无□2.有 .8糖尿病□1.无□2.有如有,请描述:1.2.4.0体格检查.1 1.T ._℃ 2.P 次/分 3.R 次/分4.SBP mmHg5.DBP mmHg6.身高 cm7.体重 Kg .2皮肤粘膜□ 1.无□2.苍白□3.黄染□4.紫绀□5.皮疹.3浅表淋巴结□ 1. 无肿大□2.有肿大.4双侧瞳孔□ 1.等大等圆□2.不等大□3.不等圆.50呼吸节律 .51肺部罗音□1.规则□2.不规则□1.无□2.有.60心律 .61心脏各瓣膜区杂音□1.齐□2.不齐□1.无□2.有.70腹部 .71腹部压痛□1.软□2.硬□1.无□2.有.72腹部包块 .73 移动性浊音□1.无□2.有. □1.无□2.有.74肝区叩痛 .75肝脏肿大□1.无□2.有□1.无□2.有.76脾脏肿大 .77肾区叩痛□1.无□2.有□1.无□2.有.80生理反射□1.存在□2.部分存在□3.不存在.81病理反射□1.未引出□2.有引出5.入组前可能与镇痛药物有关的基础症状(如果患者出现没有标识的症状,请自行填写文字)给药前生活质量记录表入组时实验室检查心电图检查医生签名:______日期____年___月___日入组时检验报告粘贴单用药情况记录表镇痛效果记录表说明1.0度:未缓解(疼痛未减轻);1度:轻度缓解(疼痛减轻约1/4);2度:中度缓解(疼痛减轻约1/2);3度:明显缓解(疼痛减轻约3/4以上);4度:完全缓解(疼痛消失)。


临床研究病例报告表crf模板英文回答:Case Report Form (CRF) Template for Clinical Research. Section 1: Study Information.Study Title:Study Number:Site Name:Site Number:Investigator Name:Investigator Signature:Date:Section 2: Patient Demographics and Medical History. Patient ID:Age:Sex:Race:Ethnicity:Medical History:Section 3: Study Procedures.Date of Visit:Treatment Administered:Dose:Route of Administration:Duration of Treatment:Adverse Events:Concomitant Medications:Physical Examination Findings:Laboratory Test Results:Section 4: Efficacy and Safety Assessments. Efficacy Outcome Measures:Safety Outcome Measures:Section 5: Patient Disposition.Reason for Discontinuation:Date of Discontinuation:Outcome at Discontinuation:Section 6: Investigator's Comments. Comments on Patient's Progress:Comments on Study Procedures:Comments on CRF Completion:中文回答:临床研究病例报告表(CRF)模板。

病例报告表(CRF填写指南(第1 版)一、制定本指南目的:为加强对医疗器械临床研究的监督管理,保证临床病历报告表记录真实、规范、完整,提高临床试验的质量,根据《医疗器械临床试验规定》、《国家档案法》以及《医疗器械监督管理条例》中的有关要求,制订本指南。
二、病例报告表(CRF的定义ICH将病例报告表(CRF定义为一种印刷的、可视的或者是电子版的文件,指按试验方案所规定设计的一种文件,用于记录每个受试者的所有试验方案要求的信息每位受试者在试验中的有关资料均应记录于病例报告表中,向申办者报告。
三、病例报告表(CRF 记录的要求病例报告表记录的基本要求:真实、及时、准确、完整、规范,防止漏记和随意涂改。
不得伪造、编造数据。
为确保达到以上要求,记录时需注意以下事项:1病例报告表中的数据来自原始文件并与原始文件一致,试验中的任何观察、检查结果均应及时、准确、完整、规范、真实地记录于病历和正确地填写至病例报告表中,不得随意更改,确因填写错误,作任何更正时应保持原始记录清晰可辨,由更正者签署姓名和时间;2临床试验中各种实验室数据均应记录或将原始报告复印件粘贴在病例报告表上,在正常范围内的数据也应具体记录。
对显著偏离或在临床可接受范围外的数据须加以核实。
检测项目必须注明所采用的计量单位;3病例报告表必须使用统一专用的带有页码编号的病例报告表。
病例报告表的幅面,根据需要设定。
4病例报告表中记录的内容要有必要的依据。
计算机、自动记录仪器打印的图表和数据资料,临床研究中的检验报告书、体检表、知情同意书、试验图片、照片等应按顺序粘贴在病例报告表的相应位置上,并在相应处注明试验日期和时间;底片装在统一制作的底片袋内,编号后另行保存。
用热敏纸打印的试验记录,须保留其复印件。
不宜粘贴的,可另行整理装订成册并加以编号,同时在病例报告表相应处注明,以便查对。
5病例报告表应保持完整,不得缺页或挖补;如有缺页、漏页,应详细说明原因。
6病例报告表的记录不得使用容易擦改的记录工具如铅笔等,宜用钢笔或圆珠笔写。

报告医疗器械临床试验结果1. 引言医疗器械临床试验是评价医疗器械安全性和有效性的重要途径之一。
本报告旨在总结与呈报XXX医疗器械的临床试验结果,以供相关部门和医疗从业人员参考。
2. 试验设计与方法本次试验采用随机对照实验设计,共纳入XXX名患者,其中XXX为试验组,接受XXX医疗器械的治疗;XXX为对照组,接受传统治疗。
试验组和对照组患者的性别、年龄、病情等基本特征均匹配。
2.1 试验设备与药物本次试验所用的XXX医疗器械根据国家标准生产,具有相关的医疗器械注册证书和生产批准文号。
2.2 试验步骤患者入组后,根据病情和临床需要,进行相应的操作和治疗。
试验组患者接受XXX医疗器械的治疗,而对照组患者接受传统治疗。
患者在试验期间将接受定期的随访和评估,以评价医疗器械的疗效和安全性。
3. 结果分析试验结果统计与分析如下所述:3.1 主要疗效指标本次试验中,试验组患者的主要疗效指标为XXX,而对照组患者的主要疗效指标为XXX。
通过对试验组和对照组患者的指标数据进行统计学分析,发现试验组在主要疗效指标方面表现出明显改善,与对照组相比有显著性差异(P值<0.05)。
3.2 次要疗效指标在次要疗效指标方面,试验组患者的XXX指标明显优于对照组(P值<0.05)。
3.3 安全性评估对试验组患者的安全性进行评估发现,XXX医疗器械在试验期间未出现严重的不良事件和并发症,证实了其较高的安全性和耐受性。
4. 讨论总结本次试验结果,XXX医疗器械在实际的临床应用中表现出较好的疗效和安全性,并与传统治疗相比具有更好的效果。
然而,对于长期疗效和长期安全性的评估仍需要进一步的研究。
5. 结论本次临床试验结果表明,XXX医疗器械具有显著的疗效改善和较高的安全性,对于相关疾病的治疗具有积极的意义。
该研究成果可为医疗从业人员提供参考,推动XXX医疗器械的进一步应用和推广。
6. 致谢感谢本次试验参与的患者和医疗人员的支持和配合。

XXXX临床研究病例报告表受试者姓名拼音缩写:|__|__|__|__|受试者编号:|__|__|__|__|__|研究者签名:________________主要研究者:XX 教授申办单位:XX医院正式填表前,请认真阅读以下说明填表说明1.参加本研究的人员均需经过GCP培训,并充分阅读了解本试验方案及相关资料,严格按方案执行,并如实填写。
2.已入选的受试者,不论是否剔除或淘汰,都需要填写病例报告表。
3.填写务必认真.准确.清晰.如实,不能随意涂改,如填写确有错误,修改时不能涂黑或使用涂改液,应将填写错误的数据用横线居中划出,在旁边写上正确的数据,并由临床试验负责医师在修改处签名.注明日期。
例如:10 20 刘明请在各选择项□内划“×”,在|_|填写相应的数字,所有栏目内应填写,在____填写文字。
选用钢笔或签字笔用力填写表格,以便第三份亦能看清。
为防止复写至一下页,请在填写时用垫板衬在下一页前。
5.患者姓名拼音缩写需填满四格,两字姓名分填两字前两个字母,三字姓名填前两字首字母与第三字青山6.所有检查项目因故未查或漏查请填写ND,具体用药剂量和时间不明请填写NK。
7.严格观察和如实填写不良事件记录表。
记录不良事件的发生时间.严重程度.持续时间.采取的措施和转归。
临床研究过程中发生的任何严重不良事件,必须立即报告协办单位.临床研究负责单位主要研究者和伦理委员会。
严重不良事件报告单位报告单位联系人联系电话XX医院伦理委员会XXXX国家食品药品监督管理局注册司-0/32/42/20筛选期签署知情同意书知情同意书签署日期:20|__|__|年|__|__|月|__|__|日访视日期:20|__|__|年|__|__|月|__|__|日人口学资料肿瘤诊断肿瘤手术史是否有肿瘤手术史□是□否化疗史是否有化疗史(包括新辅助治疗和辅助治疗)□是□否①:1=阿霉素;2=表阿霉素;3=异环磷酰胺;4=达卡巴嗪5=美司钠;6=恩度;9=其它*:若因疾病进展而换药,需记录进展影像学依据;若不耐受,需记录发生的不良反应和严重程度。
XXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXX临床研究病例报告表(X日用药)受试者姓名缩写□□□□药物编号:□□□试验中心编号:□试验开始日期年月日填表说明1.请用签字笔填写,字迹应清晰,易于辨认。
2.受试者姓名按汉语拼音首字母缩写靠左对齐填写。
3.在所有选择项目中,请在相应的方框中划“×”;疼痛强度(PI)和疼痛缓解度等数字表示项目请在选择的相应数字上画圈“○”。
4.每项填写内容务必准确,不得随便涂改,如发现填写内容有误,应在原记录上划单横线,在旁边写明正确内容,并注名修改者及日期。
不要用任何方式(橡皮、涂改液等)涂抹原记录。
5.不要改变病例报告表的格式,如发现表中没有位置填写记录者希望记录的资料时,请将有关信息记录于后面的空白附页中,并保留以上记录副本。
6.知情同意书一般为患者签名。
如患者有特殊情况,可由患者法定代理人签名。
试验观察流程图入组筛选表1.受试者应为:♦年龄:18 -70岁癌症患者(一般情况尚好,可适当放宽)♦性别不限♦预计生存期2个月以上的住院患者♦疼痛强度为中到重度,评分≥4♦并符合一下条件之一(请在符合的项目上画圈)1)入选前1周内曾使用XX,日剂量为40-60mg,疼痛强度可缓解到≤2;2)入选前1周内曾使用其它镇痛药,其全日剂量相当于40-60mgXX剂量,疼痛强度可缓解到≤2♦非放疗期或疼痛部位为非照射部位♦间歇期的化疗者,应由主管医生确认化疗后无止痛作用♦该患者是否同意参加本试验,并已签署知情同意书如以上任何一个答案为“否”,此受试者不能参加2.受试者排除标准:♦本研究开始前4周内曾参加过其他临床试验♦正在服用或本试验开始前2周内曾服用MAO抑制剂者(如优降宁、苯乙肼等)♦24小时内用过XX类镇痛药,或5日内用过XXX♦癌痛骨转移患者,近4周内接受同位素内放疗或/和双磷酸盐类药物治疗♦呼吸抑制、(肺)气道阻塞或组织缺氧♦胆道疾病♦心脏疾患(即Ⅱ级和Ⅱ级以上心功能)♦血压高于正常值♦血液系统疾病♦肝、肾功能明显异常(即指标高于正常值一倍以上)♦脑部疾病,判定能力异常♦XX药耐受、过敏,或曾在使用时因不良反应停药♦药物及∕或酒精滥用♦孕妇或哺乳期妇女如以上任何一个答案为“是”,此受试者不能参加结论:该患者是否符合上述要求,同意入组是□□□□□□□□是□□□□□□□□□□□□□□□否□□□□□□□□否□□□□□□□□□□□□□□□医生签名:______日期____年___月___日病历简况1.1检查日期:年月日.2受试者病历号:2.1出生日期:年月.2性别:□1.男□2.女.3临床诊断:分期1. T□ 2. N□ 3. M□.4现接受的抗癌治疗:□1.放疗间歇期□2.化疗间歇期□3.中医药□4.手术□5.无□6.其他(请注明).50疼痛强度 : □1.轻(评分 ) □2.中(评分 ) □3.重(评分 ) .51疼痛性质: □1.急性疼痛□2.慢性持续性疼痛□3.间歇性(规律或无规律) □4.持续性痛伴一过性加剧□5.其他.52疼痛主要部位:□1.头面部□2.颈部□3.四肢□4.胸背部□5.腹部□6.骨关节□7.会阴□8.其他(请注明).53疼痛能否自行缓解:□1.能□2.有时能□3.不能.60入选前接受的镇痛治疗:□1.无□2. 吗啡、度冷丁、二氢埃托啡、美散痛、芬太尼等普通制剂□3. 缓控释吗啡、多瑞吉□4. 自控泵□5. 可待因及其复方制剂□6. 曲马多□7. 解热镇痛药□8. 其他如有,请回答:.61药品名称用药剂量:.62用药方式:□1.口服□2.静注□3.肌注□4.其他.63用药时间:□1.近四周内□2.近三天□3.其他3.0既往史.1药物过敏史□1.无□2.有 .2脑部疾患□1.无□2.有.3心脏疾患□1.无□2.有 .4哮喘□1.无□2.有.5胆道疾患□1.无□2.有 .6习惯性便秘□1.无□2.有.7肾脏疾患□1.无□2.有 .8糖尿病□1.无□2.有如有,请描述:1.2.4.0体格检查.1 1.T ._℃ 2.P 次/分 3.R 次/分4.SBP mmHg5.DBP mmHg6.身高 cm7.体重 Kg .2皮肤粘膜□ 1.无□2.苍白□3.黄染□4.紫绀□5.皮疹.3浅表淋巴结□ 1. 无肿大□2.有肿大.4双侧瞳孔□ 1.等大等圆□2.不等大□3.不等圆.50呼吸节律 .51肺部罗音□1.规则□2.不规则□1.无□2.有.60心律 .61心脏各瓣膜区杂音□1.齐□2.不齐□1.无□2.有.70腹部 .71腹部压痛□1.软□2.硬□1.无□2.有.72腹部包块 .73 移动性浊音□1.无□2.有. □1.无□2.有.74肝区叩痛 .75肝脏肿大□1.无□2.有□1.无□2.有.76脾脏肿大 .77肾区叩痛□1.无□2.有□1.无□2.有.80生理反射□1.存在□2.部分存在□3.不存在.81病理反射□1.未引出□2.有引出5.入组前可能与镇痛药物有关的基础症状(如果患者出现没有标识的症状,请自行填写文字)给药前生活质量记录表入组时实验室检查心电图检查医生签名:______日期____年___月___日入组时检验报告粘贴单用药情况记录表镇痛效果记录表说明1.0度:未缓解(疼痛未减轻);1度:轻度缓解(疼痛减轻约1/4);2度:中度缓解(疼痛减轻约1/2);3度:明显缓解(疼痛减轻约3/4以上);4度:完全缓解(疼痛消失)。
编号:□□□□患者姓名拼音缩写:□□□□病例报告表(Case Report Form,CRF)患者姓名拼音缩写:□□□□试验编号:□□□□医院名称:研究者签名:申办单位:病例报告表填写要求1、所有记入本手册的数据需对照原始资料进行核查2、用签字笔填写,中文字应清晰可辨,英文字母需大写3、每格填写一个字,不适用的空格,请填“/”4、选择项请打“√”5、填写错误修改时,用单线划掉,切毋涂抹,原字迹需清晰可辨,并签名和注明修改时间6、患者的姓名不得出现在本病例报告表中,患者姓名拼音缩写四格需填满,两字姓名填写两字拼音前两个字母,三字姓名填写三字首字母及第三字二字母,四字姓名填写每一个字的首子母。
举例:张红ZHHO,张红旗 ZHQI 欧阳予黄 OYYH。
7、日期填写为:□□□□年□□月□□日。
一、入选标准:1、年龄18~65岁,性别不限;□是□否2、创面面积小于体表面积的50%;□是□否3、签署知情同意书;□是□否如以上任何答案为“否”,则该病人不能入选二、排除标准:1、年龄小于18岁或大于65岁;□是□否2、有严重心、脑、肝、肾功能不全的患者;□是□否3、严重营养不良的患者;□是□否4、创面面积大于体表面积50%的患者;□是□否5、有精神疾病的患者以及无自知力、不能确切表达者。
□是□否如以上任何答案为“是”,则该病人不能入选观察医师签名:日期年月日受试者一般资料姓名:□□□□性别:男□女□年龄:□□岁出生日期:□□□□年□□月□□日体重:□□□㎏病例号:□□□□□□创面资料:创面原因:□火焰□热液□化学□电烧伤□其他创面形成时间:□□月□□日创面部位:创面面积:□□□□cm2肉芽:无□有□观察医师签名:日期年月日用药后两组病例观察:1、试验组的创面三周内愈合者,观察至创面愈合日;试验组的创面愈合期大于三周,观察至第三周。
2、肉芽组织色鲜红、较湿润,触之易出血为生长良好,记为A,如无肉芽生长记为C,两者之间为B。
受试者编号:□□□□版本号:02OSAS矫治器(舌背牵拉型)及附件(规格型号OSA-I)病例报告表临床试验申请单位:****联系人:临床试验执行单位:****主要研究者:受试者编号:住院号:诊断:术式:研究开始时间:研究完成时间:【实用】医疗器械临床试验文件病例报告表填写说明1、本试验研究者必须经过GCP培训,事先充分了解本试验方案及有关资料,严格按方案执行,不得随意更改。
2、筛选合格者用签字笔填写正式病例报告表,病例报告表填写务必准确、清晰,不得随意涂改,错误之处纠正时需用横线居中划出,并签署修改者姓名及修改时间。
不要掩盖填入的原始数据,不允许用橡皮擦、修正液或划刮去原填写内容。
3、表中凡有“□”的项,请在符合的条目上划“√”。
4、病例填写务必填满,不能有空格。
5、对已入选参加本试验的病例,不论是否剔除或淘汰,都需填写病例报告表。
6、如果试验医生在试验过程中有任何问题,请与申办单位监查员联系,监查员为:徐华苹。
7、如发生严重不良事件,研究者必须在24小时内报告药品监督管理部门,同时应立即报告申办单位的紧急联系人以及试验负责单位伦理委员会,并填写严重不良事件表。
8、本病例原始记录表交组长单位,副本交公司留档。
9、试验流程:①.获取知情同意;②.入选及排除标准;③.分发器械,临床试验观察;④.剔除标准;⑤.不良事件、随访及记录。
受试者编号:□□□□入选标准及排除标准1.入选标准年龄在18~70岁,男女不限;是□否□②.确诊为鼾症或阻塞性睡眠呼吸暂停低通气综合征(OSAS)患者;是□否□③.是□否□CPAP使用不耐受或不愿意使用CPAP治疗④.经专科检查评估适合接受舌背牵拉手术;是□否□⑤.BMI<32,AHI<60是□否□⑥.病人同意参加本试验,并签署知情同意书,术前谈话同意参与临床试验,并在病历上签字确认;愿意且能够按照方案的要求及时复诊。
是□否□2.排除标准①.局部或全身急性炎症或过敏性疾病,不适合使用本器械者;是□否□②.患不适合舌背牵拉术的各种疾病(如严重心肺肝肾功能不全,严重高血压或糖尿病未有效控制者);是□否□③.有其他明显的可能会影响到疗效评价的其他疾病者(如严重自身免疫性疾病、神经肌肉疾病、恶性肿瘤、颌面解剖异常及凝血功能异常者);是□否□④.入选前4周内曾参加过其他的临床试验者;是□否□⑤.未填写知情同意书及不能够准确叙述病情者;是□否□⑥.各种精神疾病及存在心理障碍疾病者。
受试者编号:□□□□XXXXXXXXXXX(此处输入课题名称)XXXXXXXXXXX病例报告表(Case Report Form)受试者姓名缩写:□□□□研究医师:所在科室:研究单位:研究开始日期:年月日研究结束日期:年月日填表说明在正式填表前,请认真阅读下列填表说明1.筛选合格者填写正式病例报告表。
2.病例报告表应用签字笔填写。
3病例填写务必准确、清晰,不得随意涂改,错误之处纠正时需用横线居中划出,并签署修改者姓名缩写及修改时间。
举例:LGW05-02-12。
4.患者姓名拼音缩写四格需填满,两字姓名填写两字拼音前两个字母;三字姓名填写三字首字母及第三字第二字母;四字姓名填写每一个字的首字母。
举例:张红5.所有选择项目的□内用√标注。
如:√。
表格中所有栏目均应填写相应的文字或数字,不得留空。
6.因故未查或漏查,请填写“ND”;具体用药剂量和时间不明,请填写“NK”;不适用请选“NA”。
7.期间应如实填写不良事件记录表。
记录不良事件的发生时间、严重程度、持续时间、采取的措施和转归。
如有严重不良事件发生(包括临床研究过程中发生需住院治疗、延长住院时间、伤残、影响工作能力、危及生命或死亡、导致先天畸形等事件),必须立即通知主要研究者及其单位伦理委员会。
临床研究流程表研究医师(签名):日期:20□□年□□月□□日基线情况研究医师(签名):日期:20□□年□□月□□日研究医师(签名):日期:20□□年□□月□□日开始禁食时间:□□□□年□□月□□日□□时□□分第一阶段记录□□□□年□□月□□日供试制剂:受试品T :□ 参比品R : □生命体征Vital Signs临床观察记录Clinical Observation研究医师(签名):日期:20□□年□□月□□日开始禁食时间:□□□□年□□月□□日□□时□□分第二阶段记录□□□□年□□月□□日供试制剂:受试品T :□ 参比品R : □生命体征Vital Signs临床观察记录Clinical Observation研究医师(签名):日期:20□□年□□月□□日合并用药(CONCOMITANT MEDICATION)□无□有如有请填写下表注:*如研究结束后继续用药,请在□内划√研究医师(签名):日期:20□□年□□月□□日不良事件记录表*严重程度: 轻度(不处理,不停药),中度(停药,不处理),重度(停药,对症处理)。
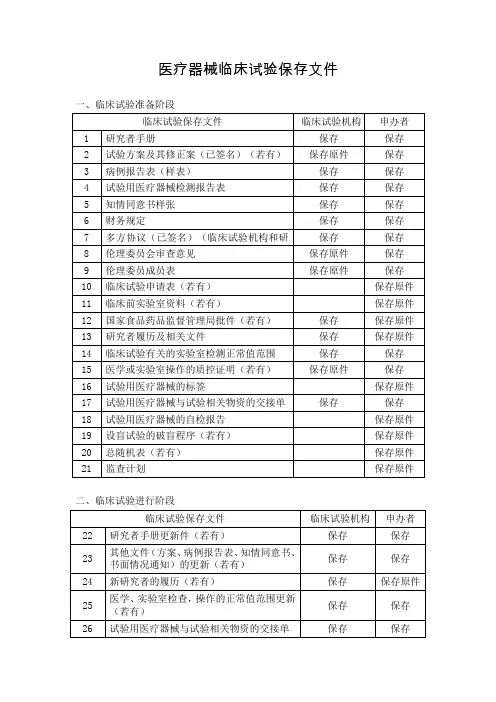
医疗器械临床试验病例报告表设计规范1 目的:规范医疗器械临床试验病例报告表的设计。
2 范围:适用于本机构所有医疗器械临床试验病例报告表的设计。
3 规范:3.1 病例报告表(case report form, CRF)是按医疗器械临床试验方案规定所设计的一种文件,是用以记录每例受试者在临床试验过程中主要临床资料的表格,是研究者记录试验数据的重要载体。
每项医疗器械临床试验开始前均应预先按医疗器械临床试验方案设计CRF。
设计科学的CRF是保证正确、完整、及时、合法记录试验数据的关键。
CRF符合“科学性”和“易操作性”,并便于使用(填写、监查、稽查)。
设计时应考虑以下内容:①临床试验流程;②研究人员的填写;③数据录入和分析;④监查员的审核。
CRF应能收集试验方案要求的用于评价安全性和有效性资料的数据。
不应收集与试验方案无关和/或研究无关的数据。
凡发现有遗漏或多余的数据应注明理由。
为保护受试者的隐私,设计病例报告表时应规定受试者姓名的填写方法,不应填写受试者全名,仅填写名字的拼音首写字母。
应有每次随访结束后最后审核页上研究者签名和签署日期的位置。
3.2 CRF 的格式与内容CRF的格式与内容因医疗器械临床试验类别和目标适应症的不同而异,但其基本要求相似。
3.2.1 封页:①标题(包含试验医疗器械通用名、研究类型等);②页眉:版本号及日期。
3.2.2 填表注意事项。
3.2.3 试验流程表。
3.2.4 受试者一般资料,含受试者联系方式。
3.2.5 受试者入选标准,是否符合纳入标准及不符合任一条排除标准。
3.2.6 各次临床及实验室检查访视表。
3.2.7 各次医疗器械发放及回收记录,包括已发放器械标签粘贴处。
3.2.8 不良事件观察表。
3.2.9 严重不良事件报告表。
3.2.10 疗效及不良反应判断总表。
3.2.11 主要研究者声明、申办单位监查员声明。
3.2.12 附页附加说明前述表格中未能记录的内容。
3.2.13 检查单及其它检查复印件或原件粘贴页。
病例报告表(Case Report Form)受试者姓名:家庭地址:联系电话:试验中心名称:申办单位:延吉喜来健医疗器械有限公司在正式填表前请认真阅读下列填表说明病例报告表填写说明:1.筛选合格者填写病例报告表。
2.病例报告表填写务必准确、清晰,不得任意涂改,错误之处纠正时需用横线居中化出,并签署修改者姓名缩写及修改时间。
3.填写记录一律用钢笔或碳素签字笔。
4.患者姓名拼音缩写四个需填满,两字姓名填写两字拼音前两个字母;三字姓名填写三字首字母及第三字第二字母;四字姓名填写每个字的首字母。
5.表中凡有“□”的项,请在符合的条目上划“√”。
表格中所有栏目均应填写相应的文字或数字,不得留空。
6.所有检验项目因故未查或漏查,请填写ND;具体合并用药剂量和时间不明,请先写NK。
7.试验期间应如实填写合并用药记录表、不良事件记录表。
记录不良事件的发生时间、严重程度、持续时间、采取的措施和转归。
如有严重不良事件发生(包括临床验证过程中发生需住院治疗、延长住院时间、伤残、影响工作能力危及生命或死亡、导致先天畸形等事件),必须立即通知主要研究单位伦理委员会及申办单位。
8.临床试验应严格按照临床试验方案要求进行。
试验不同时期需完成的检查和需记录的项目,请对照临床流程图执行。
受试者知情同意书敬爱的患者:我们现在正在进行一项临床研究,该项临床研究是经吉林省药品监督管理局备案的,研究的目的是评价物理治疗的高科技产品----温热电位治疗仪的疗效和安全性。
温热磁疗仪是XXX医疗器械有限公司根据韩国专利技术研制生产的医疗器械,本治疗仪是通过XXXXXXXXXXXXXXXXXXXXXXXXXXXXXX机理,主要用于XXXXXXXXXXXXX治疗。
具有平衡机体阴阳,增强脏腑机能,促进新陈代谢,调节植物神经,改善心脑血管血液供应,促进血液循环,调节血管张力,降低血液粘稠度,防治动脉粥样硬化,促进组织的再生修复功能,增强机体免疫功能及消炎止痛等作用。
(完整)医疗器械临床试验病例报告表
编辑整理:
尊敬的读者朋友们:
这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((完整)医疗器械临床试验病例报告表)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(完整)医疗器械临床试验病例报告表的全部内容。
编号:□□□□
患者姓名拼音缩写:□□□□
产品名称*****(商品名:***)
的安全性和有效性研究
病例报告表
(Case Report Form,CRF)
患者姓名拼音缩写:□□□□
试验编号:□□□□
医院名称:
研究者签名:
申办单位:上海******有限公司
病例报告表填写要求
1、所有记入本手册的数据需对照原始资料进行核查
2、用签字笔填写,中文字应清晰可辨,英文字母需大写
3、每格填写一个字,不适用的空格,请填“/"
4、选择项请打“√"
5、填写错误修改时,用单线划掉,切毋涂抹,原字迹需清晰可辨,并签名和注明修改时间
6、患者的姓名不得出现在本病例报告表中,患者姓名拼音缩写四格需填满,两字姓名填写两字拼音前两个字母,三字姓名填写三字首字母及第三字二字母,四字姓名填写每一个字的首子母。
举例:张红ZHHO,张红旗ZHQI 欧阳予黄 OYYH.
7、日期填写为:□□□□年□□月□□日。
一、入选标准:
1、年龄18~65岁,性别不限;□是□否
2、创面面积小于体表面积的50%;□是□否
3、签署知情同意书; □是□否
如以上任何答案为“否”,则该病人不能入选
二、排除标准:
1、年龄小于18岁或大于65岁;□是□否
2、有严重心、脑、肝、肾功能不全的患者;□是□否
3、严重营养不良的患者;□是□否
4、创面面积大于体表面积50%的患者;□是□否
5、有精神疾病的患者以及无自知力、不能确切表达者。
□是□否
如以上任何答案为“是",则该病人不能入选
观察医师签名: 日期年月日
受试者一般资料
姓名:□□□□性别: 男□ 女□年龄:□□岁
出生日期:□□□□年□□月□□日
体重:□□□㎏病例号:□□□□□□
创面资料:
创面原因:□火焰□热液□化学□电烧伤□其他
创面形成时间:□□月□□日创面部位:
创面面积:□□□□cm2肉芽:无□ 有□
观察医师签名:日期年月日
1、试验组的创面三周内愈合者,观察至创面愈合日;试验组的创面愈合期大于三周,
观察至第三周。
2、肉芽组织色鲜红、较湿润,触之易出血为生长良好,记为A,如无肉芽生长记为C,
两者之间为B。
3、愈合面积应填入已愈合面积占创面的百分比。
*有不良事件请填写“不良事件表”
观察2组病例的创面肉芽生长情况,创面愈合程度,用药三周内创面愈合或缩小2/3以上且肉芽生长情况良好为显效;用药三周内创面缩小1/3以上为有效;用药三周创面缩小不到1/3为可疑有效;创面延迟愈合或无明显变化记为无效。
观察医师签名:日期年月日
创面细菌培养(必要时):
创面重要细菌:创面其它细菌:创面是否照相记录:□是□否
第一次照相:□□□□年□□月□□日;第二次照相:□□□□年□□月□□日观察医师签名:日期年月日
患者是否完成全程研究: □是□否
患者完成或退出研究日期:□□□□年□□月□□日
中止研究的原因:(限选一项)
□不良事件(填写非严重或严重不良事件报告表)
□缺乏疗效
□依从性差
□创面严重感染
□失访详述
□患者要求详述
□被申办者中止详述
□其他原因详述
观察医师签名:日期年月日
合并用药记录
观察医师签名: 日期年月日
观察医师签名:日期年月日
CRF审核声明
监查员年月日。