高三化学离子共存及综合推断题1(2019年10月)
- 格式:ppt
- 大小:425.50 KB
- 文档页数:17

离子共存离子的检验和推断1.含有下列各组离子的溶液中通入(或加入)过量的某种物质后仍能大量共存的是( )A.H+、Ba2+、Fe3+、NO-3,通入SO2气体B.Ca2+、Cl-、K+、H+,通入CO2气体C.AlO-2、Na+、Br-、SO2-4,通入CO2气体D.HCO-3、Na+、I-、HS-,加入AlCl3溶液2.下列离子能大量共存,且满足相应要求的是( )3.某无色溶液含有下列离子中的若干种:H+、NH+4、Fe3+、Ba2+、Al3+、CO2-3、Cl-、OH-、NO-3。
向该溶液中加入铝粉,只放出H2,则溶液中能大量存在的离子最多有( )A.3种B.4种C.5种D.6种4.下列各组离子在溶液中按括号内的物质的量之比混合,得到无色、碱性、澄清溶液的是( )A.Na+、Al3+、Cl-、OH-(5∶2∶4∶4)B.NH+4、Ba2+、OH-、Cl-(1∶1∶1∶2)C.Fe3+、Na+、Cl-、S2-(1∶2∶3∶1)D.K+、H+、I-、NO-3(1∶1∶1∶1)5.(2019·河南郑州质检)下列关于物质或离子检验的推断正确的是( ) A.向X溶液中滴加KSCN溶液,溶液显红色,证明X溶液中有Fe3+,无Fe2+B.用硝酸酸化Y溶液,无现象,再加入硝酸钡溶液,产生白色沉淀,则Y 溶液中含有SO2-4C.用玻璃棒蘸Z溶液在酒精灯上灼烧,火焰呈黄色,再透过蓝色钴玻璃观察火焰无紫色,则Z溶液中有Na+,无K+D.用盐酸酸化W溶液,无现象,再向其中滴加AgNO3溶液,产生白色沉淀,则W溶液中含有Cl-6.下列各组粒子在指定溶液中一定能大量共存的是( )A.中性透明溶液中:K+、SO2-4、NO-3、Fe3+B.在酸性KMnO4溶液中:SO2-4、Mg2+、NO-3、CH3CH2OHC.常温下由水电离出的c(H+)·c(OH-)=10-20的溶液中:Na+、NH+4、Cl-、SiO2-3D.离子的物质的量浓度相同的溶液中:CH3COO-、SO2-4、NH+4、Cu2+7.(2019·湖南株洲一模)下列各组微粒在指定溶液中能大量共存的是( ) A.pH=1的溶液中:CH3CH2OH、Cr2O2-7、K+、SO2-4B.c(Ca2+)=0.1 mol·L-1的溶液中:NH+4、C2O2-4、Cl-、Br-C.加入铝粉放出大量H2的溶液中:Fe2+、Na+、Cl-、NO-3D.含大量HCO-3的溶液中:C6H5O-、CO2-3、Br-、K+8.(2019·安徽阜阳二模)下列各组离子在相应的条件下一定能大量共存的是( )A.在碱性溶液中:CO2-3、K+、S2-、Na+B.与铝粉反应放出氢气的无色溶液中:NO-3、Mg2+、Na+、SO2-4C.使pH试纸变红的溶液中:NH+4、AlO-2、Cl-、K+D.在中性溶液中:K+、Cl-、Al3+、NO-39.25 ℃时,下列各组离子在指定溶液中一定能大量共存的是( )A.pH=1的无色溶液中:Na+、Cu2+、Cl-、CO2-3B.使酚酞呈红色的溶液中:K+、Na+、NO-3、Cl-C.0.1 mol·L-1的FeCl2溶液中:H+、Al3+、SO2-4、S2-D.由水电离出的c(H+)=1×10-10 mol·L-1的溶液中:Mg2+、NH+4、SO2-4、HCO-310.下列分子或离子在指定的分散系中能大量共存的一组是( )A.硝酸钠溶液:H+、Fe3+、SO2-4、CH3COOHB.烧碱溶液:K+、HSO-3、NO-3、NH3·H2OC.空气:HCl、CO2、SO2、NOD.氢氧化铁胶体:H+、K+、S2-、Br-11.下列有关离子检验的叙述正确的是( )12.某100 mL溶液可能含有Na+、NH+4、Fe3+、CO2-3、SO2-4、Cl-中的若干种,取该溶液进行连续实验,实验过程如下图:(所加试剂均过量,气体全部逸出)100 mL 溶液BaCl2溶液过滤⎪⎪⎪⎪⎪→沉淀14.30 g――→盐酸沉淀22.33 g→滤液――→NaOH溶液气体0.672 L(标准状况)下列说法不正确的是( )A.原溶液一定存在CO2-3和SO2-4,一定不存在Fe3+B.是否存在Na+只有通过焰色反应才能确定C.原溶液一定存在Na+,可能存在Cl-D.若原溶液中不存在Cl-,则c(Na+)=0.1 mol·L-1。

高三化学离子共存试题答案及解析1.下列离子或分子在溶液中能大量共存,通后仍能大量共存的一组是A.B.C.D.K+、Ag+、NH3*H2O、NO3-【答案】C【解析】A、四种离子不能大量共存,因为溶液中含有氯气、亚铁离子,酸性条件下,氯气与亚铁离子发生氧化还原反应,不能大量共存,错误;B、通入二氧化碳后,硅酸根离子与二氧化碳反应生成硅酸沉淀,不能大量共存,错误;C、四种离子都不反应,且通入二氧化碳后也不反应,可以大量共存,正确;D、一水合氨与银离子生成银氨离子不能大量共存,错误,答案选C。
【考点】考查给定条件的离子大量共存2.在c(H+)∶c(OH-)=1∶2的水溶液中能大量共存的离子组是 ( )A.K+、Al3+、HCO3—、SO42-B.Ca2+、NH4+、CO32-、Cl-C.Na+、K+、NO3-、ClO-D.Na+、Fe2+、I-、SO32-【答案】C【解析】c(H+)∶c(OH-)=1∶2,c(H+)<c(OH-),说明该溶液呈碱性。
A、碱性溶液中Al3+、HCO3—不能大量共存,错误;B、碱性溶液中,铵根离子不能大量共存,错误;C、碱性溶液中,四种离子都不反应,可以大量共存,正确;D、碱性溶液中亚铁离子不能大量共存,错误,答案选C。
【考点】考查给定条件的离子大量共存的判断3.下列各组离子在相应的条件下一定能大量共存的是A.在碱性溶液中:HCO3-、K+、C1-、Na+B.与铝粉反应放出氢气的无色溶液中:NO3-、K+、Na+、SO42-C.在c(H+)/c(OH-)==1×1013的溶液中:NH4+、Br-、C1-、K+D.通有SO2的溶液中: Ca2+、C1-、NO3-、A13+【答案】C【解析】HCO3-为弱酸的酸式盐,在碱和酸中都不存在,A错误;一定能大量共存指各种情况都符合,与铝粉反应放出氢气的无色溶液中,若为酸环境,则一定没有NO3-,B错误;在c(H+)/c(OH-)==1×1013的溶液是酸性条件,它们都共存,C正确;通有SO2的溶液显酸性,再有NO3-,具有氧化性,会将+4价的硫氧化,D错误。

质对市爱慕阳光实验学校高三第一轮复习离子共存推断专题1.〔10分〕某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32-、SO42-,现取该溶液进行有关,结果如以下图所示:试答复以下问题:〔1〕沉淀甲是:___________________________,〔2〕沉淀乙是:_________________,由溶液甲生成沉淀乙的离子方程式为:_____________ ___.〔3〕沉淀丙是:__________________.〔4〕气体甲成分可能有哪几种?〔可以不填满也可以补充〕〔5〕综合上述信息,可以肯存在的离子:____ ___________.2.在含有Na+、Mg2+、HCO3—、SO42—的稀溶液中,它们的物质的量之比为2:1:2:1。
〔1〕向该溶液中滴加酚酞试液数滴,溶液呈淡粉,有关反的离子方程式为_____________________。
〔2〕充分加热〔1〕步所得的溶液,加热的过程中观察到的现象有___________;完全反后,溶液呈___________色,有关反的离子方程式为_______________________。
3.有A、B、C、D、E、F、G 7瓶不同物质的溶液,它们各是Na2CO3、Na2SO4、KCl、AgNO3、MgCl2、Ca(NO3)2和Ba (OH )2溶液中的一种。
为了鉴别,各取少量溶液进行两两混合,结果如表所示。
表中“↓〞表示生成沉淀或微溶化合物,“—〞表示观察不到明显变化。
试答复下面问题:〔1〕A的化学式是,G的化学式是。
判断理由是。
〔2〕写出其余几种物质的化学式。
B C D E F 。
4.A、B、C、D是四种可溶的化合物,分别由阳离子K+、Ba2+、Al3+、Fe3+和阴离子OHˉ、-23CO、-3NO、-24SO两两组合而成,它们的溶液发生如下反:A与B反生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失。

高中离子共存试题及答案一、选择题1. 在下列离子中,哪些离子在酸性溶液中不能大量共存?A. Na^+、Cl^-、HCO_3^-B. K^+、SO_4^2-、OH^-C. Mg^2+、NH_4^+、Cl^-D. Ca^2+、NO_3^-、HSO_3^-答案:A2. 以下哪种离子组合在碱性溶液中可以大量共存?A. Al^3+、SO_4^2-、OH^-B. NH_4^+、Cl^-、OH^-C. K^+、NO_3^-、HCO_3^-D. Mg^2+、Cl^-、OH^-答案:C二、填空题1. 在含有大量Fe^3+的溶液中,以下哪些离子不能大量共存?______ 答案:Fe^3+与SCN^-、CO_3^2-、PO_4^3-等不能大量共存。
2. 写出在pH=4的溶液中,以下离子可以大量共存的组合:______答案:H^+、Cl^-、SO_4^2-、K^+三、简答题1. 为什么在酸性溶液中,HCO_3^-离子不能大量共存?答案:在酸性溶液中,HCO_3^-会与H^+发生反应生成CO_2和H_2O,因此不能大量共存。
2. 为什么在碱性溶液中,Al^3+离子不能大量共存?答案:在碱性溶液中,Al^3+会与OH^-发生反应生成Al(OH)_3沉淀,因此不能大量共存。
四、实验题1. 通过实验验证,在含有大量Cu^2+的溶液中,哪些离子不能大量共存,并说明原因。
答案:在含有大量Cu^2+的溶液中,Cl^-、SO_4^2-、OH^-等离子不能大量共存。
因为Cu^2+与Cl^-可以形成CuCl_2沉淀,与SO_4^2-可以形成CuSO_4沉淀,与OH^-可以形成Cu(OH)_2沉淀。
2. 设计一个实验来证明在中性溶液中,Ca^2+离子与CO_3^2-离子不能大量共存。
答案:在中性溶液中,加入Ca^2+溶液和CO_3^2-溶液,观察到生成白色沉淀CaCO_3,说明Ca^2+与CO_3^2-不能大量共存。


高考化学复习离子共存、离子检验和推断1.在强酸性溶液中能大量共存的无色透明离子组是( )A.K+、Na+、NO-3、MnO-4B.Mg2+、Na+、Cl-、SO2-4C.K+、Na+、Br-、Cu2+D.Na+、Ba2+、OH-、SO2-4解析:A选项中的MnO-4在水溶液中显紫色;C选项中的Cu2+在水溶液中显蓝色;D选项中会发生离子反应Ba2++SO2-4===BaSO4↓和H++OH-===H2O。
答案:B2.下列离子或分子在溶液中能大量共存,通入CO2后仍能大量共存的一组是( ) A.K+、Ca2+、Cl-、NO-3B.K+、Na+、Br-、SiO2-3C.H+、Fe2+、SO2-4、Cl2D.K+、Ag+、NH3·H2O、NO-3解析:A项中离子能大量共存,通入CO2后,溶液呈酸性,不会生成CaCO3沉淀,各离子仍能大量共存,A项正确;B项中通入CO2后SiO2-3因转化为H2SiO3沉淀而不能大量存在;C 项中Fe2+与Cl2发生氧化还原反应不能大量共存;D项中Ag+与NH3·H2O因能生成银氨配离子而不能大量共存。
答案:A3.常温下,下列各组离子一定能在指定溶液中大量共存的是( )A.使酚酞变红色的溶液中:Na+、Al3+、SO2-4、Cl-B.K wc(H+)=1×10-13mol·L-1的溶液中:NH+4、Ca2+、Cl-、NO-3C.与Al反应能放出H2的溶液中:Fe2+、K+、NO-3、SO2-4D.水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO-2、CO2-3解析:使酚酞变红色的溶液呈碱性,Al3+不能大量存在,A不符合题意;K wc(H+)=1×10-13mol·L-1的溶液呈强酸性,四种离子能大量共存,B符合题意;与Al反应能放出H2的溶液可能呈强酸性也可能呈强碱性,酸性条件下NO-3氧化Fe2+生成Fe3+,碱性条件下,Fe2+不能存在,C项不符合题意;水电离的c(H+)=1×10-13mol·L-1的溶液可能呈强酸性也可能呈强碱性,酸性条件下,AlO-2、CO2-3都不能大量存在,D项不符合题意。

1.某溶液能溶解Al(OH)3,则此溶液中一定能大量共存的离子组是( ) A .Mg 2+、Cl -、Na +、NO 3- B .K +、Na +、NO 3-、HCO 3- C .Na +、Ba 2+、Cl -、NO 3-D .Fe 3+、Na +、AlO 2-、SO 42-【答案】C 【解析】试题分析:离子间如果发生化学反应,则不能大量共存,反之是可以的。
氢氧化铝是两性氢氧化物,既能溶于酸中,也能溶于强碱中。
因此该溶液可能显酸性,也可能显碱性。
如果显酸性,则HCO 3-、AlO 2-都不能大量共存;如果显碱性,则Mg 2+、HCO 3-、Fe 3+都不能大量共存,所以答案选C 。
2.在下列各组溶液中,离子一定能大量共存的是 ( ) A .强碱性溶液中:Na +、K +、SO 42-、AlO 2-B .含有0.1 mol ·L -1Fe 3+的溶液中:K +、Mg 2+、Cl -、I -C .无色透明溶液中:HCO 3-、Na +、Cl -、OH -D .与铝反应生成H 2的溶液中:Na +、Cu 2+、Cl -、SO 42-【答案】A 【解析】试题分析:A 、强碱性溶液存在大量的OH -,该组离子在碱性溶液中不反应,则一定能大量共存,故A 正确。
B 、因Fe 3+与I -能发生氧化还原反应,则一定不能大量共存,故B 错误。
C 、因HCO 3-、OH -能结合生成碳酸根离子和水,则一定不能大量共存,故C 错误。
D 、与铝反应生成H 2的溶液可能为酸或碱的溶液,若溶液为碱性,则OH -能与Cu 2+结合生成沉淀,则一定不能大量共存,故D 错误。
故选A .3.在无色透明溶液中,不能大量共存的离子组是 A .Cu 2+、Na +、SO 42-、Cl - B .K +、Na +、HCO 3-、NO 3- C .H +、CO 32-、Ca 2+、Na +D .Ba 2+、Na +、OH -、NO 3-【答案】C 【解析】试题分析:无色透明溶液,排除A 项,铜离子是蓝色;B 、D 项可以共存;C 项CO 32-与Ca 2+不能大量共存。

高中离子共存测试题及答案一、选择题1. 在酸性条件下,以下哪些离子可以共存?A. Fe^{2+}, Cl^-, SO_4^{2-}B. H^+, OH^-, Cl^-C. Fe^{2+}, NO_3^-, H^+D. Ca^{2+}, CO_3^{2-}, H^+2. 以下哪种离子在碱性条件下不能稳定存在?A. Na^+B. K^+C. Fe^{3+}D. Cl^-3. 在含有大量Cl^-的溶液中,以下哪种离子不能大量存在?A. Na^+B. K^+C. Ag^+D. Mg^{2+}二、填空题4. 当溶液中存在大量H^+时,______离子不能大量存在。
5. 在含有大量OH^-的溶液中,______离子不能大量存在。
三、简答题6. 试解释为什么在碱性条件下,Fe^{3+}不能稳定存在?7. 为什么在含有大量Cl^-的溶液中,Ag^+不能大量存在?四、计算题8. 某溶液的pH值为3,已知溶液中含有Fe^{2+}离子,求该溶液中Fe^{2+}离子的浓度。
答案一、选择题1. 答案:A解析:酸性条件下,Fe^{2+}, Cl^-, SO_4^{2-}可以共存,因为它们之间不发生反应。
2. 答案:C解析:在碱性条件下,Fe^{3+}会与OH^-反应生成沉淀,不能稳定存在。
3. 答案:C解析:Cl^-与Ag^+会形成AgCl沉淀,因此不能大量共存。
二、填空题4. 答案:OH^-解析:在酸性条件下,OH^-会与H^+反应生成水,不能大量存在。
5. 答案:H^+解析:在碱性条件下,H^+会与OH^-反应生成水,不能大量存在。
三、简答题6. 解答:在碱性条件下,Fe^{3+}与OH^-反应生成Fe(OH)_3沉淀,因此不能稳定存在。
7. 解答:在含有大量Cl^-的溶液中,Ag^+与Cl^-会形成AgCl沉淀,因此Ag^+不能大量存在。
四、计算题8. 解答:pH值为3,表示[H^+] = 10^{-3} M。
根据铁离子的平衡常数,可以计算出Fe^{2+}的浓度。
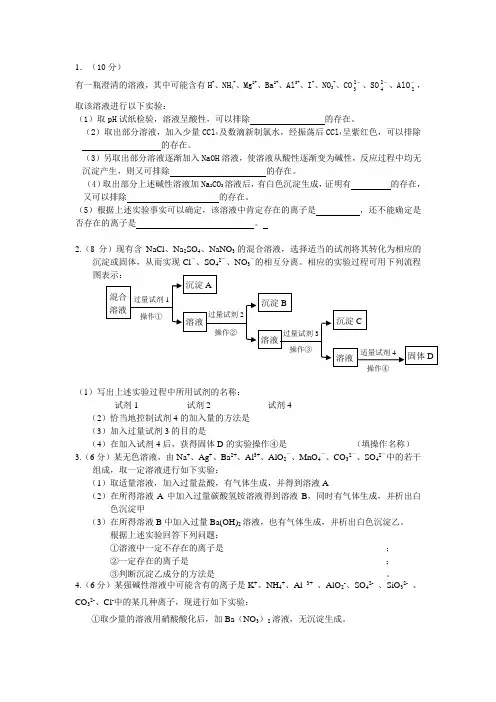
1.(10分)有一瓶澄清的溶液,其中可能含有H +、NH 4+、Mg 2+、Ba 2+、Al 3+、I -、NO 3-、CO -23、SO -24、AlO -2,取该溶液进行以下实验:(1)取pH 试纸检验,溶液呈酸性,可以排除 的存在。
(2)取出部分溶液,加入少量CCl 4及数滴新制氯水,经振荡后CCl 4呈紫红色,可以排除 的存在。
(3)另取出部分溶液逐渐加入NaOH 溶液,使溶液从酸性逐渐变为碱性,反应过程中均无沉淀产生,则又可排除 的存在。
(4)取出部分上述碱性溶液加Na 2CO 3溶液后,有白色沉淀生成,证明有 的存在,又可以排除 的存在。
(5)根据上述实验事实可以确定,该溶液中肯定存在的离子是 ,还不能确定是否存在的离子是 。
2.(8分)现有含NaCl 、Na 2SO 4、NaNO 3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl -、SO 42-、NO 3-的相互分离。
相应的实验过程可用下列流程图表示:(1)写出上述实验过程中所用试剂的名称:试剂1___________试剂2_____________试剂4________________(2)恰当地控制试剂4的加入量的方法是_________________________________(3)加入过量试剂3的目的是_______________________________(4)在加入试剂4后,获得固体D 的实验操作④是_______________(填操作名称)3.(6分)某无色溶液,由Na +、Ag +、Ba 2+、Al 3+、AlO 2—、MnO 4—、CO 32—、SO 42—中的若干组成,取一定溶液进行如下实验:(1)取适量溶液,加入过量盐酸,有气体生成,并得到溶液A(2)在所得溶液A 中加入过量碳酸氢铵溶液得到溶液B ,同时有气体生成,并析出白色沉淀甲(3)在所得溶液B 中加入过量Ba(OH)2溶液,也有气体生成,并析出白色沉淀乙。

高三化学离子共存试题1.无色透明的酸性溶液中,能大量共存的是A.Na+、K+、CO32-、NO3-B.K+、Fe2+、NH4+、NO3-C.NH4+、Al3+、SO42-、NO3-D.K+、Na+、NO3-、OH-【答案】C【解析】A、酸性溶液中,CO32-与H+反应生成二氧化碳和水,不能大量共存,错误;B、Fe2+为浅绿色,所以不符合题意,错误;C、酸性溶液中这四种离子都可以大量共存,正确;D、OH-与H+反应生成水,不能大量共存,错误,答案选C。
【考点】考查离子的大量共存的判断2.下列各组微粒能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是NH、Fe2+、SO 2NH+ 2NH+SO+Ba2++2OH-→ BaSO4↓+2NH3·H2OMg2+、HCO、Cl-Mg2++2HCO+4OH-→ Mg(OH)2↓+2CO+2H2OFe2+、NO、HSO HSO+H+→ SO2↑+H2OK+、NH3·H2O、CO2NH3·H2O+CO2→ 2NH+CO【答案】BD【解析】A、Fe2+先于NH与碱反应,错误;B、正确;C、酸性条件下NO把Fe2+、HSO氧化,错误;D、少量优先与氨水反应,正确。
【考点】考查STS中环境保护有关问题。
3.常温下,下列各组离子在指定溶液中一定能大量共存的是A.能溶解Al2O3的溶液:Na+、K+、HCO3-、NO3-B.0.1mol·L-1Ca(ClO)2溶液:K+、Na+、I-、Cl-C.能使甲基橙显红色的溶液:K+、Fe2+、Cl-、NO3-D.加入KSCN显红色的溶液:Na+、Mg2+、Cl-、SO42-【答案】D【解析】A、能溶解Al2O3的溶液既可能为强碱溶液,又可能为强酸溶液,强碱性条件下,OH-与HCO3-反应生成碳酸根和水;强酸性条件下,H+和HCO3-反应生成二氧化碳和水,不能大量共存,错误;B、0.1mol·L-1Ca(ClO)2溶液中,I-和ClO-发生氧化还原反应,不能大量共存,错误;C、能使甲基橙显红色的溶液呈酸性,酸性条件下H+、NO3-和Fe2+之间发生氧化还原反应,不能大量共存,错误;D、给定条件下,组内离子间不反应,能大量共存,正确。
高中化学离子共存、 离子的检验与推断练习题1.某混合溶液中所含离子的浓度如下表,则 M 离子可能为 ( )A.ClB . Ba 2++ 2+C .Na +D . Mg 2+解析:选 D 根据电荷守恒可知 M 带 2 个正电荷,由于 Ba 2+与 SO 42-不能大量共存,所以 M 是Mg 2+。
2.下列各组离子,能在溶液中大量共存的是 ( ) 3 + + - - + 2+ + -A .Al 3+、Na +、HCO 3-、OH -B . Na +、 Fe 2+、 H +、 NO 3-C .K +、 Fe 3+、SCN -、SO 23-D . Na +、 Ag +、H +、NO-3解析:选 D Al 3+、 HCO 3-、OH -相互之间会反应,不能大量共存, A 错误; Fe 2+、H +、 NO 3-能够发生氧化还原反应,不能大量共存, B 错误; Fe 3+、SCN -能够结合生成络合物, Fe 3 +、 SO 23-会发生氧化还原反应,不能大量共存, C 错误;该组离子之间不反应,能够大量共存,故 D 正确。
3.(2018·惠州三模 )下列有关 NaClO 和 NaCl 混合溶液的叙述正确的是 ( ) A .该溶液中, H +、NH 4+、SO 24-、I -可以大量共存 B .该溶液中, Ag +、K +、 NO 3-、NH 4+可以大量共存 C .该溶液中, Fe 2+、Fe 3+、Cl -、NO 3-可以大量共存D .向该溶液中加入浓盐酸,每产生 1 mol Cl 2,转移电子约为 6.02 ×10 23个解析:选 D A 项, ClO -和 H +结合成的 HClO 具有强氧化性,能把 I -氧化成 I 2,不能大 量共存; B 项, Ag +和 Cl -不能大量共存; C 项, ClO -具有强氧化性,能把 Fe 2+氧化成 Fe 3+, 不能大量共存; D 项,加入浓盐酸发生反应 ClO -+Cl -+2H +===Cl 2↑+H 2O ,因此每产生 1 mol Cl 2 ,转移 1 mol 电子。
高三化学离子共存复习试题(含答案和解释)高三化学离子共存复习试题(含答案和解释)高三化学离子共存复习试题 1、在碱性溶液中能大量共存且溶液为无色透明的离子组是 A.K+、MnO4-、Na+、Cl- B.K+、Ba2+、NO3-、Cl- C.Na+、HCO3-、NO3-、SO42- D.Fe3+、Na+、Cl -、SO42- 2、某无色溶液中只可能溶有NH4+、K+、Al3+、Mg2+、HCO3-、Cl-、I-、MnO4-、SO42-等离子中的几种离子。
为分析其组成,现进行如下实验:①取10mL该溶液于试管中滴加足量的Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲。
②取上述反应后的滤液,加入AgNO3溶液未见沉淀产生。
③另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加入NaOH的物质的量为0.03mol时,沉淀的量达到最大;继续滴加NaOH 溶液并加热,开始产生气体丙,收集气体丙,换算成标况下为0.224L(假设丙全部逸出),最后沉淀完全溶解。
则下列说法正确的是 A.仅由实验①可推出肯定含有SO42-,不含Cl- B.该无色溶液肯定含有NH4+、K+、Al3+、SO42- C.该无色溶液肯定不含K+、Mg2+、HCO3-、Cl-、MnO4-、I- D.不能确定该无色溶液是否含有K+ 3、下列说法正确的是 A.常温下,某溶液中由水电离出的c(H+)=1×10-amo1?L?C1,若a<7时,则该溶液可能为NaHSO4溶液B.常温下,中和同体积、同pH的硫酸、盐酸和醋酸所需相同浓度的NaOH溶液的体积关系:V(硫酸)>V(盐酸)=V(醋酸)C.25℃时,已知Ka(CH3COOH)=1.7×10-5mo1?L?C1、Ka(C6H5OH) =1.0×10-10mo1?L?C1、Ka1(H2CO3) = 4.2×10-7mo1?L?C1 、Ka2(H2CO3) =5.6×10-11mo1?L?C1pH相等的①CH3COONa②C6H5ONa ③NaHCO3溶液中,c(Na+)大小关系:②<③<① D.常温下,向饱和Na2CO3溶液中加入少量BaSO4粉末,过滤,向洗净的沉淀中加入稀盐酸有气泡产生,说明常温下Ksp(BaSO4)>Ksp (BaCO3) 4、某溶液中存在大量的H+、Clˉ、Fe3+,该溶液中还可能大量存在的离子是 A.OHˉ B.Ag+ C.CO D.SO 5、能在无色溶液中大量共存的一组离子是 A.Cu2+、SO42―、OH―、K+B.Fe3+、Cl―、NO3―、H+ C.K+、CO32―、Cl―、H+ D.H+、Na+、Cl―、SO42― 6、常温下,下列各组离子在指定溶液中可能大量共存的是: A.滴入甲基橙显红色的溶液中: Na+、NO3ˉ、Fe2+、SO32ˉ B.水电离出的 c ( H+) = 10ˉ12 mol/L 的溶液中:K+、AlO2ˉ、CH3COOˉ、Clˉ C.=10ˉ12的溶液中: K+、ClOˉ、S2ˉ、Clˉ D.c ( Fe 3+ ) =" 0" .1 mol/L 的溶液中:K+、Clˉ、SO42ˉ、SCNˉ 7、下列液体均处于25℃,有关叙述正确的是 A.某物质的溶液pH <7,则该物质一定是酸或强酸弱碱盐 B.用广泛pH试纸测得0.10 mol?L-1 NH4Cl溶液的pH=5. 2 C.pH=2的CH3COOH中c(H+)是pH=1的CH3COOH中c(H+)的2倍D.AgCl在相同物质的量浓度的CaCl2和HCl溶液中的Ksp相同8、在水溶液中能大量共存的一组离子是 A.Na+、Ba2+、Cl―、NO3― B.Pb2+、Hg2+、S2―、SO42― C.NH4+、H+、S2O32―、PO43― D.Ca2+、Al3+、Br―、CO32― 9、(10分)近年来,我国储氢纳米碳管研究获重大进展,电弧法合成的碳纳米管,常伴有大量物质――碳纳米颗粒。
2019年离子共存高考题命题人:李应有一、选择题1.下列溶液中,有关离子一定能大量共存的是()A.能使石蕊呈蓝色的溶液中:Na+、I-、Cl-、NO3-B.能使甲基橙呈黄色的溶液中:K+ SO32-- SO42— ClO—C.能使pH试纸变红色的溶液中:Mg2+ Fe3+ NO3- [Ag(NH3)]2+D.能跟金属铝反应生成氢气的溶液中:NH4+ Al3+Cl— SO42—2.某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的离子组是( )A.K+ Na+ HCO3 -- NO3- B.Na+ SO42—Cl—ClO—C.H+ Mg2+ SO42— NO3- D.Ag+ K+ Na+ NO3-3.下列的各组离子在酸性溶液中能大量共存的是()A.Na+ Fe2+ NO3- SCN— B.Ca2+ K + Cl-- NO3-C.Al3+ K+ OH—NO3— D.Na+ Ca2+ SiO32- Cl-4..某河道两旁有甲乙两工厂,它们排放的工业废水中共含有K+、Ag+、Fe3+、Cl―、OH―、NO3―六种离子,甲乙两工厂排放的废水中均含其中的三种,不重复。
已知甲厂的废水呈现明显的酸性、甲厂排放的废水中含有的三种离子是()A.Ag+、Fe3+、NO3― B.Ag+、Fe3+、K+C.Fe3+、Cl―、NO3― D. Fe3+、NO3―、K+5.在某无色透明的酸性溶液中,能大量共存的离子组是()A.Na+ k+ SO42- HCO3-- B.Cu2+ K+ NO3- SO42—C.Na+ K+ Cl- NO3- D.Ag+ K+ SO42—Cl-6.若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是( )A.Al3+、Na+、 NO3-、Cl- B.K+、Na+、Cl-、NO3-C.K+、Na+、Cl-、AlO2- D.K+、NH4+、SO42-、 NO3-7.下列离子在溶液中因发生氧化还原反应而不能大量共存的是()A.H+、MnO4-、I-、Na+ B.Ag+、NO3-、Cl-、K+C.K+、Ba2+、Cl-、SO42- D.Cu2+、NH4+、Br-、SO42-8.对某酸性溶液(可能含有Br-,SO42-,H2SO3,NH4+)分别进行如下验:①加热时放出的气体可以使品红溶液褪色②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;②加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸对于下列物质不能确认其在溶液中是否存在的是()A.Br- B.SO42-C.H2SO3D. NH4+9.下列各组离子中,由于发生氧化还原反应而不能大量共存的是()A.Al3+、Na+、Cl—、AlO2—B.Fe2 、NO3—、Cl—、H+C.Ca2+、K+、CO32-、OH—D.K+、H+、S2—、SO32—10、在某溶液中,酚酞呈红色。
离子共存、离子的检验和推断【知识梳理】一、离子共存1.实质:几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
2.离子间通常进行的四类反应(1)复分解反应:生成沉淀、气体、弱电解质等思考:试总结因发生复分解反应不能共存的离子(2)氧化还原反应:常见氧化性离子:常见还原性离子:(3)双水解反应:常见的因发生相互促进的水解反应而不能大量共存的离子如下:①Al3+与、、、、AlO2-、SiO32-;②Fe3+与、、AlO2-、SiO32-;③NH4+与AlO2-、SiO32-。
(4)形成配合物:Fe3+与形成、Ag+与NH3·H2O形成而不能大量共存注意:还应注意题干中的限制性条件(详见“知识探究”)A.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+B.气体通过无水CuSO4,粉末变蓝,证明原气体中含有水蒸气C.灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2【知识探究】一、离子共存问题中的常见“陷阱”例1 下列各溶液中一定能大量共存的离子组是()A.加入铝粉有氢气生成的溶液中:Mg2+、Cu2+、SO42-、K+B.使pH试纸呈红色的溶液中:Fe2+、I-、NO3-、Cl-C.常温下,c(H+)=10-13mol·L-1的溶液中:Na+、AlO2-、S2-、SO32-+--28的溶液中:K+、Na+、HCO-、Ca2+有色离子不能大量存在,例如:Cu2+( )、Fe3+( )、Fe2+( )、MnO4-( )、[Fe SCN2]+( )“因发生氧化还原反应而不能大量共存”只能是氧化性离子和还原性离子不能大量共存,不包括其他类型反应的离子常见的易错点“透明”“透明”也可“有色”“与Al反应放出H2”溶液既可能显酸性也可能显碱性“由水电离出的c(H+)=1×10-12 mol·L-1”溶液既可能显酸性也可能显碱性“通入足量的NH3”与NH3·H2O反应的离子不能大量存在常见题干要求(1)“一定大量共存”(2)“可能大量共存”(3)“不能大量共存”审清关键字二、离子推断例2某钠盐溶液可能含有阴离子NO3-、CO32-、SO32-、SO42-、Cl-、Br-、I-。
[考纲要求]1.应用离子反应发生的条件,正确判断常见离子在溶液中能否大量共存。
2.利用离子的特征反应,能鉴别常见离子以及进行综合推断。
考点一离子共存1.离子共存问题是离子反应条件和本质的最直接应用所谓几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
2.熟记常考离子的性质注意离子。
3.常见溶液酸、碱性的判断酸性溶液:pH<7(常温);能使pH试纸呈红色的溶液;能使甲基橙呈红色或橙色的溶液;能使石蕊试液呈红色的溶液。
碱性溶液:pH>7(常温);能使pH试纸呈蓝色的溶液;能使石蕊试液呈蓝色的溶液;能使酚酞试液呈红色的溶液。
呈酸性或碱性的溶液:和Al反应放出H2的溶液(HNO3除外);能使甲基橙呈黄色的溶液;c(H+)水或c(OH-)水等于10-a mol·L-1(a>7)的溶液。
深度思考(1)OH-不能和________________________________________________________大量共存(填具体离子,下同)。
答案H+、NH+4、Fe2+、Fe3+、Cu2+、Zn2+、Mg2+、Al3+、Cr3+、HCO-3、HS-、HSO-3、H2PO-4、HPO2-4(2)H+不能和_______________________________________________________大量共存。
答案OH-、CO2-3(HCO-3)、S2-(HS-)、SO2-3(HSO-3)、PO3-4(H2PO-4,HPO2-4)、SiO2-3、AlO-2、ClO-、F-、CH3COO-、NO-2(3)CO2-3不能和________________________________________________大量共存。
答案H+、Mg2+、Ba2+、Ca2+、Fe3+、Al3+、Fe2+、Cu2+(4)SO2-3不能和__________________________________________大量共存。
离子共存、离子的检验和推断题组一无限制条件的离子大量共存的判断1.能在水溶液中大量共存的离子组是()A.H+、Fe3+、SO、I-B.H+、NH、HCO、NOC.Ag+、K+、Cl-、SOD.K+、AlO、Cl-、OH-答案 D解析A2A.Al3+B.H+、C.Na+、D.K+、答案解析B题组二3A.K+、B.NH、C.Ca2+D.Na+、答案 A解析B反应生成CO和H2O4A.K+、B.H+、NH、Al3+、SOC.Na+、Cl-、MnO、SOD.Na+、CO、CH3COO-、HCO答案 B解析A中SiO能与SO2反应生成沉淀,NO(H+)能氧化SO2;C中MnO能与SO2发生氧化还原反应;D中CO、CH3COO -、HCO均能与SO2反应。
题组三有限制条件的离子大量共存的判断5.下列各组离子在指定的溶液中,能大量共存的划“√”,不能大量共存的划“×”(1)含有大量Fe3+的溶液:Na+、SCN-、Cl-、I-()(2)含有大量NO的溶液:H+、Fe2+、Cl-、SO()(3)常温下,pH=12的溶液:K+、Cl-、SO()(4)c(H+)=0.1mol·L-1的溶液:Na+、NH、SO、S2O()(5)使pH试纸显蓝色的溶液:Cu2+、NO、Fe3+、SO()(6)与铝粉反应放出H2的无色溶液:NO、Al3+、Na+、SO()(7)使红色石蕊试纸变蓝的溶液:SO、CO、Na+、K+()(8)常温下=1×10-12的溶液:K+、AlO、CO、Na+()(9)中性溶液:Fe3+、Al3+、NO、SO()(10)2++(11)c(H+(12)答案(7)√(13)×1(1))(2)(3)2NH,该答案3.答案题组一1A.加入B.通入Cl2后,溶液变为深黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在C.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸后沉淀不溶解时,可确定有SO存在D.加入稀盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO存在答案 B解析Cl-、SO均能与Ag+形成不溶于稀盐酸的白色沉淀,A错;I2遇淀粉变蓝,通入Cl2后,溶液变为深黄色,加入淀粉溶液后溶液变蓝,则溶液中有I-存在,B对;SO与Ba(NO3)2反应形成BaSO3沉淀,加入稀盐酸后在H+、NO的作用下可转化为BaSO4沉淀,C错;能使澄清石灰水变浑浊的气体是CO2或SO2,原溶液中可能存在的离子是CO、HCO、SO或HSO,D错。