络合滴定指示剂.
- 格式:ppt
- 大小:282.50 KB
- 文档页数:34

edta络合滴定法介绍edta络合滴定法是一种常用的化学分析方法,用于测定金属离子的浓度和种类。
edta(乙二胺四乙酸)是一种强螯合剂,可以与金属离子形成稳定的络合物。
在滴定过程中,通过滴加已知浓度的edta溶液,可以确定待测溶液中金属离子的浓度。
仪器和试剂•滴定仪:包括滴定管、滴定架等。
•edta溶液:已知浓度的edta溶液。
•指示剂:常用的指示剂有eriochrome黑T(Eri-T)和印度洋粉(xylenol orange)。
操作步骤1.准备样品:将待测溶液准确地取出一定体积,转移到滴定瓶中。
2.加入指示剂:根据待测金属离子的性质选择合适的指示剂,加入到滴定瓶中。
指示剂会与金属离子形成有色络合物,当溶液中金属离子被edta络合完全时,指示剂的颜色会发生明显变化。
3.滴定:使用滴定管滴加已知浓度的edta溶液到滴定瓶中,直到指示剂颜色发生变化。
记录下滴定所需的edta溶液体积。
4.计算结果:根据滴定所需的edta溶液体积和其浓度,可以计算出待测溶液中金属离子的浓度。
影响滴定结果的因素1.pH值:edta络合滴定法对溶液的pH值比较敏感,一般要求在特定的pH范围内进行滴定。
pH值的变化会影响金属离子和edta络合的平衡,从而影响滴定结果的准确性。
2.温度:温度的变化也会对滴定结果产生影响。
一般情况下,滴定过程应在恒定的温度下进行,以保证结果的准确性。
3.指示剂的选择:不同的金属离子需要选择不同的指示剂,以保证滴定的准确性和灵敏度。
优点和应用•优点:edta络合滴定法具有操作简便、结果准确、灵敏度高等优点,广泛应用于环境监测、食品检测、药物分析等领域。
•应用:edta络合滴定法常用于测定水中金属离子的浓度,例如测定自来水中的钙、镁离子浓度,或者测定土壤中重金属离子(如铅、镉等)的含量。
注意事项•滴定过程中要注意滴定管的使用,确保滴定液滴加均匀。
•选择合适的滴定指示剂,以确保滴定结果的准确性。
•仪器和试剂要保持干净,避免杂质的干扰。

edta络合滴定法EDTA络合滴定法是一种常用的分析化学方法,它广泛应用于金属离子的定量分析以及环境、食品、医药等多个领域。
该方法基于金属离子和EDTA(乙二胺四乙酸)之间的络合反应,通过滴定过程中络合物的形成与断裂,确定金属离子的含量。
本文将介绍EDTA络合滴定方法的原理、步骤、影响因素以及其应用。
1. 原理EDTA是一种能与金属离子形成稳定络合物的配体,它的酸碱性介于中性范围,独特的配位骨架使得它能与多种金属离子形成络合物。
在络合滴定过程中,首先将含有待测金属离子的溶液加入容器中,然后加入EDTA溶液作为滴定剂,滴定剂的浓度和体积是已知的。
加入滴定剂后,金属离子和EDTA之间发生络合反应,形成可溶的络合物,这个过程称为络合滴定反应。
2. 步骤(1)制备标准溶液:测量一定量的含有待测金属离子的溶液,加入稳定剂,稀释到一定体积。
这个溶液被称为标准溶液,用于滴定分析。
(2)准备滴定溶液:称取适量的EDTA盐固体,溶解在适量的盐酸中,并经过稀释得到EDTA滴定溶液。
(3)滴定:使用滴定管取一定量的标准溶液,加入适量的pH 缓冲液和指示剂,使其达到最适的pH条件。
然后滴定EDTA溶液,直到金属离子与EDTA发生定量的络合反应。
进一步加入指示剂,根据指示剂的颜色变化来确定终点。
(4)计算:根据滴定剂的浓度和体积,以及标准溶液的体积,计算出待测溶液中金属离子的浓度。
3. 影响因素EDTA络合滴定法的准确性和精确度受到多种因素的影响,包括pH值、温度、金属离子的选择、络合剂和指示剂的选择等。
确保滴定过程中的pH值恒定可以提高滴定的准确性。
温度的控制可以提高滴定反应的速率和反应的稳定性。
选择合适的金属离子、络合剂和指示剂可以使络合反应达到最佳效果,提高分析结果的准确性。
4. 应用EDTA络合滴定法广泛应用于金属离子的定量分析和质量控制。
它可以用于分析环境样品中的重金属含量,例如水中的铜、铁和锌。
在食品行业,EDTA络合滴定法可以用于测定食品样品中的钙、镁和锰等元素的含量。

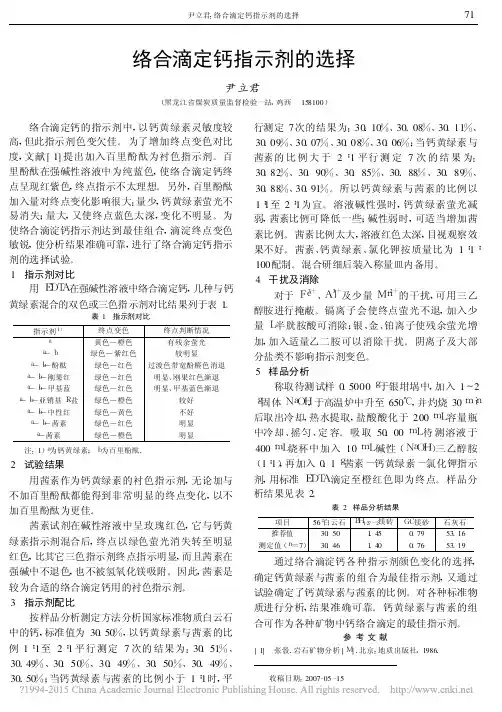
络合滴定钙指示剂的选择尹立君(黑龙江省煤炭质量监督检验一站,鸡西158100) 络合滴定钙的指示剂中,以钙黄绿素灵敏度较高,但此指示剂色变欠佳。
为了增加终点变色对比度,文献[1]提出加入百里酚酞为衬色指示剂。
百里酚酞在强碱性溶液中为纯蓝色,使络合滴定钙终点呈现红紫色,终点指示不太理想。
另外,百里酚酞加入量对终点变化影响很大:量少,钙黄绿素萤光不易消失;量大,又使终点蓝色太深,变化不明显。
为使络合滴淀钙指示剂达到最佳组合,滴淀终点变色敏锐,使分析结果准确可靠,进行了络合滴定钙指示剂的选择试验。
1 指示剂对比 用E D T A在强碱性溶液中络合滴定钙,几种与钙黄绿素混合的双色或三色指示剂对比结果列于表1。
表1 指示剂对比指示剂1)终点变色终点判断情况a黄色—橙色有残余萤光a—b绿色—紫红色较明显a—b—酚酞绿色—红色过渡色带宽酚醛色消退a—b—刚果红绿色—红色明显、刚果红色渐退a—b—甲基蓝绿色—红色明显、甲基蓝色渐退a—b—亚销基R盐绿色—橙色较好a—b—中性红绿色—黄色不好a—b—茜素绿色—红色明显a—茜素绿色—橙色明显 注:1)a为钙黄绿素;b为百里酚酞。
2 试验结果 用茜素作为钙黄绿素的衬色指示剂,无论加与不加百里酚酞都能得到非常明显的终点变化,以不加百里酚酞为更佳。
茜素试剂在碱性溶液中呈玫瑰红色,它与钙黄绿素指示剂混合后,终点以绿色萤光消失转至明显红色,比其它三色指示剂终点指示明显,而且茜素在强碱中不退色,也不被氢氧化镁吸附。
因此,茜素是较为合适的络合滴定钙用的衬色指示剂。
3 指示剂配比 按样品分析测定方法分析国家标准物质白云石中的钙,标准值为30.50%,以钙黄绿素与茜素的比例1∶1至2∶1平行测定7次的结果为:30.51%、30.49%、30.50%、30.49%、30.50%、30.49%、30.50%;当钙黄绿素与茜素的比例小于1∶1时,平行测定7次的结果为:30.10%、30.08%、30.11%、30.09%、30.07%、30.08%、30.06%;当钙黄绿素与茜素的比例大于2∶1平行测定7次的结果为: 30.82%、30.90%、30.85%、30.88%、30.89%、30.88%、30.91%。

六亚甲基四胺在络合滴定中的作用
六亚甲基四胺是一种广泛应用于分析化学领域的络合剂,其在络合滴定中起着重要作用。
络合滴定是一种定量化学分析方法,其中一个化合物(称为指示剂)与被测试的化合
物反应,形成掩蔽剂-指示剂络合物。
这个络合物的形成和消失可以通过滴定时加入的控
制试剂来检测,从而可以准确地测量被测试化合物存在的浓度。
另外,六亚甲基四胺可以与一些金属离子形成络合物。
这些络合物可以改变被测试化
合物的性质,例如使其更易与控制试剂反应或改变其在水中的溶解度。
这些化学效应通常
被用来检测或分离特定种类的金属离子。
在一些滴定方法中,六亚甲基四胺还可以作为指示剂。
由于六亚甲基四胺与许多金属
离子形成的络合物的颜色发生变化,因此它可以用来指示滴定过程何时已达到终点。
例如,在铁离子滴定中,六亚甲基四胺与Fe(II)形成的络合物呈天蓝色,而与Fe(III)形成的络
合物为黄色。
当滴定剂完全转化Fe(II)为Fe(III)时,颜色从天蓝变为黄色,这表明已经
达到了终点。

络合滴定的条件“络合滴定的条件之一是要有合适的指示剂哦,这就像在黑暗中为你指引方向的明灯!”比如说,在一次化学实验课上,我们要测定一种金属离子的浓度。
老师就强调了指示剂的重要性。
当时我们用的是EDTA滴定金属离子,选择了一种合适的指示剂,它在滴定过程中颜色变化非常明显。
当溶液的颜色从一种颜色逐渐变成另一种颜色的时候,就像一个信号告诉我们滴定达到了终点。
如果没有选对指示剂,或者指示剂的变色不灵敏,那我们就很难准确判断滴定的终点,实验结果也就不准确啦。
所以啊,合适的指示剂可是络合滴定的关键条件之一呢。
“稳定的反应体系也很重要哦,它就像一个坚固的城堡,为滴定反应提供安全的环境。
”我有个同学在做实验的时候,一开始没有注意反应体系的稳定性。
溶液的酸碱度没有调节好,结果在滴定过程中,出现了一些副反应,导致滴定结果偏差很大。
后来他重新调整了溶液的酸碱度,让反应体系变得稳定,再次进行滴定,就得到了比较准确的结果。
这就好比你要在一个平静的湖面上划船才能顺利到达目的地,如果湖面波涛汹涌,那船就很容易翻掉。
所以,在进行络合滴定时,一定要确保反应体系稳定,这样才能保证滴定反应顺利进行,得到可靠的结果。
“准确控制滴定速度也是个要点哦,它就像开车时控制油门一样,要恰到好处。
”有一次我和小组同学一起做络合滴定实验,其中一个同学滴定速度太快了,结果反应还没完全进行,就加入了过多的滴定剂,导致实验结果偏高。
后来我们重新做实验,这次大家都很注意滴定速度,慢慢地滴加滴定剂,让反应充分进行。
就像你在给花浇水的时候,不能一股脑儿地把水全倒下去,要慢慢地浇,让水充分渗透到土壤里。
这样才能保证络合滴定反应平稳进行,得到准确的结果。
所以,控制好滴定速度可不能马虎哦。
“溶液的酸碱度要合适哦,这就像给植物提供适宜的土壤酸碱度一样,关乎着反应的成败。
”比如说在测定某一种金属离子的含量时,我们需要根据金属离子和络合剂的性质,调节溶液到合适的酸碱度。
如果酸碱度不合适,金属离子可能会和其他物质发生反应,或者络合剂的络合能力会受到影响。



edta的标定实验报告EDTA 的标定实验报告一、实验目的1、掌握 EDTA 标准溶液的配制和标定方法。
2、学会用络合滴定法测定金属离子的含量。
3、熟悉络合滴定中指示剂的选择和使用。
二、实验原理EDTA(乙二胺四乙酸)是一种很强的络合剂,能与许多金属离子形成稳定的 1:1 络合物。
本实验以 Zn²⁺为基准物质,在 pH 约为 10 的条件下,以铬黑 T 为指示剂,用 EDTA 标准溶液滴定至溶液由酒红色变为纯蓝色,即为终点。
反应式为:Zn²⁺+ H₂Y²⁻⇌ ZnY²⁻+ 2H⁺三、实验仪器与试剂1、仪器电子天平、酸式滴定管(50 mL)、移液管(25 mL)、容量瓶(250 mL)、锥形瓶(250 mL)、玻璃棒、烧杯(250 mL、500 mL)、胶头滴管。
2、试剂乙二胺四乙酸二钠盐(EDTA)、基准物质 ZnO、盐酸(1:1)、氨水(1:1)、氯化铵氢氧化铵缓冲溶液(pH ≈ 10)、铬黑 T 指示剂(5 g/L)。
四、实验步骤1、 EDTA 标准溶液的配制称取约 95 g EDTA 二钠盐于 500 mL 烧杯中,加入约 200 mL 水,温热溶解后,转入聚乙烯塑料瓶中,用水稀释至 1000 mL,摇匀。
2、锌标准溶液的配制准确称取 042 g 基准物质 ZnO 于 100 mL 烧杯中,用少量水润湿,滴加 1:1 盐酸至 ZnO 完全溶解,然后定量转移至 250 mL 容量瓶中,用水稀释至刻度,摇匀。
3、 EDTA 标准溶液的标定用移液管准确移取 2500 mL 锌标准溶液于 250 mL 锥形瓶中,加入20 mL 氯化铵氢氧化铵缓冲溶液和 3 滴铬黑 T 指示剂,用 EDTA 标准溶液滴定至溶液由酒红色变为纯蓝色,即为终点。
平行标定三份,计算 EDTA 标准溶液的浓度。
五、实验数据记录与处理1、数据记录|实验序号| V(Zn²⁺)/mL | V(EDTA 初读数)/mL |V(EDTA 终读数)/mL | V(EDTA)/mL |||||||| 1 | 2500 |_____ |_____ |_____ || 2 | 2500 |_____ |_____ |_____ || 3 | 2500 |_____ |_____ |_____ |2、计算EDTA 标准溶液的浓度计算公式为:c(EDTA) = m(ZnO) /(V(Zn²⁺) × M(ZnO)) × V(EDTA)其中,m(ZnO) 为 ZnO 的质量(g),V(Zn²⁺)为移取锌标准溶液的体积(mL),M(ZnO) 为 ZnO 的摩尔质量(8139 g/mol),V(EDTA) 为滴定消耗 EDTA 标准溶液的体积(mL)。

络合滴定法(硬度的测定)一、络合滴定的原理络合滴定法是以络合反应为基础的滴定分析方法。
乙二胺四乙酸就是一种常用的络合剂。
简称EDTA 。
它是一种四元酸,微溶于水。
通常情况下,一个EDTA 分子,可与一个不同价态的离子络合,也就是说,EDTA 与金属离子1:1络合,生成易溶于水的络合物。
在络合滴定中,等当点的判别常用金属指示剂来显示。
金属指示剂本身也是一种络合剂,它与金属离子生成的络全物颜色与游离指示剂的颜色不同,而且要求它与金属离子形成的络合的稳定性略低于EDTA 和金属离子形成的络合物的稳定性,在理论终点时,指示剂由络合状态被EDTA 置换而成为游离的指示剂,根据指示剂颜色的变化就可以判断终点。
如用铬黑T (简写成HI n 2-)为指示剂测Ca 2+时Ca 2+ + HI n 2- = CaI n - + H +用EDTA (简称为H 2Y 2-)滴定过程中Ca 2+ + H 2Y 2- =CaY 2- + 2H +在终点时,溶液中游离Ca 2+都与H 2Y 2-反应了,由于CaY 2-的稳定性比CaI n 2-的稳定性高,再加入的EDTA 就会夺取CaI n -中的Ca 2+,发生如下反应H 2Y 2- +CaI n - = CaY 2-+HI N -+H +酒红色 蓝色溶液由酒红色转变为蓝色,显示终点的到来。
由于EDTA 是一种多元酸,溶液的pH 值决定EDTA 的存在形式,从而影响到络合物的稳定性。
在测硬度时,一般用缓冲溶液控制溶液的pH 值为10±0.1。
二、试剂1、C (1/2EDTA)为0.04mol/L配制:称取8g 乙二胺四乙酸二钠溶入1L 高纯水中,摇匀。
标定:称取0.4g(准确到0.2mg)于800℃灼烧至恒重的氧化锌,用少许蒸馏水湿润,滴加盐酸溶液(1+1)至样品溶解移入250mL 容量瓶中,稀释至刻度,摇匀。
取上述溶液20.00mL ,加80mL 除盐水,用10%氨水中和至pH 为7~8,加5mL 氨-氯化铵缓冲溶液(Ph =10),加5滴ρ=5g/L 铬黑T 指示剂,用C (1/2edta)=0.04mol/L 溶液滴定至溶液由紫色变纯蓝色,记录消耗EDTA 标准溶液的体积。
络合滴定指示剂—金属指示剂(一)在络合滴定中,通常利用能与金属离子生成有色协作物的显色剂来指示滴定过程中金属离子浓度的变幻,这种显色剂称为金属指示剂。
(一)金属指示剂变色原理金属指示剂的变色原理是基于金属指示剂的色彩不同于与金属离子生成的协作物的色彩,例如用EDTA标准溶液滴定镁,溶液pH=10,加入指示剂铬黑T,因与镁离子生成红色协作物溶液呈红色。
反应如下:当以EDTA滴定,EDTA夺取Mgln-中的镁生成更稳定的MgY2-,反应如下:直到Mgln-彻低改变成MgY2-,同时游离出蓝色HIn2-,此时溶液由红色变为蓝色,指示尽头到达。
(二)金属指示剂应具备的条件 (1)金属指示剂本身的色彩应与金属离子和金属指示剂形成协作物的色彩有显然的区分。
惟独这样才干使尽头色彩变幻显然。
(2)指示剂与金属离子形成协作物的稳定性适当的小于EDTA与金属离子形成的协作物的稳定性。
金属离子与指示剂所形成协作物的稳定性要符合: 1gKMIn' 4 同时还要求:1gKMY'-1gKMIn'≥2 (3)指示剂不与被测金属离子产生封闭现象。
有时金属指示剂与某些金属离子形成极稳定的协作物,其稳定性超过1gKMY'以致在滴定过程中虽然滴入了过量的EDTA,也不能从金属指示剂协作物中夺取金属离子(M),因而无法确定滴定尽头。
这种现象称为指示剂的封闭现象。
(4)金属指示剂应比较稳定,以便于储存和用法。
但有些金属指示剂本身放置空气中易被氧化破坏,或发生分子聚合作用而失效。
为避开金属指示剂失效,对稳定性差的金属指示剂可用中性盐混合配成固体混合物储存备用。
也可以在金属指示剂溶液中加入防止其变质的试剂,如在铬黑T溶液中加。
(三)常用金属指示剂 (1)铬黑T (EBT)结构式如下:铬黑T 为黑褐色粉末,略带金属光泽,溶于水后,结合在磺酸根上的Na+所有电离,以阴离子形式存在于溶液中。
铬黑T是一个三元弱酸,以H2In-表示,在不同pH值时,其色彩变幻为铬黑T与无数金属离子生成显红色的协作物,为使尽头敏锐最好控制pH=8~10,这时尽头由红色变为蓝色比较敏锐。
沉淀滴定的指示剂及原理
沉淀滴定又称络合滴定或沉淀滴定法,是通过加入沉淀剂与分析物中的金属离子产生沉淀反应,然后加入指示剂,利用指示剂对于反应溶液颜色的改变,判断沉淀落下的瞬间,从而得到测量数据的一种分析方法。
沉淀滴定的常用指示剂有:
硫化钠:可以用于检测镍、铜、镉、铈等离子。
二苯卡琳:是用来检测铁、铝、锌、钡、钴等离子的指示剂。
浓缩硫酸:是检测镉、铜、铟、银及其他卤化物离子的指示剂。
十二烷基腈:用于检测钙、锌等离子。
沉淀滴定的原理是通过沉淀剂与分析物中的金属离子发生化学反应后,形成沉淀。
加入适当的指示剂,可以探测到沉淀形成的瞬间,从而得到准确的测量结果。
沉淀滴定常用的沉淀剂有氢氧化钠、氢氧化钙、硫化氢等,它们能与离子反应生成相应的沉淀。
指示剂又称滴定指示剂或指示药,它们呈现出明显的几种颜色或颜色的变化,能够指明沉淀与分析溶液混合的比例。
总的来说,沉淀滴定通过沉淀剂与分析物中的离子反应生成沉淀,然后加入指示剂,根据沉淀形成的瞬间判断溶液
比例,从而得到测量数据的一种分析方法。
指示剂的选择要根据沉淀的化学性质和反应参数进行,以获取更精确的分析结果。