(完整版)有机化学基础第二章知识点,推荐文档
- 格式:pdf
- 大小:189.62 KB
- 文档页数:6
第2章 烃考纲 要求1.以烷、烯、炔和芳香烃的代表物为例,比较它们在组成、结构、性质上的差异。
2.了解天然气、石油液化气和汽油的主要成分及应用。
3.了解加成反应和取代反应。
4.能举例说明烃类物质在有机合成和有机化工中的重要作用。
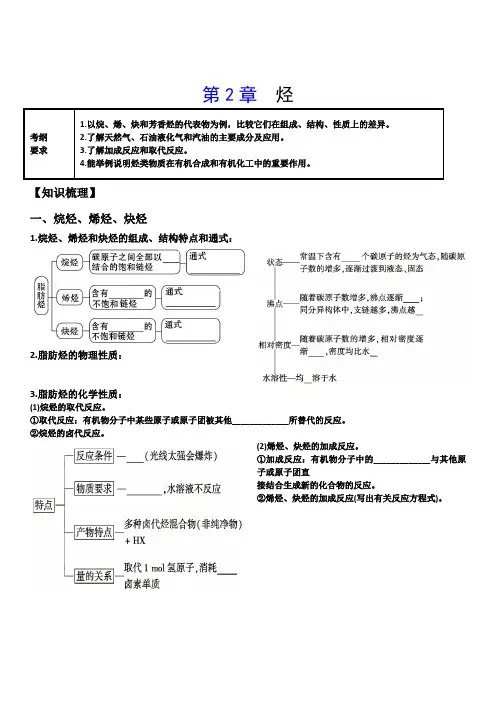
【知识梳理】一、烷烃、烯烃、炔烃1.烷烃、烯烃和炔烃的组成、结构特点和通式:2.脂肪烃的物理性质:3.脂肪烃的化学性质:(1)烷烃的取代反应。
①取代反应:有机物分子中某些原子或原子团被其他_____________所替代的反应。
②烷烃的卤代反应。
(2)烯烃、炔烃的加成反应。
①加成反应:有机物分子中的_____________与其他原子或原子团直接结合生成新的化合物的反应。
②烯烃、炔烃的加成反应(写出有关反应方程式)。
(3)烯烃的加聚反应。
①乙烯的加聚反应方程式为_______________________________。
②丙烯的加聚反应方程式_________________________________【微点拨】(1)烷烃与卤素单质的取代反应是分子中的氢原子逐步被取代,并且是各步反应同时进行,产物是烃的多种卤代物的混合物和卤化氢。
(2)鉴别烷烃和烯烃(炔烃)可用酸性高锰酸钾溶液或溴的四氯化碳溶液,而除去烷烃中的烯烃时,不能用酸性高锰酸钾溶液。
(3)加聚产物属于混合物,没有固定的熔沸点。
二、芳香烃1.苯的化学性质:易取代,能加成,难氧化。
(1)易取代——易与卤素单质、硝酸、浓硫酸发生取代反应。
①卤代反应:与Br2反应的化学方程式为_________________________________。
②硝化反应方程式为__________________________________________。
其中浓硫酸的作用是_______________。
(2)能加成——可与H2发生加成反应。
反应方程式为___________________________________。


有机化学(二)各章小结第一章羧酸一、羧酸的分类与羧基相连的烃基不同:脂肪酸、芳香酸与羧基相连的烃基饱和程度不同:饱和酸、不饱和酸羧基的数目:一元酸、二元酸、多元酸二、命名1. 普通命名法(简单羧酸)2. 系统命名法(1)选含羧基的最长的碳链作为主链(有不饱和键的选含羧基和不饱和键的最长碳链)(2)从羧基开始编号(3)全名:取代基位次-取代基名称-主链碳数羧酸名称(酸、二酸等)(4)羧基与环相连,以脂环基或芳基的名称+甲酸,其他基团作为取代基命名(5)环上及侧链都有羧基者,则以脂肪酸为母体命名二、物理性质1. 物态(C-C—液态,C以上固体,二酸和芳酸晶状固体)10192. 水溶性C1-C4与水混溶(氢键)M增加水溶性减小3. 沸点(比分子量相同的醇高—分子间氢键,分子间双分子缔合)4. 熔点(锯齿状变化,偶数>相邻奇数)三、光谱性质IR:νC=O伸缩振动-1 -1cm二缔合体~RCOOH:单体 1770-1750 cm1710-1 1720 cm=CHCOOHCH:单体~2-1cm~1690 二缔合体1715-1 1680 cm二缔合体1700~ArCOOH:-1(单体)cm: 气态~3550 O-H伸缩振动-1-1cm~2500 二聚体3000 cm-11250 伸缩振动~cmC-O-1-1cmcm和~900O-H弯曲振动~1400 NMR:RCHCOOH R=2-2.6δCHCOOH 22RCOOH δ=10.5-13四、结构分析C—sp2杂化、三个σ键、键角120°C=O的构成:一个σ一个π键C=O键长0.123nm、C-O键长0.136nm-:C-O键长相等,均为COO0.127 nm-五、化学性质1. 酸性(1)弱酸一元酸:pKa =4~5比一般无机强酸弱,比碳酸强(pKa=6.36)二元酸:KaKa pKa112><pKa(吸电诱导和场效应)2(2)影响酸性的因素A. 诱导效应:吸电诱导效应酸性增强供电诱导效应酸性减弱(短程效应,离的越近作用越强)B. 共轭效应吸电共轭效应使酸性增强、供电共轭效应使酸性减弱(取代芳酸:邻位异构体大于间位和对位异构体)C. 场效应(3)成盐(4)酸性的应用:鉴别、分离、提纯、制备酯(S2) N 2. 酰化反应—羧酸衍生物的生成(1)酰卤的生成试剂:羧酸+无机酸的酰卤(PX 、PX 和SOCl ) 235(2)酸酐的生成 甲酸脱水生成一氧化碳脱水剂:PO 、乙酐等 52丁二酸、戊二酸、邻苯二甲酸加热生成五元环或六元环的酸酐还可用酰卤与无水羧酸盐共热制备(3)酯的生成及酯化反应机理A. 酯化反应试剂:羧酸、醇 催化剂:H SO 、HCl 、对甲苯磺酸等 42特点:可逆反应 也可用羧酸盐与卤代烃反应制备.B. 两种反应机理: (Ⅰ)酰氧键断裂双分子历程(大多数酯化反应的历程) (Ⅱ)烷氧键断裂单分子历程(叔醇酯化反应历程)+OOHOH +HR'OH R C OHR C OHR C OHHOR' +OHOH OH ?£-? +2R C OHR C OR'2 + OR'+OOH +H ??£-R C OR'R C OR'+H +OCRCOHH+R 233 O OO +R' C OHH +R' C OHR' C OCR +CR 3 3 CR 3(4)酰胺的生成试剂:羧酸、氨或胺→羧酸铵→加热→酰胺或取代酰胺3. 还原反应还原剂:LiAlH 产物:伯醇 4特点:产率高、不影响碳碳不饱和键4. 脱羧反应(1)饱和一元酸脱羧A. 低级羧酸盐与碱石灰共熔脱羧→烃B. α-碳原子连有吸电子基较易脱羧C. 邻、对位连有强吸电基团的芳酸比饱和一元酸易脱羧D. 羧酸盐电解脱羧(钾或钠盐)→阳极偶联→烃(Kolbe 电解法)F. 羧酸银盐与溴/四氯化碳溶液反应→少一个碳的溴代烃(Hunsdiecker 反应)(羧酸、氧化汞、溴/四氯化碳)(2)二元酸脱羧乙二酸、丙二酸→一元酸和CO 2.丁二酸、戊二酸→环状酸酐(加热脱水)己二酸、庚二酸→环酮(脱HO 和CO ) 225. α-H 的反应—卤代(C.Hell -J.V olhard -Zelinsky )反应试剂:有α-H 的羧酸、红磷、溴或氯(PX ) 3产物:α-卤代酸6. 与有机锂试剂反应试剂:羧酸、烃基锂 产物:酮(用于酮的制备)六、羧酸的制备1. 氧化法(1)烃氧化法A. 烷烃二氧化锰、高锰酸钾氧化→混合物羧酸(碳链断裂)B. 烯烃酸性高锰酸钾氧化(碳链断裂)C. 炔烃酸性高锰酸钾氧化(碳链断裂)D. 芳烃(有α-H)酸性高锰酸钾氧化(侧链断裂)(2)伯醇或醛氧化(碳数不变)(3)甲基酮卤仿反应(制备少一个碳的羧酸)2. 腈水解反应(碳链不变)3. Grignard试剂与CO反应(增加一个碳的羧酸)2常用:伯、仲、叔卤代烷,烯丙基型卤代烃、芳基卤。

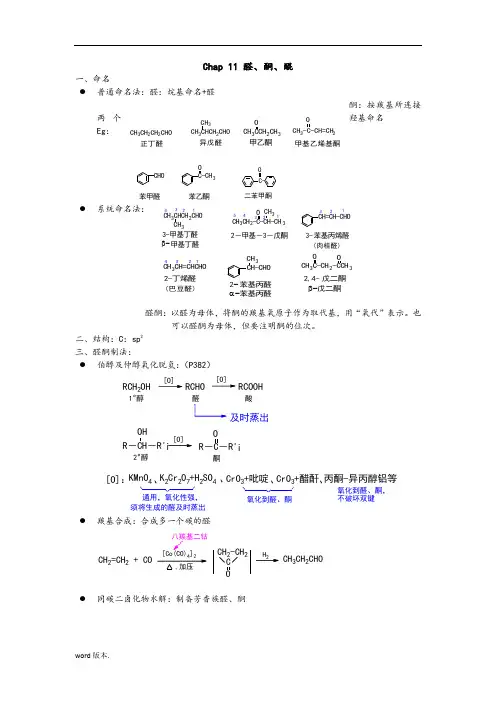
Chap 11 醛、酮、醌一、命名● 普通命名法:醛:烷基命名+醛酮:按羰基所连接两个羟基命名 Eg :● 系统命名法:醛酮:以醛为母体,将酮的羰基氧原子作为取代基,用“氧代”表示。
也可以醛酮为母体,但要注明酮的位次。
二、结构:C :sp 2三、醛酮制法:● 伯醇及仲醇氧化脱氢:(P382)RCH 2OHRCHORCOOH及时蒸出1 醇醛酸。
[O]:KMnO 4K 2Cr 2O 7+H 2SO 4CrO 3+吡啶CrO 3+醋酐 丙酮-异丙醇铝等 、、、、。
2 醇酮R -CH -¡OHR -C -R'¡O氧化到醛、酮,不破坏双键氧化到醛、酮通用,氧化性强,须将生成的醛及时蒸出● 羰基合成:合成多一个碳的醛● 同碳二卤化物水解:制备芳香族醛、酮CH 2=CH 2 + COCH 3CH 2CHO42CH 2-CH 2C O2甲乙酮 CH 3CCH 2CH 3OCH 3CH 2CH 2CHO CH 3CHCH 2CHO CH 3CH 3-C-CH=CH 2O 正丁醛异戊醛甲基乙烯基酮CHO 苯甲醛C-CH 3O 苯乙酮C-O 二苯甲酮CH 3CHCH 2CHO CH 3CH 3CH 2-C-CH-CH 3O CH 343-甲基丁醛2-甲基-3-戊酮β-甲基丁醛12345苯基丙烯醛3-CH=CH-CHO (肉桂醛)321321CH 3CH=CHCHO CH-CHOCH 32-丁烯醛苯基丙醛2-CH 3C-CH 2-CCH 3O O β-戊二酮 戊二酮2,4-(巴豆醛)1234苯基丙醛α-● 羧酸衍生物还原:(考试不涉及)R ClO + H 2R H O 4(2) H 2O , H , 88%(1) Al(n-Bu)H , 己烷,-78 C。
CH 3(CH 2)10OC 2H 5OCH 3(CH 2)10CHO● 芳烃氧化:制备芳醛、芳酮(P382)● 芳环上F-C 酰基化:(P165、P382) Gattermann-Koch 反应(由苯或烷基苯制芳醛)四、物理性质:● 沸点:与分子量相近的醇、醚、烃相比,有b.p :醇>醛、酮>醚>烃。

高二有机化学知识点第二章有机化学是化学的一个重要分支领域,研究碳及其化合物的结构、性质、制备和变化规律。
高二学生学习有机化学时,第二章是一个关键的知识点,其中包括醇、酚、醚、卤代烃等有机化合物的性质和反应。
下面将结合这些知识点,逐一介绍高二有机化学知识点第二章。
一、醇醇是一类含有羟基(—OH)的有机化合物,通式为R—OH。
其中,R代表一个有机基团。
醇的命名按照主链命名法,需要根据碳链长度和羟基位置命名。
醇的性质主要包括物理性质和化学性质两个方面。
1. 醇的物理性质醇的物理性质受到分子量和分子结构的影响。
一般来说,低分子量醇是无色、有特殊气味的液体,高分子量醇则是无色或白色固体。
醇具有高沸点和高溶解度,可与水形成氢键,使醇具有较好的溶解性。
2. 醇的化学性质醇的化学性质表现为羟基的活泼反应性。
常见的醇的反应包括酸碱中和、脱水、氧化、酯化等。
其中,醇的酸碱中和反应是指醇与强酸中和生成盐和水。
脱水反应是指醇分子内或与其他物质反应时,醇中的羟基失去一个氢原子和一个氧原子产生水分子。
氧化反应指醇分子中的羟基被氧化成醛、酮或羧酸等。
酯化反应是指醇与酸反应生成酯。
二、酚酚是一类含有羟基(—OH)的芳香化合物,通式为Ar—OH。
其中,Ar代表一个芳香基团。
酚的命名按照主链命名法,需要根据芳香基团的位置和取代基的数量命名。
1. 酚的物理性质酚的物理性质与醇类似,但酚的氢键作用较醇弱,故溶解度较低。
酚的熔点和沸点通常比相应的醇高。
2. 酚的化学性质酚的化学性质主要表现为羟基的活泼反应性。
常见的酚的反应包括酸碱中和、酚的氧化和取代反应等。
酸碱中和反应是指酚与强酸中和生成盐。
酚的氧化反应可产生醛、酮和酸。
酚的取代反应是指酚中的羟基被其他取代基替代。
三、醚醚是一类含有氧原子连接的有机化合物,通式为R—O—R。
其中,R代表两个有机基团。
醚的命名按照主链命名法,需要根据两个有机基团的名称命名。
1. 醚的物理性质醚的物理性质通常为无色液体,具有特殊的气味。

化学第二章知识点总结化学第二章主要介绍了化学的基本概念和化学方程式的应用。
下面对本章涉及的主要知识点进行总结。
1. 元素和化合物:元素是由相同类型的原子组成的物质,化合物是由不同元素通过化学键结合而成的物质。
2. 原子:原子是构成物质的基本单位,由质子、中子和电子组成。
原子量是元素相对于碳-12同位素的质量。
3. 化学式:化学式用来表示化合物中元素的种类和数量。
分子式表示化合物中原子的实际个数,而实际式则表示化合物中各元素的摩尔比。
4. 化学反应:化学反应是物质转化为其他物质的过程,可以通过化学方程式来描述。
5. 定律和原理:化学反应遵循一些定律和原理,如质量守恒定律、比如vin休特定律、电荷守恒定律等。
6. 摩尔:摩尔是化学中计量物质的单位,摩尔质量是一个物质的摩尔质量除以1摩尔的质量。
7. 化学方程式:化学方程式描述化学反应中物质的转化关系。
方程式中的化学式表示了反应物和生成物的种类和数量。
8. 反应类型:化学反应可以分为合成反应、分解反应、置换反应、双替反应等不同类型。
9. 配平方程式:配平方程式是为了满足质量守恒定律和电荷守恒定律,使化学方程式符合实验结果。
10. 摩尔比:摩尔比是化学反应中各组分的摩尔个数之比。
11. 综合反应、实验摩尔质量和理论摩尔质量:综合反应是根据实验数据确定化学方程式中各物质的摩尔比。
实验摩尔质量是实验数据确定的反应物和生成物的摩尔质量,而理论摩尔质量是根据化学方程式计算得出的摩尔质量。
12. 摩尔及摩尔式:摩尔是化学反应过程中的基本单位,摩尔式表示化学方程式中各物质的摩尔个数和种类。
13. 反应物的限定性、过剩和理论产量:反应物的限定性是指在反应中消耗完的反应物,过剩是指在反应中剩余未消耗的反应物,理论产量是根据化学方程式计算得出的理论上可能的产量。
14. 化学计量:化学计量是通过化学方程式和摩尔比计算化学反应的摩尔和质量关系。
15. 摩尔体积:摩尔体积是气体在一定条件下,占据的体积与摩尔数之间的关系。



(完整版)化学必修二第二章知识点总结,推举文档第二章化学反应与能量第一节化学能与热能一.化学键与能量变化关系关系:在任何的化学反应中总伴有能量的变化。
缘故:当物质发生化学反应时,从微观来看,断开反应物中的化学键要汲取能量,而形成生成物中的化学键要放出能量。
化学键的断裂和形成是化学反应中能量变化的要紧缘故。
一具确定的化学反应在发生过程中是汲取能量依然放出能量,决定于反应物的总能量与生成物的总能量的相对大小。
2、常见的放热反应和吸热反应(1)常见的放热反应:① 所有的燃烧与缓慢氧化;②酸碱中和反应(中和热);③金属与酸、水反应制氢气;④大多数化合反应(特别:C +CO2=2CO 是吸热反应);⑤铝热反应注:在稀溶液中,酸跟碱发生中和反应生成 1 mol 液态水时的反应热叫做中和热.ⅰ. 必须是酸和碱的稀溶液,因为浓酸溶液和浓碱溶液在相互稀释时会放热ⅱ. 强酸和强碱的稀溶液反应才干保证 H+(aq)+OH-(aq)====H2O(l)中和热均为57.3 kJ·mol-1,而弱酸或弱碱在中和反应中由于电离汲取热量,其反应热小于57.3 kJ·mol- 1;ⅲ.以生成 1 mol 水为基准.(2)常见的吸热反应:① C、H2、CO 为还原剂的氧化还原反应如:C(s)+H2O(g) CO(g)+H2(g)。
② 盐和碱的反应如Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O③ 多数分解反应如 KClO3、KMnO4、CaCO3 的分解等。
(但过氧化氢的分解是放热反应)④ 水解,弱电解质的电离注:反应条件与吸放热无关。
(3)放热反应与吸热反应的比较类型比较放热反应吸热反应定义放出热量的化学反应汲取热量的化学反应形成缘故反应物具有的总能量大于生成物具有的总能量反应物具有的总能量小于生成物具有的总能量与化学键变化的关系生成物分子成键时释放出的总能量大于反应物分子断裂时汲取的总能量生成物分子成键时释放出的总能量小于反应物分子断裂时汲取的总能量注:第二节化学能与电能(1)概念:把化学能直截了当转化为电能的装置叫做原电池。
歐亞書局歐亞書局已知的有機化合物超過三千七百萬種。
歐亞書局讓有機化合物得以依其反應性而分類成不同族的結構歐亞書局圖2.1乙烯和薄荷烯分別與溴分子的反應。
此二例中,碳的官能基以相同方式與歐亞書局具有碳歐亞書局歐亞書局第2 章烷類:有機化合物的特性p.37歐亞書局歐亞書局第2 章烷類:有機化合物的特性p.38歐亞書局歐亞書局具有碳單一鍵結至高陰電性原子的官能基歐亞書局在所有的情況下,這些鍵均具有極性,其中碳原子帶部分正電荷(δ+),而陰電性較高的原子則帶部分負電荷(δ-)。
歐亞書局第2 章烷類:有機化合物的特性p.39歐亞書局具有碳歐亞書局歐亞書局第2 章烷類:有機化合物的特性p.40乙烷中的頭)重疊而形成假如藉由C C 單鍵而連接了三個頭)重疊而形成,假如藉由-C單鍵而連接了三個、四個、五個或甚至更多個碳原子,則我們可以產生很大的一族分子,稱為烷類(alkanes)。
歐亞書局第2 章烷類:有機化合物的特性p.41烷類常被稱為肪族化合物(aliphatic compounds)。
歐亞書局像丁烷這樣的化合物,其碳皆連接於同一列者,稱歐亞書局歐亞書局歐亞書局第2 章烷類:有機化合物的特性p.43 正如兩種一般,具有相同的isomers)。
異構物具有相同數目及相同種類的原子,但這些原子歐亞書局化學家們很少會畫出分子內所有的鍵,通常以condensed structureCH3(CHH 鍵不被繪出。
歐亞書局圖2.2一些丁烷(相同,這些結構僅意味著丁烷具有一條由四個原子形成的連續鏈。
歐亞書局歐亞書局歐亞書局圖2.3歐亞書局歐亞書局關於烷基的命名:在圖歐亞書局符號歐亞書局試舉出化學式歐亞書局第2 章烷類:有機化合物的特性p.46 本書所用的命名系統是依據國際純粹及應用化學聯合歐亞書局支鏈烷類如何命名,除了最複雜的支鏈烷類之外,其須要「轉彎」:歐亞書局(b)歐亞書局步驟歐亞書局步驟歐亞書局歐亞書局步驟歐亞書局歐亞書局當我們在命名含有上述這些烷基的烷類之一時,未帶連字號的字首iso-被視為烷基名稱的一部分而依其英文字母順序來排列,而字首sec-和tert-則否。