第三单元 物质构成的奥秘
- 格式:docx
- 大小:168.11 KB
- 文档页数:2

第三章物质构成的奥秘1、原子构成:由居于原子中心带正电的原子核和核外带负电的电子构成。
原子核由质子和中子构成。
每个质子带一个单位的正电荷,每个电子带一个单位的负电荷,中子不带电。
①质子数=电子数=核电荷数②原子质量集中在原子核上③质子数不一定等于中子数;不是所有原子都有中子(氢原子无中子)2、相对原子质量(Ar):以一种碳原子质量的1/12为基准,其他原子质量与它的比值叫做这种原子的相对原子质量;①公式:,它是一种比值,单位是1,省略不写。
②Ar≈质子数+中子数。
3、元素:具有相同核电荷数(即核内质子数)的一类原子的总称。
元素种类由质子数决定。
4、地壳中元素含量顺序:氧硅铝铁钙钠钾、还有镁氢和其他;5、元素符号书写:遵循“一大二小”6、记忆元素符号:氢H、氦He、锂Li、铍Be、硼B、碳C、氮N、氧O 、氟F、氖Ne、钠Na、镁Mg、铝Al、硅Si、磷P、硫S、氯Cl、氩Ar、钾K、钙Ca、锰Mn、铁Fe、铜Cu、锌Zn、银Ag、钡Ba、金Au、铅Pb、汞Hg(共30种)7、元素符号意义:①表示一种元素(宏观意义);②表示该元素的一个原子(微观意义)。
元素符号前有系数只表示原子个数。
如:H:表示氢元素,表示一个氢原子。
2H:表示2个氢原子。
8、元素是宏观概念,只讲种类,不讲个数。
用“…由某元素组成”来描述;分子、原子、离子是构成物质的三种微观粒子,即讲种类,又讲个数,用“构成”描述。
如;由分子构成的物质,有4种描述方法(以水为例)①水由氢元素和氧元素组成;②水是由水分子构成的;③水分子由氢原子和氧原子构成;④一个水分子由两个氢原子和一个氧原子构成;由原子或离子构成的物质,有2种描述方法(以汞、食盐为例):①汞是由汞元素组成的;食盐是由钠元素和氯元素组成的;②汞是由汞原子构成的;食盐是由钠离子和氯离子构成的;9、元素周期表。
原子序数=质子数=电子数=核电荷数①每一横行叫做—个周期:共有七个横行,有七个周期。

第三单元物质构成的奥秘课题一、分子和原子一、物质由微观粒子构成(分子、原子、离子)1、物质是由分子、原子、离子微观粒子构成的。
2、微观粒子的质量和体积都很小。
3、微观粒子总是在不断运动着;温度越高,运动越快。
4、微观粒子之间存在间隔;一般气>液>固,间隔慢慢变小。
5、同种分子的化学性质相同,不同种分子的化学性质不同。
二、分子可以分为原子1、由分子构成的物质,分子是保持其化学性质的最小粒子。
2、分子是由原子构成的。
3、原子是化学变化中的最小粒子。
4、分子与原子分子原子定义分子是保持物质化学性质最小的微粒原子是化学变化中的最小微粒。
相同点体积小、质量小;不断运动;有间隙联系分子是由原子构成的。
分子、原子都是构成物质的微粒。
区别化学变化中,分子可分,原子不可分。
化学反应的实质:在化学反应中分子分裂为原子,原子重新组合成新的分子。
课题二、原子的结构一、原子的构成原子是由居于原子中心的原子核与核外电子构成的。
原子核是由质子和中子构成的。
(氢除外)1、原子不显电性。
每个质子带一个单位正电荷,中子不带电,所以原子核带正电;每个电子带一个单位负电荷。
质子和核外电子数量相等、电性相反,所以整个原子不带电。
2、原子中有:质子数=核外电子数=核电荷数=原子序数二、原子核外电子的排布1、原子核外电子是分层排布的,可用原子结构示意图简单表示,右图表示的是铝原子的结构——核电荷数为13,质子数13,核外总的电子数13,核外第一电子层上有2个电子,第二电子层上有8个电子,第三电子层(最外层)上有3个电子。
原子整体不带电。
分子由原子构成,分子也不带电。
不带电的微粒有:中子、原子、分子。
2、电子电子层的规律:(1)原子的核外电子最少一层,最多七层。
离核最近的为第一层,依次类推;最远的也叫最外层。
(2)第一层最多容纳2个电子,第二层最多容纳8个电子,第三层最多容纳18个电子。
(3)最外层电子层不超过8个,(只有一层的不超过2个)3、元素性质特别是化学性质与原子核外电子的排布,特别是最外层上的电子数有密切关系。



九年级化学上册第三单元:《物质构成的奥秘》知识点九年级化学上册第三单元:《物质构成的奥秘》知识点九年级化学上册第三单元:《物质构成的奥秘》知识点[知识结构]分子原子核(带正电)质子(带正电)物原原子(不显电性)中子(不带电)质子核外电子(带负电)构结排布规律成构原子核外电子的排布结构示意图含义的金属原子奥原子分类非金属原子秘离定义稀有气体原子子分类书写相对定义原子公式质量理解分布元素符号书写以及原则符号意义元素结构周期表规律[知识梳理]一、分子1、分子定义:分子是保持物质化学性质的最小粒子。
分子是由原子构成的。
2、分子性质:分子质量和体积都很小;分子总是在不断运动;分子之间有间隔;同种分子性质相同,不同种分子性质不同。
3、物理变化:分子本身没有发生变化,分子的化学性质不变。
化学变化:分子本身发生变化,生成了新的分子,不再保持原分子的化学性质。
典例1[湖南益阳]建立宏观和微观之间的联系对学习化学十分重要。
下列宏观事实的微观解释错误的是()A.品红在水中扩散﹣﹣分子在不断运动B.水蒸发由液态变成气态﹣﹣水分子发生改变C.NO与NO2化学性质不同﹣﹣构成物质的分子不同D.10mLH2O与10mLC2H5OH混合后体积小于20mL﹣﹣分子间有间隔[答案]B[解析]A、品红在水中扩散,是因为品红分子是在不断的运动的,运动到水分子中间去了,故选项解释正确。
B、水蒸发由液态变成气态,是因为水分子间的间隔发生了改变,故选项解释错误。
C、NO与NO2化学性质不同,是因为它们分子的构成不同,不同种的分子化学性质不同,故选项解释正确。
D、10mLH2O与10mLC2H5OH混合后体积小于20mL,是因为分子之间有间隔,一部分水分子和酒精分子会互相占据分子之间的间隔,故选项解释正确。
故选:B。
典例2[甘肃兰州一模]下列关于分子和原子的说法,错误的是()A.分子和原子都可以构成物质B.由分子构成的物质,分子是保持其化学性质的最小粒子C.在化学变化中,分子可以分成原子,原子又可以结合成新的分子D.分子和原子之间都有间隔,分子之间间隔较大,原子之间间隔较小[答案]D[解析]A、分子、原子和离子都是构成物质的微粒,故A正确;B、由分子构成的物质,分子是保持其化学性质的最小微粒,故B正确;C、在化学变化中,分子分成原子,原子再重新结合成新的分子,原子是在化学变化中不能再分的最小微粒,故正确.D、分子和原子之间都有间隔,分子之间的间隔不一定比原子间的间隔大,故D 错误;故选D。


九年级化学第三单元《物质构成的奥秘》知识点课题1 分子和原子1.物质分别是由分子、原子、离子三种微粒构成的,其中分子又是由原子构成的。
物质由元素组成。
如:水是由氢元素、氧元素组成的;水是由水分子构成的;水分子是由氢原子和氧原子构成的。
(举一反三)2、分子(1)概念:分子是保持物质化学性质的最小粒子。
注意:分子只能保持物质的化学性质,但不能保持物质的物理性质,因为一些物理性质(如颜色、状态等)是由大量的分子聚集在一起才表现出来,单个分子不能表现。
(2)分子的基本性质①分子体积和质量都很小。
②分子间有间隔,且分子间的间隔受热增大,遇冷缩小,气态物质分子间隔最大。
③分子在不停运动。
④同种物质的分子化学性质相同,不同种物质的分子化学性质不同。
(3)分子的内部结构①在化学变化中分子可分成原子,分子是由原子构成的;②同种元素的原子构成单质分子,不同种元素的原子构成化合物的分子。
3、原子(1)概念:原子是化学变化中的最小粒子。
(2)化学反应的实质:在化学反应中,分子可分成原子,原子重新组合成新的分子。
(3)分子与原子的本质区别:在化学变化中分子可分,而原子不可再分。
(4)分子与原子的联系:分子是由原子构成的,分子分成原子,原子经过组合可构成分子。
金属单质,如:铁、铜、金等(5)由原子直接构成的物质:固体非金属单质,如:硫、磷、硅等稀有气体单质,如:氦气、氖气、氫气。
4、分子与原子化学反应的实质:在化学反应中分子分裂为原子,原子重新组合成新的分子。
4、原子观点解释有关问题和现象(1)物理变化和化学变化①物理变化:分子本身没有变化;②化学变化:分子本身发生改变,原子重新组合。
(2)纯净物和混合物(由分子构成的物质)①纯净物:由同种分子构成的物质,如:水中只含有水分子;②混合物:由不同种分子构成的物质。
(3)有些生活中的现象和自然现象也可用分子、原子的观点解释。
如:衣服晾晒、花香、热胀冷缩、溶解、蒸发、物质三态变化、气体压缩等。


第三单元物质构成的奥秘课题1 分子和原子一、物质由微观粒子构成1、物质的构成物质是由分子、原子、离子微观粒子构成的。
由分子构成的物质如二氧化碳、水、氧气、氮气、氢气由原子直接构成的物质有金属、稀有气体、固体非金属单质如硅、金刚石由离子构成的物质如氯化钠,由钠离子和氯离子构成。
2、分子(原子)的性质(1)分子(原子)的质量和体积都很小。
(2)分子(原子)是不断运动的。
探究分子运动现象实验:①实验1与实验2探究过程:向盛有蒸馏水的烧杯A中滴加酚酞溶液,溶液为无色,说明水不能使酚酞变色;再从烧杯A中取少量溶液滴加浓氨水,溶液变红,说明浓氨水能使酚酞变红。
②实验3探究过程:(如图所示)现象:A烧杯中溶液变红,B烧杯中没有明显现象。
产生这一现象的原因:氨气分子运动到A烧杯中,溶于水生成氨水,氨水能使酚酞变红。
结论:(1)分子是运动的(2)浓氨水有挥发性(3)酚酞遇氨水变红(4)氨水显碱性(3)分子(原子)间有间隔分子之间的间隔大小受物质的状态和温度影响,具体为:①气体分子间的间隔> 液体分子间的间隔> 固体分子间的间隔②温度:温度升高,分子间隔变大。
3、思考题:(1)课本48页实验3-1说明分子具有什么性质?分子是不断运动的,分子之间有间隔(2)下列实例说明分子的哪些特点?(1)1个水分子的质量约是3ⅹ10-26kg(2)物质的热胀冷缩(3)100ml的酒精和100ml的水混合后体积小于200ml(4)香水和汽油都要密封保存(5)25m3的石油气可以在加压的情况下装入容积为0.024m3的钢瓶中。
(1)(说明分子的质量和体积都很小)(2)(说明分子之间有间隙)(3)(说明分子之间有间隙)(4)(说明分子是不断运动的)(5)(说明分子之间有间隙)二、分子可以分为原子1、用分子的观点解释物质的变化物质发生物理变化时,分子本身不发生变化,物质的化学性质不变,改变的只是分子之间的间隔;发生化学变化时,分子分成原子,原子又重新结合成新的分子,物质的化学性质改变。

《第三单元物质构成的奥秘》(第1课时)复习教案复习目标:1、进一步了解构成物质的微粒及其性质,能用分子、原子的观点解释某些常见的变化和现象。
2、明确构成物质的微粒间的区别和联系。
3、从微观角度认识物理变化和化学变化的区别。
4、了解原子的结构及离子的形成。
5、通过对知识的回忆,在老师的指导下形成知识体系,提高归纳和获取信息的能力。
复习重点:构成物质的微粒及其性质;原子的结构;离子的形成。
复习难点:物质微粒观的建立和知识体系的形成。
复习方法:引导式教学、讲授法、讨论法、多媒体辅助教学。
教师活动学生活动设计意图导入:现在天气比较炎热,我们每天都要补充一定量的水。
一瓶350ml的水按20滴每毫升计算,有7000滴,别小看这每一滴水,其中有许很大奥秘所在,你能否超越常人的眼光,从我们化学中物质构成的角度来看这一滴看似静止的水?展示:本课课题及复习目标说明:物质构成的奥秘在中考中约占21%的分值。
以下是通过例题小结各知识点的方式对分子、原子、离子的有关知识进行逐一复习。
引导学生归纳概括出物质微观构成的知识体系(见板书)以水的构成为起点,回忆本单元物质构成的知识。
完善知识体系通过学生对水的构成的认识来检测其对本单元内容的掌握情况让学生明确本节课复习内容及目标帮助学生把零散的知识系统化1、分子例:从分子的角度分析并解释下列问题:1、滴水中有1.67*1021个水分子;2、冲泡白沙绿茶时闻到清香的气味;3、用打气筒给自行车胎打气;4、湿衣服在夏天比在冬天干得快;5、混合物与纯净物有什么不同?6、下列图中,“”和“”分别表示不同元素的原子,则其中表示纯净物的有_________。
完成例题,小结出分子的性质以及能从物质的微观构成上区分纯净物和混合物让学生善于用已有的知识来解释一些现象和问题过渡:水是单质还是化合物?水在一定条件下会发生变化,如蒸发、电解,两者是否属于同一变化?在变化过程中分子本身是否也会发生变化?2、分子与原子的区别和联系投影:水蒸发和电解的宏观及微观过程图片 习题巩固: (1)、下列说法中正确的是:( )A 、由分子构成的物质在发生物理变化时,分子本身发生了改变B 、原子不能直接构成物质C 、分子可以分成原子,原子不能再分D 、由分子构成的物质,分子是保持其化学性质的最小粒子 (2)、下列粒子的结构图中,能保持水的化学性质的是( )A B C D (3)、苯是一种重要的化学工业原料,下图是苯分子的结构图,下列有关苯的说法正确的是( ) A 、苯是无机化合物 B 、苯的化学式为C 6H 6C 、苯中含有6个碳原子和6个氢原子D 、苯中碳、氢元素质量比为1:1(4)、汽车“尾气催化转换器”将尾气中的有毒气体转变为无毒气体。
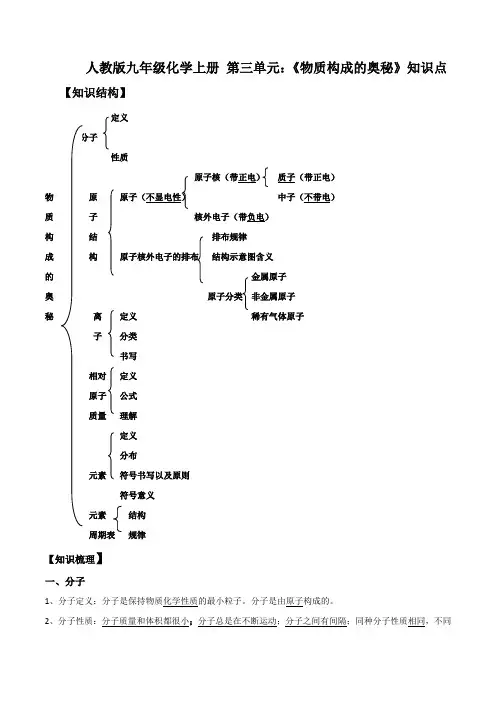
人教版九年级化学上册第三单元:《物质构成的奥秘》知识点【知识结构】定义性质原子核(带正电)质子(带正电)物原中子(不带电)质子核外电子(带负电)构结排布规律成构结构示意图含义的金属原子奥非金属原子秘离定义稀有气体原子子分类书写相对定义原子公式质量理解定义分布元素符号书写以及原则符号意义元素结构规律【知识梳理】一、分子1、分子定义:分子是保持物质化学性质的最小粒子。
分子是由原子构成的。
2、分子性质:分子质量和体积都很小;分子总是在不断运动;分子之间有间隔;同种分子性质相同,不同种分子性质不同。
3、物理变化:分子本身没有发生变化,分子的化学性质不变。
化学变化:分子本身发生变化,生成了新的分子,不再保持原分子的化学性质。
典例1 建立宏观和微观之间的联系对学习化学十分重要。
下列宏观事实的微观解释错误的是()A.品红在水中扩散﹣﹣分子在不断运动B.水蒸发由液态变成气态﹣﹣水分子发生改变C.NO与NO2化学性质不同﹣﹣构成物质的分子不同D.10mL H2O与10mL C2H5OH混合后体积小于20mL﹣﹣分子间有间隔【答案】B【解析】A、品红在水中扩散,是因为品红分子是在不断的运动的,运动到水分子中间去了,故选项解释正确。
B、水蒸发由液态变成气态,是因为水分子间的间隔发生了改变,故选项解释错误。
C、NO与NO2化学性质不同,是因为它们分子的构成不同,不同种的分子化学性质不同,故选项解释正确。
D、10mL H2O与10mL C2H5OH混合后体积小于20mL,是因为分子之间有间隔,一部分水分子和酒精分子会互相占据分子之间的间隔,故选项解释正确。
故选:B。
典例2下列关于分子和原子的说法,错误的是()A.分子和原子都可以构成物质B.由分子构成的物质,分子是保持其化学性质的最小粒子C.在化学变化中,分子可以分成原子,原子又可以结合成新的分子D.分子和原子之间都有间隔,分子之间间隔较大,原子之间间隔较小【答案】D【解析】A、分子、原子和离子都是构成物质的微粒,故A正确;B、由分子构成的物质,分子是保持其化学性质的最小微粒,故B正确;C、在化学变化中,分子分成原子,原子再重新结合成新的分子,原子是在化学变化中不能再分的最小微粒,故正确.D、分子和原子之间都有间隔,分子之间的间隔不一定比原子间的间隔大,故D错误;故选D。
第三单元物质构成的奥秘1.分子(1)概念:分子是保持物质化学性质的最小粒子。
分子只能保持物质的化学性质,不能保持物理性质。
如冰、水、水蒸气的构成粒子都是H2O分子,它们的物理性质不同,但化学性质相同。
(2)性质:①分子很小(质量小、体积小);②分子在不停地运动(温度越高,分子能量越大,分子运动越快);③分子间有间隔[其他条件相同时,温度越高分子间隔越大(热胀冷缩的原因);压强越大分子间隔越小]。
物质挥发、扩散、溶解等现象说明分子在不停地运动。
酒精与水混合后的总体积比两者体积之和略小、气体易被压缩等现象说明分子间有间隔。
(3)构成:分子是由原子构成的(描述具体分子的构成时原子要具体化。
如果指明一个(或每个)分子,则后面原子也要根据化学式说明相应原子的个数)。
如水(H2O)可以描述为:“水分子是由氢原子和氧原子构成的”或“一个水分子是由两个氢原子和一个氧原子构成的”。
过氧化氢(H2O2)可以描述为:“过氧化氢分子是由氢原子和氧原子构成的”或“每个过氧化氢分子是由2个氢原子和2个氧原子构成的”。
(4)应用:由同种分子构成的物质是纯净物(如冰水共存物都是由H2O分子构成的,是纯净物);由不同种分子构成的物质是混合物(如空气是由氮分子、氧分子、二氧化碳分子等构成的,是混合物)。
2.原子(1)概念:原子是化学变化中的最小粒子。
(2)化学变化(即化学反应)的本质是原子的重新组合。
在化学反应前后,原子的种类和数目都不变,元素的种类也不变(即元素守恒),但分子的种类一定发生改变(生成新物质)。
分子在化学反应中发生变化的过程为:分子(3)结构:①原子由原子核与核外电子构成,原子核由质子和中子构成(有一种氢原子没有中子)。
1个质子带1个单位正电荷,1个电子带1个单位负电荷,中子不带电。
核电荷数=质子数=原子的核外电子数=原子序数②相对原子质量:以1个碳12原子质量的1/12为标准,其他原子的质量与它相比较所得到的比,单位为1。
第三单元物质构成的奥秘知识总结课题一分子和原子考点一:物质是由微观粒子构成的。
1、物质是由微观粒子构成的,微观粒子主要是分子、原子和离子。
2、微观粒子是真实存在的。
3、微观粒子的性质:①粒子的质量、体积都很小。
②粒子总是运动的(温度越高,粒子的运动速率越快)说明:利用此知识点可以解释:气味、扩散、挥发、液体蒸发、气化、溶解等常见现象。
③粒子之间存在着间隔。
(一般情况下,对于同一物质的三种状态,间隔顺序为:气体>液体>固体。
特别注意的是,同质量的水,冰的体积比水的体积大)说明:利用此知识点可以解释:热胀冷缩现象、气体可以压缩、同质量的物质、一般情况下物质在固态、液态、气态时所占据的体积不同。
以上可以总结为“两小、一动、一间隔”,它是所有粒子都具有的性质。
④同种分子的化学性质相同,不同种分子的化学性质不同。
例如:过氧化氢分子的化学性质和水分子的化学性质不同。
考点二:分子可以分为原子(分子是由原子构成的)1、由分子构成的物质有以下几种:①大部分的气体:例如:氧气()氮气()氢气()氯气()臭氧()二氧化碳()一氧化碳()氨气()氯化氢()②水()过氧化氢()③有机物:甲烷()乙醇【俗称酒精】()乙酸【俗称醋酸】()葡萄糖()④其他物质:氧化汞()足球烯()【要求写出上述物质的化学符号】从上可以看出:有些物质的分子是由同一种原子构成的,有些物质的分子是由不同的原子构成的。
2、由分子构成的物质在发生物理变化时,分子本身不变,只是分子的运动速率或者分子之间的间隔发生了变化。
例如:水蒸发仅仅是水分子运动到了空气中,同时水分子之间的间隔变大了,但是分子本身不变化。
由分子构成的物质在发生化学变化时,分子分开变成了原子,原子重新进行了新的组合产生了新的分子。
例如:过氧化氢分解时,过氧化氢分子分开变成了氢原子和氧原子,氢原子和氧原子重新组合变成了水分子和氧分子。
水分子和氧分子就不能够保持过氧化氢的化学性质了。
一、选择题1.关于如图所示实验有以下说法,其中正确的说法组合是()①该实验用到了对比的方法②该实验能证明分子在不断地运动③该实验能证明分子运动的快慢与温度有关④片刻后可观察到试管A中溶液变红⑤加热后氨分子的能量升高⑥加热后氨分子的质量变小A.①②③④⑤⑥B.①③④⑥C.②③④⑤D.①②③⑤D解析:D【分析】微观粒子是不断运动的,温度越高运动的越快;氨水显碱性,能使酚酞溶液变红色。
①该实验用到了对比的方法,该选项说法正确;②该实验过程中,酚酞溶液变红色,是因为氨分子在不断地运动,运动到酚酞溶液中时,和水结合生成氨水,氨水显碱性,能使酚酞溶液变红色,该选项说法正确;③该实验过程中,C中溶液变红色比B中快,说明温度越高,分子运动的越快,该选项说法正确;④片刻后不能观察到试管A中溶液变红,该选项说法不正确;⑤加热后氨分子的能量升高,该选项说法正确;⑥加热后氨分子的质量不变,该选项说法不正确。
故选D。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
2.亚硒酸钠可用于提升人体免疫力。
下图是硒元素在元素周期表中的部分信息及原子结构示意图。
有关说法正确的是()A.硒原子易得电子B.硒是一种金属元素C.硒原子的质量为78.96g D.硒原子核内中子数为34A解析:AA、原子中,质子数=核外电子数,34=2+8+18+n,n=6,最外层电子数是6,在化学反应中易得到2个电子而形成阴离子,故选项说法正确。
B、硒带“石”字旁,属于固态非金属元素,故选项说法错误。
C、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为78.96,相对原子质量单位是“1”,不是“克”,故选项说法错误。
D、根据元素周期表中的一格可知,左上角的数字表示原子序数,该元素的原子序数为34;根据原子中原子序数=核电荷数=质子数=核外电子数,则该元素的原子核内质子数和核外电子数为34,而不是中子数为34,故选项说法错误。
完整版)第三单元物质构成的奥秘知识点总结第三单元物质构成的奥秘:分子和原子考试要求:1.了解物质的微粒性,认识分子、原子是构成物质的微粒。
2.能够用微粒的观点解释常见的物理现象和化学现象。
3.知道原子可以结合成分子。
4.能够用分子和原子的观点认识化学变化。
考点一、构成物质的微粒:分子、原子等微粒1.由分子构成的物质:例如水、二氧化碳、氢气、氧气等物质。
2.由原子构成的物质:金属、稀有气体、金刚石、石墨等物质。
3.由离子构成的物质:氯化钠等物质。
4.物质构成的描述:物质由××分子(或原子)构成。
例如:铁由铁原子构成;氧气由氧分子构成。
考点二、分子1.基本性质:⑴质量、体积都很小。
⑵不断运动且与温度有关。
温度越高,运动速率越快。
例如:水的挥发、品红的扩散。
⑶分子间存在间隔。
同一物质气态时分子间隔最大,固态时分子间隔最小。
物体的热胀冷缩现象就是分子间的间隔受热时增大,遇冷时变小的缘故。
压强增大,分子间的间距减小。
⑷同种物质间分子的性质相同,不同物质间分子的性质不同。
2.分子的构成:分子由原子构成。
分子构成的描述:①××分子由××原子和××原子构成。
例如:水分子由氢原子和氧原子构成。
②一个××分子由几个××原子和几个××原子构成。
例如:一个水分子由一个氧原子和两个氢原子构成。
3.含义:分子是保持物质化学性质的最小微粒。
(该物质由分子构成)例如:氢分子是保持氢气化学性质的最小粒子。
若该物质由原子构成,则对应的原子是保持该物质化学性质的最小微粒。
例如:铁原子是保持铁化学性质的最小微粒。
4.从分子和原子角度来区别下列几组概念⑴物理变化与化学变化由分子构成的物质,发生物理变化时,分子种类不变,原子的种类不变。
发生化学变化时,分子种类发生了改变,原子种类不变。
⑵纯净物与混合物由分子构成的物质,纯净物由同种分子构成;混合物由不同种分子构成。
第三单元物质构成的奥秘课题1分子和原子知识与技能1.认识物质是由分子、原子等微小粒子构成的。
2.认识分子是保持物质化学性质的最小粒子;原子是化学变化中的最小粒子。
3.能运用分子、原子的观点解释一些简单的生活和实验现象。
过程与方法1.学习通过观察自然、实验、识图等方法获取信息,学习运用想象类比、分析归纳、推理判断等方法处理信息。
2.能在教师的启发和指导下通过与他人合作实验的形式,对有疑惑且有探究价值的问题进行研究,实验中注意观察与思考相结合;对实验观察的结果和分析能用文字、图表及化学语言进行表述和交流。
3.认识科学探究的基本程序和一般方法,逐步形成良好学习习惯和方法。
情感、态度与价值观1.体验探究活动的乐趣,保持和增强对化学现象的好奇心和探究欲,发展学习化学的兴趣。
培养合作意识以及勤于思考、严谨求实、勇于创新和实践的科学精神。
2.建立“世界是物质的,物质是可分的”的辩证唯物主义认识观。
重点认识物质的微粒性;能用微粒的观点解释日常生活中的一些现象。
难点理解化学反应的实质。
烧杯(大小各5只)、试管、酒精灯、品红、浓氨水、酚酞溶液、酒精、水等。
一、导入新课投影四幅Flash动画画面1.小明站在阳台上想:湿衣服晒干,水跑到什么地方去了?2.路过花店时,小丸子对小英子说:我闻到了花香,你闻到了吗?3.冲糖水时,小刚感到迷惑,把白砂糖放入开水中,为什么糖不见了,而杯中的水却有了甜味?4.小强指着马路问爸爸:马路为什么要隔成许多小泥块,块与块之间的间隔冬天和夏天为何不一样宽?以上四种现象在生活中司空见惯,我相信我们一起学完分子和原子的知识以后,你一定会解释以上现象。
二、推进新课(一)分子及其特点[实验]品红在水中扩散你看见了什么?你怎样解释这种现象?结论1:宏观物质都是由微小的粒子——分子、原子构成的。
分子、原子是真实存在的。
播放动画:分子在水中扩散的微观过程投影:1.苯分子的照片;2.移走硅原子构成的文字活动与探究向盛有约40mL蒸馏水的烧杯中加入5~6滴酚酞试剂,搅拌均匀,观察溶液的颜色。
第三单元物质构成的奥秘课题1 分子和原子一、构成物质的微粒分子、原子、离子二、分子1、分子的基本性质(1)分子的质量和体积都很小(2)分子在不断的运动且温度越高,分子能量越大,运动速率越快(例如扩散、溶解、挥发等)【拓展实验】某兴趣小组做以下实验探究分子的运动,请完成实验中的有关问题。
①实验一:在盛有少量蒸馏水的小烧杯中滴入2至3滴酚酞试液,再向其中滴加浓氨水。
由实验一得出的结论有:蒸馏水不能使酚酞溶液变红,氨水能使酚酞溶液变红。
②实验二(如图1):烧杯B中的现象是:酚酞溶液变红,产生这一现象的原因是:浓氨水具有挥发性,挥发出的氨分子运动到烧杯B溶于水形成氨水使酚酞溶液变红。
③为使实验结论准确可靠,该兴趣小组设计了实验三(如图2所示)作为对比实验,你认为有无必要?理由是什么没必要;实验一已经证明蒸馏水不能使酚酞溶液变红。
(3)分子之间有间隔(通常情况下,气体分子间间隔>液体、固体分子间间隔,例热胀冷缩、三态变化、1+1<2)(4)同种分子化学性质相同,不同种分子化学性质不同2、定义:由分子构成的物质,分子是保持物质化学性质的而最小粒子。
注意:物质由什么微粒构成,化学性质就由什么微粒保持。
3、运用分子的观点解释混合物、纯净物、物理变化和化学变化(1)混合物宏观:由两种或两种以上物质混合的微观:由不种分子构成的(2)纯净物宏观:由同种物质组成的微观:由同种分子构成的(3)物理变化宏观:没有其他物质生成的变化微观:分子种类不变,改变的是分子间的间隔。
(4)化学变化宏观:有其他物质生成的变化,又叫化学反应微观:分子种类改变4、分子由原子构成三、原子(由原子直接构成的物质:金属、稀有气体、固态非金属)原子是化学变化中的最小粒子。
(原子的性质同分子)四、分子和原子的区别联系1、联系:①分子是由原子构成的②分子和原子都是构成物质的一种微粒。
2、根本区别在化学变化中,分子可分原子不可分。
课题2 原子的结构一、原子的结构质子(一个质子带一个单位的正电荷) 原子核1、原子 中子(中子不带电)核外电子(一个电子带一个单位的负电荷)(1)原子序数= 核电荷数 = 质子数 = 核外电子数(2)原子不显电性的原因:质子和电子所带电荷数量相等,电性相反。
第1页,共4页第2页,共4页
__
--------线------------------第三单元物质构成的奥秘
一、考点知识梳理 考点一原子及其构成 1.原子的构成 (+)(+)每个带一个单位正电荷 原(不显电性,普通氢原子没有) 子(-)每个带一个单位负电荷。
【要点提示】整个原子是不显电性的,在原子中,核电荷数=质子数=核外电子数。
2.原子结构示意图
原子结构示意图可简洁、方便地表示原子的结构,其各部分的意义如下图所示(以铝原子为例):
3.相对原子质量及其近似计算
定义:国际上以一种碳原子(碳--12)质量的1/12作为标准,其他原子的质量与它相比所
得的数值,就是该原子的相对原子质量。
公式:某原子的相对原子质量 = 近似计算公式:相对原子质量= 考点二元素及元素周期表
1.定义:元素是具有相同(即核内)的一类原子的总称。
3.元素符号表示的意义:(1)宏观:表示一种元素。
(2)微观:表示这种元素的一个原子。
【要点提示】①元素符号前面加数字,只具有微观意义。
例如:2H ,只表示2个氢原子;②金属、固态非金属和稀有气体习惯用元素符号表示,所以它们还能表示一种物质。
如Fe ,还能表示铁单质。
每一横行叫做一个,每一纵行叫做一个,
每种元素占一格,每格均包括元素的
等内容(如上图)。
考点三离子
1.定义:带电的或:。
带正电的是阳离子,带负电的是阴离子。
2.离子符号的意义 表示
类型一原子结构
1.2011年3月,日本近海强震引发的海啸,造成福岛核电站发生核泄漏事件,导致周边环境出现碘131超标。
碘131原子的核电荷数为53,相对原子质量为131。
碘原子的核外电子数为
A .131
B .127
C .78
D .53
2.硒是人体必需的一种微量元素,严重缺硒有可能诱发皮肤疾病。
已知硒的原子序数为34,质子数与中子数之和为79。
下列有关硒原子的说法中,不正确的是
A .核外电子数为34
B .核电荷数为79
C .质子数为34
D .中子数为45 类型二元素和元素周期表
4.根据图3的有关信息判断,下列说法错误的是
A.氯原子的核电荷数为17
B.钠的原子结构示意图中X=8
C.氯原子的相对原子质量为35.45
D.在化学反应中,钠原子容易得到1个电子 5.下图是元素周期表中钠元素的相关信息及其原子结构示意图,下列说法正确的是
A .钠元素属于非金属元素
B .钠原子核外有一个电子
C .钠的相对原子质量为11
D .钠原子在化学反应中易失电子 6.下列物质的化学符号书写正确的是 ( )
A .氧化镁 MgO 2
B .氧化铝 AL 2O 3
C .水银Ag
D .二氧化硫SO 2: 7.请用化学符号填空: 1个氢原子。
2个氮分子。
第3页,共4页第4页,共4页
3个铁离子。
氮元素显+4价的氧化物。
8.下列四种粒子的结构示意图中,属于金属元素原子的是
9.航天探测发现:金星周围的大气层中含有三氧化二碳(C 2O 3)中碳元素的化合价为 A . +1 B . +2 C . +3 D . +4 10.生活中最常见的含钠元素的化合物是
A .NaOH
B .NaCl
C .Na 2CO 3
D .NaHCO 3 11.图1是初中化学课本上元素周期表中的一格,对图中信息的理解错误的是
A .①表示原子序数为9 B.②表示元素符号
C .③表示元素名称 D.④表示1个原子的质量为19.00 g
12.下列物质的化学式书写正确的是:( )
A .氮气N
B .碳酸HC03
C .硝酸钾KN03
D .二氧化硫02S 13.电脑硬盘的盘片表面涂覆一层Y--Fe20,磁粉,Y--Fe20。
中铁元素的化合价为:( ) A ..+1 B .+2 C .+3 D .-2
14.已知硅酸钠的化学式为Na 2SiO 3,硅酸钠中硅元素的化合价是( ) A . +2 B . +3 C . +4 D . +5 15.某微粒的结构示意图为 ,该粒子的最外层电子数是 A .7 B .8 C .9 D .10 16.某粒子的结构示意图如右图所示,下列说法正确的是
A .这是镁原子的结构示意图
B .这是镁离子的结构示意图
C .该粒子的质子数等于核外电子数
D .该粒子在化学反应中易失去电子
17
18
(1)原子序数为16的元素的名称是,硅的相对原子质量为。
(2)原子序数为13的元素符号为,该元素属于(填“金属”“非金属”或“稀有气体)元素。
(3)图2是某元素的原子结构示意图,该原子 核外有个电子层,在化学反应中容易 18.蛋白质是由多种氨基酸[丙氨酸:CH 3CH(NH 2)COOH 等]构成的极为复杂的化合物,人体通过食物获得蛋白质,在胃肠道里与水发生反应,生成氨基酸,试计算: (1)丙氨酸分子中氮原子与氧原子的个数比。
(2)丙氨酸的相对分子质量。
(3)丙氨酸中碳、氢、氧、氮元素的质量比。
19.右图是元素周期表中的一部分,请回答:
碳元素的原子核内质子数为6,
相对原子质量为:
由氢元素与原子序数为8的元素组成的化合物x 是
(人类生存必需的物质),X 在通电条件下发生反应的化学方程式为;将生石灰投入少量X 中,产生的现象是,反应的化学方程式为 20.“沙滩、树林、奇石”是我市4A 级旅游景区三娘湾的一大特色。
沙滩上的细沙的主要成分是二氧化硅(SiO 2,已知SiO 2
相对分子质量为60。
)
求:
(1)组成二氧化硅的元素共有种。
(2)SiO 2硅元素的相对原子质量是。
21.悠久的钦州人文文化造就了钦州坭兴陶独有的灵气与魅力。
2010年4月,19件钦
州坭兴陶入选上海世博会,这是钦州人民的一大喜事。
品质独特的钦州坭兴陶选用独具特性的陶土按一定的比例烧制而成。
陶土主要含SiO 2、Al
2O 3、Fe 2O 3
、TiO 2,还有少量的MgO 、SrO 、CaO 以及其他着色氧化物。
请你回答有关问题: (1)用于制作坭兴陶的陶土属于(填“纯净物”或“混合物”)。
(2)原子结构示意图为
的元素在陶土中含量最高,其最外层有个电子。
该元
素属于(填“金属”或“非金属”)元素。
(3)Al 2O 3中铝元素的化合价为 ,Fe 2O 3为 色的固体。
22.将一定质量的金属锌投入到146g 质量分数为10%,的稀盐酸中,恰好完全反应。
求:(1)加入锌的质量;(2)反应后溶液中溶质的质量分数。
图
1。