2019高考化学知识点双向细目表
- 格式:doc
- 大小:145.50 KB
- 文档页数:6
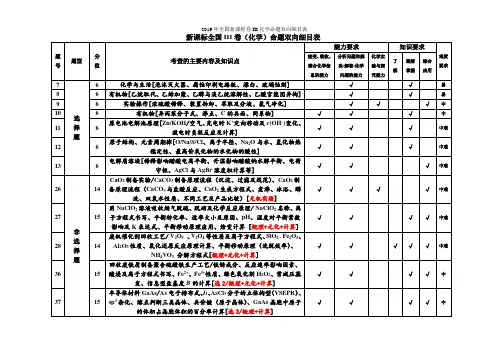

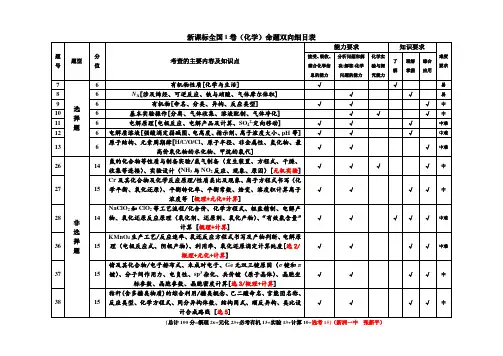
命题区间一化学基本素养的考查角度一关注“化学与技术、社会环境”的协调发展1.高考有关“化学与社会和谐发展”试题的选材热点总结(1)安全与健康——人体必需的营养元素;重金属对人体的危害;食品添加剂;有关化学与健康方面的材料等。
(2)大气污染雾霾——大气中可吸入颗粒物(PM10、PM2.5)过多,产生的主要原因有汽车尾气、化石燃料的燃烧、工业排放的废气(如:冶金、窑炉与锅炉、机电制造业等)、建筑工地和道路交通产生的扬尘。
酸雨(pH<5.6)——大气中含硫氧化物、含氮氧化物过多,与化石燃料的燃烧、工业废气的排放(如硫酸、硝酸的生产、冶金)、雷电等有关。
光化学烟雾——大气中的氮氧化物过多,与汽车尾气、化石燃料的燃烧有关。
(3)白色污染——人们对难降解的塑料垃圾(多指塑料袋)污染环境现象的一种形象称谓。
(4)能源清洁能源——天然气、氢气等在燃烧时不产生烟尘的能源;化石能源——天然气、石油和煤等能源;绿色能源——不产生负效应的能源,如氢能、风能、太阳能等;新能源——最新开发利用的能源,如氢能、风能、太阳能、核能等。
(5)无机材料一般可以分为传统的和新型的无机材料两大类。
传统的无机材料是指以二氧化硅及其硅酸盐化合物为主要成分制备的材料,因此又称硅酸盐材料,主要包括水泥、玻璃和陶瓷。
新型无机材料是指用氧化物、氮化物、碳化物、硼化物、硫化物、硅化物以及各种非金属化合物经特殊的先进工艺制成的具有某种优异性能的材料。
2.绿色化学的特点研究对环境没有任何副作用的化学试剂、化学制品和化学工艺。
它包括:(1)开发绿色反应,将原子利用率提高到100%;(2)使用无毒无害的原料;(3)选用无毒无害的催化剂;(4)使用无毒无害的溶剂;(5)发展“绿色工艺”;(6)开发和生产绿色产品。
角度二关注生产和生活中的常见物质1.熟记常见物质的俗名及化学式(1)明矾:KAl(SO4)2·12H2O(2)胆矾、蓝矾:CuSO4·5H2O(3)绿矾:FeSO4·7H2O(4)钡餐、重晶石:BaSO4(5)孔雀石(铜绿):Cu2(OH)2CO3(6)水晶、石英:SiO2(7)纯碱、苏打:Na2CO3(8)磁性氧化铁:Fe3O42.熟记生活中的下列物质(1)无机盐净水剂:氯化铁,硫酸亚铁,硫酸铁,硫酸铝,氯化铝,明矾。
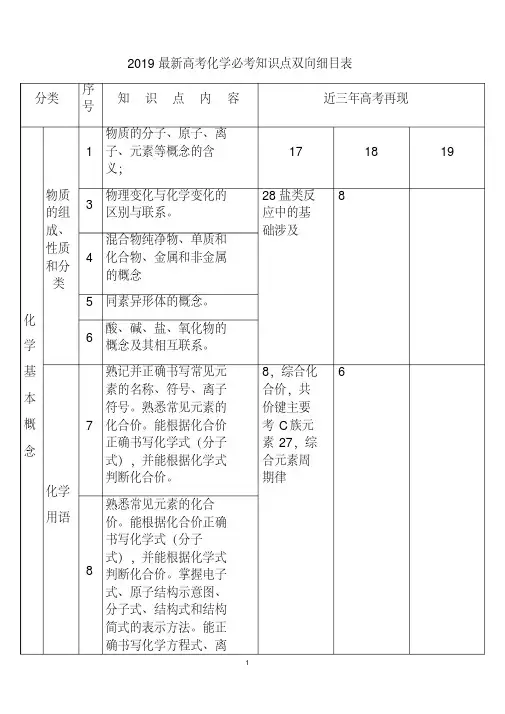
2019最新高考化学必考知识点双向细目表分类序号知识点内容近三年高考再现化学基本概念物质的组成、性质和分类1物质的分子、原子、离子、元素等概念的含义;17 18 193物理变化与化学变化的区别与联系。
28盐类反应中的基础涉及84混合物纯净物、单质和化合物、金属和非金属的概念5 同素异形体的概念。
6酸、碱、盐、氧化物的概念及其相互联系。
化学用语7熟记并正确书写常见元素的名称、符号、离子符号。
熟悉常见元素的化合价。
能根据化合价正确书写化学式(分子式),并能根据化学式判断化合价。
8,综合化合价,共价键主要考C族元素27,综合元素周期律68熟悉常见元素的化合价。
能根据化合价正确书写化学式(分子式),并能根据化学式判断化合价。
掌握电子式、原子结构示意图、分子式、结构式和结构简式的表示方法。
能正确书写化学方程式、离子方程式、电离方程式、电极反应式。
化学中常用计量12了解相对原子质量、相对分子质量的含义。
11,综合原子结构中等6,氧化还原涉及简单13物质的量的单位--摩尔(mol),摩尔质量、气体摩尔体积(相应单位为g·mol-1、L·mol-1)。
14物质的量浓度(mol·L-1)、阿伏加德罗常数。
15掌握物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系。
化学反应与能量16掌握化学反应的四种基本类型:化合、分解、置换、复分解。
12氧化还原、物质的量、化学计算中等26题一问6,综合部份物质的量计算,主要得失电子守恒、部份氧化还原,中上13题氧化与离子综合10,得失电子守恒,方程式配平17理解氧化还应反应,了解氧化剂和还原剂等概念。
掌握重要氧化剂、还原剂之间的常见反应。
18能判断氧化还原反应中电子转移的方向和数目,并能配平反应方程式。
19 了解化学反应中的能量变化,吸热反应、放热26,热方程,反应11热化学书写反应7热化学书写反应反应、反应热、燃烧热和中和热及新能源的开发等概念。
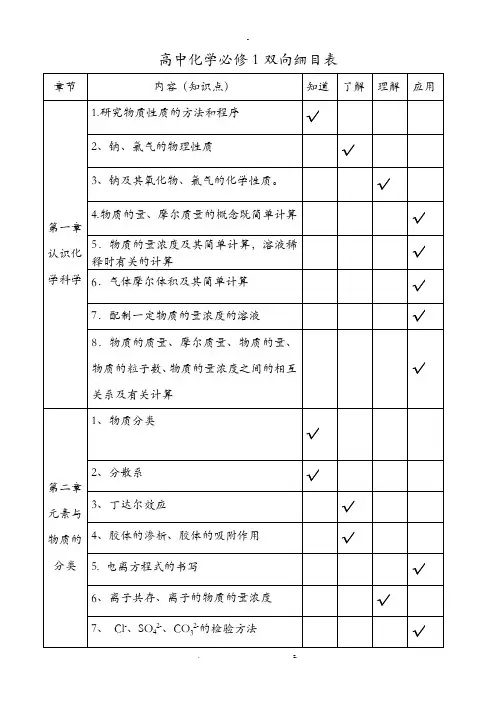
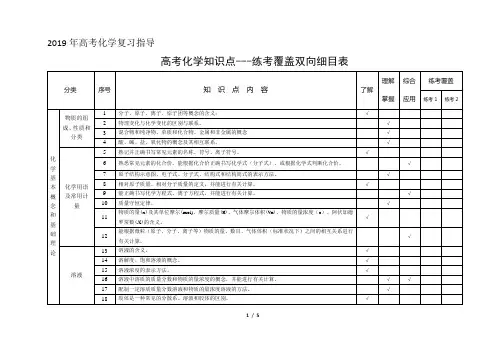
)2019 年高考化学复习指导高考化学知识点---练考覆盖双向细目表理解 综合 练考覆盖分类 序号知 识 点 内 容了解物质的组 成、性质和分类12 3 45 分子、原子、离子、原子团等概念的含义; 物理变化与化学变化的区别与联系。
混合物和纯净物、单质和化合物、金属和非金属的概念 酸、碱、盐、氧化物的概念及其相互联系。
熟记并正确书写常见元素的名称、符号、离子符号。
√√掌握√√√应用练考 1 练考 2化 6 熟悉常见元素的化合价。
能根据化合价正确书写化学式(分子式),或根据化学式判断化合价。
√学 7原子结构示意图、电子式、分子式、结构式和结构简式的表示方法。
√基 本 概 念 和 基 础化学用语 及常用计量8910 1112 相对原子质量、相对分子质量的定义,并能进行有关计算。
能正确书写化学方程式、离子方程式,并能进行有关计算。
质量守恒定律。
物质的量(n)及其单位摩尔(mol)、摩尔质量(M)、气体摩尔体积(Vm)、物质的量浓度(c )、阿伏加德 罗常数(NA 的含义。
能根据微粒(原子、分子、离子等)物质的量、数目、气体体积(标准状况下)之间的相互关系进行 有关计算。
√√√√√理 论1314溶液的含义。
溶解度、饱和溶液的概念。
√√ 溶液1516 溶液浓度的表示方法。
溶液中溶质的质量分数和物质的量浓度的概念,并能进行有关计算。
√√√17 配制一定溶质质量分数溶液和物质的量浓度溶液的方法。
√18物质结构19胶体是一种常见的分散系。
溶液和胶体的区别。
元素、核素和同位素的含义。
√√元素周期律2021原子构成。
原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
原子核外电子排布规律。
√√22元素周期律的实质。
√23元素周期表(长式)的结构(周期、族)及其应用。
√2425以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系以IA和ⅦA族为例,掌握同一主族元素性质递变规律与原子结构的关系。


化学双向细目表《化学双向细目表之化学式》同学们,今天咱们来好好唠唠化学式这个事儿。
化学式就像是化学世界里每个物质的“身份证”,它能告诉咱们这个物质是由啥组成的。
先说说化学式里的元素符号吧。
这元素符号就像每个原子的名字,比如H代表氢原子,O代表氧原子。
那原子们是怎么凑在一起组成分子或者化合物的呢?这就涉及到化学键啦。
化学键就好比是原子之间的小钩子。
离子键呢,就像是带正电和负电的原子像超强磁铁般吸在一起。
比如说氯化钠(NaCl),钠原子(Na)容易失去一个电子变成带正电的钠离子(Na⁺),氯原子(Cl)容易得到一个电子变成带负电的氯离子(Cl⁻),这一正一负就像磁铁的两极,吸得死死的,这就是离子键。
共价键呢,就是原子共用小钩子连接。
就像两个人共同拿着一个东西,互相牵制着。
比如说氢气(H₂),两个氢原子各自拿出一个小钩子(电子)来共用,这样就形成了共价键,组成了氢气分子。
那在化学的世界里啊,还有一个很有趣的概念叫化学平衡。
这化学平衡呢,咱们可以把它比作拔河比赛。
反应物和生成物就像两队人。
在拔河开始的时候,两边的力量不一样,可能反应物这边力量大,反应就朝着生成物的方向进行得快。
但是随着反应进行,生成物这边的力量慢慢增加,反应物这边力量慢慢减小。
直到最后达到一种状态,就是正逆反应速率相等,就像两队人谁也拉不动谁了,这时候浓度也不再变化了,这就是化学平衡。
咱们再说说分子的极性。
这分子的极性就类似小磁针。
比如说水(H₂O),它是极性分子。
氧一端就像磁针南极带负电,氢一端就像北极带正电。
你看水分子的形状是弯弯的,就像小磁针有两端不同的极性。
而二氧化碳(CO₂)呢,它是直线对称的,就像一个两边一样重的哑铃,是个非极性分子。
还有配位化合物,这就像一场聚会。
中心离子就是聚会的主角,配体呢就是提供孤对电子共享的小伙伴。
比如说在[Cu(NH₃)₄]²⁺这个配位化合物里,铜离子(C u²⁺)就是主角,氨分子(NH₃)就是小伙伴,氨分子把自己的孤对电子拿出来和铜离子共享,就形成了这样一个配位化合物。


高中化学命题双向细目表
高中化学命题双向细目表是一个指导教师命题的重要工具,它详细列出了高中化学的各个知识点和技能,以及它们在试卷中的比重和难度。
以下是一个简化的高中化学命题双向细目表,供您参考:
高中化学命题双向细目表
一、目标领域与认知层级
1. 知识
回忆
理解
应用
2. 技能
分析
判断
实验
3. 态度与价值观
兴趣与好奇心
安全意识
环境保护
二、内容主题
1. 物质结构与性质
分子、原子、离子的基本性质
元素周期表与元素性质
酸、碱、盐、氧化物的性质与反应2. 化学反应与能量
化学反应的类型与能量变化
电化学基础(原电池、电解池)3. 有机化学基础
常见有机物的结构与性质
有机反应类型与机理
4. 实验技能与安全
实验操作与仪器使用
实验设计与数据处理
实验安全与环境保护
5. 化学计算
物质的量与摩尔质量计算
化学反应中的定量关系与计算
6. 化学工艺流程与合成
实际生产中的化学工艺流程
有机合成与高分子合成基础
7. 综合应用
各主题的综合应用与分析解决实际问题能力。
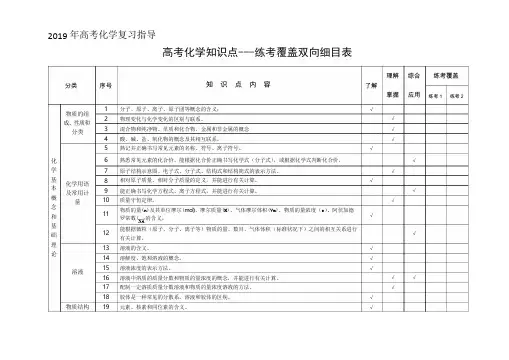
2019年高考化学知识点双向细目表分类序号知识点内容近三年高考再现化学基本概念物质的组成、性质和分类1物质的分子、原子、离子、元素等概念的含义;171819 3物理变化与化学变化的区别与联系。
28盐类反应中的基础涉及84混合物纯净物、单质和化合物、金属和非金属的概念5同素异形体的概念。
6酸、碱、盐、氧化物的概念及其相互联系。
化学用语7熟记并正确书写常见元素的名称、符号、离子符号。
熟悉常见元素的化合价。
能根据化合价正确书写化学式(分子式),并能根据化学式判断化合价。
8,综合化合价,共价键主要考C族元素27,综合元素周期律68熟悉常见元素的化合价。
能根据化合价正确书写化学式(分子式),并能根据化学式判断化合价。
掌握电子式、原子结构示意图、分子式、结构式和结构简式的表示方法。
能正确书写化学方程式、离子方程式、电离方程式、电极反应式。
化学中常用计量12了解相对原子质量、相对分子质量的含义。
11,综合原子结构中等6,氧化还原涉及简单13物质的量的单位一摩尔(mol),摩尔质量、气体摩尔体积(相应单位为g・molT、L-mol-1)o14物质的量浓度(mol-L-1)、阿伏加德罗常数。
15掌握物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系。
化学反应与能量16掌握化学反应的四种基本类型:化合、分解、置换、复分解。
12氧化还原、物质的量、化学计算中等26题一问6,综合部份物质的量计算,主要得失电子守恒、部份氧化还原,中上13题氧化与离子综合10,得失电子守恒,方程式配平17理解氧化还应反应,了解氧化剂和还原剂等概念。
掌握重要氧化剂、还原剂之间的常见反应。
18能判断氧化还原反应中电子转移的方向和数目,并能配平反应方程式。
19了解化学反应中的能量变化,吸热反应、放热反应、反应热、燃烧热和中和热及新能源的开发等概念。
26,热方程,反应热7分11热化学书写反应热,中等7热化学书写反应热,中等溶液20了解溶液的含义8涉及21了解溶液的组成,理解溶液中溶质的质量分数的概念。