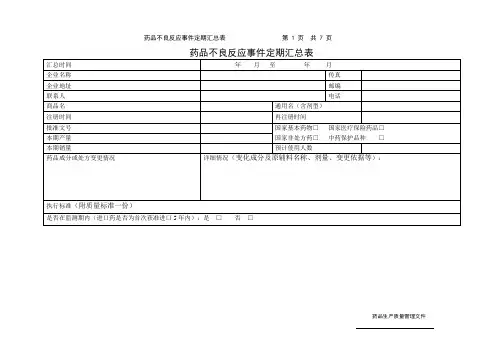
药品不良反应监测联系人登记表
- 格式:doc
- 大小:38.50 KB
- 文档页数:1

药物不良反应
登记本
定陶县人民医院注:每本50页,印100本
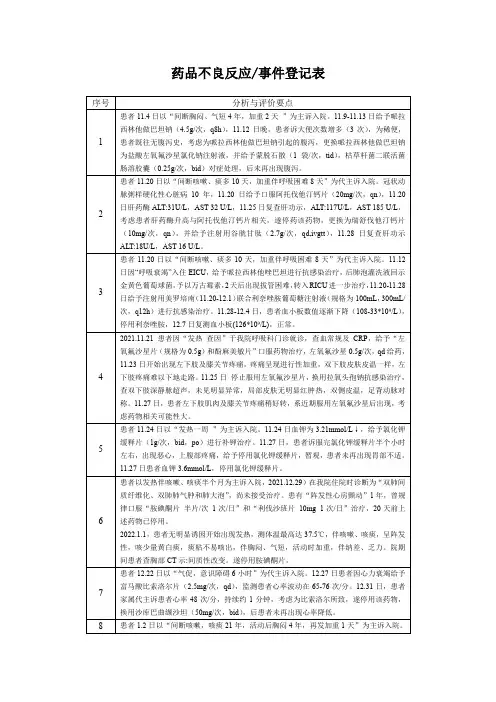
药品不良反应报告管理制度
一、药品不良反应、医疗器械不良事件的报告范围:
1、上市5年以内的药品、医疗器械和列入国家重点检测的药品、医疗器械,引起的所有不良反应事件
2、上市5年以内的药品、医疗器械,引起的严重、罕见的或新的不良反应。
二、药品不良反应主要包括药品已知和未知作用引起的副作用、毒性反应及过敏反应等。
三、一经发现可疑药品不良反应需详细记录、调查,按规定要求对典型病例详细填写《药品不良反应情况登记表》,并按规定报告。
四、应定期收集、汇总、分析药品不良反应信息,每季度直接向当地药品不良反应检测中心报告,严重、罕见的或新的药品、医疗器械(事件)不良反应病例,最迟不得超过15个工作日。
五、医疗机构各科室、药房工作人员应注意收集、分析、整理、上报本单位临床用药过程中发现的不良反应情况。
六、患者使用本医疗机构药品出现不良反应情况,经核实后,应按规定及时报告,并上报区食品药品监督管理部门。
七、药房工作人员发药时,应注意询问患者有无药物不良反应史,讲清必须严格严格按药品说明书服用,如用药后有异常反应,要及时停止用药并向医生咨询。
八、普查普治用药、预防用生物制品出现的不良反应群体和个体病例,必须随时向所在地卫生局、县食品药品监督管理局、不良反应检测中心报告。
欢迎您的下载,
资料仅供参考!
致力为企业和个人提供合同协议,策划案计划书,学习资料等等
打造全网一站式需求。
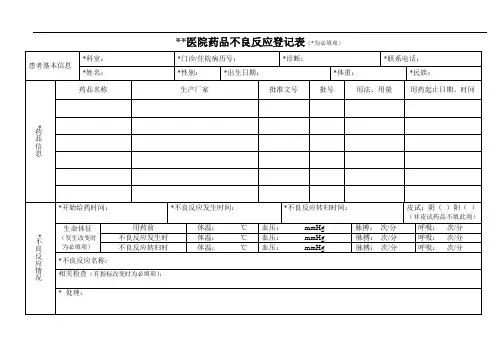


药品不良反应/ 事件记录表编号:部门:电话:记录日期:年月日患者姓名性别:男□女□出生日期:年月日民族体重(kg)联系方式家族药品不良反应/事件:有□无□不详□既往药品不良反应/事件情况:有□无□不详□不良反应/事件名称:不良反应/事件发生时间:年月日病历号/门诊号原患疾病:不良反应/事件过程描述(包括症状、体征、临床检验等)不良反应/事件处理情况(对病人的诊治情况):通用名称(含剂型,监测期内品种用*注明)生产厂家批号用法用量用药起止时间(日期、时分)国内外有无类似不良反应(包括文献报道)怀疑药品通用名称(含剂型,监测期内品种用*注明)生产厂家批号用法用量用药起止时间(日期、时分)国内外有无类似不良反应(包括文献报道)并用药品不良反应/事件的结果:治愈□好转□有后遗症□表现:死亡□直接死因:死亡时间:年月日对原患疾病的影响:不明显□病程延长□病情加重□导致后遗症□表现:导致死亡□可疑物品、药品采集、封存情况品种:状况:时间:可疑物品、药品送检情况是□否□物品、药品名称:检验结果细菌:有□无□菌种:热原:是否合格是□否□不良反应/事件后续调查、分析:不良反应/事件不良反应□(新的□严重□一般□)不良事件□及分类判定不良反应关联肯定□很可能□可能□可能无关□待评价□无法评价□性评价不良反应/事件后干预措施(向临床/药库/药房反馈、预警):记录人:报告人职业(医疗机构):医生□药师□护士□其他□报告人签名:◇不良反应/事件分析1.用药与不良反应/事件的出现有无合理的时间关系?有□无□2.反应是否符合该药已知的不良反应类型?是□否□不明□3.停药或减量后,反应/事件是否消失或减轻?是□否□不明□未停药或未减量□4.再次使用可疑药品后是否再次出现同样反应/事件?是□否□不明□未再使用□5.反应/事件是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释?是□否□不明□◇严重药品不良反应/事件是指有下列情形之一者:①引起死亡□②致畸、致癌或出生缺陷□③对生命有危险并能够导致人体永久的或显著的伤残□④对器官功能产生永久损伤□⑤导致住院或住院时间延长□。


附件:
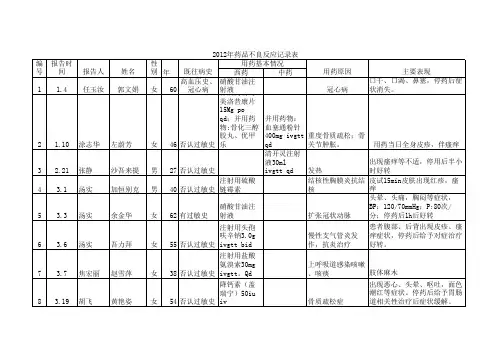
药品不良反应信息收集表YPBLFY-03-190101-01
ADR报告编码
患者姓名:性别:男□女□出生日期:年月日
或年龄:
民族:体重(kg):联系方式:
原患疾病:医院名称:不良反应/事件发生时间:年月日
药品商品名称
通用名称
(含剂型)
生产批号
用法用量
(次剂量、途径、日次数)
用药起止时间用药原因
怀疑药品
并用药
品
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况:
不良反应/事件的结果:痊愈□好转□未好转□不详□有后遗症□表现:
死亡□直接死因:死亡时间:年月日
停药或减量后,反应/事件是否消失或减轻?是□否□不明□未停药或未减量□
再次使用可疑药品后是否再次出现同样反应/事件?是□否□不明□未再使用□报告人信息联系电话:部门:签名:信息来源医疗机构□经营企业□个人□文献报道□上市后研究□其他□
备注
填表人:日期:复核人:日期:。
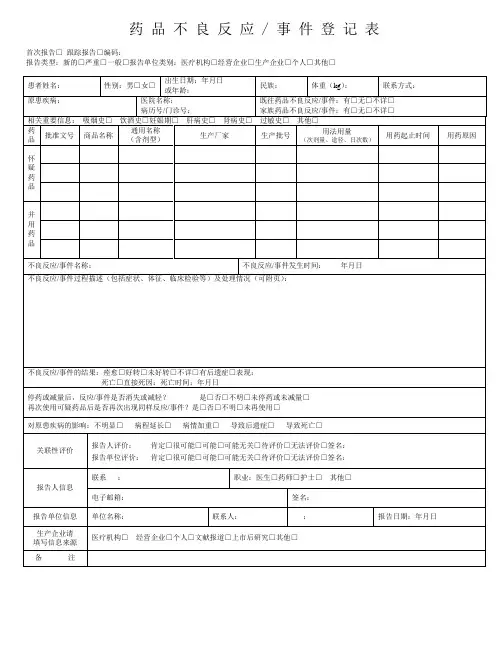
药品不良反应 / 事件登记表首次报告□跟踪报告□编码:报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:1) 导致死亡;2)危及生命;3)致癌、致畸、致出生缺陷;4)导致显著的或者永久的人体伤残或者器官功能的损伤;5)导致住院或者住院时间延长;6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应30日内报告。
有随访信息的,应当及时报告。
其他说明怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
报告的处理所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。
在极少数情况下,当认为药品的风险大于效益时,药品也会撤市。
药品不良反应 / 事件报告表首次报告□跟踪报告□编码:报告类型:新的□严重■一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:1) 导致死亡;2)危及生命;3)致癌、致畸、致出生缺陷;4)导致显著的或者永久的人体伤残或者器官功能的损伤;5)导致住院或者住院时间延长;6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。
