实际金属的晶体结构.
- 格式:ppt
- 大小:228.00 KB
- 文档页数:3

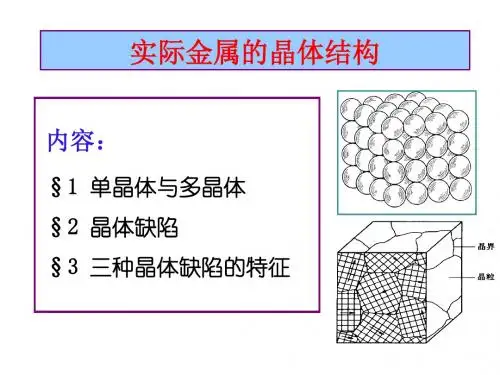
3.3 实际金属的晶体结构一、多晶体结构和亚结构实际使用的工业金属材料,即使体积很小,其内部的晶格位向也不是完全一致的,而是包含着许许多多彼此间位向不同的、称之为晶粒的颗粒状小晶体。
而晶粒之间的界面称为晶界。
这种实际上由许多晶粒组成的晶体结构称为多晶体结构(polycrystalline structure)。
一般金属材料都是多晶体(图3-12)。
通常测得的金属性能是各个位向不同的晶粒的平均值,故显示出各向同性。
图3—12 多晶体结构示意图实践证明,即使在一个晶粒内部,其晶格位向也并不是象理想晶体那样完全一致,而是存在着许多尺寸更小,位向差也很小的小晶块。
它们相互嵌镶成一颗晶粒。
这些小晶块称为亚结构。
可见,只有在亚结构内部,晶格的位向才是一致的。
二、晶体缺陷实际晶体还因种种原因存在着偏离理想完整点阵的部位或结构,称为晶体缺陷(crystal defect)。
晶体缺陷的存在及其多寡,是研究晶体结构、金属塑性变形的关键问题。
根据其几何特性,晶体的缺陷可分为三类:1.点缺陷——空位和间隙原子实际晶体未被原子占有的晶格结点称为空位;而不占有正常晶格位置而处于晶格空隙之间的原子则称为间隙原子。
在空位或间隙原子的附近,由于原子间作用力的平衡被破坏,使其周围的原子离开了原来的平衡位置,即产生所谓的晶格畸变。
空位和间隙原子都处于不断的运动和变化之中,这对于热处理和化学处理过程都是极为重要的。
2.线缺陷——位错晶体中某处有一列或若干列原子发生有规律的错排现象称为位错(dislocation)。
有刃型和螺型两种位错。
刃型位错如图3-13所示。
垂直方向的原子面EFGH中断于水平晶面ABCD上的EF处,就像刀刃一样切入晶体,使得晶体中位于ABCD面的上、下两部分出现错排现象。
EF线称为刃型位错线。
在位错线附近区域,晶格发生畸变,导致ABCD晶面上、下方位错线附近的区域内,晶体分别受到压应力和拉应力。
符号“┴”和“┬”分别表示多出的原子面在晶体的上半部和下半部,分别称为正、负刃型位错。


金属常见的三种晶体结构
金属是由原子键紧密排列在一起而形成的固态,它们的结构可以分为三种:非晶态,单斜晶格和立方晶格。
非晶态是一种金属的结构,它和晶态有很大的不同,因为它没有安排成典型排列。
它是由大量低秩排列的原子构成的,没有晶面,且具有较低的密度。
这种结构经常出现在薄膜中,但也有一些金属在处于高温状态时以非晶态存在的特点。
单斜晶格是金属中最普遍的晶体结构。
它的特点是原子被排列在能量最低的八位置中,将空间划分为六个同心圆,将其围绕中心共轭,形成金属化合物中最常见的晶格结构。
该晶体结构非常稳定,在Big Bang中释放出来的原子大多就以单斜晶格结构存在。
另一种金属常见晶体结构是立方晶格结构。
立方晶格由很多个单元格组成,每个小单元中心都有一个原子,形成一个正交的立方晶格,原子的排列形成一个空mid的和的画面,可以把金属想象为一个巨大的正方体,巨大的正方体是由正方体组成的,原子是此晶体结构的组成单位。
总之,金属通常以非晶格、单斜晶格和立方晶格三种晶体结构存在,它们的生成和行为直接关系到金属的特性。
金属的宏观特性及其在特定情况下的表现受它们的晶体结构紧密相关。
理解金属的晶体结构对科学家们的研究和应用非常重要。

小结第二章晶体与晶体结构内容:金属的晶体结构:合金的晶体结构实际金属的晶体结构第一节金属的晶体结构晶体与非晶体1. 晶体:指原子呈规则、周期性排列的固体。
常态下金属主要以晶体形式存在。
晶体具有各向异性。
非晶体:原子呈无规则堆积,和液体相似,亦称为“过冷液体”或“无定形体”。
在一定条件下晶体和非晶体可互相转化。
2. 区别(a)是否具有周期性、对称性(b)是否长程有序(c)是否有确定的熔点(d)是否各向异性3金属的晶体结构晶体结构描述了晶体中原子(离子、分子)的排列方式。
1)理想晶体——实际晶体的理想化·三维空间无限延续,无边界·严格按周期性规划排列,是完整的、无缺陷。
·原子在其平衡位置静止不动2)理想晶体的晶体学抽象(晶体)空间规则排列的原子→刚球模型→晶格(刚球抽象为晶格结点,构成空间格架)→晶胞(具有周期性最小组成单元)。
晶体学参数:a,b,c,α,β,γ晶格常数:a,b,c晶系:根据晶胞参数不同,将晶体分为七种晶系。
90%以上的金属具有立方晶系和六方晶系。
立方晶系:a=b=c,α=β=γ=90︒六方晶系:a1=a2=a3≠ c, α=β=90︒, γ=120︒原子半径:晶胞中原子密度最大方向上相邻原子间距的一半。
晶胞原子数:一个晶胞内所包含的原子数目。
配位数:晶格中与任一原子距离最近且相等的原子数目。
致密度:晶胞中原子本身所占的体积百分数。
二.常见的金属晶格晶胞晶体学参数原子半径晶胞原子数配位数致密度2 8 68% BCC a=b=c,α=β=γ=90oFCC a=b=c, α=4 12 74%β=γ=900HCP a=b c,a/2 6 12 74% c/a=1.633, α=β=90o, γ=120o第二节实际金属的晶体结构理想晶体+晶体缺陷——实际晶体实际晶体——单晶体和多晶体单晶体:内部晶格位向完全一致,各向同性。
多晶体:由许多位向各不相同的单晶体块组成,各向异性。


一、填空题1.分别填出下列铁碳合金组织的符号:奥氏体 A ;铁素体 F ;渗碳体 Fe3C ;珠光体 P ;高温莱氏体 Ld ;低温莱氏体 Ld’。
2.金属晶格的基本类型有体心立方晶格、面心立方晶格与密排六方晶格三种。
3.根据晶体缺陷的几何特点,常将其分为点缺陷、线缺陷和面缺陷三大类。
4.在固态合金中由于各组元之间相互作用的不同,合金的组织可形成固溶体、金属化合物和机械混合物三种类型。
5.热处理工艺过程由加热、保温和冷却三个阶段组成。
6.按回火温度范围可将回火分为低温回火、中温回火和高温回火三种。
7.所有断裂过程都是由裂纹的形成和扩展两个基本过程组成的。
8.莱氏体是碳的质量分数为wc=4.3%的液态铁碳合金在1148 ℃时的共晶转变的产物,是奥氏体和渗碳体组成的机械混合物。
9.形变铝合金可分为防锈铝合金、硬铝合金、超硬铝合金和锻铝合金。
10.在合金相图中固相线与液相线的距离越大,合金铸造性能越差。
11.影响再结晶后晶粒大小的因素有:加热温度和保温时间、变形程度和加热速度。
12.冷塑性变形后的金属随着加热温度的升高其组织结构会发生回复、再结晶和晶粒长大三个阶段的变化。
13.共析钢在等温转变过程中,其高温转变产物有: P 、 S 和 T 。
14.贝氏体分上贝氏体和下贝氏体两种。
15.铁碳合金相图上的ES线,用代号Acm 表示,PSK线用代号A1表示,GS线用代号A3表示。
16.淬火时,最常用的冷却介质是盐水、水和油。
17.奥氏体在l148℃时溶碳能力可达2.11%。
随着温度的下降,溶解度逐渐减小,在727℃时溶碳能力为0.77%。
18.铸铁中碳的以石墨的形式析出的过程称为石墨化。
影响石墨化的因素有化学成分和冷却速度。
19.根据溶质原子在溶剂晶格中所占据的位置不同,固溶体可分为间隙固溶体和置换固溶体两类。
20.表面热处理的方法有钢的表面淬火和化学热处理。
21.45钢按用途分类属于碳素结构钢,按碳的质量分数分类属于中碳钢,按质量分类属于高级优质。


实际金属的晶体结构金属的晶体结构是指由金属原子组成的周期性排列的三维结构。
金属晶体具有许多独特的特征和性质,这些特征和性质与金属原子的三维排列有关。
下面将介绍几种常见的金属晶体结构。
1.简单立方晶体结构(SC):简单立方晶体结构是最简单的晶体结构之一,也是最稀有的金属晶体结构之一、每个金属原子都处于一个立方体角上,每个原子周围有六个邻近原子。
简单立方晶体常见于稀有金属如钠、银等。
2.面心立方晶体结构(FCC):面心立方晶体结构是最常见的金属晶体结构之一,许多常见的金属如铝、铜、金等都采用该结构。
每个金属原子都处于一个立方体的顶点和立方体每个面的中心,每个原子周围有12个邻近原子。
面心立方结构的密堆率为0.743.体心立方晶体结构(BCC):体心立方晶体结构是另一种常见的金属晶体结构,一些金属如铁、钢等采用该结构。
每个金属原子都处于一个立方体的顶点和立方体中心,每个原子周围有8个邻近原子,体心立方结构的密堆率为0.684.密堆排列晶体结构(HCP):密堆排列晶体结构是另一种常见的金属晶体结构,钛、锆等金属常见于该结构。
每个金属原子都处于一个六角形基面的顶点和基面两侧的空间,每个原子周围有12个邻近原子。
密堆排列结构的密堆率为0.74此外,还有一些金属具有其他特殊的晶体结构,例如钻石立方晶体结构、金刚石晶体结构等。
这些结构都与金属原子之间的相互作用力和排列方式有关。
金属的晶体结构对其性质具有重要影响。
例如,面心立方结构的金属具有优良的塑性和导电性,因为金属原子的排列方式使得原子在晶体中能够相对自由地滑动。
相比之下,体心立方结构的金属则具有较高的硬度和较强的磁性。
这些不同的晶体结构直接影响到金属的导电性、热传导性、密度、力学性能等性质。
总之,金属的晶体结构是由金属原子周期性排列而成的三维结构。
不同的金属晶体结构具有不同的特征和性质,进一步影响到金属的性能和用途。
了解金属的晶体结构对于研究和应用金属材料具有重要的意义。


金属中常见的晶体结构金属,咱们生活中常见的材料,像是铁、铝、铜什么的,大家肯定都耳熟能详。
但是你知道这些金属的内部结构吗?没错,就是它们的晶体结构!嘿,别急,今天咱们就来聊聊这些有趣的东西。
听起来可能有点复杂,但其实没那么难。
想象一下,一个金属就像一个大派对,里面的人(原子)们都在按照某种特定的舞步来跳舞,形成各种有趣的图案。
咱们得说说面心立方结构,简称FCC。
这个名字听起来高深莫测,其实就是在说这些金属的原子排列得特别紧凑,像是在大场面上跳舞一样,节奏感十足。
比如说,金属铜、铝和黄金,它们都是这个大家庭的一员。
你想啊,面对面地站着,大家都紧紧围成一圈,互相碰撞又不掉队,这种感觉是不是特别温暖?这也是为什么这些金属通常比较坚固、耐用。
就像你身边的朋友,靠谱得很,一般情况下不会出什么差错。
我们聊聊体心立方结构,也就是BCC。
这个结构有点不同,像是一个不太爱社交的人,中心的原子就独自一人待在中间,周围的原子则是四面八方地围绕着他。
比如说铁就是这样的家伙。
要说BCC的金属,其实它们的排列稍微松散一点,像是那种一群朋友一起聚会,结果有人偏偏要去吃炸鸡,结果有点拉开了距离。
尽管这样,它们依然坚固,但弹性和塑性就稍微逊色一些。
不过,你要是碰到铁这个家伙,千万别小看它哦,虽然看起来有点“孤僻”,但一到关键时刻,它的强度可是数一数二的。
然后就是六方密堆积结构,简称HCP。
这个结构就像是一个立体的蜂窝,原子们在空间中安排得像个大方阵。
镁和钴就是这个派对里的明星,大家彼此之间的距离掌握得恰到好处,感觉特别和谐,简直就是“齐心协力”的最佳体现。
HCP金属虽然不像FCC那么普遍,但它们各自都有独特的魅力。
就像那种低调奢华的朋友,平时不太张扬,但关键时刻总能给你带来惊喜。
不得不提一下金属的变形能力。
金属在受力的时候,就像一个柔韧的橡皮筋,能适当伸展但又不会轻易断裂。
FCC金属在这方面表现得尤为出色,就像那种能从容应对各种挑战的健身达人,不管是什么压力,它们都能稳稳地应对。