血清蛋白醋酸纤维薄膜电泳实验
- 格式:doc
- 大小:118.50 KB
- 文档页数:3

醋酸纤维薄膜电泳分离血清蛋白实验报告醋酸纤维薄膜电泳分离血清蛋白实验报告引言:血清蛋白是人体内一类重要的生物大分子,对于维持人体正常生理功能具有重要作用。
因此,对血清蛋白的研究一直备受关注。
本实验旨在利用醋酸纤维薄膜电泳技术,对血清蛋白进行分离和鉴定,以期获得关于血清蛋白的更深入了解。
实验方法:1. 实验仪器和试剂准备本实验所需仪器包括电泳装置、电源、薄膜电泳槽等。
试剂包括醋酸纤维、缓冲液、血清样品等。
2. 实验步骤(1)制备醋酸纤维薄膜:将醋酸纤维溶液均匀涂布在玻璃板上,待干燥后剥离,得到醋酸纤维薄膜。
(2)制备电泳槽:将醋酸纤维薄膜固定在电泳槽中,保证其平整并与电极接触良好。
(3)样品准备:将待测血清样品离心,取上清液作为实验样品。
(4)电泳操作:将实验样品均匀涂布在醋酸纤维薄膜上,接通电源进行电泳,设定适当的电压和时间。
(5)染色和观察:将电泳结束后的薄膜进行染色处理,然后观察薄膜上蛋白带的分布情况。
实验结果:经过实验,我们观察到在醋酸纤维薄膜上形成了多个蛋白带,这些蛋白带代表了血清中不同种类的蛋白质。
通过比较不同样品的蛋白带分布情况,我们可以发现不同样品中蛋白质的种类和含量存在差异。
讨论:1. 醋酸纤维薄膜电泳技术的优势相比于传统的凝胶电泳技术,醋酸纤维薄膜电泳具有以下优势:操作简单、分辨率高、分离效果好、重复性好等。
因此,该技术在血清蛋白分离和鉴定中具有广泛应用前景。
2. 血清蛋白的研究意义血清蛋白是人体内一类重要的生物大分子,对于维持人体正常生理功能具有重要作用。
通过对血清蛋白的研究,可以了解人体内不同蛋白质的种类和含量,从而为临床医学、生物医学研究等领域提供重要的参考依据。
结论:本实验利用醋酸纤维薄膜电泳技术成功分离和鉴定了血清蛋白,观察到了不同蛋白质在薄膜上的分布情况。
该实验结果为进一步研究血清蛋白的功能和生理意义提供了基础数据。
醋酸纤维薄膜电泳技术的应用前景广阔,有望在血清蛋白研究领域发挥重要作用。

醋酸纤维薄膜电泳分离血清蛋白实验结果一、前言醋酸纤维薄膜电泳是一种常见的分离血清蛋白的方法,它能够将复杂的血清样品中的蛋白质分离出来,从而便于进行后续的研究。
本文将详细介绍醋酸纤维薄膜电泳分离血清蛋白实验结果。
二、实验方法1. 样品制备将血清样品加入到离心管中,并进行离心处理,去除其中的颗粒物和红细胞等杂质。
然后取出上清液,进行下一步处理。
2. 薄膜电泳将制备好的样品加入到电泳槽中,并在两端接上电极。
然后通过调节电场强度和时间等参数,使得不同分子量的蛋白质在电场作用下向不同方向移动,并最终被分离开来。
3. 银染将分离好的样品进行银染处理,使得其中存在的蛋白质能够被显色。
然后观察显色效果,并对其进行记录和分析。
三、实验结果经过以上实验步骤,我们成功地得到了血清样品中的蛋白质分离结果。
具体结果如下:1. 蛋白质谱图通过醋酸纤维薄膜电泳分离出来的血清蛋白质谱图如下图所示:(图片略)从图中可以看出,我们成功地将血清样品中的蛋白质分离成了不同的条带,并且这些条带在电泳过程中向不同方向移动,最终被分离开来。
2. 蛋白质种类通过对分离出来的蛋白质进行银染处理后,我们可以看到其中存在多种不同种类的蛋白质。
具体包括:(1)白蛋白(2)球蛋白(3)免疫球蛋白(4)转铁蛋白等。
3. 调整实验参数对结果的影响在实验过程中,我们还尝试了调整一些实验参数,以观察其对结果的影响。
具体包括:(1)电场强度:当电场强度较大时,不同分子量的蛋白质能够更快地向两端移动,并且更容易被分离开来。
但是,如果电场强度过大,也会导致蛋白质的断裂和聚集,从而影响分离效果。
(2)电泳时间:当电泳时间较长时,不同分子量的蛋白质能够更充分地被分离开来,并且条带也更加清晰。
但是,如果电泳时间过长,也会导致蛋白质的断裂和聚集,从而影响分离效果。
四、结论通过以上实验结果的观察和分析,我们可以得出以下结论:1. 醋酸纤维薄膜电泳是一种有效的血清蛋白质分离方法。

醋酸纤维薄膜电泳分离血清蛋白实验报告醋酸纤维薄膜电泳分离血清蛋白实验报告引言:血清蛋白是人体内一种重要的生物大分子,它在维持人体正常生理功能中起着至关重要的作用。
因此,对血清蛋白的研究一直备受科学家的关注。
本实验旨在利用醋酸纤维薄膜电泳技术,对血清蛋白进行分离,以期进一步了解血清蛋白的组成和功能。
实验方法:1. 准备样品:从健康人体中提取血清样品,将其离心,得到血清上清液。
2. 制备醋酸纤维薄膜:将醋酸溶液倒入玻璃容器中,将玻璃容器放置在恒温槽中,使醋酸溶液温度保持在60℃左右。
然后,将玻璃容器从恒温槽中取出,迅速浸入冷水中,使醋酸溶液迅速凝固形成醋酸纤维薄膜。
3. 实验操作:将醋酸纤维薄膜放置在电泳槽中,加入足够的电泳缓冲液,使醋酸纤维薄膜完全浸泡其中。
然后,将血清样品均匀涂抹在醋酸纤维薄膜上,并连接电源进行电泳分离。
4. 电泳条件:设置电泳电压和时间,一般情况下,电泳电压为100V,电泳时间为30分钟。
5. 实验结果:观察电泳结束后的醋酸纤维薄膜,记录血清蛋白的分离情况。
实验结果与讨论:经过电泳分离后,观察到醋酸纤维薄膜上出现了多个带状条纹,这些条纹代表了不同的血清蛋白组分。
根据条纹的迁移距离和形状,我们可以初步判断血清蛋白的分子量和电荷特性。
通过对实验结果的分析,我们可以发现,血清蛋白主要可以分为白蛋白、球蛋白、半胱氨酸蛋白和β-球蛋白等几个主要组分。
白蛋白是血清蛋白中含量最高的成分,迁移速度最快;球蛋白次之,迁移速度较慢;半胱氨酸蛋白和β-球蛋白迁移速度最慢。
这些血清蛋白的分离结果与其分子量和电荷特性有关。
白蛋白分子量较小,电荷较弱,因此迁移速度最快;球蛋白分子量较大,电荷较强,迁移速度较慢;半胱氨酸蛋白和β-球蛋白分子量更大,电荷更强,迁移速度最慢。
结论:本实验利用醋酸纤维薄膜电泳技术成功地对血清蛋白进行了分离,并初步了解了血清蛋白的组成和特性。
通过观察醋酸纤维薄膜上的带状条纹,我们可以对血清蛋白的分子量和电荷特性进行初步判断。

探究血清蛋白的醋酸纤维薄膜电泳血清蛋白的醋酸纤维薄膜电泳实验是生物化学领域中常用的一种技术手段,主要用于分离和鉴定血清蛋白。
下面我们来逐步了解该实验的步骤及意义。
1. 样品制备
首先,我们需要从血清中提取血清蛋白样品。
具体而言,我们可以采用血清蛋白沉淀法从血清中分离出蛋白质。
血清样品需要经过一定的处理,如去除颗粒物和杂质等。
2. 薄膜制备
接下来,我们需要制备醋酸纤维薄膜。
在该实验中,醋酸纤维薄膜被用作分离电泳媒介,其主要作用是减少电泳运行时加热和蛋白质流动的影响。
制备方法是,将醋酸纤维浸泡于混合溶液中,然后将醋酸纤维拉伸平展,形成均匀的膜。
3. 电泳过程
在电泳过程中,我们需要将样品加载在薄膜上。
电泳媒介溶液应该足够覆盖电泳细胞,同时样品也必须完全覆盖在膜表面上。
在电泳过程中,样品蛋白质将会在电场的作用下在膜上移动,形成不同的蛋白条带。
这些蛋白条带将被固定于膜上。
4. 实验结果
实验结果可以通过观察膜上蛋白质条带的颜色和大小来呈现。
不
同的蛋白质将会形成不同的条带,这些条带将有助于分离和鉴定样品
中的蛋白质。
这些结果可以进一步通过其他的技术手段进行分析和鉴定。
综上所述,血清蛋白的醋酸纤维薄膜电泳实验是分离和鉴定血清
蛋白的一种有效手段。
该实验依靠电泳媒介和电场的作用分离样品中
的蛋白质,从而得出膜上的蛋白条带。
这些结果有助于我们进一步了
解血清蛋白的组成和功能,从而为生物医学研究提供更多有益的信息。


血清蛋白醋酸纤维薄膜电泳实验一.实验原理1、电泳是指带电质点在电场中向本身所带电荷相反的电极移动的现象。
在一定pH条件下,不同的质点由于具有不同的等电点而带不同性质的电荷,因而在一定的电场中它们的移动方向和移动速度也不同,即它们的电泳迁移率不同,因此,可使它们分离。
2、影响电泳迁移率的外界因素:电场强度、溶液的pH值、溶液的离子强度和电渗现象。
3、影响电泳迁移率的内在因素:质点所带净电荷的量、质点的大小和形状。
4、采用醋酸纤维薄膜作为支持物的电泳方法称为醋酸纤维素薄膜电泳。
醋酸纤维素薄膜电泳具有微量、快速、简便、分辨力高,对样品无拖尾和吸附现象等优点。
5、醋酸纤维素是纤维素的羟基乙酰化所形成的纤维素醋酸酯,将它溶于有机溶剂(如:丙酮、氯仿、氯乙烯、乙酸乙酯等)后,涂抹成均匀的薄膜则成为醋酸纤维素薄膜。
该膜具有均一的泡沫状的结构,厚度约为120 μm,有很强的通透性,对分子移动阻力很小。
6、本实验以醋酸纤维素为电泳支持物,分离各种血清蛋白。
血清中含有清蛋白、α-球蛋白、β-球蛋白、γ-球蛋白和各种脂蛋白等。
各种蛋白质由于氨基酸组成、分子量、等电点及形状不同,在电场中的迁移速度不同。
以醋酸纤维素薄膜为支持物,正常人血清在pH8.6的缓冲体系中电泳,染色后可显示5条区带。
其中清蛋白的泳动速度最快,其余依次为α1-、α2-、β-及γ-球蛋白。
二.实验仪器和试剂✧器材醋酸纤维素薄膜(3×8cm),培养皿,载玻片,电泳仪,电泳槽,粗滤纸,镊子✧材料新鲜血清(未溶血)✧试剂1、巴比妥缓冲液(pH 8.6,离子强度0.06):巴比妥1.66g, 巴比妥钠12.76g,加水至1000ml。
置4℃冰箱保存,备用。
(已配置)2、染色液:氨基黑10B 0.5g, 甲醇50ml, 冰醋酸10ml,蒸馏水40ml,混匀。
3、漂洗液:含95%乙醇45ml,冰醋酸5ml,蒸馏水50ml,混匀。
4、NaOH溶液:称取NaOH 16g,定容至1000ml。


血清蛋白质醋酸纤维薄膜电泳实验报告一、实验目的1、掌握血清蛋白质醋酸纤维薄膜电泳的基本原理。
2、熟悉电泳操作的基本技术和方法。
3、了解血清蛋白质的组成和相对含量。
二、实验原理血清中含有多种蛋白质,它们在 pH 值为 86 的缓冲液中均带负电荷,在电场中会向正极移动。
由于各种蛋白质分子大小、形状及所带电荷量不同,在电场中的迁移速度也就不同,从而可将血清蛋白质分离成不同的区带。
醋酸纤维薄膜具有均一的泡沫样结构,渗透性强,对蛋白质吸附极少,因此适合用于电泳。
三、实验材料1、器材电泳仪、电泳槽、醋酸纤维薄膜(2×8cm)、点样器、镊子、培养皿、滤纸、铅笔、直尺。
2、试剂巴比妥缓冲液(pH 86,离子强度 006)、染色液(氨基黑 10B)、漂洗液。
3、样本新鲜血清四、实验步骤1、准备醋酸纤维薄膜将醋酸纤维薄膜浸泡于巴比妥缓冲液中,浸泡时间约为 30 分钟,直至薄膜完全浸透。
2、点样取出浸透的薄膜,用滤纸吸去多余的缓冲液,在无光泽面距一端15cm 处,用铅笔轻轻划一条横线作为点样线。
然后,用点样器蘸取血清,均匀地点在点样线上,使血清形成一条细窄的直线。
点样量要适中,过多会导致蛋白质区带扩散,过少则不易观察到清晰的区带。
3、电泳将点样后的薄膜小心地放入电泳槽中,点样端靠近负极,使薄膜平整地贴在电泳槽的支架上。
盖上电泳槽盖,接通电源,调节电压为120V,电泳时间约为 50 60 分钟。
4、染色电泳结束后,取出薄膜,直接放入染色液中浸泡 5 10 分钟,使蛋白质区带染上颜色。
5、漂洗将染色后的薄膜取出,放入漂洗液中漂洗数次,直至背景无色,蛋白质区带清晰可见。
五、实验结果经过染色和漂洗后,在醋酸纤维薄膜上可以观察到清晰的血清蛋白质区带。
从正极到负极依次为清蛋白、α1-球蛋白、α2-球蛋白、β球蛋白和γ球蛋白。
通过与标准图谱对比,可以大致估算出各蛋白质组分的相对含量。
六、结果分析1、影响电泳结果的因素(1)点样不均匀或点样量过多过少都会导致区带不清晰或不完整。

血清蛋白醋酸纤维薄膜电泳实验报告一、实验介绍血清蛋白醋酸纤维薄膜电泳是一种常用的生物化学实验,用于分离血清中的蛋白质。
该实验利用电泳原理,将血清中的蛋白质按照它们的电荷、大小和形状进行分离。
这种技术可以帮助诊断一些疾病,并可作为治疗方案的参考。
二、实验步骤1. 样品制备:取少量血清,加入等量的缓冲液,混合均匀。
2. 样品处理:将样品加入SDS-PAGE样品缓冲液,煮沸5分钟。
3. 准备凝胶:将凝胶混合物倒入凝胶模板中,待凝胶固化后倒掉上层溶液。
4. 加载样品:将处理好的样品加入凝胶孔中。
5. 电泳:将凝胶放入电泳槽中,连接电源进行电泳。
6. 染色:取出凝胶,在染色溶液中染色15分钟至2小时。
7. 脱色:取出凝胶,在脱色溶液中脱色至背景清晰。
三、实验结果实验结果可通过观察凝胶图谱来进行分析。
在凝胶上,蛋白质会被分离成多个带状区域,每个区域代表一种蛋白质。
观察带状区域的大小、形状和颜色,可以判断样品中蛋白质的种类和含量。
四、实验注意事项1. 样品处理时需要加入SDS-PAGE样品缓冲液,以去除蛋白质的天然电荷。
2. 凝胶制备时需要严格按照说明书操作,确保凝胶固化均匀。
3. 电泳槽中需要加入足够的电泳缓冲液,并保证电极完全浸入缓冲液中。
4. 染色和脱色时需要注意时间控制,过长或过短都会影响染色效果。
5. 实验过程中应注意安全,避免接触电源和有毒溶液。
五、实验应用血清蛋白醋酸纤维薄膜电泳广泛应用于临床诊断和治疗方案的制定。
例如,在肝功能异常的患者中,可以通过该技术检测血清中的蛋白质种类和含量,以判断肝脏功能是否正常。
此外,该技术还可用于研究蛋白质结构和功能,以及新药物的筛选。
六、实验优化为了提高实验效率和准确性,可以对实验进行优化。
例如,可以选择不同类型的凝胶和电泳缓冲液来适应不同的样品类型;也可以尝试不同的染色方法来提高染色效果。
此外,在实验过程中还需要注意控制变量,以确保实验结果的可靠性。
七、总结血清蛋白醋酸纤维薄膜电泳是一种常用的生物化学实验,用于分离血清中的蛋白质。
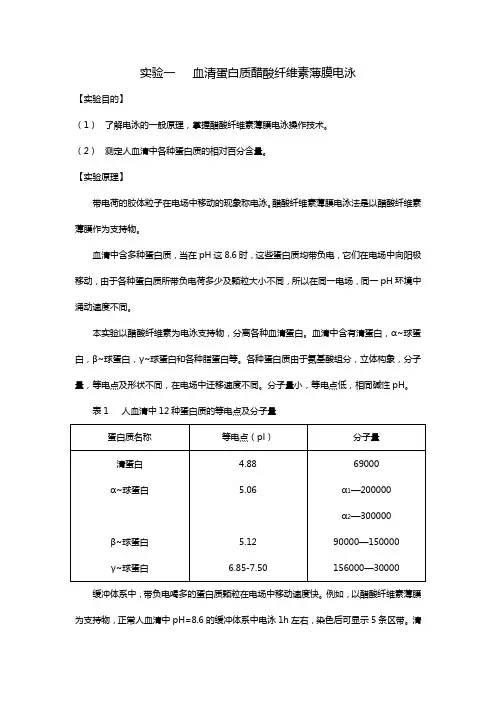
实验一血清蛋白质醋酸纤维素薄膜电泳【实验目的】(1)了解电泳的一般原理,掌握醋酸纤维素薄膜电泳操作技术。
(2)测定人血清中各种蛋白质的相对百分含量。
【实验原理】带电荷的胶体粒子在电场中移动的现象称电泳。
醋酸纤维素薄膜电泳法是以醋酸纤维素薄膜作为支持物。
血清中含多种蛋白质,当在pH这8.6时,这些蛋白质均带负电,它们在电场中向阳极移动,由于各种蛋白质所带负电荷多少及颗粒大小不同,所以在同一电场,同一pH环境中涌动速度不同。
本实验以醋酸纤维素为电泳支持物,分离各种血清蛋白。
血清中含有清蛋白,α~球蛋白,β~球蛋白,γ~球蛋白和各种脂蛋白等。
各种蛋白质由于氨基酸组分,立体构象,分子量,等电点及形状不同,在电场中迁移速度不同。
分子量小,等电点低,相同碱性pH。
表1 人血清中12种蛋白质的等电点及分子量缓冲体系中,带负电喝多的蛋白质颗粒在电场中移动速度快。
例如,以醋酸纤维素薄膜为支持物,正常人血清中pH=8.6的缓冲体系中电泳1h左右,染色后可显示5条区带。
清蛋白泳动最快,其余依次为α1~,α2~,β~及γ~球蛋白。
这些区带经洗脱后可用分光光度法定量,也可直接进行光吸收扫描自动绘出区带吸收峰及相对百分比。
临床医学常利用它们异常区带的出现作为临床鉴别诊断的依据。
此法由于操作简单,快速。
图1 正常人血清醋酸纤维素薄膜电泳示意图为清蛋白,2,3,4,5分别为α1,α2,β~及γ~球蛋白,6为点样原点(3)优点。
目前,已成为临床生化检验的常规操作之一。
【临床意义】清蛋白62-72% α1—球蛋白3-4% α2—球蛋白6-10% β~—球蛋白7-11% γ~—球蛋白9-18%血清蛋白电泳的病理改变多半是清蛋白降低和一种或二种以上球蛋白增加。
表2 血清蛋白的临床意义【试剂】1.巴比妥缓冲液(pH=8.6离子强度为0.06):称取巴比妥纳12.76克,巴比妥1.66克,置于盛有200ml蒸馏水的烧杯中稍加热溶解后,移置100ml容量瓶中,加蒸馏水稀释至刻度。

血清蛋白醋酸纤维薄膜电泳及其定量实验报
告
血清蛋白醋酸纤维薄膜电泳是一种常用的蛋白质分离和定量技术。
本实验旨在通过电泳分离血清样品中的蛋白质,并利用醋酸纤维薄膜定量测定其含量。
以下是实验的具体步骤和结果。
实验步骤:
1. 样品制备:将血清样品离心并取上清液。
2. 样品混合:将取得的血清样品与等体积的缓冲液混合。
3. 样品加载:将混合样品加在聚丙烯酰胺凝胶电泳板上。
4. 电泳分离:通电使蛋白质沿着凝胶板移动,根据分子大小进行分离。
5. 醋酸纤维薄膜染色:将凝胶板放在染色缸中进行染色。
6. 图像采集:使用分析软件采集凝胶板图像。
7. 定量分析:利用染色蛋白质的光密度值进行定量分析。
实验结果:
经过电泳分离和醋酸纤维薄膜染色后,我们成功地分离出血清样品中的主要蛋白质,并通过定量分析得出各蛋白质的相对含量。
在实验中,我们发现血清蛋白主要包括白蛋白、球蛋白和纤维蛋白等。
结论:
血清蛋白醋酸纤维薄膜电泳是一种有效的蛋白质分离和定量技术,能够帮助我们了解血清样品中的蛋白质组成及含量。
通过实验,我们成功地完成了蛋白质的分离和定量分析,为后续的研究奠定了基础。
以上就是本次实验的全部内容及结果,希望对您有所帮助。
感谢您的阅读!。
醋酸纤维薄膜电泳分离血清蛋白实验结果引言醋酸纤维薄膜电泳是一种常用于生物分离和分析的技术,可以通过电场作用将带电粒子在纤维薄膜上移动,实现对混合物的分离。
本实验旨在利用醋酸纤维薄膜电泳技术对血清蛋白进行分离,以便进一步研究其组成和功能。
实验方法1.准备醋酸纤维薄膜:将醋酸纤维薄膜切割成所需尺寸,并在实验室条件下保持干燥。
2.准备电泳槽:将醋酸纤维薄膜放置在电泳槽中,确保其与电极接触良好。
3.准备样品:采集血清样品,并将其稀释至适当浓度。
4.进行电泳分离:将稀释后的血清样品均匀地涂抹在醋酸纤维薄膜上,然后施加适当电场使样品在薄膜上移动。
5.停止电泳:根据需要的分离程度,适时停止电泳过程。
6.分析结果:观察血清蛋白在醋酸纤维薄膜上的分离情况,并记录相关数据。
实验结果血清蛋白分离图谱根据实验结果,我们观察到在醋酸纤维薄膜上成功地分离了血清蛋白。
下图展示了血清蛋白分离图谱,其中纵轴表示电迁移率,横轴表示时间。
1.血清蛋白A的电迁移率为X,迁移时间为Y。
2.血清蛋白B的电迁移率为X,迁移时间为Y。
3.血清蛋白C的电迁移率为X,迁移时间为Y。
4.…血清蛋白组成分析根据血清蛋白分离图谱,我们可以进一步分析血清蛋白的组成。
通过与已知标准品进行比对,我们确定了以下血清蛋白的组成及相对含量:1.血清蛋白A占总蛋白的X%。
2.血清蛋白B占总蛋白的X%。
3.血清蛋白C占总蛋白的X%。
4.…血清蛋白功能研究根据血清蛋白的组成分析结果,我们可以进一步研究血清蛋白的功能。
以下是我们对某些血清蛋白功能的初步研究结果:血清蛋白A的功能1.血清蛋白A在某种生理过程中起到重要的调节作用。
2.进一步研究表明血清蛋白A可能与X疾病的发生和发展有关。
血清蛋白B的功能1.血清蛋白B与免疫系统的调节密切相关。
2.研究发现血清蛋白B在X疾病的治疗中具有潜在的应用价值。
血清蛋白C的功能1.血清蛋白C参与了血液凝固过程的调控。
2.进一步研究表明血清蛋白C可能与X疾病的预后有关。
血清蛋白醋酸纤维薄膜电泳实验
一.实验原理
1、电泳是指带电质点在电场中向本身所带电荷相反的电极移动的现象。
在一定pH条件下,不同的质点由于具有不同的等电点而带不同性质的电荷,因而在一定的电场中它们的移动方向和移动速度也不同,即它们的电泳迁移率不同,因此,可使它们分离。
2、影响电泳迁移率的外界因素:电场强度、溶液的pH值、溶液的离子强度和电渗现象。
3、影响电泳迁移率的内在因素:质点所带净电荷的量、质点的大小和形状。
4、采用醋酸纤维薄膜作为支持物的电泳方法称为醋酸纤维素薄膜电泳。
醋酸纤维素薄膜电泳具有微量、快速、简便、分辨力高,对样品无拖尾和吸附现象等优点。
5、醋酸纤维素是纤维素的羟基乙酰化所形成的纤维素醋酸酯,将它溶于有机溶剂(如:丙酮、氯仿、氯乙烯、乙酸乙酯等)后,涂抹成均匀的薄膜则成为醋酸纤维素薄膜。
该膜具有均一的泡沫状的结构,厚度约为120 μm,有很强的通透性,对分子移动阻力很小。
6、本实验以醋酸纤维素为电泳支持物,分离各种血清蛋白。
血清中含有清蛋白、α-球蛋白、β-球蛋白、γ-球蛋白和各种脂蛋白等。
各种蛋白质由于氨基酸组成、分子量、等电点及形状不同,在电场中的迁移速度不同。
以醋酸纤维素薄膜为支持物,正常人血清在pH8.6的缓冲体系中电泳,染色后可显示5条区带。
其中清蛋白的泳动速度最快,其余依次为α1-、α2-、β-及γ-球蛋白。
二.实验仪器和试剂
✧器材
醋酸纤维素薄膜(3×8cm),培养皿,载玻片,电泳仪,电泳槽,粗滤纸,镊子
✧材料
新鲜血清(未溶血)
✧试剂
1、巴比妥缓冲液(pH 8.6,离子强度0.06):
巴比妥1.66g, 巴比妥钠12.76g,加水至1000ml。
置4℃冰箱保存,备用。
(已配置)
2、染色液:氨基黑10B 0.5g, 甲醇50ml, 冰醋酸10ml,蒸馏
水40ml,混匀。
3、漂洗液:含95%乙醇45ml,冰醋酸5ml,蒸馏水50ml,混匀。
4、NaOH溶液:称取NaOH 16g,定容至1000ml。
三.实验过程
一.准备与点样
1.将薄膜剪成3×8cm的小条,在薄膜无光泽面距一端1.5cm处用铅笔轻轻划一条直线,表示点样位置。
2.将薄膜无光泽面向下,浸泡于PH8.6的巴比妥缓冲液中至少十分钟,使之完全浸泡透。
3.将浸泡的薄膜取出,用滤纸吸去多余水分。
用毛细管吸取新鲜血清约5ul,涂于厚0.5厘米的载玻片末端,然后轻轻压在划痕处,待血清完全浸入膜内以后移开载玻片。
二、电泳
将点样后的薄膜置于电泳槽支架上,无光泽面朝下,点样末端置于负极。
槽架上用四层滤纸作桥垫,膜条与滤纸必须贴紧,平衡5分钟后通电,电压110伏,电泳1小时左右关电源。
三、染色和漂洗
通电完毕后,用镊子将膜取出,直接浸于染色液中2分钟后取出,立即浸泡于漂洗液中,反复漂洗,直至背景漂洗净为止。
用滤纸吸干薄膜。
四、定量(洗脱法)
⒈取6支试管,编号,每管加入0.4mol/LNaOH 4毫升,剪下薄膜上各条蛋白色带。
另于无色部分剪一大小与色带相仿的薄膜作空白对照。
⒉将各条区带分别放入试管内,不时摇动,待蓝色完全脱下后。
在波长650nm处比色。
以空白调零,分别读出各蛋白组分的光密度,然后计算出总光密度:
光密度总和T=清蛋清(A)+A1+A2+B+ r各管的0.D。
各部分蛋白质的百分数为:
清蛋白A=A/T
α1球蛋白= α1/T
α2球蛋白= α2/T
β球蛋白= β/T
γ球蛋白= γ/T
四.注意事项
保持薄膜清洁,务必戴上塑料手套,勿用手指接触薄膜表面,以免油污或污物沾上,影响电泳结果。
✧注意醋酸纤维膜的质量,至少浸泡10分钟,浸泡很久仍有大块白色硬点者须弃之不
用。
✧加样时一定要呈直线、垂直、分布均匀,这样泳动的区带整齐、不歪。
以免影响蛋
白质区带图谱的完美。
✧电泳槽两边的缓冲液应保持液面在同一水平面上,槽里的缓冲液要保持清洁。
✧电泳电压大小,时间长短与缓冲液的离子强度都有一定的关系。
一般电流约
0.4—0.6mA/cm,电压110—160V,通电时间40—60min。
电压高,电流大,电泳速度
加快,时间可缩短,但薄膜上蒸发严重,因此不能无限增大电流。
✧使用比色皿时要润洗。
✧染色的同时也是蛋白质的固定,所以,不要将很多蛋白条重叠在一起。
✧注意薄膜正负极不要搭反,注意簿膜的正反不要放反。
放的时候注意血样不要与滤
纸接触了。
✧通电完毕时,必须切断电源,以防触电事故。
五、失败图谱的分析
✧拖尾状点样量过多,被分离的血清蛋白不能分离成5条区带或产生拖
尾。
✧有斑点点样不均匀,不整齐,导致被分离的区带出现斑点。
✧边流现象点样板蘸取血清一边多一边少,导致区带分离不清,出现边流现
象。
✧区带模糊薄膜过湿,样品扩散迅速,导致样品分离不成区带。
✧锯齿状薄膜用滤纸吸水过度(薄膜上出现白斑)或点样过慢,又未及
时大桥,导致薄膜过于干燥,使区带成锯齿状。
✧区带倾斜薄膜搭载滤纸上的位置歪斜,弯曲,与电流方向不平行,或点样
一边多一边少,区带容易泳斜。
✧显色过浅点样太少,区带显色不明显。
✧区带重叠染色时,醋酸纤维薄膜不是一张一张放入染色液的,在染色固
定前,薄膜与薄膜之间重叠,造成薄膜上还未固定的血清蛋白彼此粘连。
✧区带过密电泳时电压,电流或电泳过小或时间不够,造成区带未分离。
六、思考题
请你回忆一下你的实验过程,并圆满解释你的结果!
本次实验对细节的要求较高,请大家务必耐心仔细,
预祝大家实验成功!·^_^。