达泊西汀的合成进展
- 格式:pdf
- 大小:183.64 KB
- 文档页数:3




盐酸达泊西汀生产工艺盐酸达泊西汀是一种常用的化学药品,它在医药领域有着广泛的应用。
本文将介绍盐酸达泊西汀的生产工艺。
盐酸达泊西汀的生产工艺主要分为以下几个步骤。
首先,将原料达泊西汀与盐酸溶液进行反应。
这一步骤的目的是将达泊西汀与盐酸结合,形成盐酸达泊西汀。
反应过程中需要注意控制温度和反应时间,以确保反应的完全性和产物的纯度。
接下来,对反应混合物进行过滤和干燥处理。
通过过滤,可以去除反应中产生的杂质和固体物质。
干燥处理可以将产物中的水分去除,提高产物的纯度和稳定性。
然后,对干燥后的产物进行结晶处理。
结晶过程中,可以通过控制温度和溶剂的浓度来促使产物结晶。
结晶后的产物通常具有较高的纯度和良好的结晶形态。
对结晶后的产物进行干燥和粉碎处理。
干燥可以进一步去除残留的水分,提高产物的稳定性和保存期限。
粉碎处理可以将产物研磨成所需的粒度,以满足不同的应用需求。
盐酸达泊西汀的生产工艺中,需要注意的一些关键技术点。
首先,反应温度和反应时间的控制十分重要,这可以确保反应的完全性和产物的纯度。
其次,过滤和干燥处理需要采用适当的方法和设备,以提高产物的纯度和稳定性。
此外,结晶过程中的温度和溶剂浓度的选择也对产物的纯度和结晶形态有着重要影响。
盐酸达泊西汀的生产工艺需要严格遵守相关的安全操作规程。
在操作过程中,应注意防止产生有害气体和溶液的泄漏。
同时,应配备必要的防护设施,如安全眼镜、手套和防护服等,以确保操作人员的安全。
盐酸达泊西汀的生产工艺是一个复杂而严谨的过程。
通过控制反应条件、过滤干燥和结晶处理等关键步骤,可以获得高纯度和良好结晶形态的盐酸达泊西汀产物。
在实际生产中,应严格遵守相关的操作规程和安全要求,确保产品质量和操作人员的安全。
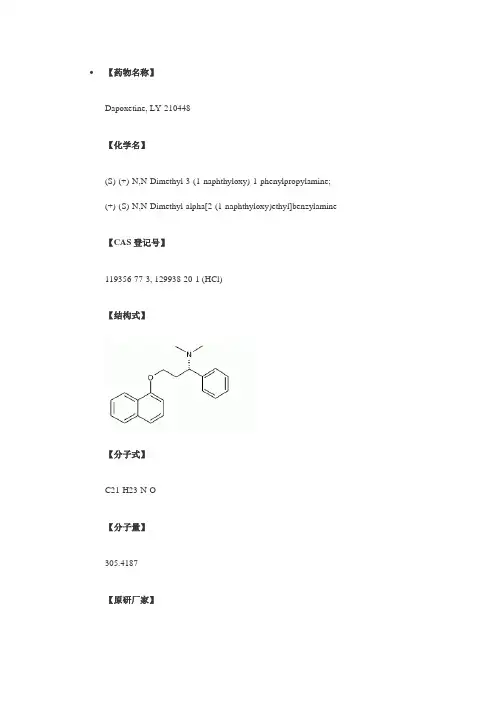
【药物名称】Dapoxetine, LY-210448【化学名】(S)-(+)-N,N-Dimethyl-3-(1-naphthyloxy)-1-phenylpropylamine;(+)-(S)-N,N-Dimethyl-alpha[2-(1-naphthyloxy)ethyl]benzylamine 【CAS登记号】119356-77-3, 129938-20-1 (HCl)【结构式】【分子式】C21-H23-N-O【分子量】305.4187【原研厂家】Lilly (Originator), Dynogen Pharmaceuticals (Not Determined), Alza (Licensee), PPD GenuPro (Licensee)【作用类别】Prevention of Premature Ejaculation, RENAL-UROLOGIC DRUGS, Treatment of Male Sexual Dysfunction, 5-HT Reuptake Inhibitors【研发状态】Phase III【合成情况】〖来源〗J Label Compd Radiopharm〖合成路线〗〖标题〗A chiral synthesis of dapoxetine hydrochloride, a serotonin reuptake inhibitor, and its 14C isotopomer〖合成方法〗In the original synthesis of the title compound, Knoevenagel condensation of benzaldehyde (I) with malonic acid (II) in the presence of ammonium acetate produced the beta-aminoacid (III). Reductive alkylation of the amino group of (III) with formaldehyde produced the dimethyl amine (IV). Then, Fischer esterification of (IV) with ethanolic HCl furnished the intermediate amino ester (V). Amino ester (V) was alternatively obtained by Michael addition of dimethylamine to ethyl cinnamate (VI).Reduction of the ester function of (V) provided amino alcohol (VII). The sodium alkoxide of (VII) was then coupled with 1-fluoronaphthalene (VIII) to produce the racemic amino ether, which was finally resolved into enantiomers by means of tartaric acid.〖作者〗Wheeler, W.J.; O'Bannon, D.D.〖参考〗Wheeler, W.J.; O'Bannon, D.D.; A chiral synthesis of dapoxetine hydrochloride, a serotonin reuptake inhibitor, and its 14C isotopomer. J Label Compd Radiopharm 1992, 31, 4, 305〖出处〗J Label Compd Radiopharm1992,31,(4):305〖来源〗J Label Compd Radiopharm〖合成路线〗〖标题〗A chiral synthesis of dapoxetine hydrochloride, a serotonin reuptake inhibitor, and its 14C isotopomer〖合成方法〗An alternative synthesis starting from the chiral precursor N-Boc-(R)-phenylglycine (IX) was reported. Borane reduction of (IX) provided the N-Boc aminoalcohol (X), which was activated as the mesylate (XI) by reaction with methanesulfonyl chloride in pyridine, yielding (XI). Displacement of the mesylate group of (XI) with NaCN furnished theBoc-aminonitrile (XII). Hydrolysis of the nitrile group of (XII) with concomitant N-Boc group cleavage under acidic conditions gave aminoacid (XIII). This was reduced toamino alcohol (XIV) using borane in THF. Eschweiler-Clarke methylation of aminoalcohol (XIV) yielded the dimethyl amine (XV). This was finally condensed with 1-fluoronaphthalene (VIII) to produce the title naphthyl ether. The [14C]-labeled compound was similarly prepared employing 14C-sodium cyanide.〖作者〗Wheeler, W.J.; O'Bannon, D.D.〖参考〗Wheeler, W.J.; O'Bannon, D.D.; A chiral synthesis of dapoxetine hydrochloride, a serotonin reuptake inhibitor, and its 14C isotopomer. J Label Compd Radiopharm 1992, 31, 4, 305〖出处〗J Label Compd Radiopharm1992,31,(4):305〖来源〗Nucl Med Biol〖合成路线〗〖标题〗Synthesis of [11C]dapoxetine.HCl, a serotonin re-uptake inhibitor: biodistribution in rat and preliminary PET imaging in the monkey〖合成方法〗The synthesis of the [11C]-labeled compound was also reported. Selective tosylation of the primary hydroxyl of (R)-1-phenyl-1,3-propanediol (XVI) provided (XVII). From this, naphthyl ether (XIX) was prepared by Williamson's synthesis with the sodium alkoxide of 1-naphthol (XVIII). The remaining hydroxyl group of (XIX) was then converted to mesylate (XX) upon treatment with methanesulfonyl chloride and DMAP. Subsequent displacement with methylamine in a sealed vessel afforded the secondary amine (XXI). This was finally alkylated with 11CH3I to yield the target 11C-labeled compound.〖作者〗Livni, E.; et al.〖参考〗Livni, E.; et al.; Synthesis of [11C]dapoxetine.HCl, a serotonin re-uptake inhibitor: biodistribution in rat and preliminary PET imaging in the monkey. Nucl Med Biol 1994, 21, 4, 669〖出处〗Nucl Med Biol1994,21,(4):669〖来源〗AU 8814335; EP 0288188; JP 1988258837; US 5135947〖合成路线〗〖标题〗1-Phenyl-3-naphthalenyloxypropanamines〖合成方法〗In the original synthesis of the title compound, Knoevenagel condensation of benzaldehyde (I) with malonic acid (II) in the presence of ammonium acetate produced the beta-aminoacid (III). Reductive alkylation of the amino group of (III) with formaldehyde produced the dimethyl amine (IV). Then, Fischer esterification of (IV) with ethanolic HCl furnished the intermediate amino ester (V). Amino ester (V) was alternatively obtained by Michael addition of dimethylamine to ethyl cinnamate (VI).Reduction of the ester function of (V) provided amino alcohol (VII). The sodium alkoxide of (VII) was then coupled with 1-fluoronaphthalene (VIII) to produce the racemic amino ether, which was finally resolved into enantiomers by means of tartaric acid.〖作者〗Robertson, D.W.; Thompson, D.C.; Wong, D.T. (Eli Lilly and Company)〖参考〗Robertson, D.W.; Thompson, D.C.; Wong, D.T. (Eli Lilly and Company);1-Phenyl-3-naphthalenyloxypropanamines. AU 8814335; EP 0288188; JP 1988258837; US 5135947〖出处〗AU 8814335; EP 0288188; JP 1988258837; US 5135947,,():。

收稿日期:2010-09-29作者简介:尹玲丽(1985-),女(汉族),浙江台州人,硕士研究生,E m a i:l y i nli ng li @163.co m;*通讯作者:陈国华(1963-),男(汉族),福建莆田人,副研究员,硕士生导师,主要从事药物化学研究,T e:l (025)83241246,E m a i:l cgh63@163.co m 。
文章编号:1005-0108(2011)01-0037-03盐酸达泊西汀的合成工艺研究尹玲丽,陈国华*(中国药科大学药物化学教研室,江苏南京210009)摘 要:目的研究选择性5 羟色胺重摄取抑制剂盐酸达泊西汀的合成工艺。
方法以3 苯基丙醇和1 氟萘为起始原料,经醚化、溴代、二甲胺基取代、拆分、成盐反应制得目标化合物。
结果与结论目标化合物的结构经1H NM R 、M S 、I R 谱以及比旋光度确证。
该路线原料易得,操作简便,条件温和,有利于工业化生产,消旋体收率达61 2%。
关键词:选择性5 羟色胺重摄取抑制剂;盐酸达泊西汀;化学合成;工艺改进中图分类号:R 914 文献标志码:A盐酸达泊西汀(dapoxetine hydrochlori d e ,1)化学名为(S ) (+) (N,N 二甲胺基) 3 (萘基 1 氧基) 1 苯基丙烷盐酸盐,是一种选择性5 羟色胺重摄取抑制剂(SSRI),由美国礼来制药公司(E li L ill y )研制,2009年在欧洲上市,商品名为Prili g y ,用于治疗男性早泄(PE)。
该药半衰期短、不良反应小、效果显著,是世界上第一种被批准治疗PE 的经口给药的处方药[1]。
1 合成路线文献报道的合成盐酸达泊西汀(1)的方法较多[2-7]。
本研究参考文献[2]的方法,以3 苯丙醇(2)、1 氟萘(3)为起始原料,在氢化钠作用下成醚得到化合物4,4经NBS 苄位溴代得到5,化合物5与二甲胺进行亲核取代反应得到化合物6,6经L (+) 酒石酸拆分,成盐酸盐得目标化合物1。


达泊西汀合成总结引言达泊西汀(Dapoxetine)是一种专门用于治疗早泄的选择性5-羟色胺再摄取抑制剂。
由于早泄是男性性功能障碍中最常见的问题之一,因此达泊西汀合成就显得非常重要。
本文将概述达泊西汀的合成过程,并介绍其中的关键步骤和反应条件。
合成步骤达泊西汀的合成过程通常基于对5-羟基色胺的一系列化学反应进行改进和改造。
下面是达泊西汀的一种合成方法,其中包括了主要的合成步骤和反应条件。
步骤一:取代氢化首先,将4-氯-3-硝基苯胺经过醚处理和盐酸处理,得到4-氯-3-硝基苯胺的盐酸盐。
然后,使用芳香胺类化合物对其进行取代反应,生成目标产物7-硝基-4-(3-取代基苄基)吡啶类化合物。
反应条件: - 取代反应中使用合适的芳香胺类化合物 - 利用合适的酸性催化剂步骤二:氢化还原目标产物经过氢化反应,将硝基还原为胺基。
该步骤通常在加氢反应器中进行,并且需要适当的压力和温度条件。
结果是得到7-胺基-4-(3-取代基苄基)吡啶化合物。
反应条件: - 反应温度:40-60°C - 反应压力:正常压力下加氢 - 加氢催化剂:常用的加氢催化剂如氢气和钯碳步骤三:酰化反应在这一步骤中,通过酰化反应将胺基化合物与2-(二甲基氨基)乙酸进行反应,生成目标产物达泊西汀的酰化衍生物。
反应条件: - 反应温度:室温 - 催化剂:具有酰化活性的催化剂,如二甲基亚锡(DMAP)步骤四:碱解反应在最后一步中,通过碱解反应使酰化衍生物脱去酰基,形成达泊西汀的自由胺。
反应条件: - 碱催化剂:常用的碱催化剂如碳酸钠或氢氧化钠 - 反应温度:室温结论通过这种合成路线,我们可以有效地合成达泊西汀。
根据文献报道,该方法可产率高,反应条件温和,适用于大规模合成。
然而,为了确保产品质量和纯度,仍需对合成过程进行完善和优化。
未来的研究可以尝试改进合成路径、催化剂和反应条件,以提高达泊西汀的合成效率和产率。
总之,达泊西汀作为一种用于治疗早泄的药物,在医疗领域发挥着重要的作用。


盐酸达泊西汀的合成及工艺优化作者:付丙月张宁张宗磊段崇刚来源:《中国药房》2020年第07期摘要目的:优化盐酸达泊西汀的合成工艺。
方法:采用手性合成的方法,以3-氯苯丙酮为原料,采用(1S,2R)-(-)-1-氨基-2-茚醇为催化剂、硼烷-N,N-二乙基苯胺为还原剂进行不对称还原,然后依次经过与α-萘酚醚化、磺酸酯化、二甲胺取代、HCl成盐反应得到最终产物。
通过核磁共振和质谱技术对合成产物进行表征。
对中间体Ⅰ、中间体Ⅱ、中间体Ⅲ和最终产物的合成反应进行工艺优化。
结果:表征结果显示最终产物为盐酸达泊西汀,纯度为99.8%,收率为58.9%。
与传统的拆分工艺比较,本工艺采用手性合成的方法不需要拆分,收率明显高于文献报道的拆分工艺收率(31.9%)。
优化后的工艺减少了杂质的产生,提高了产品质量。
结论:本合成工艺反应条件较温和、合成路线较短、收率较高。
关键词盐酸达泊西汀;手性合成;不对称还原;工艺优化ABSTRACT; ;OBJECTIVE: To optimize the synthesis process of dapoxetine hydrochloride. METHODS: By chiral synthesis, asymmetric reduction was carried out by using 3-chlorophenylacetone as raw material,(1S, 2R) -(-)-1-amino-2-indanol as catalyst, and borane-N, N-diethylaniline (DEANB) as reducing agent. Then,it was reacted with α-naphthol etherification, sulfonation, dimethylamine substitution, and HCl salt formation reaction to obtain the final products. The products were characterized by NMR and MS. The synthesis reaction of intermediate Ⅰ, intermediate Ⅱ, intermediate Ⅲ and the final product were optimized. RESULTS: The final product was dapoxetine hydrochloride with purity of 99.8% and yield of 58.9%. Compared with traditional splitting technology, the chiral synthesis technology of this study did not need splitting, and the yield of the technology was significantly higher than that of splitting technology reported in literature (31.9%). The optimized technology reduced the generation of impurities and improved the product quality. CONCLUSIONS: The improved technology has milder reaction conditions, shorter synthesis route and higher yield.KEYWORDS; ;Dapoxetine hydrochloride; Chiral synthesis; Asymmetric reduction; Technology optimization鹽酸达泊西汀(Dapoxetine hydrochloride)化学名为(S)-(+)-(N,N-二甲胺基)-3-(萘基-1-氧基)-1-苯基丙烷盐酸盐,是一种选择性5-羟色胺再摄取抑制剂(SSRIs),2009年在欧洲上市,之后陆续在多个国家和地区上市,2013年进入中国市场(商品名:必利劲),用于成年男子早泄的按需治疗,是世界上第一个被批准用于治疗早泄的口服药[1]。

达泊西汀药物制备技术研究进展张丽萍;王普【期刊名称】《浙江化工》【年(卷),期】2015(000)006【摘要】Dapoxetine is a potent selective serotonin re-uptake inhibitor (SSRI) used in the treatment of patients with premature ejaculation. Many methods are currently available for the synthesis of Dapoxetine. This paper reviewed the synthetic process of Dapoxetine by asymmetric synthesis or chiral pool synthesis, and summarized the status and progress of Dapoxetine preparation with the chemical methods.%达泊西汀是一种主要用于治疗男性早泄的选择性5-羟色胺再摄取抑制剂(SSRI)。
目前该药合成有多种方法,本文主要概述了合成达泊西汀的化学不对称法和手性源法,重点介绍了化学不对称法制备达泊西汀的研究现状。
【总页数】6页(P17-22)【作者】张丽萍;王普【作者单位】浙江工业大学药学院,浙江杭州 310014;浙江工业大学药学院,浙江杭州 310014【正文语种】中文【相关文献】1.盐酸达泊西汀治疗早泄的临床研究进展 [J], 易培训2.达泊西汀合成研究进展 [J], 王亚娜;陶莹莹;张恩3.新型糖尿病治疗药物西他列汀制备技术研究进展 [J], 章鹏鹏;孟凡婷;牛婷婷;王普4.达泊西汀联合中等剂量西地那非治疗早泄合并轻度勃起功能障碍的临床效果 [J], 陈庆;黄志扬;辛军;辛明华5.新型液相色谱-荧光检测法测定药物剂型和人血浆中的他达拉非和盐酸达泊西汀(英文) [J], MAHA Hegazy;AMIRA Kessiba;MOHAMED Abdelkawy;AHMED EMAD El Gindy因版权原因,仅展示原文概要,查看原文内容请购买。
工艺改进在盐酸达泊西汀合成中的具体体现盐酸达泊西汀是一种新型的快速选择性5-羟色胺在摄取类抑制剂,早期用于治疗相关情感障碍及抑郁症,近年来则应用到男性性功能障碍的治疗领域。
本文以研究5-羟色胺在摄取类抑制剂盐酸达泊西汀的合成工艺,传统工艺是以苯甲醛和丙二酸为原料反应制出目标化合物。
本次研究以1-氟萘和3-苯基丙醇为起始原料,经醚化、溴代等盐反应制得目标化合物。
结果显示目标化合物结构R谱及比旋光度确认,该路线原料易得且条件温和,操作简便,有利于工业化生产。
其中,消旋体收集率达到65%以上。
标签:盐酸达泊西汀;5-羟色胺在摄取类抑制剂;工艺改进;化学合成盐酸达泊西汀是一种快速选择性5-羟色胺在摄取类抑制剂,结构上与氟西汀类似,都有抗抑郁功能,临床研究用其盐酸盐。
达泊西汀最初是美国礼来制药公司研制出来的抗抑郁类药物,进行了一期临床试验。
2005年,强生公司在全美泌尿协会科学会议上公布了盐酸达泊西汀的三期临床数据,以及相关药学实验结果和药物作用。
各项指标和数据显示结果证明,该药物不良反应小且半衰期短,是治疗早泄的理想类药物。
国外文献记载工艺复杂不利于工业生产,本文在综合文献资料的基础上设计出适合盐酸达泊西汀工业生产的技术路线。
1 合成路线在相关文献报道中,合成盐酸达泊西汀的方法较多,以苯甲醛和丙二酸为原料反应制得目标化合物。
合成手法有手性催化合成、手性试剂拆分以及手性原料合成等方式。
但是由于手性试剂拆分的目的是得到较高的化合物,但拆分过程十分繁琐,且需要多次重结晶,在反应阶段会浪费大量原料。
同时,反应路线较短,副反应较多且收率较低不适合大量生产。
手性催化又分还原法与合成法两种,该方法得到原料过程中还原剂价格较贵,容易产生消旋化合物,不适合工业化生产。
而手性原料合成,是直接以手性化合物为主,得到目标化合物,由于手性原料不易获得导致价格过高,且反应过程部分定,故而不适合工业化生产。
本次研究中以方便快捷、反应时间短、路线短、减少重结晶、减少原料价格为核心,改进了制备1-苯基-3-(1-萘氧基)丙烷的方法,由于在传统制作工艺中苯甲醛和丙二酸的原材料较为昂贵,因此,改为容易购得的1-氟萘和3-苯基丙醇为起始原料,经醚化、溴代等盐反应制得目标化合物。
2010年第18卷合成化学V o.l18,2010第5期,647~649Ch i nese Journa l o f Synthe tic Che m istry N o.5,647~649 #制药技术#盐酸达泊西汀的合成*薛大泉1a,张威1b,邓泽军1b,马红梅1b,郑实1a,虞心红1b(1.华东理工大学a.化工学院;b.药学院,上海200237)摘要:以3-氯苯丙酮为起始原料,经不对称还原、烃化、O-甲磺酰化、SN2二甲胺化和成盐合成了盐酸达泊西汀,总收率39.9%,其结构经1H NM R和M S确证。
关键词:3-氯苯丙酮;盐酸达泊西汀;药物合成中图分类号:O625.63;R914.5文献标识码:A文章编号:1005-1511(2010)05-0647-03 Synthesis of Dapoxeti ne Hydrochlori deXUE D a-quan1a,Z HANG W ei1b,DENG Ze-j u n1b,M A H ong-me i1b,Z HENG Shi1a,YU X in-hong1b(a.Schoo l of Chem ical Eng i neeri ng;b.Schoo l of Pha r m acy,1.East China U niversity of Sc i ence and T echno logy,Shangha i200237,Chi na)A bstract:Dapoxetine hydrochloride was synthesized fro m3-ch lor oprop i o phenone by catalytic asy m-m etric reduction,alky lation,O-m et h lsu lfony lation,S N2d i m ethy la m i n ation,as w ell as sa lt for m ati o n in an overall y ie l d o f39.9%.The str ucture w as confir m ed by1H NMR and M S.K eywords:dapoxeti n e hydr och l o ri d e;3-chloropropiophenone;drug synthesis达泊西汀[1,化学名(S)-(+)-(N,N-二甲氨基)-3-(萘基-1-氧基)苯丙胺]是一种选择性5-羟色胺重摄取抑制剂,临床上用其盐酸盐[1]。