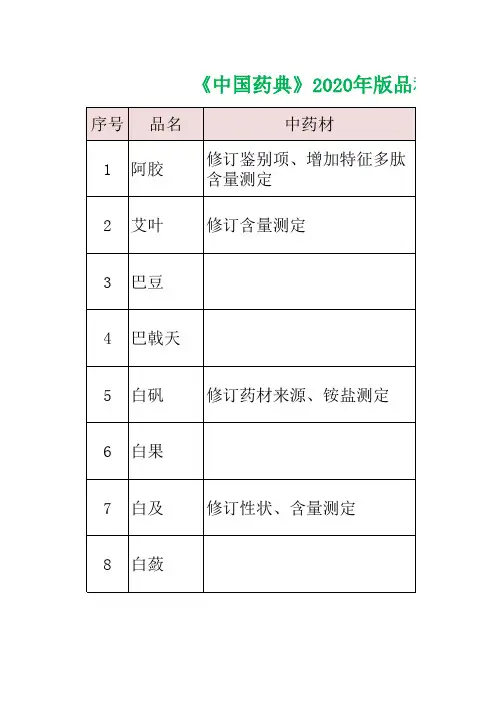
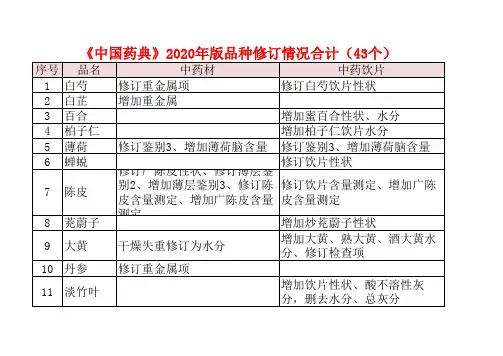
2020年版药典中药材、中药饮片都有哪些新变化
- 格式:doc
- 大小:29.00 KB
- 文档页数:9

2020版中国药典修订工作展示6大特点,预示药品质控新趋势对于中国制药行业的小伙伴们,2020年注定是充实和知识体系重新构建的一年。
2019年底修订发布的《药品管理法》为引领开启了系列法规、工作文件和指南的修订和实施工作,必将引发行业巨变和持续学习压力。
而《中国药典》2020版的修订和颁布,也必将对于药品研发、注册、生产和质控产生巨大影响。
笔者长期跟踪《中国药典》2020版的增修订工作,根据笔者的持续搜集信息和分析,为各位展示即将到来的2020版《中国药典》的崭新特点。
特点一:强化调动社会资源,对方协力推动标准提高在2010版《中国药典》实施之前,中国药典委员会的委员多来自官方机构,例如医药大学、药品检验机构。
自2015《中国药典》修订工作开启,就开始积极吸纳民间科技专家参加中国药典的各类增订和修订工作。
而在2020版《中国药典》大纲上面则强调:完善国家药品标准形成和淘汰机制,着力突出政府在国家标准制定中的主导作用和企业在产品标准制定中的主体地位,采取积极的鼓励政策和措施引导社会和行业将更多的人力、物力和财力投入到标准的研究制定,构建药品标准工作的新格局。
例如,中国药典委曾经委托中国医药设备协会承担了《中国药典》通则"制药用水"修订科研课题调研工作。
根据笔者统计,截止到2019年底,中国药典委共召开各类技术会议34次。
具体情况参见下表。
可以说,通过上面这些技术会议的召开和各类密集沟通,这版药典极大的调动了社会各界积极参与药典增订和修订和修订的工作,促进了行业交流。
特点二:大幅度增修订辅料标准,为制剂创新和质量提高夯实基础辅料在制剂开发和生产中发挥着重要作用;如果没有辅料行业的持续发展,制药行业的发展必定受到掣肘。
曾经有中国制剂人员这样感叹,即使原料药(API)的品质再好,把很好的原料药和脏的辅料混合,然后投入药品内包装中,这就是中国制剂的现状和水平。
应该说,这段感叹既表达了制剂人员的无奈和期盼,也说明持续加强辅料发展和管理的必要性。

2020版我国药典对中药饮片的定义一、主题概述1. 我国药典的意义2. 中药饮片的定义和特点在中医药领域,我国药典是一部不可或缺的重要文献,它对中药材和中药饮片的质量、生产、加工等方面作出了详细规定和标准。
而中药饮片作为一种常见的中药剂型,其定义、特点和相应的标准也备受关注。
在本篇文章中,我们将深入探讨2020版我国药典对中药饮片的定义,并从不同角度进行全面评估和解析。
二、我国药典的意义1. 我国药典的历史和演变2. 我国药典在中医药发展中的作用我国药典是国家药品监督管理部门发布的法定药典,它记录了中药材、中药饮片、中成药等的质量标准、性状描述、检验和评价方法等内容。
作为中医药领域的权威文献,我国药典的制订和修订历经千年,其规范和标准为中药产业的发展提供了重要依据。
在中药质量控制、生产加工、临床应用等方面,我国药典的作用不可替代。
三、中药饮片的定义和特点1. 中药饮片的制备方法和工艺流程2. 中药饮片的质量标准及评价指标3. 中药饮片的特点和临床应用中药饮片是指用中药材制成的干燥品,是中医治疗的一种重要剂型。
其制备方法包括浸泡、煮沸、干燥等工艺,制成的饮片应符合我国药典规定的质量标准和评价指标。
中药饮片具有药效稳定、用药方便、剂型多样等特点,是中医临床常用的重要药剂。
在临床应用中,中药饮片的质量直接影响着疗效和安全性,因此对其质量标准的严格执行至关重要。
四、个人观点和理解1. 对中药饮片的认识和看法2. 对我国药典对中药饮片的定义的理解个人认为,中药饮片作为一种传统的中药剂型,具有悠久的历史和丰富的临床经验,其在中医治疗中发挥着重要作用。
2020版我国药典对中药饮片的定义,明确了其质量标准和评价指标,为中药饮片的生产和使用提供了科学依据。
中药饮片在未来的发展中,需要更加注重质量控制和标准化生产,以确保其安全有效地应用于临床。
五、总结与回顾1. 对中药饮片的定义和特点进行总结2. 我国药典对中药饮片的定义意义的回顾通过本文的探讨,我们全面了解了2020版我国药典对中药饮片的定义,以及中药饮片的特点和质量标准。

9月20日,由中国药品监督管理研究会主办的2016年首届中国药品监管科学大会在京召开。
会上获悉,2020年版《中国药典》编制工作已经开始启动。
据国家药典委员会秘书长张伟在会上介绍,2020版中国药典计划收录品拟达到6400个。
相比2015年版收录的5608个品种,增加了800个。
重点增加原料、中药材、药用辅料标准的收录。
其中,中药品种拟增加220个,化药品种拟增加420个,生物制剂拟增加30个,药用辅料拟增加100个,药包材品种拟增加30个。
2020年版药典拟修订1400个品种的标准,其中中药500个,化药60 0,生物制剂150个,药用辅料150个。
业内知名专家施枝江对赛柏蓝表示,《药典》每次修订都是一次标准的提高,提高标准后,低于标准的企业将被淘汰。
可以说,每次药典的修订是一次淘汰赛。
比如2015版的《药典》,与2010版相比,就有43个品种被踢出。
中药饮片标准将进一步提高去年12月1日,2015年版《药典》开始实施,作为新版药典的一大特色是饮片标准大幅度提高。
中药饮片标准大幅度提高,特别是安全性指标,增加了对中药材及饮片中二氧化硫残留量限度标准,加大农残、重金属、黄曲霉等标准,而这些指标的有效解决,有赖于中药整个产业链的规范,特别是需规范中药材种植、中药材贸易。
仅仅是这项标准的设定,就让不少中药企业直呼成本大大提高,在中药材市场,标准提高后,有药商对表示,不少药商遭遇退货潮。
有关人士表示,2020年新版药典还将进一步加强中药材安全性方面标准的制定,拟参照食品安全评估的方法,在对中药材污染物进行大规模调查基础上,在科学研究和大数据的基础上,建立部分品种农药残留、重金属限量标准的制定工作。
这意味着,未来中药材的标准将进一步提高。
一位中药企业管理者对此感叹道:中药企业再不自建药材基地就没戏了,如果按照现在模式生产、收购药材,想药监检查这么严格的情况下,尤其是最近发对药企的警告,要求所有的企业都重视药品原料的情况下,如果等到2020年标准提高后再计划,真就晚了。

2020版我国药典单列饮片标准一、概述2020年版的我国药典是我国医药卫生领域的重要标准之一,它包含了大量的药品标准和质量控制要求,对于规范药品生产、使用和监管具有重要意义。
其中,单列饮片是我国传统药材的重要剂型,具有广泛的应用价值和市场需求。
根据我国药典2020版的相关规定,单列饮片的标准也得到了更新和完善。
本文将就2020版我国药典单列饮片标准进行探讨分析,希望能够为相关医药从业人员提供一些参考和帮助。
二、单列饮片的定义和分类1. 单列饮片:指采用各种中药饮片、粉末等原料,经过炮制、加工、制丸、薄膜衣或其他工艺制成的外观呈扁圆形、椭圆形,表面光洁或具纹理的固体制剂。
2. 单列饮片的分类:根据原材料和用途的不同,单列饮片可以分为多种类型,包括清泻剂类、利湿剂类、攻下剂类、化痰剂类等。
每种类型的单列饮片都有相应的成分要求和质量标准。
三、单列饮片的质量要求1. 原料的质量要求:单列饮片的制备需要用到各种中药饮片或粉末,这些原料的质量直接影响着单列饮片的质量。
我国药典规定了单列饮片原料的质量要求,包括外观、色泽、气味、含水量、杂质等指标。
2. 成品的质量要求:成品的质量是评价单列饮片合格与否的重要标准。
我国药典对单列饮片的成品质量要求包括外观、尺寸、含量、含量变化、薄膜衣的质量等方面的指标,严格规定了各项指标的标准值和允许偏差范围。
3. 检验方法:为了保证单列饮片的质量,我国药典规定了一系列的检验方法,包括物理性状检验、含量测定、薄膜衣的成分鉴别和含量测定等。
这些检验方法科学、准确,能够有效地评价单列饮片的质量。
四、单列饮片的生产工艺1. 原料的加工和炮制:单列饮片的生产首先需要对各种中药饮片或粉末进行加工和炮制,以保证其质量和稳定性。
2. 制丸和薄膜衣工艺:制丸是单列饮片生产的重要环节,需要采用先进的设备和技术,确保丸剂的外观和物理性状符合要求。
薄膜衣工艺也是单列饮片生产的关键步骤,要求工艺精细,薄膜衣的质量稳定可靠。

我国药典2020年版四部增补本:全面评估与深度探讨近年来,随着中医药产业的快速发展和国际化进程的加快,我国药典也在不断更新和完善。
作为规范中药材、中药饮片、中成药等中药制剂的质量标准和国家药典,我国药典2020年版四部增补本的出台必将对中医药产业的发展起到积极推动作用。
本文将对我国药典2020年版四部增补本的内容进行全面评估,并围绕其重要意义、具体内容、以及对中医药产业的影响进行深度探讨。
一、我国药典2020年版四部增补本的重要意义我国药典是我国国家药典的简称,也是我国制订和发布的唯一具有法定地位的集中体现中药材、中药饮片、中成药等中药制剂质量标准的大部头书。
而2020年版四部增补本作为我国药典的更新内容,对于进一步规范和提高中药质量,推动中药产业升级,提升中医药产业国际竞争力具有非常重要的意义。
二、我国药典2020年版四部增补本的具体内容我国药典2020年版四部增补本主要是在原有的基础上进行修订和完善,增补了一些新的内容或者修正了一些不合理的地方。
其中包括《中华人民共和国药典》、《中华人民共和国药材》、《中华人民共和国中药饮片》、《中华人民共和国中成药》四个部分。
在这些部分中,涵盖了大量的中药材、中药饮片和中成药的制备、炮制、品质、质量标准、检验方法等内容,以及一些新的药材和新的中药制剂。
三、我国药典2020年版四部增补本对中医药产业的影响我国药典2020年版四部增补本的出台,将对中医药产业产生深远的影响。
它将提高中药质量标准,加强对中药材、中药饮片、中成药等中药制剂的质量监管,保障中药的安全有效性。
增加了一些新的药材和新的中药制剂,有利于促进中药资源的合理开发和利用。
再次,修订了一些不合理的地方,对于中药产业的规范化发展具有积极的意义。
我国药典2020年版四部增补本的出台将进一步提高中医药产业的整体水平,为中医药产业的健康发展提供坚实的保障。
四、个人观点和理解我国药典2020年版四部增补本的出台,对中医药产业的发展无疑是一件好事。


2020版《中国药典》农残、重金属变化、212味单品种变化、取消收载、特殊检验品种统计、趁鲜加工统计等▍《中国药典》2020版植物类中药33种农药残留列入药材和饮片鉴定通则《中国药典》2020版69种趁鲜加工统计2020版药典共收载可以趁鲜加工中药材69种,其中药材切片29种,药材切段18种,药材切块3种,药材切瓣4种,可选用多种切制方法加工的药材11个品种,药材去心2种,药材去粗皮2种,共计69种。
1.药材切片(共29个品种)干姜、土茯苓、山柰、山楂、山药、川木通、三棵针、片姜黄、乌药、功劳木、地榆、皂角刺、鸡血藤、佛手、苦参、狗脊、粉萆薢、浙贝母、桑枝、菝葜、绵萆薢、葛根、紫苏梗、黄山药、竹茹、桂枝、狼毒、滇鸡血藤、附子。
2.药材切段(共18个品种)大血藤、小通草、肉苁蓉、青风藤、钩藤、高良姜、益母草、通草、桑寄生、黄藤、锁阳、槲寄生、颠茄草、野木瓜、广东紫珠、首乌藤、桃枝、铁皮石斛。
3.药材切块(共3个品种)何首乌、茯苓块、商陆;4.药材切瓣(共4个品种)木瓜、化橘红、枳壳、枳实5.药材切瓣或片、段(指可选用多种切制方法加工的药材,共11个品种)丁公藤、大黄、天花粉、木香、白蔹、防己、两面针、虎杖、香橼、粉葛、大腹皮。
6.药材去心(共2个品种)远志、莲子;7.去粗皮(共2个品种)苦楝皮、椿皮。
《中国药典》2020版中药材特殊检验品种统计1、其他有机氯农药残留量:人参、甘草、西洋参、红参、黄芪(共5个)2、重金属及有害元素检测品种:人参、三七、山茱萸、山楂、丹参、冬虫夏草、水蛭、甘草、白芍、白芷、当归、西洋参、牡蛎、阿胶、昆布、金银花、珍珠、栀子、枸杞子、桃仁、海螵蛸、海藻、黄芪、黄精、葛根、蛤壳、蜂胶、酸枣仁。
(共28个)3、黄曲霉毒素检测品种:九香虫、土鳖虫、延胡索、水蛭、陈皮、胖大海、桃仁、僵蚕、柏子仁、莲子、使君子、槟榔、麦芽、肉豆蔻、决明子、远志、薏苡仁、大枣、地龙、蜈蚣、全蝎、酸枣仁。

020年版《中国药典》新增品种319种,修订3177种,不再收载10种,品种调整合并4种,共收载品种5911种。
一部中药收载2711种,其中新增117种、修订452种。
在中药安全性控制方面,新版药典要求有效控制外源性污染物的影响,并有效控制内源性有毒成分对中药安全性产生的影响。
在中药有效性控制方面,要求强化标准的专属性和整体性,重点开展了基于中医临床疗效的生物评价和测定方法研究。
新增了药材:裸花紫珠。
新增制剂:116个,具体清单如下:二部化学药收载2712种,其中新增117种、修订2387种。
在药品安全性控制方面,要求进一步完善杂质和有关物质的分析方法,推广先进检测技术的应用,重点强化了对有毒有害杂质(特别是基因毒性杂质)的控制,加强了对药品安全性相关控制项目和限度标准的研究制定。
在药品有效性控制方面,要求将药品质量和疗效一致性评价的成果体现在相关制剂的质量标准提高中,进一步完善了常规固体制剂溶出及释放度检测方法,且在整体质量控制方面进一步借鉴国际要求。
2020年版药典二部新增品种(117个),与一部新增品种居然一样!未收载品种(8个),名称变化的品种(5个)。
具体清单如下:未收载品种(8个)本版药典(二部)未收载2015年版药典(二部)中的品种名单:•鱼肝油•重组人生长激素•注射用重组人生长激素•重组人胰岛素•重组人胰岛素注射液•精蛋白重组人胰岛素注射液•盐酸吡硫醇注射液•注射用盐酸吡硫醇新增品种(117个)本版药典(二部)新增品种名单:1.注射用门冬氨酸鸟氨酸2.马来酸氟伏沙明3.马来酸氟伏沙明片4.扎来普隆5.乌苯美司片6.丙戊酸钠缓释片(I)7.丙泊酚乳状注射液(曾用名:丙泊酚注射液)8.丙酸氟替卡松9.左卡尼汀10.左甲状腺素钠11.左甲状腺素钠片12.右佐匹克隆13.右佐匹克隆片14.卡培他滨15.卡培他滨片16.甲钴胺片17.甲钴胺注射液18.甲磺酸多沙唑嗪19.甲磺酸多沙唑嗪片20.甲磺酸多沙唑嗪胶囊21.甲磺酸瑞波西汀22.甲磺酸瑞波西汀片23.甲磺酸瑞波西汀胶囊24.兰索拉唑肠溶胶囊25.矛头蝮蛇血凝酶(曾用名:蛇毒血凝酶、血凝酶)26.注射用矛头蝮蛇血凝酶(曾用名:注射用蛇毒血凝酶、注射用血凝酶)27.地红霉素肠溶片28.地红霉素肠溶胶囊29.西尼地平胶囊30.西吡氯铵31.西吡氯铵含漱液32.西咪替丁注射液33.西洛他唑片34.托拉塞米35.托拉塞米片36.托拉塞米胶囊37.注射用托拉塞米38.吗替麦考酚酯分散片39.伏格列波糖40.伏格列波糖片41.伏格列波糖胶囊42.米氮平43.米氮平片44.那他霉素45.那他霉素滴眼液46.坎地沙坦酯片47.克霉唑阴道膨胀栓[曾用名:克霉唑栓(指含膨胀棉条的克霉唑栓)]48.更昔洛韦胶囊49.来曲唑50.来曲唑片51.吲哚美辛片52.佐米曲普坦分散片53.阿托伐他汀钙54.阿利沙坦酯55.阿利沙坦酯片56.阿那曲唑片57.苯磺酸左氨氯地平58.苯磺酸左氨氯地平片59.拉西地平60.拉西地平片61.依巴斯汀62.依巴斯汀片63.草酸艾司西酞普兰64.草酸艾司西酞普兰片65.枸橼酸坦度螺酮66.枸橼酸坦度螺酮胶囊67.抗凝血用枸橼酸钠溶液[曾用名:(1)输血用枸橼酸钠注射液(适应症为仅用于单采原料血浆的体外抗凝血)K2)枸橼酸钠抗凝剂]68.枸橡酸钾颗粒69.氟尿苷(曾用名:氟脲苷)70.复方氨基酸(15)双肽(2)注射液71.美司钠72.美司钠注射液73.盐酸乙哌立松74.盐酸乙哌立松片75.盐酸左布比卡因76.盐酸左布比卡因注射液77.盐酸托烷司琼片78.盐酸托烷司琼胶囊79.盐酸曲普利啶80.盐酸伊达比星81.注射用盐酸伊达比星82.盐酸奈福泮胶囊83.盐酸度洛西汀84.盐酸度洛西汀肠溶片85.盐酸度洛西汀肠溶胶囊86.盐酸羟甲唑啉87.盐酸羟甲唑啉喷雾剂88.盐酸羟甲唑啉喷鼻液89.盐酸羟苄唑90.盐酸羟苄唑滴眼液(曾用名:羟苄唑滴眼液)91.盐酸奥布卡因92.盐酸奥布卡因滴眼液93.氨糖美辛肠溶片94.氨糖美辛肠溶胶囊95.脂肪乳注射液(C14~24)(曾用名:脂肪乳注射液)96.酒石酸溴莫尼定97.酒石酸溴莫尼定滴眼液98.酚磺乙胺99.注射用酚磺乙胺100.铝碳酸镁101.铝碳酸镁咀嚼片102.葡萄糖酸钙氯化钠注射液103.硝酸益康唑阴道膨胀栓[曾用名:硝酸益康唑栓(指含膨胀棉条的硝酸益康唑栓)] 104.氯沙坦钾105.氯沙坦钾片106.氯沙坦钾胶囊107.酮咯酸氨丁三醇108.酮咯酸氨丁三醇注射液109.腺苷110.腺苷注射液[曾用名:腺苷注射液(供诊断用)]111.去氨加压素片(曾用名:醋酸去氨加压素片)112.注射用去氨加压素(曾用名:注射用醋酸去氨加压素)113.磷酸氟达拉滨114.注射用磷酸氟达拉滨115.磷酸腺嘌呤(曾用名:维生素b4)116.磷酸腺嘌呤片(曾用名:维生B4片)117.碘帕醇注射液三部生物制品收载153种,其中新增20种、修订126种;新增生物制品通则2个、总论4个。

中国药典》2020年版(三部)增修订概述中国药典》2020年版三部的编制工作,以科学为基础,以建立“最严谨的标准”为指导,进一步强化了质量标准的科学性和先进性。
此次修订以临床需求为导向,扩大了品种收载范围,完善了国家药品标准体系,同时加强了生物制品全过程质量控制的相关要求,推动了现代先进检测技术的应用。
本部药典收录凡例、生物制品通用技术要求、总论、各论、通则(检测方法),具体增修订情况见表1.在生物制品通用技术要求方面,本部药典新增了“生物制品通用名称命名原则”、“生物制品分包装及贮运管理”和“生物制品病毒安全性控制”通用技术要求。
其中,“生物制品病毒安全性控制”基于风险评估和生物制品各类产品特点,提出了综合技术要求,同时兼顾了生产工艺和上市后监测的需求,从生物制品生产全过程质量控制保证生物制品全生命周期的病毒安全性。
此外,为规范生物制品通用名称的使用,保证临床使用和流通过程中对生物制品的准确识别,以及对上市药品全生命周期追溯和药物警戒监管,根据我国生物制品实际情况,参照国际通用原则制定了“生物制品通用名称命名原则”。
表1总结了《中国药典》2020年版三部的收载情况,其中治疗类制品中有4个重组细胞因子品种系由2015年版9个不同表达载体的品种合并而成,另有从药典二部转来4个胰岛素类品种,未作为新增品种统计。
在修订生物制品通用技术要求方面,具体情况详见表1.本部药典新增了多个生物制品品种各论,包括“乙肝疫苗”,“水痘疫苗”,“人用流感病毒疫苗”,“人用人瘤病毒疫苗”,“人用人免疫缺陷病毒疫苗”,“人用人瘤病毒疫苗”,“人用肺炎球菌多糖疫苗”等。
这些品种各论针对不同的生物制品进行了详细的规定和要求,包括生产工艺、质量控制、贮存和运输等方面。
这些规定和要求有助于确保生物制品的质量和安全性,同时也为相关企业提供了标准化操作的指导。
1.3.2修订品种本部药典对多个生物制品品种进行了修订,包括“狂犬病疫苗”,“乙型脑炎疫苗”,“百白破联合疫苗”,“麻疹、风疹、流腮疹三联疫苗”,“人用丙型肝炎疫苗”等。
2020版中国药典变化情况
根据《中国药典》(2020版)公开信息,整理了2020版药典的变化内容,主要如下:
2020年版《中国药典》新增品种319种,修订3177种,不再收载10种,品种调整合并4种,共收载品种5911种。
1、一部中药收载2711种,其中新增117种、修订452种。
2、在中药安全性控制方面,新版药典要求有效控制外源性污染物的影响,并有效控制内源性有毒成分对中药安全性产生的影响。
3、在中药有效性控制方面,要求强化标准的专属性和整体性,重点开展了基于中医临床疗效的生物评价和测定方法研究。
4、二部化学药收载2712种,其中新增117种、修订2387种。
5、在药品安全性控制方面,要求进一步完善杂质和有关物质的分析方法,推广先进检测技术的应用,重点强化了对有毒有害杂质(特别是基因毒性杂质)的控制,加强了对药品安全性相关控制项目和限度标准的研究制定。
6、在药品有效性控制方面,要求将药品质量和疗效一致性评价的成果体现在相关制剂的质量标准提高中,进一步完善了常规固体制剂溶出及释放度检测方法,且在整体质量控制方面进一步借鉴国际要求。
7、三部生物制品收载153种,其中新增20种、修订126种;新增生物制品通则2个、总论4个。
此外还将进一步完善生物制品全过程质量控制的要求,补充完善生物检测技术、方法以及相关技术指南,完善品种收载类别,加快我国近年来批准上市的、成熟的疫苗及治疗性生物药的收载。
8、四部收载通用技术要求361个,其中制剂通则38个(修订35个)、检测方法及其他通则281个(新增35个、修订51个)、指导原则42个(新增12个、修订12个);药用辅料收载335种,其中新增65种、修订212种。
2020年版中国药典概述:中国药典是中国医药行业的重要参考工具之一,旨在规范和统一药品质量标准,保障公众用药安全,并促进医药行业的发展。
中国药典由国家药品监督管理局(NMPA)主管,并由中国药典委员会(CPD)负责编纂和修订。
2020年版中国药典是继2015年版后的更新和修订版,全面涵盖了各类药品的质量要求和检测方法。
重要变化:2020年版中国药典相较于以往版本,包含了一系列的重要变化和更新,以适应当前医药行业的发展和需求。
其中一些重要变化包括:1. 新增药品和药材:2020年版中国药典新增了许多新药品和药材,反映了医药行业近年来的创新和发展。
这些新药品包括治疗癌症、心血管疾病、神经系统疾病等疾病的创新药物,为患者提供了更多的治疗选择。
2. 更新的药品质量标准:随着科技的进步和药物研发的不断推进,药品质量标准也需要相应更新。
2020年版中国药典对许多药品的质量标准进行了修订,包括化学成分、纯度、溶解度、微生物限度等方面的要求,以确保药物的质量和安全性。
3. 新的检测方法:为了更准确地评估药品的质量,2020年版中国药典引入了一些新的检测方法。
例如,使用高效液相色谱法(HPLC)对药品中活性成分进行测定,或使用气相色谱法(GC)对溶剂残留进行检测。
这些新的检测方法可以提高药品检测的准确性和可靠性。
4. 药典创新技术:2020年版中国药典还包括了一些创新技术的应用。
例如,生物制品的质量评价中引入了基因测序技术,为生物制品的研发和质量控制提供了更多的手段和指标。
影响和意义:2020年版中国药典对医药行业的影响和意义不可低估。
首先,药品质量标准的统一和规范将为医药企业提供更明确的生产和质量控制指南,提高产品质量,促进行业健康发展。
其次,药典的更新和修订反映了医药科技的进步和发展趋势,为患者提供了更安全、有效的治疗选择。
此外,药典的发布还将促进药品质量监管的加强,加强对药品生产、流通和使用中的监督和管理,保障公众用药安全。
中国药典将再编,中药扩军220个,标准制订引争议!问题:怎么才能每天收到这种文章呢?答案:只需点击上方蓝字药信达即可!日前,国家药典委员会与北京医药行业协会联合在京召开《中国药典》中药饮片标准执行与修订工作研讨会。
国家药典委员会秘书长张伟指出,2020版中国药典将更加关注中药饮片标准的完善,特别是安全标准的提升。
通过药典标准形成机制的改革完善,使标准的制订更加开放、科学、严谨。
结合前期国家药典委员会透露信息,我们发现,新版2020版药典在中药领域,新增和修订品种预计超过1600个。
其中新增中药材品种220个,修订当前中药标准500个。
2020版药典,中药方面的“扩军”原则按照“临床常用、疗效确切、使用安全、工艺成熟、质量可控”的品种遴选原则,新进入药典品种需符合以下条件:1.基础研究扎实,来源单一,有安全型和有效性研究资料,资源(野生和栽培)有保障的;2. 药典收载过,且现版药典收载的多个中成药处方中含有的;3. 药典未曾收载过,但在现版药典收载的多个中成药处方含有的,且在临床配方上有应用的;4. 单个中成药处方中含有,如果该制剂的产量和经济效益很大,原则上可考虑收录;5. 对于新收录品种,本着高标准的原则,严格要求;6. 对于已有药材品种新增基源的,原则上不考虑,应按照新药品种报批。
按照以上原则,哪些药材可能进入新版药典呢?如果有220个药材品种进入药典,则意味着在2015版药典的618种药材和饮片品种基础上,将再次大幅度扩编至838个,增幅达到35.6%,是近几版药典扩充力度最大的一次。
那么,我中心预计将有以下药材可能进入新版药典:一是进入基药目录中成药的部分原料,如桉叶、蟾皮、金樱根、獐牙菜、芒果核等;二是单个中成药配方使用,且经济效益较大的品种,如田基黄、莽草、金莲花、天青兰、桃儿七、隔山消等;三是近些年新开发且用量较大的药材或药食两用品种,如桑黄、金蝉花、溪黄草、金线莲、黄花倒水莲等;四是临床用量较为普遍,但尚未进入药典的习用品种,例如毛冬青、夜交藤、透骨草、隔山消、葫芦茶、扁豆花、白花蛇舌草、薜苈、地胆草、叶下珠、海浮石等;五是同名但功效差异较大,甚至同名异物,必须进行药典明确的品种,如黄芥子与白芥子、菥蓂与败酱草、杭菊花和菊花、芦根与苇茎等。
2020年版药典中药材、中药饮片都有哪些新变化{{中国药典}}2020年版收载品种总数计划达到6400个左右,其中:中药增加品种约220个,化学药增加品种约420个,生物制品增加品种收载30个,药用辅料增加品种约100个,药包材品种收载30个,共约800个。
药典已收载品种计划修订1400个,其中:中药500个,化药600个,生物制品150个。
中药材标准的增修订
中药材是中医临床和中药产业的根本,是基础中的基础,必须建立严格、科学的标准。
(一)品种的增加与退出
(1)增加收载有临床用药需求、基础研究扎实、资源(野生和栽培)丰富的品种。
(2)增加收载现版药典收载或拟收载中成药处方药味中未收入药典的中药材标准。
(3)对于野生资源枯竭、商品匮乏、存在明显安全性、伦理等问题(如化石类、人类胎盘类、动物粪便类等),以及基础研究薄弱的品种从药典中退出或不再增加收入本版药典。
(4)已有中药材品种新增基原,原则上按照“新发现中药材”进行申报注册,获得批准后,可考虑作为新的基原收入药典,但经本草考证证明属于历史误用需要正本清源的品种不在此列。
(二)中药材名称、来源和药用部位的修订与规范
根据本草考证,结合中药材生产实际,对部分中药材名称、来源和药用部位进行修订;对原植、动物的科、属、种和拉丁学名、原矿物的类、族和矿石进行进一步的考证,进一步修订和规范中药材的来源。
(三)中药材采收和加工方法及药材性状的修订
当前,随着中药农业的快速发展,许多常用中药材已不再依赖野生资源,实现了大规模种植养殖,且采收和加工已相对集中,并逐步实现机械化。
中国药典要顺应中药产业的变革和进步,把好质量关,本版药典须对中药材采收和加工方法及药材性状进行修订。
(1)制定中药材采收加工技术评价方法和指导原则,把中药材采收和产地加工纳入科学化、法制化轨道。
(2)收载和规范中药材趁鲜切片直接干燥的产地加工方式。
其收载品种必须符合上述指导原则的要求,仅限于部分传统采收加工方法落后,药材难以干燥且长时间干燥过程中易霉变或导致成分明显下降的中药材以及对传统采用硫磺熏蒸改用产地无硫加工方法的中药材。
(3)对上述相关产地加工的中药材来源、性状进行修订,鼓励先进技术应用,提升和保障中药材质量。
对于经产地加工后可直接作为饮片使用的按中药饮片建立标准,其加工条件也应符合饮片生产规定,并按饮片生产管理。
(4)对于存在明显的产地依赖性和对生长年限要求严格的中药材,要明确产地、采收期和采收年限。
全面提升安全性控制水平
完善中药材安全性检测方法,根据《中国药典》“中药有害残留物限量指导原则”,建立中药材中重金属及有害元素、农药残留、易霉变中药材真菌毒素等的限量标准,尤其对国家明令禁用限用的农药必须制定统一的限量标准,通过严格的限量标准,反制源头种植阶段滥用农药乱象,严把中药材安全关。
(四)中药饮片标准的增修订
1、建立和完善中药饮片标准体系
为了加强饮片的质量控制和市场监管,更好地服务于临床,本版药典拟探索建立能体现中药饮片特点的独立的饮片标准体系。
根据现版药典各饮片品种的质量标准状况,对各项检测项目进行全面补充、修订和提高。
2、增收中药饮片
根据临床需求,适当增加全国普遍使用的来源明确、炮制工艺科学、合理的饮片品种。
3、规范饮片名称
对本版药典收载的所有饮片梳理,全面规范饮片名称。
对于个别饮片名称虽然不规范,但中医临床已约定俗成的要酌情处理(如有些饮片在药材名称后加“片”)。
重点完善和规范饮片炮制方法
本版药典饮片炮制方法在体例和内容上要和饮片炮制规范相结合进行补充、修订和完善。
实现饮片炮制方法规范化。
5、增修订饮片的规格和性状
建立、完善和规范产地鲜切加工饮片、机械切制饮片、非传统方法切制饮片等新型饮片片形的规格及性状,保障和提升饮片质量。
6、加强饮片的专属性鉴别
研究野生和栽培药材对显微特征产生的变化,对相关饮片进行相应的修订;研究饮片炮制前后产生的成分变化,建立饮片的薄层鉴别、特征图谱鉴别等专属性方法;尤其对于贵细饮片、易混饮片、市场掺假
染色增重等现象较严重的饮片,着力研究建立特征图谱鉴别方法,通过专属的鉴别方法,反制假冒伪劣。
着力研究“毒性”、“生熟异治”等中药饮片有别于中药材的专属性鉴别指标。
7、重点加强饮片外源性有毒有害残留物的限量检测,保障临床用药的安全性
建立和完善中药饮片安全性检测方法,根据《中国药典》“中药有害残留物限量指导原则”,全面制定饮片中重金属及有害元素、农药残留的限量标准,并收入相应通则项下。
继续开展易霉变饮片的真菌毒素研究,对于易检出真菌毒素的品种,制定相应的限量标准,并收入通则项下。
8.研究建立专属性能体现饮片特点的含量测定,逐步建立饮片成分整体控制方法
根据饮片炮制研究成果,研究并建立符合饮片特点的含量测定方法,着力研究“毒性”、“生熟异治”等中药饮片有别于中药材的关键质量指标,并建立相关指标成分的含量测定;依据中药整体成分发挥作用的特点,进行指纹图谱和多成分含量测定研究并建立标准,提升饮片有效性的控制方法。
(五)植物油脂和提取物质量标准的增修订
1、增加植物油脂和提取物品种
随着创新药物的发展,一批有效成分和有效部位新药获得注册上市,重点遴选获得批准的有效成分和有效部位提取物收入药典,并对相应的标准进行提升,所有有效部位提取物均须建立指纹图谱,有利于这类产品的监督管理。
2、规范植物油脂和提取物的名称
针对现版药典收载的部分植物油脂和提取物的名称与其实际生产工艺和提取物中所含主要成分不符,拟对名称进行进一步的核实和修订。
3、全面提高植物油脂和提取物标准
所有提取物均须建立专属性鉴别、含量测定和指纹图谱,现版药典部分植物油脂和提取物缺乏专属性鉴别,含量测定指标成分少,尚未建立指纹图谱或特征图谱,本版药典要“填平补齐”,提升质量控制水平。
(六)中药成方制剂和单味制剂质量标准的增修订
1、品种的增加与退出
为了满足临床用药需求,保障基本药物和医保目录中成药的遴选,本版药典计划增收中成药约220种。
重点考虑临床急需、安全有效、质
量可控、剂型合理,并能体现中医药特色和现代中药产业发展现状的中成药品种,尤其是标准提高行动计划中已全面提高标准并符合上述要求的中成药品种。
在品种遴选和标准制定中,充分发挥企业的主体作用。
进一步完善药典中成药的退出机制。
对药典收载的老品种进行医学和药学评估,以野生濒危动植物、化石类、人类胎盘类、动物粪便类等为原料的中成药不再收入药典;对临床长期不使用的品种、剂型或规格不合理的品种,可考虑退出药典,转入其他国家药品标准;不同意公开处方量、制法的品种,原则上不再收入药典。
2、完善和规范中成药标准体系
全面完善中成药标准体系,补充各品种项下的缺项;进一步规范药典收载中成药品种的名称;除国家保密品种外,收入药典的中成药实现处方与制法全部公开。
3、修订和规范中成药的制法
通过调研和现场核查,厘清中成药标准中规定的“制法”与企业实际生产“工艺”的定位和区别,全面规范中成药制法和制成量的描述。
4、加强中成药专属性鉴别
对医保和基本药物收载的品种以及临床需求量大的重点品种,进一步开展处方药味定性鉴别研究,建立处方中主要植物性药味的薄层鉴
别,积极推进1个薄层条件下鉴别多个药味,简化鉴别方法;对于药味复杂、鉴别难度大的品种,建立特征图谱鉴别标准。
5.加强中成药能表征其有效性检测技术的研究
对医保和基本药物收载的品种以及临床需求量大的重点品种,开展处方药味主要成分的含量测定研究,建立多成分含量测定方法;对于独家生产的品种,原则上应建立指纹图谱标准。
(七)国际协调
主动组织、积极参与药品标准的国际协调,进一步扩大《中国药典》中药标准的国际影响力,掌握国际标准制定话语权,保持中药标准的国际主导地位。
《中国药典》2020 年版中药材、中药饮片共拟修订药材标准218 个(不含重金属、禁用农药涉及的数量);重金属、禁用农药通用要求涉及药典收载的植物类药材标准有544 个;植物油脂和提取物拟修订7 个;中成药拟新增加品种117 个,修订品种160 个。
全面制定易霉变中药材、饮片真菌毒素限量标准。
例如:蜂房、土鳖虫等4 个增加了黄曲霉毒素的限量要求。
薏苡仁增加玉米赤霉烯酮的限量要求。
全面制定中药材与饮片中重金属及有害元素、农药残留的限量标准,并收入相应通则项下。
铅不得过5mg/kg,镉不得过1mg/kg,砷不得
过2mg/kg,汞不得过0.2mg/kg,铜不得过20mg/kg ;禁用农药不得检出。
②修订通则2341农药残留量测定法,增订药材及饮片(植物类)中禁用农药的残留测定法。
③修订通则9302 中药中有害残留物限量制定指导原则。
(以上内容从百度资料整理)。