推断题题眼集锦
- 格式:docx
- 大小:13.58 KB
- 文档页数:1


“题眼”1.以物质的特征颜色找“题眼”。
(1)固体颜色黑色:C 粉、CuO 、MnO 2、Fe 3O 4、Fe 粉; 紫红色单质:Cu (一般可用作导线); 红棕色粉末:Fe 2O 3(赤铁矿、铁锈成分)。
(2)溶液颜色——“铜蓝亚铁绿铁黄” 蓝色:CuSO 4、CuCl 2等含Cu 2+的溶液; 浅绿色:FeSO 4、FeCl 2等含Fe 2+的溶液; 棕黄色:FeCl 3、Fe 2(SO 4)3含Fe 3+的溶液。
(3)沉淀颜色——“一蓝一红褐五白” 蓝色:Cu(OH)2; 红褐色:Fe(OH)3; 白色:(可溶酸)CaCO 3、BaCO 3、Mg(OH)2,(不溶酸)BaSO 4、AgCl 。
2.以物质的特性、用途及现象找“题眼”。
(1)能使澄清石灰水变浑浊的气体是CO 2; (2)有剧毒、与血红蛋白结合的气体是CO ; (3)人体胃液中帮助消化的物质(酸)是HCl ; (4)常用的食品干燥剂是CaO ;(5)一种调味品,常用来腌渍蔬菜的是NaCl ; (6)能跟水反应,且放出热量的氧化物是CaO ; (7)改良酸性土壤的碱是Ca(OH)2; (8)俗名为纯碱的物质是Na 2CO 3。
(9)作糕点发酵粉的盐是NaHCO 3;(10)为建筑材料的主要成分,常用作补钙剂的盐是CaCO 3。
3.以物质的特征反应条件找“题眼”。
1.A B+C ,A 一般是H 2O ,生成H 2和O 2。
2.A B+C ,A 一般是CaCO 3,生成CaO 和CO 2。
3.A+B C+D ,一般是CO 炼铁、C 还原CuO 。
若A 、B 有一种为气体或红色粉末,一般是CO 炼铁。
若A 、B 均为黑色固体,一般为C 还原CuO 。
,一般是5. A B+C+D ,A 一般是 。
6.A+B →C+D+E,一般为 。
7.A BC+D 或A+B →B+C+D ,一般为 。
8. A B C+D 或A+B →B+C+D ,一般为 。


推断题【解题思路】审题,关键在于寻找突破口,然后顺藤摸瓜,进而完成全部未知物的推断.1、以物质颜色,气味,状态为突破口。
①固体颜色:【黑色】单质: 氧化物、、【暗紫色】【红色】单质:、【黄色】单质:②溶液颜色:【蓝色】【浅绿色】③气体颜色:【无色无味的气体】、、、、、【有刺激性气味的气体】、2、以沉淀颜色为突破口:白色沉淀:、蓝色沉淀:3、以物质反应条件为突破口:【点燃】【通电】【催化剂】4、以物质特征现象为突破口①能使澄清石灰水变浑浊的无色无味气体是②形成温室效应的主要气体④让紫色石蕊溶液变红的气体⑤让酚酞溶液变红的气体⑥形成酸雨的气体⑦能使黑色固体变红的气体是或,固体是⑧能使带火星木条复燃的是⑨在O2中燃烧火星四射的物质是⑩大理石、石灰石、鸡蛋壳的主要成分:⑪具有可燃性的气体是、、⑫具有还原性的物质是、、⑬组成元素相同的液态化合物和,气态化合物和5、以物质之最为突破口①相对分子质量最小、最理想的燃料气体是②相对分子质量最小的氧化物是③自然界中硬度最大的物质是④地壳中含量最多的元素是,金属元素是⑤人体中含量最多的元素是 ,金属元素是⑥空气中含量最多的物质是例题:1、A—G是初中常见的7种物质,它们有如图所示的转化关系.已知A、C是无色液体,B、F、G是无色气体,其中大量排放F会引起温室效应,D是黑色固体,E在纯净的B中燃烧发出明亮的蓝紫色火焰.(1)请写出下列物质的化学符号 D 、F .(2)请写出下列变化的化学方程式并注明反应类型为(填化合反应或分解反应)①B→F ()②C→B ()2、有一瓶气体,它由H2、CO、CO2、CH4中的一种或几种组成,用它进行如图所示的实验;用化学式回答问题:(1) 气体中一定没有_____________ 。
(2) 气体的组成可能是(有几种填几种,可不填满)①________________②_____________③______________3、A 是一种白色难溶于水的物质,三种元素组成,其相对分子质量为100。


阅读理解中的推理判断与推断能力(练习题及)一、练习题1. 根据以下短文回答问题:在一个晴朗的早晨,小明骑着自行车去上学。
他经过了一片森林,看到了许多不同种类的树木。
他注意到一种树叶颜色特别鲜艳,决定采一片回家留作纪念。
他发现这种树叶上有小小的红点。
小明观察到这种树叶在树上只长在阳光直射的地方。
他推断这种红点是由阳光引起的,阳光直射的位置养分较多,树叶不太容易受到风雨侵蚀。
问题:小明是如何推断这种树叶上的小红点的?2. 根据以下短文回答问题:李雷和韩梅是好朋友,他们两人分别住在城市的两个不同区域。
有一天,李雷打电话给韩梅说:“我突然发现在我居住的区域里,超市里的菜价比以前贵了很多,而且交通拥堵情况也越来越严重。
你觉得你那边的情况怎么样呢?”韩梅答道:“奇怪,我这边的超市菜价相对较低,交通也没有拥堵的情况。
也许我们可以通过数据来比较一下两个区域的情况。
”问题:韩梅是如何通过数据比较分析两个区域的情况的?二、解答1. 小明推断这种树叶上的小红点是由阳光引起的,基于以下观察:- 小红点只出现在阳光直射的位置;- 阳光直射的位置养分较多,树叶不太容易受到风雨侵蚀。
通过这些观察,小明可以推断阳光引起了这种树叶上的小红点。
2. 韩梅通过数据比较分析两个区域的情况,可能采取以下步骤:- 收集李雷所在区域的超市菜价和交通拥堵情况的数据;- 收集自己所在区域的超市菜价和交通情况的数据;- 对两个区域的数据进行比较分析,包括计算平均菜价、比较交通拥堵指数等;- 根据比较分析的结果得出结论,判断两个区域的情况异同。
通过以上数据比较分析,韩梅可以了解两个区域的超市菜价和交通状况是否存在差异,并得出结论。

物质结构元素周期律推断题一:题眼及解读:1.某原子最外层电子数为次外层(或倒数第m层)的n倍。
(n为大于1的整数)2.元素原子的最外层电子数等于电子层数。
(H、Be、Al)3.原子的次外层电子数为8。
(第三周期的元素和第四周期的K和Ca)4.Am+和Bn-具有相同的电子层结构(A应是金属元素,而B是A上一周期的非金属元素)5.已知元素的气态氢化物的化学式,又知该元素最高价氧化物对应的水化物中该元素的百分含量为A%,以及元素的原子核中所含的中子数。
解读:由元素的气态氢化物的化学式可知元素的负价和最高正化合价,根据元素的最高化合价写出元素的最高价氧化物的化学式,再据其氧化物中所含该元素的质量分数,可求得元素的相对原子质量,相对原子质量与元素原子的质量数近似相等,质量数减去中子数即为其质子数,从而确定出该元素。
6.1molA与足量的盐酸反应产生标况下的22.4LH2。
(第ⅡA元素)7.A、B、C三种元素最高价氧化物的水化物可两两发生反应。
(一个为酸,一个为碱,另一个为两性氢氧化物)8.在周期表中,相邻的A、B、C三种元素原子序数之和为m,其中A、B同周期,B、C同主族。
(设三元素的原子序数为a、b、c,则a+b+c=m,a=b±1,c=b±8或c=b±18,这样就可以解出三元素的原子序数。
当然,也可以用观察元素周期表的方法来找出三种元素。
)9.元素的最高正价与负价绝对值之差为m。
解读:因为主族元素的最高正价与负价的绝对值之和为8,若其绝对值之差为m,则可设其最高正价为x,负价为y,得方程式:|x|+|y|=8,|x|-|y|=m(因为负价的绝对值一般不超过4,所以正价的绝对值大于负价的绝对值),解出其化合价数值,推出其所在的族序数。
10.元素A、B可形成A2B、A2B2型的化合物。
解读:通常情况下,A2B、A2B2型的化合物有Na2O、Na2O2或H2O、H2O2,所以可以推断典例分析:例1.A、B、C、D四种元素。

附录三解推断题必备“题眼”集锦一、以物质的特征颜色为突破口1.固体颜色(1)黑色固体(5种):Fe(粉)、C粉、CuO、MnO2、Fe3O4。
(2)红色固体(2种):Fe2O3、P(红磷)。
(3)紫红色固体:Cu。
2.三种溶液颜色(1)蓝色溶液(含Cu2+离子的溶液):CuCl2、CuSO4、Cu(NO3)2。
(2)浅绿色溶液(含Fe2+离子的溶液):FeCl2、Fe(NO3)2、FeSO4。
(3)黄色溶液(含Fe3+离子的溶液):FeCl3、Fe(NO3)3、Fe2(SO4)3。
3.沉淀颜色(1)有色沉淀:蓝色沉淀Cu(OH)2、红褐色沉淀Fe(OH)3。
(2)白色沉淀(7个):BaSO4、AgCl、CaCO3、BaCO3、Ag2CO3、Mg(OH)2、Al(OH)3。
①其中不溶于稀硝酸的白色沉淀(2个):BaSO4、AgCl;②溶于酸并有气体放出的白色沉淀(3个):CaCO3、Ag2CO3、BaCO3;③溶于酸但没有气体放出的白色沉淀(2个):Mg(OH)2、Al(OH)3。
二、以“反应的特征现象”为突破口1.能使澄清石灰水变浑浊的无色无味气体是CO2。
2.能使黑色CuO变红(或红色Fe2O3变黑)的气体是H2或CO,固体是C。
3.能使燃着的木条正常燃烧的气体是空气,燃烧更旺的气体是O2,使火焰熄灭的气体是CO2或N2;能使带火星的木条复燃的气体是O2。
4.在O2中燃烧火星四射的物质Fe。
5.在O2中燃烧发出耀眼的白光的物质是Al、Mg。
6.在空气中燃烧生成水和二氧化碳的物质是有机物,如CH4、C2H5OH等。
7.溶于水呈碱性的是NH3。
三、以元素或物质之最为突破口1.化学元素、微粒(1)地壳中含量最多的元素O。
(2)形成化合物最多的元素C。
(3)地壳中含量最多的金属元素Al。
(4)人体中含量最多的元素是O。
空气中含量最多的元素是N。
2.常见化学物质(1)最理想的清洁燃料H2。
(2)最简单的有机物CH4。

初中化学常见推断题“题眼”1.火焰颜色:淡蓝色:H2、S在空气中燃烧蓝色:CO、CH4和酒精在空气中燃烧蓝紫色:S在氧气中燃烧火星四射:Fe在氧气中燃烧2.还原性物质:能使黑色CuO变红的气体为H2或CO,固体为C,其中CO和C都生成了能使澄清石灰水变浑浊的气体,3.特殊反应的物质:①与盐酸反应产生无色无味并能使澄清石灰水变浑浊的气体,这种物质中含有CO32-或HCO3-②在空气中能自燃的是白磷③遇Ba2+生成不溶于稀盐酸的白色沉淀的物质中含有SO42--④遇Ag+生成不溶于稀硝酸的白色沉淀的物质中含有Cl⑤遇碱液能生成蓝色沉淀的物质中含有Cu2+⑥遇碱液能产生氨气(刺激性味)为铵态氮肥常见物质的俗称:名称俗名化学式汞水银Hg氧化钙生石灰CaO氧化铁铁锈Fe2O3二氧化碳(固体)干冰CO2一氧化碳煤气CO甲烷天然气、沼气、瓦斯气CH4乙醇酒精C2H5OH氢氯酸盐酸HCl氢氧化钠火碱、烧碱、苛性钠NaOH氢氧化钙熟石灰、消石灰Ca(OH)2氯化钠食盐NaCl碳酸钠纯碱、苏打Na2CO3碳酸氢钠小苏打NaHCO3碳酸钙大理石、石灰石、CaCO3硫酸铜晶体胆矾、蓝矾CuSO45H2O物质的用途O2:炼钢、医疗CO:炼铁、燃料CO2:灭火人工降雨CaO:建筑材料Ca(OH)2:制波尔多液、改良酸性土壤CaCO3:建筑材料、工业制CO2NaOH:化工原料、制肥皂、精炼石油、造纸、纺织;固体可作某些气体干燥剂HCl:除锈、少量助消化、制化肥H2SO4:除锈、制化肥,浓硫酸可作某些气体干燥剂碳酸钠:用于玻璃、造纸、纺织和洗涤剂生产碳酸氢钠:发酵粉的主要成分,可治疗胃酸氯化钠:医疗生理食盐水,农业选种,融雪剂,工业制碳酸钠、氢氧化钠、氯气、盐酸等。
蒸馏可降低水的硬度,肥皂水可以区分软水和硬水治疗胃酸过多用Al(OH)3尾气吸收用NaOH化学与社会发展:1.当今世界最重要的三大化石燃料是煤、石油和天然气。
2.石油主要含有C、H元素,煤主要含有C元素,煤和石油都是混合物。

一、不饱和度1不饱和度的概念不饱和度乂称缺氢指数或者环加双键指数,是有机物分子不饱和程度的量化标志,即有机物分子中与碳原子数相等的开链烷轻相比较,每减少2个氢原子, 则有机物的不饱和度增加1,用希腊字母Q表示。
2不饱和度的计算2.1根据有机物的化学式计算常用的计算公式:2.2非立体平■面有机物分子,可以根据结构计算Q=双键数+参键数X2+环数备注:双键包含碳碳、碳氮、氮氮、碳氧双键;参键包含碳碳、碳氮参键;环数等丁将环状分子剪成开链分子时,剪开碳碳键的次数,环包含含 N 、O 、S 等的杂环。
如苯:Q=6+1-6/2=3+0 X2+1=4 即苯可看成三 个双键和一个环的结构形式。
例子:=8+0 X2+3=132.3立体封闭有机物分子(多面体或笼状结构)不饱和度的计算,其成环的不饱 和度比面数少数1 例子:立方烷面数为6, Q=5 降冰片烷面数为3, Q=2 棱晶烷面数为5, Q=43不饱和度的应用3.1分子的不饱和度(Q )与分子结构的关系: ① 若Q=0,说明分子是饱和链状结构② 若Q=1 ,说明分子中有一个双键或一个环;③ 若Q=2 ,说明分子中有两个双键或一个三键; 或一个双键和一个环;或两个环; 余类推;④ 若Q >4,说明分子中很可能有苯环。
3.2辅助推导化学式,思路如下结构简式一一计算不饱和度一一计算H 原子数一一确定分子式例1 : 1mo1X 能与足量碳酸氢钠溶液反应放出 44.8LCO 2(标准状况),则X 的分 子式是:()A 、C 5H 10O 4 B. C 4H 8O 4 C. C 3H 6O 4 D. C 2H 2O 4例2: 一种从植物中提取的天然化合物 a-damascone ,可用丁制作“香水”,其结 构如下图,有关该化合物的下列说法不正顿.的是()A.分子式为C 13H 20O 0B. 该化合物可发生聚合反应C.1mol 该化合物完全燃烧消耗19mol O 2[ ID .与漠的CCl 4溶液反应生成的产物经水解、稀硝酸化后可用AgNO 3溶液检验例3:请仔细阅读以下转化关系:=6+1 X2+2=10QQ=4+0 X2+2=6Q oA 是从蛇床子果实中提取的一种中草药有效成分,是由碳、氢、氧元素组成 的酯类化合物;B 称作冰片,可用丁医药和制香精、樟脑等;C 的核磁共振氢谱显示其分子中含有 4种氢原子;D 中只含一个氧原子,与 Na 反应放出H2; F 为轻。
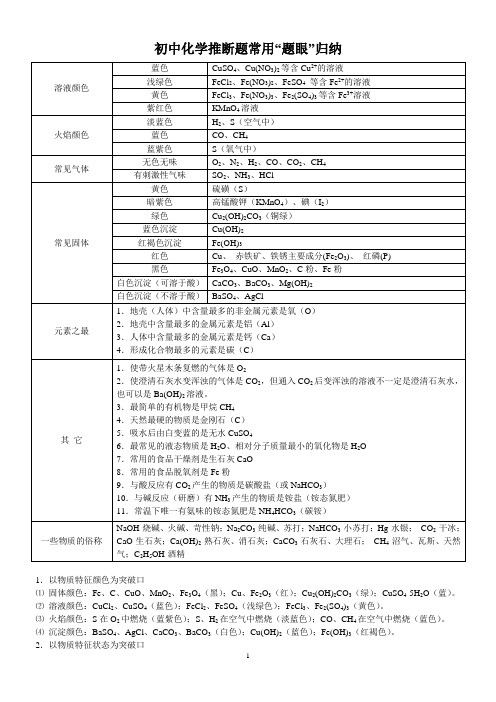
初中化学推断题常用“题眼”归纳1.以物质特征颜色为突破口⑴固体颜色:Fe、C、CuO、MnO2、Fe3O4(黑);Cu、Fe2O3(红);Cu2(OH)2CO3(绿);CuSO4·5H2O(蓝)。
⑵溶液颜色:CuCl2、CuSO4(蓝色);FeCl2、FeSO4(浅绿色);FeCl3、Fe2(SO4)3(黄色)。
⑶火焰颜色:S在O2中燃烧(蓝紫色);S、H2在空气中燃烧(淡蓝色);CO、CH4在空气中燃烧(蓝色)。
⑷沉淀颜色:BaSO4、AgCl、CaCO3、BaCO3(白色);Cu(OH)2(蓝色);Fe(OH)3(红褐色)。
2.以物质特征状态为突破口常见固体单质有Fe、Cu、C、S;气体单质有H2、N2、O2;无色气体有H2、N2、O2、CO、CO2、CH4、SO2;常温下呈液态的物质有H2O。
3.以特征反应条件为突破口:点燃(有O2参加的反应);通电(电解H2O);催化剂(KCIO3分解制O2);高温(CaCO3分解,C、CO还原CuO、Fe2O3);加热(KCIO3、KMnO4、Cu2(OH)2CO3等的分解,H2还原CuO、Fe2O3)。
4.以物质特征现象为突破口⑴能使澄清石灰水变浑浊的无色无味气体是CO2。
⑵能使黑色CuO变红(或红色Fe2O3变黑)的气体是H2或CO,固体是C。
⑶能使燃烧着的木条正常燃烧的气体是空气,燃烧得更旺的气体是O2,熄灭的气体是CO2或N2;能使带火星的木条复燃的气体是O2。
⑷能使白色无水CuSO4粉末变蓝的气体是水蒸气。
⑸在O2中燃烧火星四射的物质是Fe。
⑹在空气中燃烧生成CO2和H2O的物质是有机物,如CH4、C2H5OH等。
⑺能溶于盐酸或稀HNO3的白色沉淀有CaCO3、BaCO3;不溶于稀HNO3的白色沉淀有AgCl、BaSO4。
5.以元素或物质之最为突破口⑴地壳中含量最多的元素是O,含量最多的金属元素是AI。
⑵人体中含量最多的元素是O。
⑶空气中含量最多的元素是N。

初中化学推断题常用“题眼”归纳突破口1.以物质特征颜色为突破口⑴固体颜色:Fe、C、CuO、MnO2、Fe3O4(黑色);Cu、Fe2O3(红色);Cu2(OH)2CO3(绿色);CuSO4·5H2O(蓝色)。
⑵溶液颜色:CuCl2、CuSO4(蓝色);FeCl2、FeSO4(浅绿色);FeCl3、Fe2(SO4)3(黄色)。
⑶火焰颜色:S在O2中燃烧(蓝紫色);S、H2在空气中燃烧(淡蓝色);CO、CH4在空气中燃烧(蓝色)。
⑷沉淀颜色:BaSO4、AgCl、CaCO3、BaCO3(白色);Cu(OH)2(蓝色);Fe(OH)3(红褐色)。
2.以物质特征状态为突破口常见固体单质有Fe、Cu、C、S;气体单质有H2、N2、O2;无色气体有H2、N2、O2、CO、CO2、CH4、SO2;常温下呈液态的物质有H2O。
3.以物质特征反应条件为突破口点燃(有O2参加的反应);通电(电解H2O);催化剂(KCIO3分解制O2);高温(CaCO3分解,C、CO还原CuO、Fe2O3);加热(KCIO3、KMnO4、Cu2(OH)2CO3等的分解,H2还原CuO、Fe2O3)。
4.以物质特征现象为突破口⑴能使澄清石灰水变浑浊的无色无味气体是CO2。
⑵能使黑色CuO变红(或红色Fe2O3变黑)的气体是H2或CO,固体是C。
⑶能使燃烧着的木条正常燃烧的气体是空气,燃烧得更旺的气体是O2,熄灭的气体是CO2或N2;能使带火星的木条复燃的气体是O2。
⑷能使白色无水CuSO4粉末变蓝的气体是水蒸气。
⑸在O2中燃烧火星四射的物质是Fe。
⑹在空气中燃烧生成CO2和H2O的物质是有机物,如CH4、C2H5OH等。
⑺能溶于盐酸或稀HNO3的白色沉淀有CaCO3、BaCO3;不溶于稀HNO3的白色沉淀有AgCl、BaSO4。
5.以元素或物质之最为突破口⑴地壳中含量最多的元素是O,含量最多的金属元素是AI。
⑵人体中含量最多的元素是O。

常见气体单质气体:H2、O2、N2、Cl2(黄绿色)、F2(淡黄绿色)气态氢化物:NH3(无色有刺激性气味,易液化,极易溶于水,能使湿润的红色石蕊试纸变蓝,遇到HCl形成白烟)HCl(无色有刺激性气味,极易溶于水,能使湿润的蓝色石蕊试纸变红,在空气中形成白雾,遇到NH3形成白烟)H2S(无色有臭鸡蛋气味,蛋白质腐败的产物,能溶于水,能使湿润的醋酸铅试纸变黑)非金属气态氧化物:CO、CO2(直线型非极性分子)、NO(遇到空气变红棕色)、NO2(红棕色,加压、降温会转变成无色N2O4)、SO2(无色、有刺激性气味、能使品红溶液褪色)[固态氧化物]:SO3(无色晶体、易挥发)、P2O5(白色固体、易吸湿,常用作干燥剂)、SiO2(不溶于水、不溶于普通酸的高熔点固体,但溶于氢氟酸和强碱溶液)气态卤代烃:一氯甲烷(CH3Cl)、氯乙烯(CH2=CHCl)气态醛:甲醛(HCHO)2.题眼二:气体溶解性归纳难溶于水的:H2、N2、CO、NO、CH4、C2H4;微溶于水的:O2、C2H2;能溶于水的:Cl2(1:1)、H2S(1:2.6)、SO2(1:40);极易溶于水的:NH3(1:700)、HCl(1:500)、HF、HBr、HI。
3.题眼三:常见液态物质无机物:液溴Br2、水(H2O)、过氧化氢(H2O2)、二硫化碳(CS2)、三氯化磷(PCl3)有机物:一般5个碳原子以上的低级烃;除一氯甲烷、氯乙烯之外的低级卤代烃;低级醇;除甲醛之外的低级醛;低级羧酸;低级酯。
常见物质的颜色①红色:Fe(SCN)3(红色溶液);Cu2O(红色固体);Fe2O3(红棕色固体);液溴(深红棕色);Fe(OH)3(红褐色固体);Cu(紫红色固体);溴蒸气、NO2(红棕色)②紫色:Fe3+与苯酚反应产物(紫色);I2(有金属光泽紫黑色固体)KMnO4固体(紫黑色);MnO4-(紫红色溶液)钾的焰色反应(紫色)I2蒸气、I2在非极性溶剂中(紫色)③橙色:溴水(橙色)K2Cr2O7溶液(橙色)④黄色:AgI(黄色固体);AgBr(淡黄色固体);FeS2(黄色固体);Na2O2(淡黄色固体);S(黄色固体);I2的水溶液(黄色);Na的焰色反应(黄色);工业浓盐酸(黄色)(含有Fe3+);Fe3+的水溶液(黄色);久置的浓硝酸(黄色)(溶有分解生成的NO2);浓硝酸粘到皮肤上(天然蛋白质)(显黄色);⑤绿色:Cu2(OH)2CO3(绿色固体);Fe2+的水溶液(浅绿色);FeSO4?7H2O(绿矾);Cl2、氯水(黄绿色);F2(淡黄绿色);CuCl2的浓溶液(蓝绿色);⑥棕色:FeCl3固体(棕黄色);CuCl2固体(棕色)⑦蓝色:Cu(OH)2、CuSO4?5H2O、Cu2+在水溶液中(蓝色);淀粉遇I2变蓝色;Cu(OH)2溶于多羟基化合物(如甘油、葡萄糖等)的水溶液中(绛蓝色);⑧黑色:FeO;Fe3O4;FeS;CuO;CuS;Cu2S;MnO2;C粉;Ag2S;Ag2O;PbS;AgCl、AgBr、AgI、AgNO3光照分解均变黑;绝大多数金属在粉末状态时呈黑色或灰黑色。

压轴题06 推断题化学推断题是初中化学中的重要题型,是每年中考必考题型。
该类题目考查知识面广、变化多端、思维量大、综合性强,是考查学生求异思维、发散思维、抽象思维及逻辑推理能力。
解题的关键是牢固掌握基础知识,从自己已有的知识中寻找突破口,然后顺藤摸瓜,从而完成全部未知的推断,题目形式以选择题和填空题为主。
题眼1 物质的特征颜色黑色固体——炭粉、Fe3O4、MnO2、铁粉、CuO红色固体——KMnO4(紫红色)、Fe2O3(红棕色)、红磷蓝色溶液——含Cu2+的溶液浅绿色溶液——含Fe2+的溶液黄色溶液——含Fe3+的溶液蓝色沉淀——Cu(OH)2红褐色沉淀——Fe(OH)3白色沉淀(碱)——Mg(OH)2、Al(OH)3白色沉淀(难溶于酸的盐)——BaSO4、AgCl白色沉淀(溶于酸放出气体的盐)——CaCO3、BaCO3题眼2 元素或物质之最1.元素之最地壳中含量最多的元素:O地壳中含量最多的金属元素:Al相对原子质量最小的元素:H人体中含量最多的元素:O人体中含量最多的金属元素:Ca组成化合物种类最多的元素:C2.物质之最生物体内含量最多的物质:H2O最常用的溶剂:H2O相对分子质量最小的氧化物:H2O最理想的清洁燃料:H2相对分子质量最小的单质、最轻(或密度最小)的气体:H2天然存在最硬的物质:金刚石人类最早使用的金属:Cu目前世界上年产量最高的金属、使用最广泛的金属:Fe最简单的有机物:CH4题眼3 物质的用途常用于灭火、人工降雨(固态)的气体:CO2加剧温室效应、参与植物光合作用的气体:CO2能供给呼吸、支持燃烧的气体:O2常用于冶炼金属的还原性气体:CO、H2常用于冶炼金属的还原性固体:炭胃液中能帮助人体消化的物质:盐酸常用作建筑材料的碱:Ca(OH)2常用作建筑材料的盐:CaCO3常用于金属除锈:稀硫酸、稀盐酸常用作干燥剂:CaO(作食品干燥剂)、浓硫酸(干燥酸性和中性气体)、氢氧化钠固体发酵粉的主要成分、用于焙制糕点:NaHCO3治疗胃酸过多的药物中含有的碱:Mg(OH)2、Al(OH)3治疗胃酸过多的药物中含有的盐:NaHCO3常用于改良酸性土壤:Ca(OH)2炉具清洁剂的有效成分:NaOH常用作复合肥的盐:KNO3常用于配置农药波尔多液的盐:CuSO4常用于配置农药波尔多液的碱:Ca(OH)2实验室常用的燃料:C2H5OH(乙醇、酒精)常用的调味品、配制生理盐水的物质:NaCl题眼4 组成元素相同的物质气态氧化物:CO和CO2液态氧化物:H2O和H2O2固态氧化物:Fe2O3和Fe3O4盐:FeCl2和FeCl3、FeSO4和Fe2(SO4)3碱:Fe(OH)2和Fe(OH)3题眼5 物质的相对分子质量及金属元素的质量分数相对分子质量为18的氧化物:H2O相对分子质量为40且金属元素的质量分数为60%的氧化物:MgO相对分子质量为56的氧化物:CaO相对分子质量为80且金属元素的质量分数为80%的氧化物:CuO相对分子质量为160且金属元素的质量分数为70%的氧化物:Fe2O3相对分子质量为84的盐:NaHCO3相对分子质量为100且金属元素的质量分数为40%的盐:CaCO3相对分子质量为160且金属元素的质量分数为40%的盐:CuSO4相对分子质量为16且的有机物:CH4题眼6 物质间的转化关系1.相互转化的物质(1)单质与氧化物O2与H2O(或CO2)H2与H2O Cu与CuO Fe与Fe3O4(2)化合物与化合物CO与CO2 CO2与H2CO3(或CaCO3或Na2CO3)CaCl2与CaCO3 NaOH与Na2CO32.物质间的三角转化(CO)CCO2碳三角O2H2O2(H2O)氧三角H2HCl(H2O)氢三角1.(2023·山东潍坊·模拟预测)在给定条件下,下列物质间的每一步转化,均能通过一步反应实现的是( )A .223 Fe Fe O O Fe Fe 点燃点燃B .223CO NaOH HCl NaCl Na COC .2444H SO Fe CuO FeSO CuSOD .233223Na CO SO Ca(OH)NaOH Na SO【答案】C【详解】A 、铁在氧气中燃烧生成的是四氧化三铁,而不是氧化铁,故铁和氧气点燃要生成氧化铁,无法一步实现,不符合题意;B 、二氧化碳和氯化钠不能反应,故二氧化碳和氯化钠无法生成碳酸钠,不符合题意;C 、氧化铜加入稀盐酸能生成硫酸铜,再加入铁,能发生置换反应生成硫酸亚铁,均能一步实现,符合题意;D 、氢氧化钠溶液通入三氧化硫,生成的是硫酸钠而不是亚硫酸钠,故氢氧化钠和三氧化硫无法一步生成亚硫酸钠,不符合题意。

“无机框图推断题”题眼集锦方法一:根据物质的特殊颜色推断2O3红棕色;Fe(OH)3红褐色;[Fe(SCN)]2+红色(或血红色);Cu2O红色(或砖红色);被氧化的苯酚(即苯醌)粉红色;石蕊在pH<5的溶液中呈红色;酚酞在pH8~10的溶液中呈浅红色;NO2红棕色;红磷暗红色;Br2深棕红色;品红溶液红色;充氦气、氖气的灯管红色; Cu紫红色;甲基橙在pH<3.1的溶液中显红色。
4-紫红色;[Fe(C6H5O)6]3—紫色;I2紫黑色;I2蒸汽紫色;I2的CCl4或苯或汽油等溶液紫红色(碘酒褐色);石蕊在pH5--8的溶液中呈紫色。
pH3.1~4.4的溶液中呈橙色。
2变成Fe(OH)3的中间产物灰绿色。
2晶体棕黄色;FeCl3溶液溶液棕黄色。
、AgI、Fe3+、Na2O2、AgBr、F2;甲基橙在pH>4.4的溶液中呈黄色。
2+、Cu(OH)2、CuSO4·5H2O;石蕊在pH>8的溶液中呈蓝色;I2遇淀粉变蓝色;液态、固态的氧气淡MnO2、CuO、CuS、Cu2S、PbS、Ag2S、FeS、FeO、Fe3O4黑色;Si灰黑色。
2+浅绿色;Cl2淡黄绿色;CuCl2浓溶液绿色(很浓黄绿色、稀则蓝色);碱式碳酸铜绿色。
2O褐色。
二.有色物质状态分类有色单质:呈液态的非金属单质:Br2 (深棕红色液体)、I2(紫黑色固体)、S(淡黄色固体)、Cu(红色固体)、Au(金黄色固体)、P(白磷是白色固体,红磷是赤红色固体)、Si(灰黑色晶体)、C(黑色粉未)呈液态的金属单质:Hg (银白色液体)黄色固体:S、Na2O2、AgBr、AgI、FeS2黑色固体:FeO、Fe3O4、MnO2、C、CuS、PbS、CuO红色固体:Fe(OH)3、Fe2O3、Cu2O、Cu蓝色固体:五水硫酸铜(胆矾或蓝矾);绿色固体:七水硫酸亚铁(绿矾);紫黑色固体:KMnO4、碘单质。
白色:Fe(0H)2、CaCO3、BaSO4、AgCl、BaSO3铵盐,白色或黄色腊状固体:白磷有色离子(溶液)Cu2+、Fe2+、Fe3+、MnO4-不溶于稀酸的白色沉淀:AgCl、BaSO4不溶于稀酸的黄色沉淀:S、AgBr、AgI有色溶液: Cu2+蓝、 MnO4-紫红、Fe2+浅绿、Fe3+ 棕黄、Fe(SCN)3血红、NO2-浅黄。

中考专项复习——物质推断题题眼一物质的特征颜色固体的颜色(1)黑色固体:C粉、Fe粉、CuO、MnO2、Fe3O4(2)红色固体:Cu、Fe2O3(3)暗紫色:KMnO4、I2(碘)(4)绿色:Cu2(OH)2CO3(5)蓝色:CuSO4·5H2O溶液的颜色(1)浅绿色溶液:含Fe2+的溶液,如FeCl2溶液、FeSO4溶液(2)蓝色溶液:含Cu2+的溶液,如CuCl2溶液、CuSO4溶液(3)黄色溶液:含Fe3+的溶液,如FeCl3溶液、Fe2(SO4)3溶液沉淀的颜色(1)蓝色沉淀:Cu(OH)2(2)红褐色沉淀:Fe(OH)3(3)白色沉淀:BaSO4、BaCO3、CaCO3、AgCl、Ag2CO3、Mg(OH)2、Al(OH)3注:①不溶于稀硝酸的白色沉淀:AgCl、BaSO4②溶于酸并有气体放出的白色沉淀:BaCO3、CaCO3、Ag2CO3③溶于酸但没有气体放出的白色沉淀:Mg(OH)2、Al(OH)3题眼二物质的用途生活类(1)能供给呼吸的物质:________。
(2)气体常用于灭火,固体可用于人工降雨的物质:__________。
(3)厨房中常用的调味品,还可用于腌制食品、配制生理盐水和融雪剂的物质:____________。
(4)常用作燃料的气体:______________________。
(5)生命之源、常温为无色无味的液体、最常用的溶剂:__________。
(6)可作干燥剂的物质:__________、__________、__________。
(7)发酵粉的主要成分:________________。
(8)常用作食品保护气的气体:________。
健康类(1)能与血红蛋白结合的有毒气体:________。
(2)人体胃酸的主要成分:__________。
(3)可用作补钙剂的物质:______________。
(4)能治疗胃酸过多的物质:________________、__________________、__________________。

2021高考化学无机推断题集锦“无机框图推断题〞题眼知识准备:物质颜色L有色固体:白色:Fe〔0H〕2、CaCOS. BaSO4, AgCk BaSO3、筱盐,白色或黄色腊状固体:白磷淡黄色或黄色:S黄或浅黄、FeS2黄、Agl黄、Au黄、Na2O2浅黄、AgBr浅黄、Ag3Po4 浅黄等.红色或红棕色:Cu紫红、Cu20红、Fe2O3红棕色、Fe〔0H〕3红褐色.黑色:C、CuS、Cu2S、FeS、Mn02、FeO. Fe3O4 〔磁性物质〕、CuO. PbS、Ag20 棕黑紫黑色:12紫黑、KhfnO4紫黑.2有色溶液:Cu2+蓝、Mn04紫红、Fe2+浅绿、Fe3+棕黄、Fe 〔SCN〕 3血红、N02浅黄.——氯水浅黄绿色、滨水橙黄色、碘水棕黄色、溟的有机溶液橙红一红棕、12的有机溶液紫红3气体小结1、有颜色的包体:F2 〔淡黄绿色〕,C12 〔黄绿色〕,N02 〔棕色〕,澳蒸气〔红棕色〕、12 〔紫色〕、03 〔淡蓝色〕.其余均为无色气体.2、有刺激性的气体:HF, HCL HBr, HL NH3, S02, N02, F2, C12,溟蒸气.有臭鸡蛋气味的气体:H2S3、易溶于•水的气体:HF, HCL HBr, HI, NH3, S02和N02«能溶于水的‘〔体:C02,C12, H2S和溪蒸气.4、易液化的气体:NH3, SO 2, C125、有毒的气体:F2, HF, C12, H2S, S02, CO, NO, N02 和汰蒸气.6、在空弋中易形成白雾的气体:HF, HCL HBr, HI7、常温下由于发生化学反响而不能共存的气体:H2s和S02, H2s和C12, HI和C12, NH3 和HCL NO 和02, F2 和H28、其水溶液呈酸性且能使紫色石浅试液变红色的气体:HF. HC1, HBr, HI, H2S, S02, C02, N02和漠蒸气.可使紫色石蕊试液先变红后褪色的包体:C12.可使紫色石蕊试纸变蓝且水溶液呈弱碱性的气体:NH39、有漂白作用的气体:C12 〔有水时〕和S02.10、能使澄清石灰水变浑浊的气体:C02, S02, HFo11、能使无水CuS04变蓝的气体:水蒸气.12、在空气中可燃的气体:H2, CH4, C2H2, C2H4, CO, H2S.在空气中点燃后火焰呈淡蓝色的气体:H2S, CH4, CO, H2o13、具有氧化性的气体:F2, C12,浪蒸气,NO2, 02.具有复原性的气体:H2S, H2, CO, NH3, HI, HBr, HC1, NO.S02和N2通常既可显示氧化性又可技示复原性.14、与水可发生反响的气体:C12, F2, N02,澳蒸气,C02, SO2, NH3.其中C12, F2, N02,滨蒸气和水的反响属于氧化复原反响.15、在空气中易被氧化变色的气体:NO.16、能使湿润的KI淀粉试纸变蓝的气体:C12, N02,澳蒸气.17、遇AgN03溶液可产生沉淀的气体:H2S, C12,溟蒸气,HCL HBr, HI, NH3.其中NH3通入AgN03溶液产生的沉淀当NH3过量时会溶解.18、能使滨水和酸性KMnO4溶液褪色的气体:H2S, SO2, C2H2, C2H4.19、由于化学性质稳定,通常可作为保护气的气体:N2和Ar.20、制得的气体通常为混合气的是:NO2和N2O4,4物质的状态、气味硬度等:呈液态的金属单质:Hg 呈液态的非金属单质:Br2 呈液态的化合物:H2O常温呈气态的单质:H2> 02、C12、N2、F2、稀有气体等.地壳中元素的含量:0、Si、Al、Fe、硬度最大的单质:C (金刚石)形成化合物种类最多的元素:C方法二、根据特征反响现象推断知识准备:特征反响现象1焰色反响:Na+ (黄色)、K+ (紫色)2能使品红溶液褪色的化体可能是:加热恢发原颜色的是SO2,不恢兔的是C12、NaClO. Ca(C10)2等次氯酸盐、氯水、过氧化钠、过氧化氢、活性碳等3白色沉淀[Fe(OH)2]空气红褐色[Fe(0H)3](由白色—灰绿一>红褐色)4能在空气中自燃:P45在空气中变为红棕色:NO6能使石灰水变浑浊:C02、S027通C02变浑浊:石灰水(过最变清)、Na2SiO3、饱和Na2co3、浓苯酚钠、NaA1028体燃烧呈苍白色:H2在C12中燃烧:在空气中点燃呈蓝色:CO、H2、CH49遇酚猷显红色或湿润红色石蕊试纸变蓝的气体:NH3 (碱性气体)10使湿润的淀粉碘化钾试纸变蓝:C12, Br2> FeC13,碘水等.11加狗盼显紫色或加SCN-、显血红色或加碱产生红褐色沉淀,必有Fe3+12遇BaC12生成不溶于硝酸的白色沉淀,可能是:SO42、Ag+、SO32 ——13遇HC1 生成沉淀,可能是:Ag+、S1O32、A1O2. S2O32------------14遇H2so4 生成沉淀,可能是:Ba2+、Ca2+、S2O32. S1O32、A1O2 ------------15.与H2s反响生成淡黄色沉淀的气体有C12、02、S02、N0216电解时阳极产生的气体一般是:C12、02,阴极产生的气体是:H217两种气体通入水中有沉淀的是2H2S+SO2=3S+2H2O ;同一元素的气态氯化物和最高价氧化物对应的水化物生成盐的元素一定是氮(NH4NO3)18.两种溶液混介生成沉淀和气体,这两种溶液的溶质可能是①Ba(0H)2 hi(NH4)2SO4 或(NH4)2CO3 或(NH4)2SQ3②强烈双水解③可溶性铁盐与可溶性碳酸盐或碳酸氢盐④Na2s203 溶液与强酸H20 CO32 HCO3 CO2 Al OH 3 H2OAI3 与S2 HS H2S Al OH 3H2O Al OH 3 A10219.能使滨水褪色的物质:H2s和S02及它们相对应的盐、活泼金属、不饱和烧、醛、酚、碱20.两物质反响先沉淀后溶解的有:C02与Ca9H)2或Ba(0H)2、NaOH与铝盐、氨水与AgN03、强酸与偏铝酸盐知识准备:依据特征结构1.正四面体型分子:CH4、31H4、CC14、31cl4、P4 等.2.直线型分子:乙快、二氧化碳、二硫化碳等.3 .平面型分子:苯、乙烯等.4 .含有非极性共价键的离子化合物:过氧化钠(Na2O2)、二硫化亚铁(FeS2). C 心等.5 .含有 10 个电子的粒子:离子:02、F 、Ne 、Na+、Mg2+> A13+、NH4+、H3O+、OH 、 NHZ 分子: --------- CH4、NH3、H2O 、HF6 .电子总数为 18 的粒子:分子:Ar 、F2、S1H4、PH3、H2S 、HCk H2O2、C2H6、CH3OH. CH3NH2. CH3F 、NHZ OH 、NHZ —NH2 等:离子:K+、Ca2+> HS —、S2—、Cl —、 022—7 . 9 个电子的粒子:一OH 、—CHS. —NH2、F 方法三、根据特殊反响条件推断知识准备:熟悉具仃特殊反响条件的反响,多数是重要工业生产反响 1、高温条件C+H20co2+2H2, 3Fe+4H2OFe3O4+4H2, CaCO3CaO+CO2,高温 高温 SiO24-CaCO3CaSiO34-CO2, SQ2 + 2CS1 +2coT ,SiOCaSiO3, 2+ CaO 高温 高温 4FeS2+llO22FeNa2SiO3 + CO2 2O3 + 8SO2, SiO2+Na2CO3 2、高温高压催化剂:N2+3H23、催化剂、加热: 催化剂 高温高压H2+C0, C + 2H2O2NH3催化剂 4NH3 + 5O24NO + 6H2O 2SO2 + O2A MnO 2H202 2H2O + O2T △ 催化剂 加热 2s032KC103Mn0△ 2KC1 +302T4、放电:N24-O22NO302203方法四、根据特征转化关系推断知识准备:1、一般思路是找出特别的变化关系,用可能的几种情况试探,得出介理答案2、掌握一些特别的连续变化关系33、注意几个典型转化关系 三角转化:4、置换反响:或H2O1.金属盐金属盐活泼金屈(Na 、Mg 、Fe) H M2 (1)金属一>金属 (2)金属一>非金属 点燃2铝热反响 2MgO C 2Mg CO22F2 2H2O 4HF 02 高温 Si 2CO 〔3〕非金属一非金属 2c SiO2高温 CO H2 c H2OCl 〔Br 、I 〕 HS S 2HC1 〔HBi\ HI 〕 2 222H2金属氧化物高温 金属H2O 〔4〕非金属一>金属 高温 金属〔1〕 O2O22OA B C OOHO222 〔气体〕 NO 222②H2s 〔气体〕 SO2222 CO CO2 222 Na2O Na2O2〔2〕A 与强酸或强碱的反响H D 〔酸或粉NO2 HNO3 ①NH3 S03 H2SO4 OOHOH2CO3 ③C 〔固体〕00H0 NaOH @Na 〔固体〕00H0A 为弱酸的钱盐:(NH4)2CO3或NH4HCO3; 〔KH4〕2S 或 NH4HS ; 〔NH4〕2SO3, NH4HS0C02 C金属氧化物5、与碱反响产生气体Ak Si OH H2 碱⑪单质2Al 2NaOH 2HO 2NaAlO 3H ⑫核盐:NH4 NH3 H2O 222 Si 2NaOH H20 Na2SiO3 2H26、与酸反响产生气体HC1 H2 浓H2SO4SO2 金属HNO3NO2、NO ⑪®浓HS04NO2 单质SO2 、CO2 2 C 浓HNO3CO2非金属浓HS04SO2 2 S 浓HN03SO2 、NO2H CO32 HCO3 CO2H化合物S2 HS H2S2 H SOHSO SO23 37、既能酸反响,又能与碱反响Al、A12O3、Al〔0H〕3.弱酸的酸式盐〔NaHC03、NaHSOS. NaHS 等〕、弱酸的氨盐[NH4HCO3、〔NH4〕2CO3. NH4HSO3、〔NH4〕2SO3. 〔NH4〕2S. NH4Hs 等]、氨基酸等;8、与水反响产生气体2Na2O2 2H2O 4NaOH 022Na 2H2O 2NaOH H2 Mg3N2 3H2O 3Mg OH 2 2NH3 〔 1 〕单质〔 2 〕化合物2F2 2H2O 4HF 02 AI2S3 6H2O 2AI OH 3 3H2S CaC 2HOCa OH CH222229、气体反响特征〔1〕苍白色:H2在C12中燃烧:〔2〕蓝色:CO在空气中燃烧:〔3〕淡蓝色:H2S.CH4、CH3CH2OH. 3等在空气中燃烧:〔4〕明亮的蓝紫色:3在纯氧中燃烧;〔5〕金属的焰色反响烟、雾〔1〕在空气中形成白雾的:HCk HBr 、HI 、NH3等气体及浓盐酸、浓硝酸;〔2〕相遇形成白烟或固体的:NH3+HCR NH3+HBr 、NH3+HNO3, H2S+SO2. H2S+C12: 〔3〕燃烧时出现白色烟雾的:〔P+C12〕; 〔4〕燃烧时出现棕黄色烟的:〔CuC12〕.10、受热分解产生2种或3种气体的反响: NH4HCO3[(NH4)2CO3] NH3 CO2 2Cu(NO3)2 2CuO 4NO2 02 酸盐 NH SO HO 43423322NH3 H2S NH4HS[(NH4)2S](3)硝酸:4HNO3=2H2O+4NO2f+O2T(4)碱式碳酸铜:Cu2(0H)2co3=2CuO + CO2T +H20 (5)碳酸氢盐:ZNaHCO △ 2CO3+H2O4-CO2; Ca(HCO3)2rajmlCaO+H2O4-2CO2方法五、根据特殊工业生产推断知识准备:重要工业生产反响1、煨烧石灰石2、煨烧黄铁矿3、二氧化硫的催化氧化4、氨的催化氧化5、合成氨6、电 解饱和食盐水7、工业制盐酸8、高炉炼铁9、工业制取漂粉精10、工业制水煤气11、硅酸 盐工业方法六、根据特征数据推断知识准备:近两年计算型推断题成为高考热点之一,解这类题时要善「抓住物质转化时相 为分子质量的变化〔例C0—C02, NO T N02, SO2—SO3转化时分子中都增加1个氧原 子,相对分子质量变化均为16 〕:放出气体的体积或生成沉淀的量:化合物中各元素的含 量:气体的相对密度:相对分子质量;离子化合物中离子个数比:反响物之间的物质的量比: 电子总数;质子总数等重要数据. 能够做喷泉实验的气体1、NH3、HCL HBr 、HI 等极易溶于水的气体均可做喷泉实验.2、C02、C12、S02与氢氧化钠溶液;3、C2H2、C2H2与澳水反响“10电子〞、“18电子〞的微粒小结 1.2. 4,18H2O(1)钱盐 NHHSO[(NH)SO] (2)硝 2Ag 2NO2 02 2AgNO3几个很有必要熟记的相等式量能使酸性高钵酸钾溶液褪色的物质〔-〕无机1 . 一2价破的化合物〔H2S 、氢硫酸、硫化物〕;2 . +4价硫的化合物〔SO2、H2s03及亚硫酸盐〕:3 .双氧水〔H2O2,其中氧为一1价〕 元素的一些特殊性质4 .周期表中特殊位置的元素①族序数等于周期数的元素:H 、Be 、Al 、Ge ②族序数等于周期数2倍的元素:C 、So ③族序数等于周期数3倍的元素:0. ④周期数是族序数2倍的元素:Li 、Ca o ⑤周期数是族序数3倍的元索:Na 、B⑥最高正价与最低负价代数和为零的短周期元素:Co ⑦最高正价是最低负价绝对值3倍的短周期元素:So ⑧除H 外,原子半径最小的元素:F . ⑨短周期中离子半径最大的元 素:Po5 .常见元素及其化合物的特性①形成化合物种类最多的元索、单质是自然界中硬度最大的物质的元素或气态氢化物中氢 的质量分数最大的元素:Co②空气中含量最多的元素或气态氢化物的水溶液呈碱性的元素:N a③地壳中含量最多的元素、气态氢化物沸点最高的元素或氢化物在通常情况下呈液态的元 素:Oo④最轻的单质的元素:H :最轻的金属单质的元素:Li .⑤单质在常温卜.呈液态的非金属元素:Br :金属元素:Hg o⑥最高价氧化物及其对应水化物既能与强酸反响,又能与强碱反响的元索:Be 、Ak Zno ⑦元素的气态氨化物和它的最高价氧化物对应水化物能起化合反响的元素:N:能起氧化还 原反响的元素:So⑧元索的气态氢化物能和它的氧化物在常温卜;…生.成核兀素单质的兀素•: SoNe 3 Fe CuOAr20 KHCO3 56 CaO 80 SO3 40 Ca HF 3N2 KOH NaOHBr. NH4NO3 MgO N2 H2SO4 C3H8 28 C2H4 98 44 CH3CH2CH2OH CO H3PO4 N2O 1.常用相对分子质量 Na2O2: 78Na2c03: 106 BaS04: 233 Al (OH)3: 78 CuSO4 CH3COOH CO2 64 160 Fe2O3 Br2 HCOOCH3 NaHCOS : 84 C6H12O6:Na2so4: 14260⑨元素的单质在常温下能与水反响放出气体的短周期元素:Li、Na、Fo ⑩常见的能形成同素异形体的元素:C、P、0、So。
推断题“题眼”集锦
一、物质的颜色
黑色固体CuO C Fe3O4Fe
红色固体Cu Fe2O3
蓝色溶液Cu2+
浅绿色溶液Fe2+
黄色溶液Fe3+
二、特殊反应条件
1、通电水通电分解
2、高温碳酸钙高温分解一氧化碳高温还原铁矿石
3、催化剂过氧化氢分解氯酸钾分解
4、能与水发生反应生石灰变成熟石灰
三、物质的用途
改良酸性土壤Ca(OH)2
1、
2、调味品NaCl
3、建筑材料CaCO3 Ca(OH)2
4、胃液中含有的酸HCl
5、铅酸蓄电池填充液H2SO4
6、最清洁的燃料H2
7、食品干燥剂CaO
8、金属除锈HCl
9、冶炼金属CO H2
四、物质的特殊性
1、有毒气体CO SO2
2、遇水变蓝无水CuSO4
3、有刺激性气味NH3SO2 HCl
4、能使湿润的红色石蕊试纸变蓝的气体NH3
5、溶于水放热的物质浓H2SO4NaOH CaO
6、溶于水吸热的物质NH4NO3
7、组成元素相同的物质气体CO2 CO
液体H2O2H2O
固体Fe2O3Fe3O4
8、还原性H2CO C
五、物质之最
1、最理想的燃料相对分子质量最小密度最小的气体H2
2、天然存在的最硬的物质金刚石C
3、最常见的溶剂,相对分子质量最小的氧化物,人体中含量最多的物质H2O
4、日常生活中使用范围最广,年产量最大的金属Fe
5、最简单的有机物CH4。