24 溶胶的稳定性
- 格式:pdf
- 大小:1.77 MB
- 文档页数:63

8.4 胶体的稳定性和聚沉作用8.4.1 溶胶的稳定根据胶体的各种性质。
溶胶稳定的原因可归纳为:(1) 溶胶的动力稳定性胶粒因颗粒很小,布朗运动较强,能克服重力影响不下沉而保持均匀分散。
这种性质称为溶胶的动力稳定性。
影响溶胶动力稳定性的主要因素是分散度。
分散度越大,颗粒越小,布朗运动越剧烈,扩散能力越强,动力稳定性就越大,胶粒越不溶易下沉。
此外分散介质的粘度越大,胶粒与分散介质的密度差越小,溶胶的动力稳定性也越大,胶粒也越不溶易下沉。
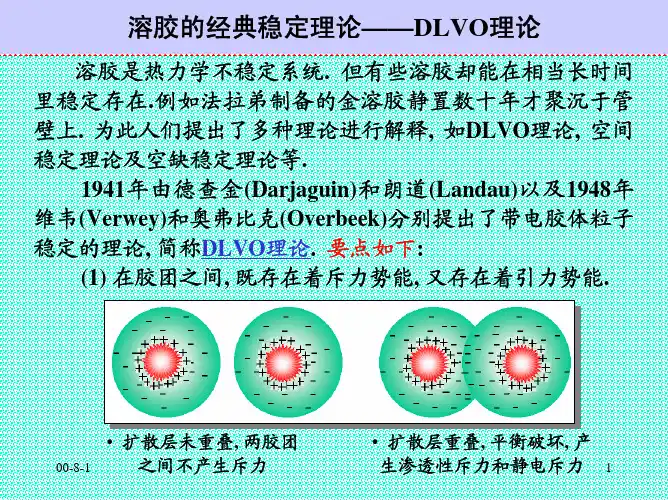
(2) 胶粒带电的稳定作用下图表示的是一个个胶团。
蓝色虚线圆是扩散层的边界,虚线圆以外没有净电荷,呈电中性。
因此,当两个胶团不重迭时,如左图,它们之间没有静电作用力,只有胶粒间的引力,这种引力与它们之间距离的三次方成反比,这和分子之间的作用力(分子之间的作用力与分子之间距离的六次方成反比)相比,是一种远程力,这种远程力驱使胶团互相靠近。
当两个胶团重迭时,如右图,它们之间就产生静电排斥力。
重叠越多,静电排斥力越大。
如果静电排斥力大于胶粒之间的吸引力,两胶粒相撞后又分开,保持了溶胶的稳定。
胶粒必须带有一定的电荷才具有足够的静电排斥力,而胶粒的带电量与ζ电势的绝对值成正比。
因此,胶粒具有一定的ζ电势是胶粒稳定的主要原因。
(3) 溶剂化的稳定作用物质和溶剂之间所起的化合作用称为溶剂化,溶剂若为水,则称水化。
憎液溶胶的胶核是憎水的,但它吸附的离子都是水化的,因此增加了胶粒的稳定性。
由于紧密层和分散层中的离子都是水化的,这样在胶粒周围形成了水化层。
实验证明,水化层具有定向排列+ + ++ ++ + + - - -- - -- - 胶核 + + + + + + + + - - - - - - - - 胶核结构,当胶粒接近时,水化层被挤压变形,它有力图恢复定向排列结构的能力,使水化层具有弹性,这成了胶粒接近时的机械阻力,防止了溶胶的聚沉。
以上影响溶胶稳定的三种因素中,尤以带电因素最重要。

简述溶胶的动力学稳定性的定义溶胶的动力学稳定性( dynamic stability of colloid):是指在外加因素(如搅拌速度、离心力等)的作用下,不稳定溶胶经过一段时间后会自发地转化为稳定溶胶的特性。
溶胶分散于溶液中形成的一种胶体系统。
它具有溶液的性质,但又不完全具备溶液的性质。
可用蒸发的方法从溶液中得到的称为浓溶液;可用结晶的方法从溶液中得到的称为稀溶液。
实际上应用最广泛的还是均一稳定的稀溶液,如食盐水、蔗糖水等,在这些溶液中分散相颗粒较小,分散质浓度较高,故常称为“胶体”。
胶体的特点是具有独立的稳定系统。
其中分散相只占少数,而且多为小颗粒或小滴。
大多数分散相是大的、分散的、聚集体形式的颗粒或小滴。
例如,聚乙烯醇(分子量1000以上),分散相颗粒只有100~1000nm,相当于淀粉溶液中分散相粒子的大小。
溶胶对溶液的动力学稳定性有重要影响,并且影响程度取决于溶液的性质和胶体本身的性质,主要包括以下几个方面: 1、分散介质的性质与分散质的性质(1)当分散介质是有机溶剂时,溶胶对溶液的稳定性与其极性及溶解度有关,在水中有较好的稳定性;在非极性溶剂中分散相具有较好的稳定性。
(2)分散介质对分散质的吸附能力对分散相的稳定性也有影响,吸附能力越强,越易形成分散相,但形成的稳定系统越不稳定。
(3)当分散介质是无机胶体(如水、土壤等)时,它们对溶液的稳定性与它们的电性、粒子大小及形状有关,如土壤胶体、大分子胶体比水溶胶更稳定;溶胶对土壤胶体的稳定性比水溶胶高得多。
(4)由于溶液粘度与浓度成正比,所以分散介质对浓度也有影响,表现出良好的溶液稳定性。
(5)分散介质的温度和压力对溶液稳定性的影响,对于分散相是微小的分子和离子的溶液来说,随着温度的升高或压力的增加,分散相形成溶胶的能力增强,而且溶液粘度急剧增大,当压力增加到某一临界值时,则析出大量的分散相,形成非均相的溶液。
对于分散相是高聚物,分散相的大小与结构有关,即粒子的尺寸越小,形成的稳定系统越不稳定,聚合物越细,形成的稳定系统越不稳定,溶胶就越难形成。


胶体的稳定性和聚沉憎液溶胶属热力学不稳定体系,有集结长大以至于聚沉的趋势。
但在短时间内甚至在相当长时间内(对某些特殊的溶胶如金溶胶),憎液溶胶却能稳定存在。
1.溶胶的稳定性除布朗运动外,溶胶的稳定性还与下面两个因素有关。
(1).胶粒的电性:带电的胶粒由于胶粒间的范德华力而相互吸引,而相同电荷的斥力又将使之分开。
胶粒是否稳定,取决于这两种相反的力的相对大小。
这也是20世纪40年代由Derjaguin、Landan、Verwey、Overbeek等人提出的溶胶稳定性理论(通常称为DLVO理论)的主要点。
(2).溶剂化作用:溶剂化作用降低了胶粒的表面能,同时溶剂分子把胶粒包围起来,形成一具有弹性的水合外壳。
当胶粒相互靠近时,水合外壳因受到挤压而变形,但每个变形胶团都力图恢复其原来的形状而又被弹开。
可见,水合外壳(溶剂化层)的存在起着阻碍聚结的作用。
综上所述:分散相粒子的带电、溶剂化作用、布朗运动是憎液溶胶三个最重要的稳定因素。
凡是能使上述稳定因素遭到破坏的作用,皆可以使溶胶聚沉2.溶胶的聚沉溶胶中的分散相微粒互相聚沉,颗粒变大,最后发生沉淀的现象称为聚沉。
溶胶的聚沉可分为二个阶段,第一为无法用肉眼观察出分散程度变化的阶段,称为"隐聚沉";第二阶段则可用肉眼观察到颗粒的变化,称为"显聚沉"。
(1).电解质的聚沉作用当往溶胶中加入过量的电解质后,往往会使溶胶发生聚沉。
这是由于电解质加入后,电解质中与扩散层反离子电荷符号相同的那些离子将由于同电排斥而将反离子压入到吸附层,从而减少胶粒的带电量,ζ电势降低。
当扩散层中的反离子被全部压入吸附层内,胶粒处于等电状态,ζ电势为零,此时溶胶的稳定性最差,非常易于聚沉。
如豆浆使荷负电的蛋白质胶体,卤水中的Ca2+、Mg2+、Na+等离子压缩扩散层厚度,使ζ电势下降并使蛋白质聚沉。
实验表明,当溶胶的ζ电势降低到一定值时,(不必降到零!),就可观察到聚沉现象的发生。


溶胶的制备、纯化、稳定性研究及溶胶聚沉值的测定—电压对溶胶稳定性的影响和KCl聚沉值的测定一、前言(一)实验背景电泳法测定氢氧化铁溶胶ξ-电势是大多数高校化学专业开设的基础物理化学实验之一,胶体是日常生活中比较常见的混合物体系,本文从水解法制备Fe(OH)3溶胶、Fe(OH)3溶胶的纯化、电泳实验、测定不同电解质对Fe(OH)3溶胶的聚沉值等四个方面对Fe(OH)3溶胶的性质进行深入的探究,通过本实验我们可以探究利用溶胶的性质来处理水污染等实际问题。
(二)实验要求1、了解制备胶体的不同方法,学会制备Fe(OH)3溶胶。
2、实验观察胶体的电泳现象,掌握电泳法测定胶体电动电势的技术。
3、探讨不同外加电压、电泳时间、溶胶浓度、辅助液的pH值等因素对Fe(OH)3溶胶电动电势测定的影响。
4、探讨不同电解质对所制备Fe(OH)3溶胶的聚沉值,掌握通过聚沉值判断溶胶荷电性质的方法。
二、实验部分(一)实验原理胶体现象无论在工农业生产中还是在日常生活中,都是常见的问题。
为了了解胶体现象,进而掌握其变化规律,进行胶体的制备及性质研究实验很有必要。
1、溶胶的制备溶胶的制备方法可分为分散法和凝聚法。
分散法是用适当方法把较大的物质颗粒变为胶体大小的质点,如机械法,电弧法,超声波法,胶溶法等;凝聚法是先制成难溶物的分子(或离子)的过饱和溶液,再使之相互结合成胶体粒子而得到溶胶,如物质蒸汽凝结法、变换分散介质法、化学反应法等。
Fe(OH)3溶胶的制备就是采用化学反应法使生成物呈过饱和状态,然后粒子再结合成溶胶。
2、溶胶的纯化制成的Fe(OH)3溶胶溶液中常有其它杂质存在,而影响其稳定性,而且制得的Fe(OH)3水溶胶冷却时,反应要逆向进行,因此必须纯化。
常用的纯化方法是半透膜渗析法。
渗析时以半透膜隔开胶体溶液和纯溶剂,胶体溶液中的杂质,如电解质及小分子能透过半透膜,进入溶剂中,而大部分胶粒却不透过. 如果不断换溶剂,则可把胶体中的杂质除去. 要提高渗析速度,可用热渗析或电渗析的方法。

二氧化硅溶胶稳定性的研究一、本文概述二氧化硅溶胶,作为一种重要的无机非金属材料,因其独特的物理化学性质和广泛的应用领域,一直受到科研工作者和工业界的广泛关注。
其稳定性问题更是决定其应用性能的关键因素。
本文旨在全面研究和探讨二氧化硅溶胶的稳定性问题,通过对溶胶的稳定性机制、影响因素以及提升策略等方面进行深入分析,以期为提高二氧化硅溶胶的应用性能提供理论支撑和实践指导。
具体而言,本文将首先概述二氧化硅溶胶的基本性质和应用领域,明确研究的重要性和意义。
接着,从溶胶的稳定性机制出发,分析二氧化硅溶胶在不同环境条件下的稳定性表现。
在此基础上,通过实验研究,探讨各种影响因素,如pH值、温度、离子强度等,对二氧化硅溶胶稳定性的影响规律。
还将研究如何通过调整制备工艺、添加稳定剂等手段提高二氧化硅溶胶的稳定性。
本文将总结研究成果,提出可能的改进方案,并展望二氧化硅溶胶未来的研究方向和应用前景。
本文的研究不仅有助于深入理解二氧化硅溶胶的稳定性问题,而且可以为提高其在各个领域的应用性能提供有力支持,具有重要的理论价值和实践意义。
二、二氧化硅溶胶的稳定性因素二氧化硅溶胶的稳定性受到多种因素的影响,这些因素可以大致分为内在因素和外在因素两大类。
内在因素主要包括二氧化硅溶胶的粒径、比表面积、表面电荷和表面官能团等。
粒径的大小对溶胶的稳定性有重要影响。
一般来说,粒径越小,溶胶的稳定性越高,因为小粒径的粒子具有更大的比表面积,粒子间的相互作用力更强,更难以聚沉。
表面电荷也是影响溶胶稳定性的重要因素。
二氧化硅溶胶的表面通常带有一定的电荷,这些电荷可以通过静电斥力防止粒子间的聚沉,从而增强溶胶的稳定性。
表面官能团的存在也能对溶胶的稳定性产生影响。
例如,硅羟基(Si-OH)等官能团可以通过氢键等作用增强粒子间的相互作用,从而提高溶胶的稳定性。
外在因素则主要包括温度、pH值、电解质浓度和溶剂类型等。
温度是影响溶胶稳定性的重要因素。
随着温度的升高,溶胶的粒子运动速度加快,粒子间的碰撞几率增大,从而可能导致溶胶的聚沉。


简述溶胶的动力学稳定性的定义由于溶胶的微粒极小,溶剂分子可以自由穿过它们的界面,因此溶胶的稳定性是指微粒的热运动被限制到最小程度的特性。
如果微粒受到足够大的外力作用而脱离了溶剂分子的束缚,微粒将回复到它们原来的尺寸和形状。
为了保持溶胶的这种稳定性,必须使微粒彼此相互接触,并与溶剂保持一定的接触角。
一般把这种现象称为溶胶的动力学稳定性。
溶胶的动力学稳定性也叫范德华力。
那么在什么条件下,溶胶才会丧失动力学稳定性呢?1、流体粘度低。
在一般情况下,低粘度流体的溶胶都是不稳定的,因为流体粘度太低,溶胶分子的平均自由程很短,它们相互碰撞的机会很少。
所以低粘度流体的溶胶常是无规则结构的聚集体,例如水中的油滴就是典型的一个例子。
2、溶剂化能力高。
在一般情况下,当溶剂的挥发度很高,即自由能升高时,溶胶是比较稳定的。
例如,对于硫化橡胶来说,硫化过程实际上是溶剂分子不断地从橡胶大分子中夺取氢原子,直至全部夺走。
但是,当橡胶大分子分裂成两个或两个以上的亚分子时,分子间的作用力有所增强,它的溶胶分子就不容易再重新恢复原来的大分子结构,结果出现了稳定的结构,这时的溶胶称为化学稳定溶胶。
溶胶中的平均分子量的变化越大,这种现象越明显。
3、流体密度梯度大。
在一般情况下,随着流体的压强的降低,溶胶的粘度会迅速增大,溶胶的稳定性随之减小。
所以,溶胶分散体系的压强越小,粘度越大,越不稳定。
4、具有多相平衡。
例如,溶胶的稳定还与温度有关。
温度升高时,溶胶稳定性增加。
溶胶的结构与聚集态能够根据它的各种物理属性进行不同的分类。
在日常生活中我们遇见的各种晶体往往是由于热振动或其他形式的热激励作用的结果,在聚集态中的质点并没有发生真正的位移。
当热振动停止后,质点仍然保持在各自的平衡位置上。
这种相对静止的形式称为定态,如果质点在振动的过程中有明显的位移,就产生了热激励作用,这种相对运动的形式称为动态。
在某些条件下,单纯依靠热激励的方法还不足以形成聚集态结构,要使得聚集态发生稳定的结构,必须有一定的能量作用。

溶胶的稳定因素
1、外加电解质的影响。
这影响最大,主要影响胶粒的带电情况,使
电位下降,促使胶粒聚结。
2、浓度的影响。
浓度增加,粒子碰撞机会增多。
3、温度的影响。
温度升高,粒子碰撞机会增多,碰撞强度增加。
4、胶体体系的相互作用。
带不同电荷的胶粒互吸而聚沉。
溶胶是胶体颗粒的直径大小为1-100nm(也有人主张1-1000nm)。
并把
直径为1-100nm的分散相粒子均匀分布在分散介质里的分散质。
溶胶是多
相分散体系,在介质中不溶,有明显的相界面,为疏液胶体。
扩展资料:
液溶胶,液溶胶是指通过水解和聚合作用,形成的有机或无机的纳米
或微米级的粒子。
这些粒子通常带有电荷,并由于电荷作用,吸附一层溶
剂分子,形成由溶剂包覆的纳米或微米粒子,即胶体粒子,这些胶体粒子
由于带有电荷而相互排斥,从而能以悬浮状态存在于溶剂中,即形成溶胶。
胶体粒子由于失去电荷,或者包覆在外圈的溶剂层被破坏,胶体粒子
发生聚合,溶胶发生固化即形成凝胶。
分散相粒子大小在1—100nm范围,且分散相在分散介质中的溶解度
很小。
分散相和分散介质存在分界面,因此它是高度分散的多相体系,粘
度比真溶液大。
溶胶不稳定,胶粒具有自动凝结变大的趋势,放置较长一段时间后,
也会沉淀出来,但是短时间内具有一定稳定性;胶体沉淀后,如果再放入
分散介质也不会再自动形成溶胶,因此沉淀是不可逆的过程。
溶胶具有动力学稳定性的原因溶胶具有动力学稳定性是一个具有研究价值的课题,我们更多的
研究如何保持溶胶的动力学稳定性,以及在不同的应用场景中如何发
挥动力学稳定作用,并使其能有效地发挥作用。
溶胶是一种常见的混合饮料,而其动力学稳定性也是控制饮料质
量的重要因素之一。
溶胶动力学稳定性是指溶胶在某个特定条件下,
水溶液不受物理和化学外部因素的影响,不会发生析出或分离的情况。
溶胶的动力学稳定性的关键因素有两个,一是温度,另一个是外界因素。
溶胶中存在的因素,如流体粘度、离子强度、增加剂等,将在受
到外界因素的影响时产生热力变化,有可能趋近它们的自由能最低值,使溶液均匀地分布于溶胶中,从而保持动力学稳定性。
当外界条件发
生变化时,溶液将倾向于自由能最低值,促进溶胶的稳定,从而把溶
液自由能控制在一定范围内。
另外,温度是控制溶胶动力学稳定性的关键因素,特别是水溶解
溶胶。
如果温度超过溶胶解离的温度,则溶液中的溶质将开始析出,
表明溶胶失去了它的动力学稳定性,而当温度低于溶胶解离的温度时,溶质将继续处于溶液状态,溶胶保持高度的动力学稳定性。
此外,添加一定量的增强剂对溶胶的动力学稳定性也有显著作用。
添加的增强剂能够形成薄膜结构,在外界因素的影响下,形成保护膜,有效阻碍外部因素对溶质的析出和分离,从而保持溶胶的稳定。
溶胶可以用于各种应用场景,如医药、食品、皮革等,因此控制
溶胶的动力学稳定性是重要的任务。
比如,医药中的溶胶必须能够在
某一特定的温度范围内保持动力学稳定性,以为病人提供有效抗菌剂,而食品行业中,溶胶也必须经常检测调整,以确保溶胶的长期动力学
稳定性和食品安全性。
简述溶胶的聚结稳定性的定义聚结稳定性是指溶胶在受到一定的外力作用下发生凝聚形成大分子而不再继续下滴的能力。
定义:溶胶在受到一定的外力作用下发生凝聚形成大分子而不再继续下滴的能力。
应用:聚结稳定性,这种性质往往用来确定溶液或悬浊液中大分子在水中聚集的难易程度。
它表示溶液或悬浊液的胶体粒子聚集成为胶体微粒团的倾向性,亦即溶液或悬浊液凝聚成为大分子胶体粒子的倾向性。
这个倾向性愈大,则该溶液或悬浊液愈易于聚结成胶体粒子,即胶体粒子愈易于形成胶体粒子团。
聚结稳定性与胶体粒子的大小和形状无关。
溶液的聚结稳定性对生产、科学实验和医疗卫生等具有重要意义。
评价溶胶的聚结稳定性主要从以下几方面入手:首先,测量出悬浊液中大分子物质的浓度;其次,求出混合后悬浊液中的胶体粒子浓度;第三,称出悬浊液的总固体含量;最后,称出其中大分子物质的总量。
如果胶体粒子在悬浊液中的浓度相同,且粒子的直径又都大致相同,那么,不论哪一种溶液聚结成胶体粒子的倾向性都是相同的,这样就可以通过测定胶体粒子的总量来表示胶体粒子的聚结稳定性。
由于聚结稳定性是一种非常重要的性质,因此,在评价粘土矿物的品质时,必须考虑这一性质。
测定溶胶的聚结稳定性,目前有两种较为普遍的方法,即称重法和光散射法。
我们来看一个例子:定义:溶胶在受到一定的外力作用下发生凝聚形成大分子而不再继续下滴的能力。
应用:这种性质往往用来确定溶液或悬浊液中大分子在水中聚集的难易程度。
它表示溶液或悬浊液的胶体粒子聚集成为胶体微粒团的倾向性,亦即溶液或悬浊液凝聚成为大分子胶体粒子的倾向性。
这个倾向性愈大,则该溶液或悬浊液愈易于聚结成胶体粒子,即胶体粒子愈易于形成胶体粒子团。
聚结稳定性与胶体粒子的大小和形状无关。
溶液的聚结稳定性对生产、科学实验和医疗卫生等具有重要意义。
评价溶胶的聚结稳定性主要从以下几方面入手:首先,测量出悬浊液中大分子物质的浓度;其次,求出混合后悬浊液中的胶体粒子浓度;第三,称出悬浊液的总固体含量;最后,称出其中大分子物质的总量。
简述溶胶的聚结稳定性的定义聚结稳定性(aggregated stability of colloids,又称胶体的絮凝稳定性):溶胶粒子之间通过静电引力、范德华力等引力相结合的能力。
又称胶体的絮凝稳定性。
通常也将“溶胶的聚结稳定性”称为溶胶的絮凝稳定性。
我们知道,溶胶体系包括非均一溶液和胶体。
从其外部形态看,固体溶质微粒是聚集在一起的;而胶体微粒却是弥散在溶液中,并没有一定的形状。
因此,必须使溶胶稳定下来,才能保持溶胶的存在,这就需要了解如何聚结。
最初,人们把由这种现象得到的效应称为“聚结”,因为这种效应有某种类似物理学上所讲的凝聚作用,但更接近化学上所讲的絮凝。
现代生物化学家普遍接受这样一种观点:在正常条件下,胶体可以自发地转变为溶胶;但当环境条件改变时,则有可能导致溶胶的转变成为一种新的溶胶。
所以,在胶体系统中研究聚结问题就成为十分重要的课题。
聚结稳定性理论认为:对于多数溶胶,当其中两个或更多的粒子大小分布相近或粒子间有相互作用力时,只有少数大小较小的粒子能聚集成为大颗粒而沉降;相反,则大部分的大小较小的粒子都会絮凝成大颗粒。
为了确定两者之间的比例,要求得溶胶粒子在单位体积中能被捕获的颗粒数,以及胶粒分散介质中单位面积能提供给单位质量胶粒的表面积,即聚结因子n。
计算公式如下: n=ln2-ln1(1)式中:n为聚结因子; ln为颗粒半径的平方根; ln1为粒子之间引力和范德华力的平方根。
1、当两个溶胶中各种粒子的大小分布及粒子间的相互作用都相同时, n值为0,因此不会发生聚结现象。
2、若两个溶胶中粒子的大小分布不同,而粒子间又有相互作用时, n随着粒子大小分布的差异增加而减小。
3、当两个溶胶中粒子的大小分布不同时,其粒子间的相互作用又很弱时, n值很小甚至接近于0。
4、在胶粒粒子之间有强烈相互作用时, n值很小,甚至接近于1。
5、随着胶粒粒子之间的相互作用逐渐减弱, n也逐渐增大。
这是因为当强相互作用时,聚结的概率增加;反之,则不易聚结。
溶胶具有聚结稳定性的原因
溶胶具有聚结稳定性是指溶胶中的溶质分子能够形成稳定的结构,使溶胶的结构不易发生变化。
溶胶的聚结稳定性是由溶质分子之间的相互作用所决定的。
溶质分子之间的相互作用可以分为两类:一类是由溶质分子之间的弱相互作用所决定的,
如氢键、疏水性相互作用等;另一类是由溶质分子之间的强相互作用所决定的,如金属离
子之间的离子键、离子络合物等。
弱相互作用是指溶质分子之间的相互作用力较弱,但是它们能够形成稳定的结构,使溶胶
的结构不易发生变化。
例如,氢键是指溶质分子之间的氢原子能够与另一个溶质分子的氢
原子形成氢键,使溶胶的结构更加稳定。
强相互作用是指溶质分子之间的相互作用力较强,它们能够形成稳定的结构,使溶胶的结构更加稳定。
例如,金属离子之间的离子键是指金属离子之间的电荷相互作用,使溶胶的结构更加稳定。
此外,溶质分子之间的疏水性相互作用也能够使溶胶的结构更加稳定。
疏水性相互作用是
指溶质分子之间的水分子能够与另一个溶质分子的水分子形成疏水性相互作用,使溶胶的结构更加稳定。
总之,溶胶的聚结稳定性是由溶质分子之间的相互作用所决定的,这些相互作用包括氢键、离子键、离子络合物和疏水性相互作用等。
这些相互作用能够使溶胶的结构更加稳定,从
而使溶胶具有聚结稳定性。