胶体稳定性
- 格式:ppt
- 大小:666.50 KB
- 文档页数:19





食品中的胶体稳定性研究胶体稳定性是指液体中分散相颗粒的稳定状态,是食品行业研究的一个重要课题。
胶体稳定性影响着食品的质量和口感,因此对其进行深入研究具有重要意义。
胶体稳定性与胶体颗粒之间的相互作用密切相关。
在食品中,常见的胶体颗粒有胶状体、脂质体、乳液等。
这些胶体颗粒存在于各种食品中,例如酱料、乳制品、饮料等。
胶体颗粒的稳定性受到多种因素的影响,包括表面电荷、溶液中的离子浓度、温度等。
首先,胶体稳定性与胶体颗粒的表面电荷有关。
在水溶液中,胶体颗粒的表面带有电荷,这种表面电荷使胶体颗粒之间形成静电斥力,防止其聚集。
这种静电斥力是维持胶体颗粒分散状态的重要力量。
然而,当溶液中的离子浓度增加时,胶体颗粒的表面电荷可能被中和,导致静电斥力减弱,使得胶体颗粒易于聚集。
其次,胶体稳定性还受到离子浓度和pH值的影响。
溶液中存在的离子可以干扰胶体颗粒的电荷平衡,从而影响胶体的稳定性。
离子浓度较高时,离子与胶体颗粒表面电荷之间发生相互作用,导致胶体的稳定性降低。
此外,溶液的pH值也会影响胶体稳定性。
适当的pH值可以保持胶体颗粒表面电荷的平衡,从而维持胶体的稳定性。
温度是另一个影响胶体稳定性的重要因素。
随着温度的升高,分子的活动性增加,这可能导致胶体颗粒的聚集。
此外,一些食品中的成分在高温下可能发生变化,从而影响胶体稳定性,例如乳制品中的蛋白质在高温下会发生变性,导致乳液的稳定性降低。
针对食品中的胶体稳定性问题,研究人员提出了一些解决方案。
一种常用的方法是添加稳定剂或乳化剂。
稳定剂可以增加胶体颗粒表面的电荷密度,从而增强胶体分散的稳定性。
乳化剂则可以在液体中形成薄膜或界面活性剂层,减少胶体颗粒之间的相互作用。
这些添加剂的选择和使用方法需要进行深入研究,以确保其对食品质量和安全性的影响。
此外,利用纳米技术也是研究胶体稳定性的新方法。
纳米颗粒具有较大的比表面积和特殊的物理化学性质,可以在食品中起到纳米稳定剂的作用。
通过纳米技术可以制备具有独特结构和性质的纳米胶体颗粒,从而提高胶体的稳定性。



胶体的稳定性
答案:
胶体(Colloid)又称胶状分散体,是一种分散质粒子直径介于粗分散体系和溶液之间的一类分散体系[1]。
胶体不一定都是胶状物,也不一定是液体,常见的胶体有有色玻璃、果冻、鸡蛋清、血液等。
介稳性:
胶体的稳定性介于溶液和浊液之间,在一定条件下能稳定存在,属于介稳体系。
胶体具有介稳性的两个原因:
原因一:胶体粒子可以通过吸附而带有电荷,同种胶粒带同种电荷,而同种电荷会相互排斥(要使胶体聚沉,就要克服排斥力,消除胶粒所带电荷)。
原因二:胶体粒子在不停地做布朗运动,与重力作用相同时便形成沉降平衡的状态。
结构:
根据法扬斯规则(能与晶体的组成离子形成不溶物的离子将优先被吸附.优先吸附具有相同成分的离子),胶体粒子是胶粒,胶粒与扩散层在一起组成了胶团,而胶粒又包括胶核与吸附层。

胶体化学中的胶体颗粒与胶体稳定性胶体化学是一门用于研究胶体系统的分散、吸附和稳定性的科学。
胶体颗粒是这个领域中的基本单元。
在本文中,我们将深入探讨胶体颗粒和胶体稳定性的概念,以及相关的应用。
1. 胶体颗粒的定义胶体颗粒可以被定义为直径在1纳米到1微米之间的粒子,它们被悬浮在溶液中。
这些粒子的大小足够小,使得它们不能通过滤纸,但在光学显微镜下仍然可以观察到。
胶体颗粒可以是不同的化学物质,包括无机和有机物质。
例如,金属,二氧化硅,胶体银等。
这些粒子一般是由于表面的吸附或形成胶体,通过固体粉末的分散和乳化剂的辅助下形成。
2. 胶体稳定性的概念胶体稳定性指的是保持胶体颗粒均匀分布在溶液中的能力。
这个过程中,粒子之间的排斥力和吸引力的平衡非常重要。
不稳定的胶体颗粒会聚集在一起,形成沉淀和凝胶。
稳定胶体颗粒有两种类型:静电稳定和机械稳定。
静电稳定指的是通过带电荷的粒子之间的排斥力来维持稳定。
机械稳定指的是通过液体流动和分散体积来维持稳定。
3. 胶体化学的应用胶体化学的应用十分广泛。
其中一些应用如下:3.1 医学在医学中,胶体颗粒被用于制成药物的载体。
通过精细控制胶体颗粒的大小,形状和表面性质,可以控制药物的释放速度和吸收。
3.2 食品工业胶体颗粒被广泛用于食品工业中。
一些例子包括饮料,调味品和乳制品。
通过胶体化学技术,可以改变食品的质地和口感。
3.3 工业应用在工业应用中,胶体颗粒可以用于涂料和油漆的生产中。
通过粒径、形状控制,可以调节涂料的光学性能、抗污染性能,还可以增强涂料的耐候性和防水性。
3.4 环境科学胶体颗粒在环境科学中也有重要的应用。
例如,它们可以被用于处理废水和切割油污。
此外,研究人员还使用胶体颗粒来探索污染物在河流、海洋和海底的传输和生物富集过程。
在总结中,胶体颗粒和胶体稳定性是胶体化学的核心概念。
通过这些概念的应用,我们可以真正的理解和利用这些微小的颗粒。
除了本文中提到的领域,胶体化学还有着其他重要的应用,如燃料电池、润滑油添加剂和纳米材料的生产等。
65胶体稳定性的DLVO 理论胶体(憎液溶胶)是一个高度分散的系统,它有很大的表面自由能,且具有自发降低表面自由能的倾向,这就是说,在本质上,憎液溶液胶属于热力学不稳定系统。
某些物理条件的改变,特别是电解质的加入,会显著地影响它的稳定性,使它聚集而沉淀。
早在一个世纪前,Schulze(舒尔茨)和Hardy(哈迪)就经验发现,异号离子的电荷数对溶胶的聚沉影响很大。
电荷数(价数)愈高,聚沉能力愈大。
如果将使溶胶聚沉的电解质最低浓度称为聚沉值,则一价、二价和三价异号离子的聚沉值之比约为66)31(:)21(:1,这个规律称为Schulze —Hardy 规则。
怎样解释这个规则,就成了胶体稳定性理论必须面对的首要任务。
直到上个世纪的四十年代,这个问题才被两位前苏联学者Дерягин(杰里亚金)、Ландау(朗道)和两位荷兰学者Verwey(弗威)和Overbeek(奥弗比克)所解决,因此,称为DLVO 理论。
本专题就专门来介绍这个理论。
鉴于理论是建立在数学解析的基础上,下面的介绍只取推导的结果,而将介绍的重心放在物理意义上。
1.DLVO 理论这个理论完全着眼于溶胶粒子的作用势能与粒子间距的关系。
认为粒子间存在着两个相互制约的作用力,一是van der Waals 引力,它要使粒子兼并而聚沉。
另一是扩散双电层重迭所引起的静电斥力,它是维护溶胶稳定的原因。
因此,溶胶是否能够相对地稳定就取决于这两种力谁占据优势,DLVO 理论的首要任务便是分别计算粒子之间的引力和斥力势能与粒子间距的定量关系。
(1) 粒子间的van der Waals 引力势能如所周知,分子之间是存在短程的van der Waals 引力的,这种力的大小与分子间距的7次方成反比。
它包括分子间的偶极—偶极作用,偶极与诱导偶极的作用和分子间的色散作用。
后者亦称London 力,在胶体中常常起着主要的作用,量子力学算得,London 力的引力势能与分子间距的关系可由下式表示662A 43−−−=−=x x h V βνα (65-1) 式中h 为Planck 常数, ν为分子的特征振动频率,α为分子的极化率,x 为分子间距,负号表示吸引。
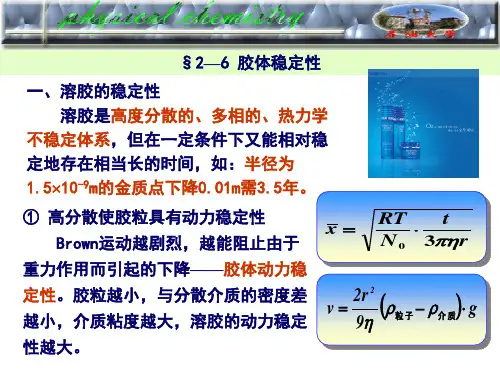
胶体稳定性一、胶体的分类所谓胶体是一种分散质粒子直径介于粗分散体系和溶液之间的一类分散体系,其值通常在1nm—100nm之间,这是一种高度分散的多相不均匀体系。
按分散剂的不同可分为气溶胶、固溶胶、液溶胶;按分散质的不同可分为粒子胶体、分子胶体。
二、胶体的稳定及不稳定性胶体因质点很小,强烈的布朗运动使它不致很快沉降,故具有一定的动力学稳定性;另一方面,疏液胶体是高度分散的多相体系,相界面很大,质点之间有强烈的聚结倾向,所以又是热力学不稳定体系。
一旦质点聚结变大,动力学稳定性也随之消失。
因此,胶体的聚集稳定性是胶体稳定与否的关键。
三、双电层与zeta电位由于分散粒子表面带有电荷而吸引周围的反号离子,这些反号离子在两相界面呈扩散状态分布而形成扩散双电层。
根据双电层理论可将双电层分为Stern层和扩散层。
当分散粒子在外电场的作用下,稳定层与扩散层发生相对移动时的滑动面即是剪切面,该处对远离界面的流体中的某点的电位称为Zeta电位。
即Zeta电位是连续相与附着在分散粒子上的流体稳定层之间的电势差。
四、聚集沉降理论影响因素起聚沉作用的主要是电荷与胶体相反的离子(称为反离子)。
反离子的价数越高,则聚沉效率越高,聚沉值越低。
一价反离子的聚沉值约为25~150,二价的为0.5~2,三价的为0.01~0.1。
聚沉值大致与反离子价数的六次方成反比,这称为舒尔茨-哈代规则。
五、胶体稳定性疏液胶体的稳定性理论通称DLVO理论。
此理论的出发点是:胶体质点间因范德瓦耳斯力而相互吸引,质点在相互接近时又因双电层的重叠而产生排斥作用,胶体的稳定程度取决于上述两种作用的相对大小。
DLVO理论计算了各种形状质点之间的范德瓦耳斯吸引能与双电层排斥能随质点间距离的变化。
在质点相互接近的过程中,如果在某一距离上质点间的排斥能大于吸引能,胶体将具有一定的稳定性;若在所有距离上吸引皆大于排斥,则质点间的接近必导致聚结,胶体发生聚沉。
溶液中的离子浓度或反离子的价数增加时,质点间的范德瓦耳斯力几乎不受影响,但双电层的排斥能却因双电层的压缩而大大降低,因此胶体的稳定性下降,直至发生聚沉。
胶体比较稳定的原因
胶体是由小分子组成的大分子络合物,它受聚合物分子内和分子
间力的作用形成半固定的结构,因此具有较高的稳定性。
胶体溶剂中分子间的相互作用有利于提高胶体稳定性,例如胶体
结构中的疏水键作用、侧链分子和芳香稠结、氢键等力之间相互作用,增强了胶体分子间的氢键作用和共轭作用,进一步增强了胶体的稳定性。
另外,一定的pH值也是影响胶体稳定性的重要因素,当胶体所在
的溶剂的pH值发生变化的时候,胶体分子荷电状态的改变会对胶体的
稳定性造成影响,进而影响了胶体的稳定性及活性。