九年级化学溶解现象
- 格式:pptx
- 大小:5.93 MB
- 文档页数:22
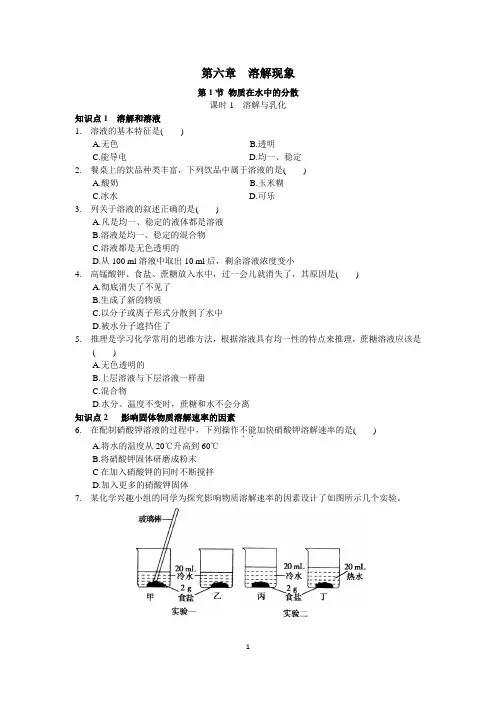
第六章溶解现象第1节物质在水中的分散课时1 溶解与乳化知识点1 溶解和溶液1. 溶液的基本特征是( )A.无色B.透明C.能导电D.均一、稳定2. 餐桌上的饮品种类丰富,下列饮品中属于溶液的是( )A.酸奶B.玉米糊C.冰水D.可乐3. 列关于溶液的叙述正确的是( )A.凡是均一、稳定的液体都是溶液B.溶液是均一、稳定的混合物C.溶液都是无色透明的D.从100 ml溶液中取出10 ml后,剩余溶液浓度变小4. 高锰酸钾、食盐、蔗糖放入水中,过一会儿就消失了,其原因是( )A.彻底消失了不见了B.生成了新的物质C.以分子或离子形式分散到了水中D.被水分子遮挡住了5. 推理是学习化学常用的思维方法,根据溶液具有均一性的特点来推理,蔗糖溶液应该是( )A.无色透明的B.上层溶液与下层溶液一样甜C.混合物D.水分、温度不变时,蔗糖和水不会分离知识点2 影响固体物质溶解速率的因素6. 在配制硝酸钾溶液的过程中,下列操作不能..加快硝酸钾溶解速率的是( )A.将水的温度从20℃升高到60℃B.将硝酸钾固体研磨成粉末C在加入硝酸钾的同时不断搅拌D.加入更多的硝酸钾固体7. 某化学兴趣小组的同学为探究影响物质溶解速率的因素设计了如图所示几个实验。
(1)实验一探究的是对物质溶解速率的影响。
(2)实验二中观察到丁中的食盐比丙中溶解得快,由此得出的结论是。
(3)实验三中观察到.由此得出的结论是固体的颗粒越小,溶解得越快。
知识点3 乳化8. 下列洗涤或除污过程应用乳化原理的是( )A用水清洗沾在手上的蔗糖B.用水洗去盘子上的水果渣C.用洗洁精洗去餐具上的油污D.用稀盐酸清洗长期盛放石灰水的烧杯9. 下列应用与乳化现象无关..的是( )A.用汽油洗去金属表面的油污B.化妆品及乳制饮品的配制C.用洗发水清洗头发上的油脂D.用乳化剂稀释难溶于水的液态农药10. 下列关于溶解和乳化的说法正确的是( )A.利用乳化作用将油污溶解而除去B.向植物油与水的混合物中加入乳化剂,可得到溶液C.用酒精洗去试管中的碘利用了乳化原理D.用肥皂洗衣服利用了乳化原理11. 小刚分别试用以下方法清洗餐具:①只用冷水;②只用热水;③在冷水中加入几滴洗涤剂;④在热水中加入几滴洗涤剂。

九年级化学下册《溶解现象》知识点沪
教版
一、物质在水中的分散
1、将深紫色的高锰酸钾加入水中,你将发现高锰酸钾固体不见了,得到紫红色的液体。
2、将紫色固体碘加入酒精中,你发现碘消失,得到暗黄的液体。
通过实验可以知道高锰酸钾能溶解在水里,碘能溶解在酒精里。
二、溶液组成的表示
1.用溶质的质量分数和溶质的物质的量浓度来表示溶液组成。
溶液的组成:溶质和溶剂。
浓溶液、稀溶液:在一定量的溶剂里所含的溶质多为浓溶液,所含的溶质少为稀溶液。
溶液的“浓、稀”只是溶液组成的一种粗略表示方法。
溶液的“浓、稀”与饱和不饱和无关,即浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液。
溶液体积与溶液质量的关系:溶液质量=溶液体积×溶液密度。
三、物质的溶解性
1.溶液的定义:一种或几种物质分散在另一种物质中,
形成均一、稳定的混合物叫做溶液。
2,溶液的特征
均一性:是制溶液各部分组成、性质完全相同。
稳定性:是指外界条件不变,溶剂的量不变时,溶液长期放置不会分层也不会析出固体或气体。

初中化学实验现象总结大全
一、溶解现象
1、溶剂液体蒸发:溶质溶于溶剂,溶剂液体集中在溶剂中,当其扩散到空气中时,溶剂液体随气流而散发,蒸发挥发,从而溶质析出。
2、挥发性溶剂溶质会慢慢挥发:溶质溶于挥发性溶剂,当热量使溶质气化后,慢慢挥发,吸收热量,溶质析出。
3、融化:某些固体溶质在适当的温度下,溶质完全溶解,而溶质析出。
二、结晶现象
1、滴液析出:某种溶质或溶剂沉积到固态表面,使溶质析出,形成滴液状的晶体。
2、霍夫曼析出:在溶液中,溶质有一定比例有规律地移动,形成晶体,叫做霍夫曼析出。
3、沸腾析出:把溶液沸腾一段时间,溶质就会蒸发析出,析出晶体形成沸腾析出。
三、沉淀现象
1、热沉淀:当溶液热度提高时,由于温度升高,溶质的活力增强,溶质析出,形成沉淀物。
2、冷沉淀:把溶液冷却,溶质的活力减弱,溶质沉淀,形成沉淀物。
3、加入试剂沉淀:加入一定的试剂,使溶质的活力减弱,溶质
析出,析出沉淀物。

中考化学第一轮专题复习第六章溶解现象溶液:物质相互分散,形成均一的、稳定的混合物。
1、混合物状态不同:悬浊液:存在固体小颗粒(不均一,不稳定,会形成沉淀)乳浊液:存在液体小颗粒(不均一,不稳定,会分层)※“均一”是指溶液各组成成分和性质完全相同。
※“稳定”是指当条件不变是,长时间放置,溶液中的溶质和溶剂也不会出现分离的现象。
※“颜色”不是判定溶液的标准:如溶液中含有Cu2+会显蓝色;含有Fe2+(亚铁)的溶液显浅绿色;含有Fe3+的溶液显黄色;含有MnO4-的溶液显紫红色。
2、物质的溶解是构成物质的离子或分子分散的过程。
※像氯化钠NaCl、氢氧化钠NaOH等物质溶解是由于在水分子的作用下电离出的阴阳离子。
NaCl = Na+ + Cl-;NaOH = Na+ + OH-※像蔗糖的物质,它们是由分子构成的,溶于水只是其分子脱离晶体表面,分散到水中的道理。
硝酸铵NH4NO3的溶解使溶液温度下降(吸热)3、溶解现象:像氯化钠NaCl等物质的溶解不会造成溶液温度发变化氢氧化钠NaOH、浓硫酸H2SO4、生石灰CaO溶解时放热,造成溶液温度上升。
4、洗洁精能使难溶于水的油以小液滴均匀悬浮在水中形成乳浊液,这称为乳化现象。
乳化的应用:油污清洗、洗涤剂和化妆品的配制、石油开采、污水处理、制剂合成及纺织印染。
※用纯碱、汽油和洗涤剂的水溶液都能除去衣物上的油污,其实它们的原理各不相同:纯碱是与油污中的物质发生化学反应;汽油是将油污溶解;洗涤剂是和油污发生乳化作用。
5、较快溶解物质的方法:⑴用玻璃棒搅拌;⑵提高溶解的水温;⑶使固体变成粉末颗粒6、物质溶于水后,溶液的凝固点下降,沸点升高。
例1、冬天厨房中最易结冰的是(D )A、酱油B、米酒C、食醋D、水※水的凝固点比溶液的低例2、寒冬里,为什么水缸往往会冻裂,而装有腌制食品的水缸却不会冻裂?冰的密度比水小,等质量的水和冰相比,冰的体积大,所以水结冰后体积变大,把水缸撑裂;腌制食品的水形成溶液,溶液的凝固点低,所以不易结冰。

初中化学溶解现象教案
教学内容:溶解现象
教学目标:了解溶解的定义、特点和影响因素,掌握一些实际生活中的有关溶解现象的知识。
教学重点:溶解的定义和特点。
教学难点:影响溶解的因素。
教学准备:实验器材、实验药品、PPT课件。
教学步骤:
第一步:引入
通过简单的实验现象引入本课主题,让学生观察实验现象,并提出问题:为什么溶质会溶解在溶剂中?
第二步:学习
1. 讲解溶解的定义:溶质在溶剂中彻底分散形成溶液的过程称为溶解。
2. 讲解溶解的特点:溶解是一个动力过程,速度快慢取决于溶质与溶剂之间的相互作用。
3. 探究影响溶解的因素:温度、溶质粒子的大小和形状、溶剂性质等因素会影响溶解的速度。
第三步:实验
组织学生进行简单的实验,观察不同条件下溶解过程的状态变化,验证影响溶解速率的因素。
第四步:总结
归纳出影响溶解速率的因素,并进行梳理总结。
第五步:拓展
通过实际生活中的案例,让学生理解溶解现象在日常生活中的应用,并启发学生思考更多的问题。
第六步:作业
布置作业:整理溶解现象相关知识,写出影响溶解速率的因素及其解释。
教学反思:
通过本节课的学习,学生应该能够了解溶解的定义和特点,掌握影响溶解速率的因素,并能够在实际生活中运用所学知识。
在教学中需要引导学生思考,让其能够在学习中得到启发和提高。

九年级化学溶解部分知识点溶解是化学中一种常见的物质现象,指的是将固体、液体或气体溶于溶剂中形成溶液的过程。
在九年级化学中,我们需要了解溶解的基本概念、溶解过程中的物质性质变化以及一些关键的知识点。
本文将围绕这些方面进行探讨。
一、溶解的基本概念溶解是指固体、液体或气体溶质与溶剂之间发生相互作用,使溶质分散均匀地分布在溶剂中,形成溶液的过程。
在溶解过程中,溶质的微观粒子与溶剂的微观粒子发生相互作用,以致溶质的微观粒子能够均匀地分散在溶剂中。
二、溶解的物质性质变化1. 固体溶解:固体溶解是指固体溶质与溶剂之间的相互作用。
在固体溶解过程中,溶质的微观粒子逐渐与溶剂的微观粒子分散均匀,与此同时,溶质的粒子间距减小、有序性降低,溶液的熵增加。
2. 液体溶解:液体溶解是指液体溶质与溶剂之间的相互作用。
液体溶解过程相对较为复杂,涉及到溶质与溶剂之间的相互作用力。
对于大多数液体溶解过程,存在着相互溶解的情况,即溶液中既有溶质的分子也有溶剂的分子。
3. 气体溶解:气体溶解是指气体溶质与溶剂之间的相互作用。
溶解气体的实质是气体分子与溶剂分子之间的碰撞,通过相互碰撞而相互溶解。
溶解气体的能力与气体的性质、温度、压强等因素有关。
三、九年级化学溶解部分的知识点1. 溶解度:溶解度指的是在一定温度下,单位溶剂中溶质溶解的最大量。
它与溶质和溶剂之间的相互作用、温度等因素有关。
常用的溶解度单位有g/100g溶剂、mol/L等。
2. 饱和溶液:当在给定的温度下继续向已经饱和的溶液中加入溶质,无法再通过溶解达到更高浓度时,称该溶液为饱和溶液。
饱和溶液中溶质的溶解度等于溶解度的值。
3. 过饱和溶液:在较高温度下溶解较多溶质,然后迅速冷却,也可以得到一个溶液。
在此情况下,溶液中含有超过饱和度的溶质,称为过饱和溶液。
4. 离子溶解:在水溶液中,其溶解过程涉及到离子的形成和断裂。
当固体物质溶解于水中时,其溶质通常以形成个别的离子,溶剂通常以离子形式存在。

九年级化学溶解现象知识点总结溶解现象是化学中一种重要的物质变化过程,是指固体、液体或气体中的微粒分散在另一种物质中,形成均匀透明的混合物。
以下是九年级化学中关于溶解现象的知识点总结:一、溶解的定义与特点溶解是指溶质的微粒逐渐分散在溶剂中形成溶液的过程。
溶解的特点包括:溶质微粒与溶剂微粒之间的相互作用力,保持永久为弱化学键;溶质微粒在溶剂中自由运动而不聚集;溶质不能被过滤分离,只能靠蒸发得到纯物质。
二、溶解的影响因素1. 温度:温度升高,溶解度一般会增大,但对气体溶解度却相反。
2. 压力(只适用于气体溶解度):压力升高,气体溶解度增大。
3. 溶质与溶剂之间的相互作用力:相互作用力越强,溶解度越大。
4. 溶质与溶剂的粒径:溶质的粒径越小,溶解度越大。
三、溶液的浓度及计算1. 质量分数:溶质的质量与溶液总质量之比。
2. 体积分数:溶质的体积与溶液总体积之比。
3. 摩尔浓度:溶质的摩尔数与溶液总体积之比。
4. 溶解度:在规定温度下,饱和溶液中溶质质量与溶剂质量之比。
四、饱和溶液与过饱和溶液饱和溶液是指在一定温度下,已经溶解了最大量的溶质的溶液。
而过饱和溶液是指在一定温度下,溶质溶解度超过平衡溶解度,在稳定条件下存在溶解度不稳定的现象。
五、溶解的物质状态1. 水溶液:以水为溶剂的溶液,如盐水、糖水等。
2. 液体溶液:由液体溶质溶解于液体溶剂中,如酒精和水的混合物。
3. 气体溶液:由气体溶质溶解于液体溶剂中,如汽水。
六、分离溶液中的溶质与溶剂1. 晶体得到分离:通过蒸发溶剂,使其发生结晶得到溶质。
2. 沉淀得到分离:通过加入反应剂使溶质发生反应,沉淀得到分离。
3. 蒸馏:通过将溶液加热至溶剂的沸点,使溶剂蒸发得到分离。
七、溶解现象在日常生活中的应用1. 调味品:食盐、白糖等溶于水中,增添食物的味道。
2. 药物:药物以溶解的形式进入人体,发挥治疗作用。
3. 清洁剂:洗衣液、洗洁精等能将污渍溶解,起到清洁作用。




初中化学溶解现象知识点总结篇一:初中化学溶液知识点总结初中化学溶液知识点总结一、溶液和乳浊液1、定义:由一种或一种以上物质分散到另一种物质中形成均一、稳定的混合物2.溶液的特征:均一性:指溶液形成以后,溶液各部分的组成、性质完全相同。
如溶液中各部分密度、颜色等完全一样稳定性:指外界条件不变时溶液长期放置,溶质不会从溶液里分离出来注意:(1)溶液的关键词:均一、稳定、混合物。
均一、稳定的液体不一定是溶液,如水。
(2)判断某物质是否为溶液,一般看以下两点:①是否为均一、稳定的混合物;②一种物质是否溶解于另一种物质中。
(3)溶液是澄清、透明的,但不一定是无色的。
如CuSO4溶液为蓝色。
(4)一种溶液中可以含一种或多种溶质,但只有一种溶剂。
3、溶液的组成①从宏观上看,溶液是由溶质和溶剂组成的。
溶质:被溶解的物质溶剂:能溶解其它物质的物质②从微观上看,溶液的形成过程是溶质的分子(或离子)均一地分散到溶剂分子之间。
③溶液、溶剂和溶质之间的量的关系溶液质量=溶质质量+溶剂质量;溶液体积≠质体积+溶剂体积4、溶液中溶质、溶剂的判断①根据名称:溶液的名称一般为溶质的溶剂溶液,即溶质在前,溶剂在后,如植物油的汽油溶液中,植物油为溶质,汽油为溶剂;当溶剂为水时,水可以省略,如食盐水中食盐是溶质,水是溶剂;碘酒中碘是溶质,酒精是溶剂。
②若固、气体与液体混合,一般习惯将液体看作为溶剂,固、气体看作溶质③若是由两种液体混合组成的溶液,一般习惯上量多的作为溶剂,量少的看作溶质。
④两种液体混合且有水时,无论水多少,水一般作为溶剂? 注意:a一般水溶液中不指名溶剂,如硫酸铜的溶液就是硫酸铜的水溶液,所以未指明溶剂的溶液,溶剂一般为水。
b、物质在溶解过程中发生了化学变化,那么在形成的溶液中,溶质是反应后且溶于水的生成物,如将足量的锌溶于稀硫酸所得到的溶液中,溶质是反应后且溶于水的生成物,如将足量的锌溶于稀硫酸所得到的溶液中,溶质是生成物硫酸锌,而不是锌;5. 影响因素溶解的因素有:①温度②溶质颗粒大小③搅拌6.乳浊液定义:由小液滴分散在液体里形成的混合物叫做乳浊液。
初三化学溶解现象知识点1. 碳酸盐能溶于盐酸或硝酸,并放出无色无味、能使澄清石灰水变浑浊的气体――co2。
2. 含cu的溶液呈蓝色,含fe的溶液呈黄色。
粉未为白色,但它的晶体――cuso4•5h2o胆矾却显蓝色,但胆矾受热后又会变成白色cuso4。
4. 蓝色絮状沉淀为cuoh2,红褐色絮状沉淀为feoh3。
5. 不溶于水也不溶于酸的白色沉淀有两样:agcl和baso4。
钾钠铵硝皆可溶、盐酸盐不溶银亚汞; 硫酸盐不溶钡和铅、碳磷酸盐多不溶。
多数酸溶碱少溶、只有钾钠铵钡溶钾、钠、硝酸溶,钾盐、钠盐和硝酸盐都溶于水。
盐酸除银亚汞,盐酸盐里除氯化银和氯化亚汞外都溶。
再说硫酸盐,不容有钡、铅,硫酸盐中不溶的是硫酸钡和硫酸铅。
其余几类盐,碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物只溶钾、钠、铵,只有相应的钾盐、钠盐和铵盐可溶最后说碱类,钾、钠、铵和钡。
氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶另有几种微溶物,可单独记住。
溶解时的热现象:吸热如硝酸铵温度不变如氯化钠放热如氢氧化钠、浓硫酸加快物质溶解速度的方法有:⑴加热或升温⑵搅拌或振荡⑶将固体研成粉末。
a、溶液不一定无色,如CuSO4为蓝色 FeSO4为浅绿色 Fe2SO43为黄色b、溶质可以是固体、液体或气体;水是最常用的溶剂c、溶液的质量 = 溶质的质量 + 溶剂的质量溶液的体积≠ 溶质的体积 + 溶剂的体积d、溶液的名称:溶质的溶剂溶液如:碘酒——碘的酒精溶液固体、气体溶于液体,液体为溶剂① 通常不指明溶剂的溶液,一般是水溶液。
② 当固体、气体溶于液体时,固体、气体做溶剂,液体做溶剂。
③ 当两种液体互相溶解时,量多的叫做溶剂,量少的叫做溶质。
④ 当物质溶解发生化学变化时,一定要正确判断溶质。
⑤ 溶质和溶剂是溶液所特有的概念,悬浊液和乳浊液不存在溶质和溶剂。
⑥ 溶质质量是指溶液中已溶解溶质的质量。
⑦ 通常把在室温20度下,溶解度在10g/100g水以上的物质叫易溶物质,溶解度在1~10g/100g水叫可溶物质,溶解度在0.01g~1g/100g水的物质叫微溶物质,溶解度小于0.01g/100g水的物质叫难溶物质.可见溶解是绝对的,不溶解是相对的.感谢您的阅读,祝您生活愉快。
第六章溶解现象第一节物质在水中的一、溶解1、定义:一种或几种物质分散到另一种物质里形成的均一、稳定的混合物2、特征:均一性:溶液内各部分性质完全相同稳定性:外界条件不变时(即温度或压强不改变,溶剂不蒸发),溶液长时间放置不会分层,也不会析出固体物质;混合物:至少包含两种物质3、说明:均一稳定的不一定是溶液,如水、酒精等溶液不一定是无色的,如FeCl3溶液是黄色的,KMnO4溶液是紫红色的4、溶液的微观形成过程:溶质分子(或离子)在溶剂分子的作用下扩散到溶剂中的过程,溶质在溶液中以分子或离子的形式均一地分散在溶剂中,如图NaCl溶于水的微观过程5、水溶液的某些性质:导电性,一些物质在水中溶解时能生成自由移动的离子,使溶液能够导电,例如食盐水、硫酸溶液、氢氧化钠溶液;蔗糖溶于水后,以分子形式存在与水中,不能形成自由移动离子,因此蔗糖水溶液很难导电二、溶液形成中的能量变化1、物质的溶解过程扩散过程(了解):溶质的分子(或离子)向水中扩散,这一过程吸收热量如:硫酸铵水合过程(了解):溶质的分子(或离子)和水分子作用,生成水合分子(或水合离子)这一过程放出热量如:硫酸、氢氧化钠、氧化钙与水反应放热溶于水温度不变的物质:氯化钠三、乳化现象1、乳浊液:小液滴分散到液体里形成的混合物;特点:不稳定,静置分层2、悬浊液:一种物质以固体小颗粒的形态分散到液体里形成的不均一、浑浊的混合物,如泥与水混合用力振荡后得到的不均一、不稳定、不透明的液体就是悬浊液;悬浊液不稳定,静置一段时间后,其中的固体小颗粒会沉淀下来,故悬浊液可用过滤法分离3、乳化(1)概念:洗涤剂能使植物油在水中分散成无数细小的液滴,而不聚集成大的油珠,从而使油和水不再分层,所形成的乳浊液稳定性增强的现象(2)乳化作用在生活中的应用→洗涤:用乳化剂(洗涤剂)可以将衣服、餐具上的油污洗掉→农药的使用:将农药加入一定量的乳化剂后,再溶解在有机溶剂里,混合均匀后制成的透明液体叫乳油→生活中常用的乳化剂有肥皂、洗洁精等乳化现象第二节溶液组成的表示一、溶质的组成1、溶质:被溶解的物质(溶质可以是固体、液体、气体)溶剂:起溶解作用的物质(通常是水,也可以是其他液体,如:酒精、汽油、氯仿等)溶液:溶解了某种溶质的混合物判断溶质、溶剂:(1)若气体、固体溶于液体,则气体、固体为溶质,液体为溶剂;如食盐水、高锰酸钾溶液、盐酸(2)若液体溶于液体,质量少的为溶质,质量多的为溶剂;如碘酒(3)有水存在的溶液,无论水多少,水都为溶剂;如酒精溶液(4)如有化学反应,则应根据反应情况判断溶质、溶剂二、溶质浓度的表示——溶质质量分数1、定义:溶质质量与溶液质量之比2、表达式:溶质的质量分数= =溶液的质量(g)=溶液的体积(mL)×溶液密度(g。
九年级化学溶解现象知识点化学是一门关于物质变化的科学,而溶解现象则是其中一个重要的知识点。
溶解是指固体溶质在液体溶剂中完全分散,形成一种均匀透明的混合物的过程。
本文将重点介绍九年级化学中关于溶解现象的知识点,包括溶解的条件、溶解过程、溶解度、浓度相关概念以及一些与溶解现象相关的实际应用。
一、溶解的条件为了使固体能够溶解在液体中,有一些条件需要满足。
其中最主要的条件是物质的颗粒之间具有相互吸引力。
这是因为在溶解过程中,固体溶质的颗粒要克服一定的吸引力才能脱离固体表面分散到液体中。
此外,温度和压力也会对溶解产生一定的影响。
通常情况下,溶解随着温度的升高而增加,但也有个别例外情况。
二、溶解过程溶解是一个物质从一种状态转化为另一种状态的过程。
在溶解过程中,溶质的颗粒分散在溶剂中,形成溶液。
这个过程可以分为三个步骤:溶质颗粒与溶剂颗粒之间发生相互作用;溶质颗粒从固体表面逐渐脱离,并开始在溶液中游离;溶质颗粒在溶液中游动并与溶剂颗粒相互作用。
三、溶解度溶解度是指在一定温度下,能够溶解在单位溶剂质量中的溶质质量。
以盐溶解为例,当我们往水中加入盐时,随着溶质质量的增加,一段时间后溶解过程将处于动态平衡。
此时,在溶液中溶解的盐离子的数量与重新结晶的盐离子的数量相等,这时的溶解度就称为饱和溶解度。
饱和溶解度与溶剂的温度有关,通常随温度的升高而增加。
四、浓度相关概念浓度是指溶质在溶液中的相对含量。
根据不同的计量单位和测量方法,我们可以有多种浓度相关概念,比如质量浓度、摩尔浓度和体积浓度等。
质量浓度是指溶质在单位溶液体积中所含的溶质质量,常用的单位是g/L。
摩尔浓度是指溶质在溶液中的摩尔数与溶液体积的比值,单位为mol/L。
体积浓度是指溶质在溶液中的体积与溶液体积的比值,单位为mL/L。
五、溶解现象的实际应用溶解现象在日常生活中有着广泛的应用。
比如,我们在喝茶或咖啡时,茶叶和咖啡粉是通过溶解的方式将其香味和味道释放出来;在吃薄荷糖时,糖和薄荷的香味也是通过溶解来实现的。