不同温度水的表面张力
- 格式:doc
- 大小:15.00 KB
- 文档页数:1

无水乙醇表面张力
答案:22.27 mN/m
无水乙醇的表面张力
无水乙醇在20℃时的表面张力为22.27 mN/m,而在25℃时为21.97 mN/m。
此外,无水乙醇在不同温度下的表面张力如下:
20℃时,表面张力为22.3 mN/m。
30℃时,表面张力为21.2 mN/m。
40℃时,表面张力为20.4 mN/m。
50℃时,表面张力为19.8 mN/m。
60℃时,表面张力为18.8 mN/m。
70℃时,表面张力为18.0 mN/m。
80℃时,表面张力为17.1 mN/m。
90℃时,表面张力为16.2 mN/m。
100℃时,表面张力为15.2 mN/m。
无水乙醇表面张力的变化规律
液体的表面张力与温度有关,温度愈高,表面张力愈小。
到达临界温度时,液体与气体不分,表面张力趋近于零。
此外,液体的表面张力也与液体的纯度有关。
在纯净的液体中如果掺进杂质,表面张力就会发生变化。
微波加热对无水乙醇表面张力的影响
研究表明,在同一温度条件下,微波加热无水乙醇的表面张力高于传统加热无水乙醇的表面张力。
微波增强表面张力的现象为微波非热效应提供直接证据,也为超温沸腾现象给出合理的解释。


水的表面张力是多少
水的表面张力有多大?我们经常会看到有小虫子落在水面上,但是它的脚踩在水面就好像踩在了一层薄膜上,并不会渗下去,这就是水的表面张力。
在比如生活中溅起的水花,为什么往往总呈现出水珠的形状,这其实也是由于表面张力的存在。
做个实验就知道了,往一个杯子里倒满水,此时如果在往水中不断地扔进去,别针会发现水并不会溢出来,只会在杯口处慢慢地向上突起,明明已经高过了杯口,却不会溢出,这也是由于表面张力的原因。
而之所以会有表面张力,是因为水分子中氢原子与氧原子构成共价键,相互吸引,但是不同水分子间的氢原子与氧原子也会相互吸引,这就使得水分子之间相互拉扯,从而产生表面张力。
今天我们可以就来算一下水的表面张力是多少?
公式:水的表面张力=75.796-0.145t-0.00024t^2。
式中t 为摄氏温度,表面张力单位为mN/m。
这个公式在10-60℃时适用.算得24.5度下水的表面张力为72.099mN/m。

不同液体之间的表面张力系数标题:深入探索不同液体之间的表面张力系数导语:表面张力是液体界面上自发形成的一种现象,它决定着液体在容器内的形状和液滴的稳定性。
不同液体之间的表面张力系数差异巨大,这种差异是由分子之间的力引起的。
本文将深入探索不同液体之间的表面张力系数及其影响因素,旨在帮助读者更全面、深刻地理解这一现象。
一、什么是表面张力表面张力是指液体界面上自发形成的一种力,使得液体呈现出一种将表面缩小的趋势。
表面张力决定着液体的形状和液滴的稳定性。
我们可以通过在水面上洒撒一些小颗粒来观察表面张力的效应,这些颗粒会在水面上聚集成团,并呈现出一个较小的弯曲角度。
二、影响表面张力的因素1. 分子之间的作用力:表面张力与液体分子之间的相互作用力密切相关。
分子之间的吸引力越大,表面张力越高。
一般来说,极性分子之间的吸引力比非极性分子之间的吸引力要强,因此极性液体的表面张力通常较高。
2. 温度:温度也会对表面张力产生影响。
随着温度的升高,分子的热运动增强,表面张力会减小。
这也是为什么在冷天气里,水滴往往形成较为圆润的原因,因为此时水的表面张力较高。
3. 杂质和溶质的存在:杂质和溶质的存在会干扰液体分子之间的相互作用力,进而影响表面张力。
特别是一些表面活性剂,它们可以改变液体的表面性质,使表面张力降低。
三、不同液体之间的表面张力差异不同液体之间的表面张力系数差异巨大,这是由液体本身的化学性质决定的。
以下是几种常见液体的表面张力系数(单位:N/m):1. 水:0.07282. 甲醇:0.02223. 乙醇:0.02124. 丙酮:0.02175. 水银:0.465从上述数据可以看出,水银的表面张力系数远远高于其他液体,这是因为水银是一种金属,具有比较强的分子间相互作用力。
四、不同液体之间的表面张力影响实际应用不同液体之间的表面张力差异直接影响到实际应用中的一些现象和现象。
以下是一些例子:1. 水滴形状:不同液体的表面张力决定了水滴的形状。

表面张力与温度解释说明以及概述1. 引言1.1 概述表面张力是指液体介质表面上存在的一种强大的分子间相互吸引力,导致液体表面呈现出拉力状态的现象。
温度是物质热运动的量度,对表面张力产生显著的影响。
本文将详细介绍表面张力与温度之间的关系,并探讨其背后的物质性质及应用领域。
1.2 文章结构本文主要分为五个部分。
首先,在引言部分我们将概述论文内容和结构,并明确研究目标。
然后,在第二部分中我们将详细介绍表面张力的概念以及温度对其影响的机制,配以具体实例进行分析。
接着,在第三部分中我们将探讨表面张力与物质性质之间的联系,包括不同物质溶液之间表面张力比较和解释、以及温度变化对物质表面张力行为造成的影响。
在第四部分中,我们将重点探讨工业应用中的表面张力研究意义和生物界面现象中的表面张力效应研究进展,同时展望未来可能的研究方向和挑战。
最后,在第五部分中我们将总结全文内容并得出结论。
1.3 目的本文的目的主要有两个方面:第一,通过深入探讨与表面张力相关的温度影响,加深对这一现象的理解;第二,介绍表面张力与物质性质的联系,为工业应用和生物界面现象中的相关研究提供基础和启示。
通过本文的阐述和探讨,希望能够拓宽读者对表面张力与温度之间关系的认识,并为相关领域的进一步研究提供参考和借鉴。
2. 表面张力与温度的关系2.1 表面张力的概念表面张力指的是液体表面上存在的一种引起液体表面缩小,使其尽可能形成最小表面积的趋势。
它是由于液体分子间的相互作用而产生的。
2.2 温度对表面张力的影响温度对表面张力有着明显的影响。
一般情况下,随着温度升高,液体分子具有更大的平均动能,分子活跃程度提高,因此表面张力会减小。
这是因为高温下分子运动趋势增强,造成了大量分子逸出并进入气相状态。
2.3 实例分析以水作为实例来说明温度对表面张力的影响。
在常温下(例如25°C),水的表面张力为72.8 mN/m。
但当水被加热至沸点时(100°C),水的表面张力降低到58.9 mN/m。
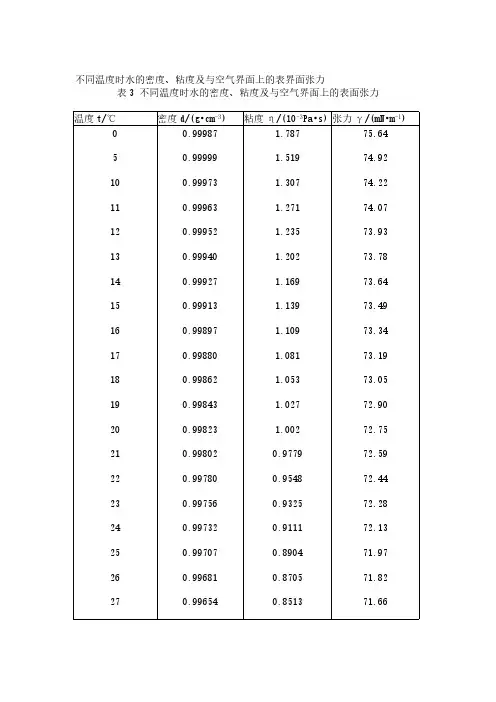
不同温度时水的密度、粘度及与空气界面上的表界面张力表3 不同温度时水的密度、粘度及与空气界面上的表面张力温度t/℃密度d/(g•cm-3)粘度η/(10-3Pa•s)张力γ/(mN•m-1)0 5 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 270.999870.999990.999730.999630.999520.999400.999270.999130.998970.998800.998620.998430.998230.998020.997800.997560.997320.997070.996810.996541.7871.5191.3071.2711.2351.2021.1691.1391.1091.0811.0531.0271.0020.97790.95480.93250.91110.89040.87050.851375.6474.9274.2274.0773.9373.7873.6473.4973.3473.1973.0572.9072.7572.5972.4472.2872.1371.9771.8271.662829304050600.996260.995970.995670.992240.988070.965340.83270.81480.79750.65290.54680.314771.5071.3571.1869.5667.9160.75在293K 下水的表面张力系数为72.75×10-3 N·m-1,乙醇为22.32×10-3N·m-1,正丁醇为24.6×10-3N·m-1,而水-正丁醇(4.1‰)的界面张力为34×10-3 N·m-1。
(1)定义或解释 ①促使液体表面收缩的力叫做表面张力[1]。
②液体表面相邻两部分之间,单位长度内互相牵引的力。

液体表面张力系数与温度和浓度的关系液体由于表面张力的作用而具有自发收缩成球状的趋势.表面张力的大小, 可用表面张力系数来描述。
影响表面张力系数的因素主要有:一、温度越高表面张力系数越小;二、在液体中加入杂质可显著改变表面张力系数。
在实践中, 液体自发收缩成球状的现象有时对工农业生产是不利的。
例如, 在喷洒农药时, 药液在液面上收缩成液滴将影响叶片对农药的吸收, 因此必须减小液滴的表面张力系数使液滴在液面上呈延展分布。
减小液体表面张力最有实用意义的方法是添加表面活性物质如肥皂、皂素、皂角粉等。
液体表面张力与温度和浓度的关系表面张力是指液面作用于单位长度分界线的张力。
通常说的表面张力实际上指的是界面张力, 因为这种张力是在相的界面上发生的行为.物质表面层分子与内部分子周围的状况不同, 内部分子所受邻近相同分子的作用力是对称的, 各方向的力相互抵消;但表面层分子, 一方面受到本相内分子的作用, 另一方面受到性质不同的另一相分子的作用。
由于两相分子性质不同, 液体表面层里分子受力的球对称性遭到破坏而受到指向液体内部的合力作用. 因此如果把一个分子从内部移到表面或增大表面积时, 就必须克服体系内部分子之间的吸引力而对体系作功。
在温度上升时,表面张力将随着温度升高而下降。
液体表面张力与浓度的关系在纯液体中加入杂质时, 体系的表面张力会发生相应的变化。
根据试验, 稀溶液的表面张力和浓度的关系大致可分为3类:第一类的特征是浓度增加时, 溶液的表面张力随之下降, 大多数非离子型的有机物如短链脂肪酸、醇、醛类的水溶液都有此行为。
第二类溶液的特征是, 当溶质的浓度增加时, 溶液的表面张力随浓度上升。
第三类的特征是它与第一类曲线不同, 当溶液很稀时,表面张力随浓度的增加而急剧下降。
随后表面张力不会随着浓度而变化。
(有时也可能会出现最低值, 是由于溶液中含有杂质之故)。
当把表面活性物质加入到体系中时, 则会被吸附在该体系的表面上, 使这些表面的表面自由能明显降低, 从而降低表面张力。

为什么水在不同温度下会表现出不同的状态?
下:
分子热运动:水分子在不同温度下具有不同的热运动能量。
当温度较低时,水分子的热运动较为缓慢,分子之间的相互作用较强,水分子更容易形成稳定的结构,呈现为固态。
相变过程:当水温升高时,水分子的热运动能量增加,分子之间的相互作用逐渐减弱。
在一定温度范围内,水分子的热运动能量足以克服分子之间的吸引力,使得水分子之间的排列结构不再稳定,水体呈现出液态。
这个温度范围称为水的液态存在的温度区间。
沸点和凝固点:水的液态存在的温度区间中,有一特定温度称为水的沸点,当水温达到沸点时,水分子的热运动能量达到一定程度,水分子能够克服表面张力和大气压力,从液态转变为气态。
另外,水的凝固点是指水从液态转变为固态的特定温度。
气态:当水温继续升高超过了沸点,水分子的热运动能量增加到足以克服液态分子之间的吸引力,使得水分子能够自由运动,呈现为气态。
综上所述,水在不同温度下会表现出不同的状态,是由于水分子
的热运动和相互作用的影响导致的相变现象。
水的状态随着温度的变化而变化,包括固态、液态和气态。

表面张力表面张力,是液体表面层由于分子引力不均衡而产生的沿表面作用于任一界线上的张力。
通常,由于环境不同,处于界面的分子与处于相本体内的分子所受力是不同的。
在水内部的一个水分子受到周围水分子的作用力的合力为0,但在表面的一个水分子却不如此。
因上层空间气相分子对它的吸引力小于内部液相分子对它的吸引力,所以该分子所受合力不等于零,其合力方向垂直指向液体内部,结果导致液体表面具有自动缩小的趋势,这种收缩力称为表面张力。
表面张力(surface tension)是物质的特性,其大小与温度和界面两相物质的性质有关在293K下水的表面张力为72.75×10-3 N·m-1,乙醇为22.32×10-3 N·m-1,正丁醇为24.6×10-3N·m-1,而水-正丁醇(4.1‰)的界面张力为34×10-3 N·m-1。
表面张力的测值通常有多种方法,目前实验室及教科书中,通常采用的测试方法为最大气泡压法.由于其器材易得,操作方法相对易于学生理解表面张力的原理,因而长期以来是教学的必备方法.作为表面张力测试仪器的测试方法,通常有白金板法(du Nouy method)\白金环法(Wilhelmy plate method)\悬滴法\滴体积法\最大气泡压法等.定义及相关(1)定义或解释①促使液体表面收缩的力叫做表面张力[1]。
②液体表面相邻两部分之间,单位长度内互相牵引的力。
(2)单位表面张力的单位在SI制中为牛顿/米(N/m),但仍常用达因/厘米(dyn/cm), 1dyn/cm = 1mN/m。
(3)说明①表面张力的方向和液面相切,并和两部分的分界线垂直,如果液面是平面,表面张力就在这个平面上。
如果液面是曲面,表面张力就在这个曲面的切面上。
②表面张力是分子力的一种表现。
它发生在液体和气体接触时的边界部分。
是由于表面层的液体分子处于特殊情况决定的。

温度对表面张力的影响温度对表面张力的影响
表面张力是指在液体表面上一个单位长度的静水压力,它是由于液体分子表面相互作用引起的。
表面张力对于液体的形态稳定性以及液体与固体和液体与液体之间的相互作用等方面起着重要的作用。
温度是表面张力的一个重要影响因素,它对表面张力的影响是复杂的,会在很多方面产生影响。
液体的表面张力与温度的变化呈现出相反的趋势。
随着液体的温度升高,表面张力呈下降趋势。
这一现象可以从分子层面去解释:当液体温度上升时,分子热运动加剧,表面分子处于不断运动状态。
因此,液体分子的亲合力会减弱,导致表面张力降低。
另一方面,温度的变化会对液体的表面活性产生影响。
表面活性是液体表面上的分子分布所产生的现象,包括表面张力和表面吸附等特性。
温度的变化会引起表面活性的不同反应。
一些研究发现,温度的升高会对表面活性物质(如胶体分子)的表面张力产生削弱作用,使得分子更容易发生相互作用,这样会促进各种化学反应的发生。
这也是为什么在许多煮沸反应中,加热可有效促进反应的发生。
此外,温度变化还会影响液体的流动性。
当液体温度升高时,其粘性也会随之降低,这样液体流动的阻力就会变小。
这个过程也会对表面张力产生影响,因为液体的流动会改变表面上分子的分布的方式,使得分子间相互作用发生改变,进而会引起表面张力的变化。
总的来说,温度对表面张力的影响是一个复杂的过程,它涉及到分子间的吸引力和排斥力的作用,以及液体表面的分子分布等因素。
在科学研究和工程应用中,深入分析温度对表面张力的影响,可以为我们更好地控制液体的行为和相互作用提供帮助。

水和气体的界面张力(共3篇)以下是网友分享的关于水和气体的界面张力的资料3篇,希望对您有所帮助,就爱阅读感谢您的支持。
篇1不同温度时水的密度、粘度及与空气界面上的表界面张力表3 不同温度时水的密度、粘度及与空气界面上的表面张力在293K下水的表面张力系数为72.75×10-3 Nm-1,乙醇为22.32×10-3 Nm-1,正丁醇为24.6×10-3Nm-1,而水-正丁醇(4.1‰)的界面张力为34×10-3 Nm-1。
(1)定义或解释①促使液体表面收缩的力叫做表面张力[1]。
②液体表面相邻两部分之间,单位长度内互相牵引的力。
(2)单位表面张力的单位在SI制中为牛顿/米(N/m),但仍常用达因/厘米(dyn/cm), 1dyn/cm = 1mN/m。
(3)说明①表面张力的方向和液面相切,并和两部分的分界线垂直,如果液面是平面,表面张力就在这个平面上。
如果液面是曲面,表面张力就在这个曲面的切面上。
②表面张力是分子力的一种表现。
它发生在液体和气体接触时的边界部分。
是由于表面层的液体分子处于特殊情况决定的。
液体内部的分子和分子间几乎是紧挨着的,分子间经常保持平衡距离,稍远一些就相吸,稍近一些就相斥,这就决定了液体分子不像气体分子那样可以无限扩散,而只能在平衡位置附近振动和旋转。
在液体表面附近的分子由于只显著受到液体内侧分子的作用,受力不均,使速度较大的分子很容易冲出液面,成为蒸汽,结果在液体表面层(跟气体接触的液体薄层)的分子分布比内部分子分布来得稀疏。
相对于液体内部分子的分布来说,它们处在特殊的情况中。
表面层分子间的斥力随它们彼此间的距离增大而减小,在这个特殊层中分子间的引力作用占优势。
因此,如果在液体表面上任意划一条分界线MN把液面分成a、b两部分。
F表示a部分表面层中的分子对b部分的吸引力,F6表示右部分表面层中的分子对a部分的吸引力,这两部分的力一定大小相等、方向相反。
附表一不同温度下水的表面张力用origin 作σ~t 曲线图得以下图:σ/10-3N ·m -1t℃由上图能够看出水的表面张力与温度呈负相关,且近似为线性关系,即温度越高,水的表面张力越小。
表面张力是指液体作用于单位长度分界限的张力。
通常说的表面张力事实上指的是界面张力,因为这种张力是在相的界面上发生的行为。
物质表面层分子与内部份子周围的状况不同,内部份子所受临近相同分子的作使劲是对称的,各方向的力彼此抵消;但表面层分子,一方面受到本相内分子的作用,另一方面受到性质不同的另一相分子的作用。
由于两相分子性质不同,液体表面层里分子受力的球对称性受到破坏而受到指向液体内部的合力作用。
因此,若是把一个分子从内部移到表面或增大表面积时,就必需克服体系内部份子之间的吸引力而对体系作功,称为表面功。
在恒温、恒压和组成恒按时,有-dW ’=σdA (1)式中,W ’为表面功(J );σ为表面张力(N );A 为表面积(m 2).在恒温恒压下,吉布斯自由能ΔG=-ΔW ’,那么ΔG=σΔA ,因此(1)式可变成σ=(аG/аA )T,P (2)此式为温度、压强一按时,表面张力的经常使用概念式。
T ,P 表示在恒温恒压下。
依照(2)式及热力学的大体公式,可取得:(аσ/аT )A,V =-(аS/аA)T,V (3) (аσ/аT) A,P =-(аS/аA)T,P (4) 式中,S 为表面熵,V 为体积。
将(3)、(4)两式两边都乘以T ,那么有:-T (аσ/аT )=(T*dS/dA ) (5)-T (аσ/аT )的值等于在温度不变时扩大单位表面积所吸的热(T*dS/dA ),这是正值,因此(аσ/аT )<0,即该值随T 的升高而下降,从而可推知假设以绝热的方式扩大表面积,体系的温度必将下降。
附表二由σ=K*ΔP 可求得不同浓度的正丁醇溶液的表面张力σ,见下表:K=*10^(-4)m0.000.050.100.150.200.250.300.350.400.0350.0400.0450.0500.0550.0600.0650.070σ/(N /m )C/(mol/L)σ~C曲线如下图,正丁醇溶液的σ~C 曲线为近似滑腻的曲线,且正丁醇溶液的表面张力σ随浓度C的增大而减小,即(dσ/dc)T<0。
不同温度时水的密度、粘度及与空气界面上的表界面张力表3 不同温度时水的密度、粘度及与空气界面上的表面张力温度t/℃密度d/(g•cm-3)粘度η/(10-3Pa•s)张力γ/(mN•m-1)0 5 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 270.999870.999990.999730.999630.999520.999400.999270.999130.998970.998800.998620.998430.998230.998020.997800.997560.997320.997070.996810.996541.7871.5191.3071.2711.2351.2021.1691.1391.1091.0811.0531.0271.0020.97790.95480.93250.91110.89040.87050.851375.6474.9274.2274.0773.9373.7873.6473.4973.3473.1973.0572.9072.7572.5972.4472.2872.1371.9771.8271.662829304050600.996260.995970.995670.992240.988070.965340.83270.81480.79750.65290.54680.314771.5071.3571.1869.5667.9160.75在293K 下水的表面张力系数为72.75×10-3 N·m-1,乙醇为22.32×10-3N·m-1,正丁醇为24.6×10-3N·m-1,而水-正丁醇(4.1‰)的界面张力为34×10-3 N·m-1。
(1)定义或解释 ①促使液体表面收缩的力叫做表面张力[1]。
②液体表面相邻两部分之间,单位长度内互相牵引的力。
液体表面张力系数的测量实验液体沿表面总是存在着使液面紧张且向液体内收缩的力称为表面张力。
液体的许多现象,如毛细管现象、湿润现象、泡沫的形成等,都与表面张力有关。
表面张力系数是液体表面的重要力学性质:对于不同种类的液体,其表面张力不同,而对于同一种液体,其表面张力系数随着温度及其所含杂志的改变而增大或减小。
这些性质广泛应用于工业生产中,如浮法选矿、液体的传输技术、化工生产线的设计等等都要对液体的表面张力进行研究。
测定液体表面张力系数的方法很多。
常用的有拉脱法和毛细管升高法。
本次实验介绍用拉脱法测定液体表面张力系数。
一、实验目的1.用砝码对硅压阻力敏传感器进行定标,计算该传感器的灵敏度,学习传感器的定标方法; 2.观察拉脱法测量表面张力的过程,并用物理学基本概念进行分析,加深对物理规律的认识;3.测量纯水和其它液体(如:甘油)的表面张力系数。
二、实验仪器实验仪器主要由液体表面张力系数测量实验仪主机以及实验装置以及镊子、砝码组成。
应用电脑采集测量时需要壹根串口转USB 连接线、电脑和采集软件,仪器装置见下图。
三、实验原理一个金属环固定在传感器上,将该环浸没于液体中,并渐渐拉起圆环,当它从液面拉脱瞬间传感器受到的拉力差值f 为απ)(21D D f +=(1)式中: 1D 、2D 分别为圆环外径和内径,α为液体表面张力系数,g 为重力加速度,所以液体表面张力系数为:)](/[21D D f +=πα(2)实验中,液体表面张力可以由下式得到:B U U f /)(21-=(3)B 为力敏传感器灵敏度,单位V/N 。
1U ,2U 分别为即将拉断水柱时数字电压表读数以及拉断时数字电压表的读数。
四、实验步骤1.连接硅压阻力敏传感器,并开机预热15~20分钟。
测量吊环内外直径,然后清洗玻璃器皿(盛装待测液体)和吊环,给实验装置加水(注意加水量不可过多,可以参考装置外壁加水刻度线);2.将吊环挂在力敏传感器的钩上,将力敏传感器转至水容器外部,这样取放砝码比较方便。