考马斯亮蓝法(Bradford法)测定蛋白质含量:分光光度的使用
- 格式:ppt
- 大小:403.50 KB
- 文档页数:24

实验二考马斯亮蓝法(Bradford法)测定蛋白质含量一、目的与要求1. 掌握考马斯亮蓝染色法定量测定蛋白质含量的原理与方法2. 熟练分光光度计的使用和操作方法。
二、实验原理考马斯亮蓝G250测定蛋白质含量属于染料结合法的一种,它与蛋白质的疏水微区相结合,这种结合具有高敏感性。
它在酸性溶液中呈棕红色,最大光吸收峰在465nm,当它与蛋白质结合形成复合物时,其最大吸收峰改变为595nm。
考马斯亮蓝G-250—蛋白质复合物呈蓝色,在一定范围内,595nm下光密度与蛋白质含量呈线性关系,故可以用于蛋白质含量的测定。
考马斯亮蓝结合法是近年来发展起来的蛋白质定量测定法,本方法具有操作方便、快速、干扰因素少的特点。
附:(一)、分光光度法原理:光的吸收定律(朗伯-比尔定律):一束单色光(强度为I0)通过某吸光物质的溶液时,其光能量的被吸收与该物质浓度的关系符合朗伯—比尔定律即当入射光波长、温度和溶液的厚度一定时,吸光度与溶液的浓度成正比。
用公式表示为:T = I/I0则A = lg(1/T)=Kbc式中T —透光率I —透过光强度I0—入射光强度 A —吸光度K —比例常数 b —溶液的厚度 c —溶液的浓度(二)、离心机的使用说明:1.要离心的离心管和管套要称重,重量不等时将水加在管套里。
2.离心管的放置是对角线放置,要求必须对称。
3. 先将离心机转速旋钮恢复到零刻度后,再定时间,定好时间后缓慢旋转转速旋钮,使离心机均匀的提速到预定转速。
(三)、分光光度计的使用说明:1.接通电源开关,预热20min后,再选择须用的单色光波长。
2.放入已加入溶液的比色皿,盖上样品室盖,推动试样架拉手,使对照比色皿(溶液装入4/5高度,置第一格)置于光路上,调节100%透射比按钮,使吸光度值A=0.00。
3.推动试样架拉手,使样品比色皿置于光路上,读出吸光度值。
4.测量完毕,取出比色皿,洗净后置于乙醇溶液中浸泡脱色。
5.电源开关置于“关”,拔下电源插头。

蛋白质含量测定法——考马斯亮蓝法[实验目的]学习、掌握考马斯亮蓝法(Bradford 法)测定蛋白质含量的方法[实验原理](蓝色)变为氨基酸芳香族碱性染料考马斯亮蓝磷酸nm G 595250max λ−−→−+-[器材与试剂]器材722型可见光分光光度计、漩涡混合器、试管16支 试剂1.标准蛋白质溶液,用牛血清清蛋白(BSA ),配制成1.00mg/ml 。
2.考马斯亮蓝G-250染料试剂:称100mg 考马斯亮蓝,溶于50ml 95%的乙醇后,再加入120ml 85% 的磷酸,用水稀释至1升。
[实验方法]标准方法1.取10支试管,分别编号后按 表1 剂量依次加入标准蛋白(或未知蛋白)、去离子水和考马斯亮蓝染料。
每支试管加完后,立即在漩涡混合器上混合。
2.加完染料20min 后,使用722分光光度计,塑料比色皿,在595nm 处测量吸光度A 595。
3.用标准蛋白浓度(mg/ml )为横坐标,用A 595为纵坐标,进行直线拟合,得到标准曲线。
根据测得的未知样品的A 595,代入公式即可求得未知样品的蛋白质含量。
根据所测样品的吸光度,在标准曲线上查得相应的蛋白质含量,按下式计算: 样品蛋白质含量(μg/g 鲜重) =)测定时提取液体积()样品重()提取液总体积()查得的蛋白质(ml g ml g g ⨯⨯/μSDS 干扰实验1.取5支试管,分别编号后按表2剂量依次加入标准蛋白、SDS 、去离子水和考马斯亮蓝染料。
每支试管加完后,立即在漩涡混合器上混合。
2.加完染料20min 后,使用753分光光度计,塑料比色皿,在595nm 处测量吸光度A 595。
[实验数据与结果分析](一)标准方法的数据和图表1 考马斯亮蓝标准法实验表格根据表1,以A595为纵坐标,标准蛋白质量/(μg)为横坐标,作图1。
图1 考马斯亮蓝标准法根据线性拟合公式y=a x+b计算所测溶液的蛋白质的含量。
(二)SDS干扰数据和图表2 考马斯亮蓝SDS干扰实验表格根据表2,以A595为纵坐标,SDS浓度为横坐标,作图2。


考马斯亮蓝法测定蛋白质含量流程:该方法用于大多数蛋白质的定量是比较精确的,但不适用于小分子碱性多肽的定量。
如核糖核酸酶或溶菌酶。
去污剂的浓度超过0.2%影响测定结果。
如TritonX-100、SDS、NP-40等。
1.Bradford浓染液的配制:将100mg考马斯亮蓝G-250溶于50ml 95%乙醇,加入100ml85%的磷酸,然后,用蒸馏水补充至1000ml,此染液放4℃至少6个月保持稳定。
2.标准曲线蛋白质样本的准备:尽量使用与待测样本性质相近的蛋白质作为标准品,例如测定抗体,可用纯化的抗体作为标准。
如果待测样本是未知的,也可用抗体作为标准蛋白。
通常在20ug—150ug/100ul之间绘制标准曲线。
3.将待测样本溶于缓冲溶液中,该缓冲溶液应与制作标准曲线的缓冲溶液相同(最好用PBS)。
4.按1:5用蒸馏水稀释浓染料结合溶液,如出现沉淀,过滤除去。
5.每个样本加5ml稀释的染料结合溶液,作用5~30min。
染液与蛋白质结合后,将由红色变为蓝色,在595nm波长下测定其吸光度。
注意,显色反应不得超过30min.6.根据标准曲线计算待测样本的浓度。
注意:考马斯亮蓝和皮肤中蛋白质通过范德华力结合,反应快速,并且稳定,无法用普通试剂洗掉。
待一两周左右,皮屑细胞自然衰老脱落即可无碍。
适用范围考马斯亮蓝显色法的基本原理是根据蛋白质可与考马斯亮蓝G-250 定量结合。
当考马斯亮蓝G-250 与蛋白质结合后,其对可见光的最大吸收峰从465nm 变为595nm。
在考马斯亮蓝G-250 过量且浓度恒定的情况下,当溶液中的蛋白质浓度不同时,就会有不同量的考马斯亮蓝G-250 从吸收峰为465nm 的形式转变成吸收峰为595nm 的形式,而且这种转变有一定的数量关系。
一般情况,当溶液中的蛋白质浓度增加时,显色液在595nm 处的吸光度基本能保持线性增加,因此可以用考马斯亮蓝G-250 显色法来测定溶液中蛋白质的含量。

考马斯亮蓝法测定蛋白浓度一、实验原理考马斯亮蓝G250比色法,也被称为Bradford法是常用的一种蛋白质浓度的测定方法。
考马斯亮蓝G250是一种染料,能与蛋白质通过疏水作用结合,形成蛋白质-染料复合物,颜色由红色转变为蓝色,最大光吸收波长为595nm,并且在低浓度范围(0.01~1.0mg/mL)内,与蛋白质浓度的关系服从比尔定律。
二、实验材料1、实验设备电子天平、分光光度计、恒温水浴锅2、试剂考马斯亮蓝G250、牛血清蛋白、NaCl、95%乙醇、85%磷酸三、操作步骤(一)试剂配制1、考马斯亮蓝G250溶液配制准确称取0.1 g考马斯亮蓝G250,溶于50mL 95%乙醇,加入100mL 85%磷酸,最后用蒸馏水稀释定容到1000mL。
备注:考马斯亮蓝G250溶液的用量100mL足够。
2、牛血清蛋白溶液配制准确称取50mg牛血清蛋白,加入0.526gNaCl,溶于少量蒸馏水中,然后稀释定容到500mL,配制成浓度为100 μg/mL的牛血清蛋白原液。
(二)标准曲线的制作1、取5-7支试管,分别准确配制不同浓度梯度的牛血清蛋白溶液(浓度控制在10~100μg/mL范围内)1mL,具体操作:取100-900 μl牛血清蛋白原液,水补足到1 mL,浓度相当于所取原液量的十分之一;2、在不同浓度的1mL牛血清蛋白溶液中,分别加入5mL考马斯亮蓝溶液,混合均匀,置于25℃水浴保温10min;3、以1mL蒸馏水加5mL考马斯亮蓝溶液为空白对照,冷却后测定波长595nm处的吸光值;4、以配制的标准蛋白浓度为横坐标,对应吸光值为纵坐标制作标准曲线,并做线性回归分析,求线性方程。
(三)目标样品的蛋白浓度测定取目标蛋白样品按标准曲线方法测定A595。
依据线性方程计算目标样品的蛋白质浓度。
五、注意事项1、染料-蛋白复合物形成受温度和时间影响较大,反应需控制在同一条件下进行。
2、比色杯易受蓝色污染,应注意用乙醇清洗。



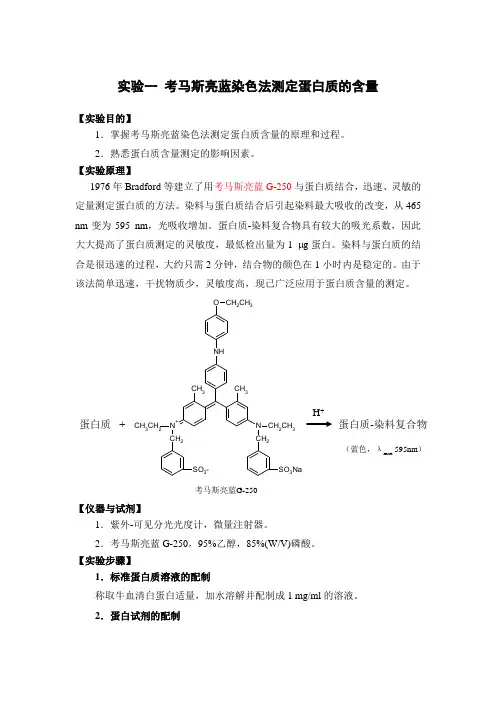
实验一 考马斯亮蓝染色法测定蛋白质的含量【实验目的】1.掌握考马斯亮蓝染色法测定蛋白质含量的原理和过程。
2.熟悉蛋白质含量测定的影响因素。
【实验原理】1976年Bradford 等建立了用考马斯亮蓝G-250与蛋白质结合,迅速、灵敏的定量测定蛋白质的方法。
染料与蛋白质结合后引起染料最大吸收的改变,从465 nm 变为595 nm ,光吸收增加。
蛋白质-染料复合物具有较大的吸光系数,因此大大提高了蛋白质测定的灵敏度,最低检出量为1 g 蛋白。
染料与蛋白质的结合是很迅速的过程,大约只需2分钟,结合物的颜色在1小时内是稳定的。
由于该法简单迅速,干扰物质少,灵敏度高,现已广泛应用于蛋白质含量的测定。
N CH 2CH 3CH 2N +CH 3CH 2CH 2NHCH 3CH 3O CH 2CH 3SO 3-SO 3Na蛋白质+ 蛋白质-染料复合物H +考马斯亮蓝G-250(蓝色,λmax595nm )【仪器与试剂】1.紫外-可见分光光度计,微量注射器。
2.考马斯亮蓝G-250,95%乙醇,85%(W/V)磷酸。
【实验步骤】1.标准蛋白质溶液的配制称取牛血清白蛋白适量,加水溶解并配制成1 mg/ml 的溶液。
2.蛋白试剂的配制称取100 mg考马斯亮蓝G-250,加入95%乙醇50 ml溶解,再加入85%(W/V)磷酸100 ml,将溶液用水稀释至1000 ml。
试剂的终浓度为0.01%考马斯亮蓝G-250,4.7%乙醇和8.5%(W/V)磷酸。
3.标准曲线的制作取标准蛋白质溶液5、10、20、50、100 μl于小试管中,用水稀释至0.1 ml,然后分别加入5 ml蛋白试剂,充分振荡混合,2分钟后于595 nm测定其吸光度值。
以0.1 ml水及5 ml蛋白试剂作为空白对照。
以蛋白浓度为横坐标,吸光度值为纵坐标,绘制标准曲线作为定量依据。
4.样品测定取含10~100 μg蛋白质溶液于小试管中,加水稀释至0.1 ml,然后加入5 ml 蛋白试剂,充分振荡混合,2分钟后于595 nm测定其吸光度值。

考马斯亮蓝法测蛋白含量测定试剂盒说明书分光光度法50管/48样注意:正式测定之前选择2-3个预期差异大的样本做预测定。
测定意义:样品可溶性蛋白质含量常常用于酶活性计算。
此外,可溶性蛋白质含量也用于食品等质量分析。
测定原理:在酸性溶液中,考马斯亮蓝G-250与蛋白质结合形成蓝色复合物;该复合物在620nm处有最大吸收峰,其颜色的深浅与蛋白质的浓度成正比。
该方法灵敏度高,适合微量蛋白质分析。
自备仪器和用品:离心机、分光光度计、石英比色皿、移液器和蒸馏水。
试剂组成和配制:试剂一:液体30 mL×1瓶,4℃保存。
样品中可溶性蛋白质提取:1. 液体样品:澄清液体样品可以直接测定。
2. 组织样品:按照组织质量(g):提取液体积(mL)为1:20的比例(建议称取约0.05 g组织,加入1mL提取液(自备,根据需要选用酶提取缓冲液或者蒸馏水或者生理盐水))冰浴匀浆,8000g,4℃离心10min,取上清,即待测液。
(动物样品常常需要稀释)3. 细菌、真菌:按照细胞数量(104个):提取液体积(mL)为500~1000:1的比例(建议500万细胞加入1mL提取液),冰浴超声波破碎细胞(功率300w,超声3秒,间隔7秒,总时间3min);然后8000g,4℃,离心10min,取上清置于冰上待测。
测定操作:1. 分光光度计预热30 min,蒸馏水调零。
2. 在石英比色皿中加入:试剂(μL)测定管空白管样本500蒸馏水500试剂一500 500混匀后,测定波长620 nm吸光值,△A=A测定-A空白。
注意:空白管只需要测定一次。
计算公式:标准曲线:y = 14.253x - 0.0007 R2 = 0.9997 x: 蛋白标准品浓度(mg/mL)y: 吸光值差值1.按液体样本体积计算:Cpr(mg/mL)=(△A+0.0007)÷14.253=0.07×(△A+0.0007)2.按组织样本质量计算:Cpr(mg/g)=(△A+0.0007)÷14.253×V总÷W=0.07×(△A+0.0007)÷WV总:提取液体积,1 mL; W:样本质量,g。

考马斯亮蓝测蛋白实验报告Document serial number【UU89WT-UU98YT-UU8CB-UUUT-UUT108】实验二:分光光度计的学习之考马斯亮蓝G-250法(Bradford法)测定蛋白质含量定一实验目的学习分光光度计的基本原理和使用方法,并使用考马斯亮蓝G-250法测定蛋白质含量。
二实验原理考马斯亮蓝G-250(Coomassie brilliant blue G-250)测定蛋白质含量属于染料结合法的一种。
考马斯亮蓝G-250 在游离状态下呈红色,最大光吸收在488nm;当它与蛋白质结合后变为青色,蛋白质-色素结合物在595nm 波长下有最大光吸收。
其光吸收值与蛋白质含量成正比,因此可用于蛋白质的定量测定。
蛋白质与考马斯亮蓝G-250 结合在2min 左右的时间内达到平衡,完成反应十分迅速;其结合物在室温下1h 内保持稳定。
该法是1976年Bradford 建立,试剂配制简单,操作简便快捷,反应非常灵敏,灵敏度比Lowry 法还高4 倍,可测定微克级蛋白质含量,测定蛋白质浓度范围为0~1 000μg/mL,是一种常用的微量蛋白质快速测定方法。
三实验材料1. 实验材料:未知浓度的牛血清样品2. 主要仪器:试管、移液枪、分光光度计等。
3. 试剂:蛋白试剂考马斯亮蓝G-250 的配制:称取100mg 考马斯亮蓝G-250,溶于50mL90%乙醇中,加入85%(W/V)的磷酸100mL,最后用蒸馏水定容到1 000mL。
此溶液在常温下可放置一个月。
四实验步骤标准曲线制作:取6 支10mL 干净的试管,按表1 取样。
摇匀后放置2min ,用1cm 光经的比色杯在595nm 波长下比色,记录测定的光密度OD595nm,并做标准曲线。
表1 低浓度标准曲线制作上图数据标准曲线如下:拟合标准方程:y=+2.未知蛋白质浓度的测定另取2 支10mL 试管,按下表取样。
吸取测定液,蒸馏水 mL放入试管中,加入5mL 考马斯亮蓝G-250 蛋白试剂,充分混合,放置2min 后用1cm 光径比色杯在595nm 下比色,记录光密度OD595nm,并通过标准曲线查得待测品提取液中蛋白质的含量X(μg)。
实验一 考马斯亮蓝染色法测定蛋白质的含量【实验目的】1.掌握考马斯亮蓝染色法测定蛋白质含量的原理和过程。
2.熟悉蛋白质含量测定的影响因素。
【实验原理】1976年Bradford 等建立了用考马斯亮蓝G-250与蛋白质结合,迅速、灵敏的定量测定蛋白质的方法。
染料与蛋白质结合后引起染料最大吸收的改变,从465 nm 变为595 nm ,光吸收增加。
蛋白质-染料复合物具有较大的吸光系数,因此大大提高了蛋白质测定的灵敏度,最低检出量为1 g 蛋白。
染料与蛋白质的结合是很迅速的过程,大约只需2分钟,结合物的颜色在1小时内是稳定的。
由于该法简单迅速,干扰物质少,灵敏度高,现已广泛应用于蛋白质含量的测定。
N CH 2CH 3CH 2N +CH 3CH 2CH 2NHCH 3CH 3O CH 2CH 3SO 3-SO 3Na蛋白质+ 蛋白质-染料复合物H +考马斯亮蓝G-250(蓝色,λmax595nm )【仪器与试剂】1.紫外-可见分光光度计,微量注射器。
2.考马斯亮蓝G-250,95%乙醇,85%(W/V)磷酸。
【实验步骤】1.标准蛋白质溶液的配制称取牛血清白蛋白适量,加水溶解并配制成1 mg/ml 的溶液。
2.蛋白试剂的配制称取100 mg考马斯亮蓝G-250,加入95%乙醇50 ml溶解,再加入85%(W/V)磷酸100 ml,将溶液用水稀释至1000 ml。
试剂的终浓度为0.01%考马斯亮蓝G-250,4.7%乙醇和8.5%(W/V)磷酸。
3.标准曲线的制作取标准蛋白质溶液5、10、20、50、100 μl于小试管中,用水稀释至0.1 ml,然后分别加入5 ml蛋白试剂,充分振荡混合,2分钟后于595 nm测定其吸光度值。
以0.1 ml水及5 ml蛋白试剂作为空白对照。
以蛋白浓度为横坐标,吸光度值为纵坐标,绘制标准曲线作为定量依据。
4.样品测定取含10~100 μg蛋白质溶液于小试管中,加水稀释至0.1 ml,然后加入5 ml 蛋白试剂,充分振荡混合,2分钟后于595 nm测定其吸光度值。
考马斯亮蓝法测定蛋白质含量一,原理1、考马斯亮蓝G-250染料,在酸性溶液中与蛋白质结合,使染料最大吸收峰位置由465nm变为595nm,溶液的颜色也由棕黑色变为亮兰色.染料主要是与蛋白质中碱性氨基酸和芳香族氨基酸残基结合.2、蛋白质-染料复合物在595nm下测定的吸光度与蛋白质的浓度成正比.二,Bradford法优点1)灵敏度高其最低检测蛋白质含量可达1ug/mL,这是因为蛋白质与染料相结合后产生的颜色变化很大,蛋白质-染料复合物有更高的吸光系数,因而光吸收值随蛋白质浓度的变化要比其它方法大得多。
2)测定快速、简洁只需要加一种试剂;完成一个样品的测定,只需要5分钟左右。
染料与蛋白质结合的过程大约只要2分钟即可完成,其颜色可以在1小时内保持稳定,且在5分钟至20分钟之间颜色的稳定性最好。
3)干扰物质少一些阳离子如K+、Mg2+、Na+和硫酸铵等不干扰测定。
干扰物质:去污剂SDS、TritonX-100三,Bradford法缺点(1)由于各种蛋白质中的碱性氨基酸(特别是精氨酸)和芳香族氨基酸的含量不同,因此Bradford 法用于不同蛋白质时有较大的偏差.(2)仍有一些物质干扰此法的测定,主要的干扰物质有去污剂等.(3)标准曲线也有轻微的非线形,因而不能用比尔定律进行计算,只能用标准曲线来测定未知蛋白质的浓度.四,试剂与器材1.试剂(1)标准蛋白质溶液,用牛血清蛋白配制成0.1mg/ml。
(2)考马斯亮兰G-250染料试剂:称100mg考马斯亮兰G-250,溶于50ml 95%的乙醇后,再加入120ml85 %的磷酸,用水稀释至1L后过滤使用。
2.器材(1)可见光分光光度计(2)试管3,操作管号 0 1 2 3 4 5 6 7 8 9标准蛋白质 0 0.1 0.2 0.4 0.6 0.8 1.0(0.1mg/ml)未知蛋白质 0.2 0.4 0.6蒸馏水 1.0 0.9 0.8 0.6 0.4 0.2 0 0.8 0.6 0.4考马斯亮蓝 5.0 5.0 5.0 5.0 5.0 5.0 5.0 5.0 5.0 5.0充分混匀后,两分钟于595nm处比色。
考马斯亮蓝法测蛋白质含量实验报告考马斯亮蓝法(Bradford assay)是一种常用于测定蛋白质含量的实验方法。
本文将对考马斯亮蓝法进行详细介绍,并展示一个实验报告的范例。
1. 引言蛋白质是生命体中不可或缺的重要分子,因此准确测定蛋白质的含量对于生物学研究至关重要。
考马斯亮蓝法是一种常用的蛋白质测定方法,其原理基于蛋白质与考马斯亮蓝染料之间的非共价结合。
2. 实验目的本实验的目的是利用考马斯亮蓝法测定给定溶液中蛋白质的含量。
3. 实验步骤3.1 准备工作首先,准备好所需的试剂和设备,包括考马斯亮蓝试剂、蛋白质标准品、显微管、离心机等。
3.2 制备标准曲线按照给定的浓度,分别取一系列蛋白质标准品,加入不同的显微管中。
然后,加入适量的考马斯亮蓝试剂,充分混合。
将显微管放入离心机中离心,使液体沉淀。
离心后,取出显微管,观察颜色变化,并使用分光光度计测定吸光度。
3.3 测定待测样品将待测样品加入显微管中,加入适量的考马斯亮蓝试剂,充分混合。
然后,将显微管放入离心机中离心,使液体沉淀。
离心后,取出显微管,观察颜色变化,并使用分光光度计测定吸光度。
4. 结果与讨论通过测定标准曲线,我们可以得到各个蛋白质标准品的吸光度与浓度之间的关系。
利用这个关系,我们可以计算出待测样品中蛋白质的浓度。
在实验中,我们观察到显微管中的液体颜色会随着蛋白质浓度的增加而加深。
这是因为考马斯亮蓝染料与蛋白质发生非共价结合,形成复合物,使溶液变色。
吸光度的测定则是通过分光光度计来实现的。
需要注意的是,考马斯亮蓝法对于某些物质的干扰较大,因此在实验中应该选择适当的样品稀释倍数,以确保测定结果的准确性。
5. 结论通过考马斯亮蓝法,我们成功测定了给定溶液中蛋白质的含量,并得到了标准曲线。
通过标准曲线,我们可以计算出待测样品中蛋白质的浓度。
6. 结束语考马斯亮蓝法是一种简单、快速且准确的测定蛋白质含量的方法。
它被广泛应用于生物学研究和实验室工作中。
实验方案的制定(一)实验名称:蛋白质含量测定法——考马斯亮蓝法(二)实验时间:第14-15周(三)实验地点:生命科学学院实验楼307或其他实验室。
(四)实验人员:邓泰濠,何国杰,(五)实验目的:1.学习并掌握考马斯亮蓝法(Bradford法)测定蛋白质含量。
2.学会使用721或722型分光光度计(六)实验材料取材:燕塘牛奶仪器设备:100ul微量进样器,2个枪头,可见光分光光度计,1ml 移液管3支,2ml移液管2支,试管11支,25ml容量瓶1个,旋涡混合器离心机,1支5ml移液管,3个洗耳球主要试剂:燕塘牛奶,考马斯亮兰G—250染料试剂,无离子水考马斯亮兰G—250染料试剂:称100mg考马斯亮兰G—250,溶于50ml 95%的乙醇后,再加入120ml 85%的磷酸,用水稀释至1升.标准蛋白质溶液:牛血清白蛋白(BSA)(电泳纯)用0.15 mol•L-配制0.15mol/L NaCl,pH=7的磷酸缓冲液无离子水(七)实验方法:1、蛋白质标准曲线的制作2提取:将燕塘牛奶倒在25ml容量瓶中,摇匀。
3.按顺序滴加各途中溶液。
4..测量分光光度值;5..制作标准曲线(八)实验过程:(1)取BSA标准溶液(1mg/ml)各0、20、40、60、80、100ul于不同试管中(蛋白质含量分别为0、20、40、60、80、100ug),不足100ul的用0.15 mol•L-1 NaCl调至100ul。
于以上试管中加入5ml蛋白质试剂,混匀。
2min后各取2~3ml 于3ml比色杯中,以空白作为对照,用分光光度计测定595nm的吸收值。
管号空白 1 2 3 4 51mg/ml BSA(ul)0 20 40 60 80 100 0.15M NaCl (ul) 100 80 60 40 20 0总体积(ul)100 100 100 100 100 100相当蛋白质含量(ug) 0 20 40 60 80 100 G-250(ml) 5 5 5 5 5 5 OD595(2)取8支试管,1支作空白,3支留作未知样品,其余试管分为两组按表中顺序,分别加入样品、水和试剂,用蛋白质溶液给各试管分别加入:0、0.2、0.6、0.8、1ml,然后用无离子水补充到2ml。
考马斯亮蓝法测蛋白质含量的流程下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!利用考马斯亮蓝法测定蛋白质含量的流程及操作步骤摘要:本文将介绍如何利用考马斯亮蓝法(Bradford法)测定蛋白质含量的详细流程及操作步骤。