高考化学试题 广东化学
- 格式:docx
- 大小:37.56 KB
- 文档页数:4


广东省2024届高三下学期高考化学仿真模拟试题全卷共8页,20题。
全卷满分100分,考试用时75分钟可能用到的原子量:H1 Li7 C 12 O 16 K 39 Co 59一、选择题(本题共16小题,共44分。
第1~10小题,每小题2分;第11~16小题,每小题4分。
在每小题给出的四个选项中,只有一顼是符合题目要求。
)1.岭南文化源远流长,对社会的发展起着积极的推动作用。
下列地方文化涉及的材料主要成分不属于有机高分子化合物的是2.二十大报告提出科技创新是赢得未来发展主动权的必然选择。
下列说法错误的是A.“天和号”推进器上的氮化硼陶瓷属于有机高分子材料B.量子通信材料螺旋碳纳米管和石墨烯互为同素异形体C.“天宫”空间站中太空机械臂的主要成分为铝合金,其强度大于纯铝D.中国研制的微纳米光刻机,其材料之—四甲基氢氧化铵[(CH3)4NOH]可溶于水3.广东作为工业强省,是国内较早发展工业旅游的地区。
下列说法正确的的是A.罗浮山豆腐花现代全自动制作工艺——蛋白质溶液中加入石膏可发生变性B.东莞稻作智造之旅——水稻中的核酸可以水解为核苷和磷酸C.茂名油城之旅——石油的分馏、石油裂化均为物理变化D.广州药醉之旅——中医之米酒酿制过程涉及淀粉和葡萄糖的水解4.化学改善人类的生活,创造美好的世界。
下列生产生活情境中的化学原理正确的是选项生产生活情境化学原理A用洁厕灵(主要含浓盐酸)清洗马桶含氯化合物具有杀菌消毒功能B用铝槽运输浓硝酸浓硝酸与Al不反应C用FeCl3溶液腐蚀Cu刻制印刷电路板Fe比Cu金属性强D用聚乳酸塑料替代传统塑料以减少白色污染聚乳酸具有生物可降解性O82-+2I-2SO42-+I2,向溶液中5.水溶液中,过二硫酸盐与碘离子反应的离子方程式为:S加入含Fe3+的溶液,反应机理如图所示。
下列有关该反应的说法不正确的是A.向反应后的溶液滴加淀粉溶液,溶液变蓝,再适当升温,蓝色变浅B.Fe3+是该反应的催化剂,加入Fe3+后反应体系更快达到平衡C.反应①的速率比反应②的速率快D.反应②的离子方程式为2Fe2++ S2O82-2Fe3++2SO42-6.百服宁口服液为解热镇痛药,其主要化学成分的结构简式如图所示,下列有关该有机化合物的叙述正确的是H8NO2A.分子式为CB.碳原子杂化轨道类型只有sp2杂化C.1 mol该有机物最多与2 mol NaOH反应D.能发生氧化、还原、水解、消去反应7.设N A为阿伏加德罗常数的值。


广东省惠州市2024年高考化学模拟试题1.下列邮票内容所涉及的主要物质,属于无机化合物的是A.A B.B C.C D.D2.孔雀石古称石绿,是铜的表生矿物[化学式[Cu(OH)2⋅CuCO3],“水色”从植物中提取,如花青(分子式C15H11O6)。
下列说法错误的是A.“石绿”耐酸、耐碱B.Cu(OH)2⋅CuCO3属于纯净物C.保存不善的国画,“水色”容易变色D.从蓝草中提取花青,可用有机溶剂萃取3.下列文物修复和保护的过程中涉及化学变化的是A.A B.B C.C D.D4.下列有关化学用语的表述正确的是A.乙烯的结构简式:CH2CH2B.乙酸的分子式:CH3COOHC.铝离子的结构示意图:D .OH −的电子式:[:O ····:H]−5.为检验下列久置于空气中的物质是否变质,所选检验试剂(括号内)能达到目的的是A .新制氯水(AgNO 3溶液)B .FeCl 2溶液(KSCN 溶液)C .漂白粉(Na 2CO 3溶液)D .Na 2SO 3溶液(BaCl 2溶液)6.勤劳致富,越努力越幸福。
下列劳动项目与所述的化学知识没有关联的是A .AB .BC .CD .D7.X 、Y 、Z 、W 为短周期元素,它们在周期表的位置如图所示,Y 原子的最外层电子数是次外层电子数的3倍。
下列说法中正确的是A .X 的单质中σ键和π键个数之比为1∶1B .Y 和Z 只能组成一种化合物C .Z 的氧化物的晶体属于分子晶体D .最高价氧化物对应水化物的酸性:Z>W8.下列有关实验操作正确的是A .点燃酒精灯B .称量10.05g 固体C .检查容量瓶是否漏水D.稀释浓硫酸9.设N A为阿伏加德罗常数的值。
下列说法正确的是A.0.1molNa2O2固体中含有的离子数目为0.3N AB.标况下4.48LCH3OH所含的分子数为0.2N AC.一定条件下,0.5molSO2与足量的O2反应,转移的电子数为N AD.1L0.1mol⋅L−1Na2SO4溶液中含有的氧原子数为0.4N A10.下列有关微粒性质的排列顺序中,错误的是A.元素的电负性:P<O<FB.元素的第一电离能:C<N<OC.离子半径:O2−>Na+>Mg2+D.原子的未成对电子数:P>S>Cl11.水合肼(N2H4·H2O)为无色透明的油状发烟液体,是一种重要的精细化工原料,其制备的反应原理为NaClO +2NH3=N2H4·H2O+NaCl。

广东省2019年高考化学试题及答案(满分50分,考试时间100分钟)可能用到的相对原子质量:H 1 C 12 N 14 O 16 Mg 24 S 32 Fe 56 Cu 64一、选择题:本题共7个小题,每小题6分。
共42分,在每小题给出的四个选项中,只有一项是符合题目要求的。
1.陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。
下列说法错误的是A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点2.关于化合物2−苯基丙烯(),下列说法正确的是A.不能使稀高锰酸钾溶液褪色 B.可以发生加成聚合反应C.分子中所有原子共平面 D.易溶于水及甲苯3.实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是A.向圆底烧瓶中滴加苯和溴的混合液前需先打开KB.实验中装置b中的液体逐渐变为浅红色C.装置c中的碳酸钠溶液的作用是吸收溴化氢D.反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯4.固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。
下图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图。
下列叙述错误的是A.冰表面第一层中,HCl以分子形式存在B.冰表面第二层中,H+浓度为5×10−3 mol·L−1(设冰的密度为0.9 g·cm−3)C.冰表面第三层中,冰的氢键网络结构保持不变D.冰表面各层之间,均存在可逆反应HClH++Cl−5.NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的K a1=1.1×10−3 ,K a2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。
下列叙述错误的是A.混合溶液的导电能力与离子浓度和种类有关B.Na+与A2−的导电能力之和大于HA−的C.b点的混合溶液pH=7D.c点的混合溶液中,c(Na+)>c(K+)>c(OH−)6.利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。
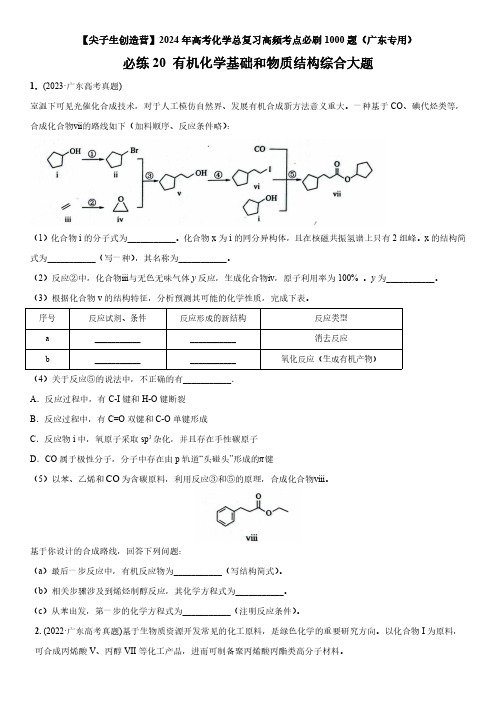
【尖子生创造营】2024年高考化学总复习高频考点必刷1000题(广东专用)必练20有机化学基础和物质结构综合大题1.(2023·广东高考真题)室温下可见光催化合成技术,对于人工模仿自然界、发展有机合成新方法意义重大。
一种基于CO、碘代烃类等,合成化合物ⅶ的路线如下(加料顺序、反应条件略):(1)化合物i的分子式为___________。
化合物x为i的同分异构体,且在核磁共振氢谱上只有2组峰。
x的结构简式为___________(写一种),其名称为___________。
(2)反应②中,化合物ⅲ与无色无味气体y反应,生成化合物ⅳ,原子利用率为100%。
y为___________。
(3)根据化合物v的结构特征,分析预测其可能的化学性质,完成下表。
序号反应试剂、条件反应形成的新结构反应类型a______________________消去反应b______________________氧化反应(生成有机产物)(4)关于反应⑤的说法中,不正确的有___________.A.反应过程中,有C-I键和H-O键断裂B.反应过程中,有C=O双键和C-O单键形成C.反应物i中,氧原子采取sp3杂化,并且存在手性碳原子D.CO属于极性分子,分子中存在由p轨道“头碰头”形成的键(5)以苯、乙烯和CO为含碳原料,利用反应③和⑤的原理,合成化合物ⅷ。
基于你设计的合成路线,回答下列问题:(a)最后一步反应中,有机反应物为___________(写结构简式)。
(b)相关步骤涉及到烯烃制醇反应,其化学方程式为___________。
(c)从苯出发,第一步的化学方程式为___________(注明反应条件)。
2.(2022·广东高考真题)基于生物质资源开发常见的化工原料,是绿色化学的重要研究方向。
以化合物I为原料,可合成丙烯酸V、丙醇VII等化工产品,进而可制备聚丙烯酸丙酯类高分子材料。
(1)化合物I 的分子式为_______,其环上的取代基是_______(写名称)。
2023年广东省佛山市高考化学质检试卷一、单选题(本大题共12小题,共36.0分)1.中国文物具有鲜明的时代特征。
下列文物的主要成分不属于硅酸盐的是()A.新石器时代红陶兽形器B.北燕鸭形玻璃柱 C.明象牙雕佛坐像D.清五彩花卉瓷盖碗A. B.C.D.2.工业制备硫酸可通过反应制得。
下列说法正确的是()A.的电子数为B.的电子式为C.属于离子化合物,仅含离子键D.的空间填充模型为3.实验室模拟侯氏制碱法的装置如图所示,其中正确且能达到目的的是()A.制备B.制备C.加热固体D.检测产品中是否含有A. B. C. D.4.连花清瘟胶囊的有效成分大黄素的结构如图所示,该成分有很强的抗炎抗菌药理活性,关于大黄素的说法正确的是()A.分子式为B.分子中所有原子可能共平面C.该物质最多能与氢氧化钠反应D.可以发生氧化、取代、加成反应5.连花清瘟胶囊的有效成分大黄素的结构如图所示,该成分有很强的抗炎抗菌药理活性,基于结构视角,下列说法正确的是()A.该分子中碳原子的杂化类型均为B.分子中所含元素的电负性C.基态氧原子核外电子的空间运动状态有种D.该分子为非极性分子6.碳酸盐约占海水盐分的,一种海水脱硫的新工艺如图所示。
下列说法错误的是()A.排入大气易引起酸雨B.海水吸收二氧化硫时可能有逸出C.处理后的海水增大D.海水脱硫工艺简单,投资及运行费用低7.食醋有效成分主要为醋酸用表示,常温下的。
下列说法错误的是()选实验操作结论项溶液的导电能力、的电离程度均增大常温下测得水溶液溶于水不发生水解加入溶液与醋酸溶液恰好中和中和后:常温下,溶液与溶液混合,测得溶液反应后:A. B. C. D.8.下列反应的离子方程式正确的是()A.向溶液中滴加溶液:B.向中投入固体:C.向溶液通入:D.用醋酸溶解石灰石:9.化学是以实验为基础的学科。
下列实验操作能达到对应目的的是()选项实验操作目的乙醇与浓硫酸混合迅速加热到制备乙烯分别测定饱和、溶液的比较、的酸性铁锈溶于稀盐酸,再滴加酸性高锰酸钾溶液检验铁锈中是否含溶液中依次滴加过量氯水、淀粉溶液比较、、氧化性A. B. C. D.10.、、为短周期元素且原子序数依次增大,其中、为同一周期元素,为周期表中电负性最强的元素,三者可以形成配合物。
2002年高考广东化学试题和参考答案第Ⅰ卷(选择题共60分)可能用到的原子量:H 1 C 12 N 14 O 16 Na 23 K 39一.选择题(本题包括5小题,每小题4分,共20分。
每小题只有一个选项符合题意。
)1.目前我国许多城市和地区定期公布空气质量报告,在空气质量报告中,一般不涉及A SO2B NO2C CO2D 可吸入颗粒物2.为了除去蛋白质溶液中混入的少量氯化钠,可以采用的方法是A过滤 B 电泳 C 渗析 D 加入AgNO3溶液,过滤3.铁屑溶于过量的稀硫酸,过滤后向滤液中加入适量硝酸,再加入过量的氨水,有红褐色沉淀生成。
过滤,加热沉淀物至质量不再发生变化,得到红棕色的残渣。
上述沉淀和残渣分别为A Fe(OH)3;Fe2O3B Fe(OH)2;FeOC Fe(OH)2、Fe(OH)3;Fe3O4D Fe2O3;Fe(OH)34.六氯苯是被联合国有关公约禁止或限制使用的有毒物质之一。
下式中能表示六氯苯的是ABCD5.R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应;X2++Z=X+Z2+;Y+Z2+=Y2++Z。
这四种离子被还原成0价时表现的氧化性大小符合A R2+>X2+>Z2+>Y2+B X2+>R2+>Y2+>Z2+C Y2+>Z2+>R2+>X2+D Z2+>X2+>R2+>Y2+参考答案:1.C 2.C 3.A 4.D 5.A二.选择题(本题包括10小题,每小题4分,共40分。
每小题有一个或两个选项符合题意。
若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项。
只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。
)6.室温时,0.01 mol·L-1某一元弱酸的电离度为1%,则下列说法正确的是A上述弱酸溶液的pH=4B 加入等体积0.01 mol·L-1 NaOH溶液后,所得溶液的pH=7C 加入等体积0.01 mol·L-1 NaOH溶液后,所得溶液的pH>7D 加入等体积0.01 mol·L-1 NaOH溶液后,所得溶液的pH<77.周期表中16号元素和4号元素的原子相比较,前者的下列数据是后者的4倍的是A电子数 B 最外层电子数 C 电子层数 D 次外层电子数8.将40 mL 1.5 mol·L-1的CuSO4溶液与30 mL 3 mol·L-1的NaOH溶液混合,生成浅蓝色沉淀,假如溶液中[Cu2+]或[OH-]都已变得很小,可忽略,则生成沉淀的组成可表示为A Cu(OH)2B CuSO4·Cu(OH)2C CuSO4·2Cu(OH)2D CuSO4·3Cu(OH)29.下列离子方程式书写正确的是A碳酸氢钙溶液中加入过量的氢氧化钠溶液:HCO3-+OH-=CO32-+H2OB 氯化铁溶液中通入硫化氢气体:2Fe3++S2-=2Fe2++S↓C 次氯酸钙溶液中通人过量二氧化碳Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClOD 氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑10.在原电池和电解池的电极上所发生的反应,同属氧化反应或同属还原反应的是A原电池的正极和电解池的阳极所发生的反应B 原电池的正极和电解池的阴极所发生的反应C 原电池的负极和电解池的阳极所发生的反应D 原电池的负极和电解池的阴极所发生的反应11.在一定温度下,向a L密闭容器中加入1mol X气体和2 mol Y气体,发生如下反应:X(g)+2Y(g)2Z(g)此反应达到平衡的标志是A容器内压强不随时间变化B 容器内各物质的浓度不随时间变化C 容器内X、Y、Z的浓度之比为1︰2︰2D 单位时间消耗0.1mol X同时生成0.2mol Z12.在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气,当制得同温、同压下相同体积的氧气时,三个反应中转移的电子数之比为A1︰1︰1 B 2︰2︰1 C 2︰3︰1 D 4︰3︰213.1mol某烃在氧气中充分燃烧,需要消耗氧气179.2 L(标准状况下)。
高考化学试题广东化学
一、选择题
(本题共5分,每小题1分)
1. 下列哪个金属元素在常温下是液体?
A. 铅
B. 铝
C. 汞
D. 铁
2. 以下哪个气体不属于惰性气体?
A. 氩
B. 氮
C. 氢
D. 氖
3. 当硝酸和氢氧化钠溶液混合时,生成的产物是:
A. 氯化钠和水
B. 亚氯酸钠和水
C. 硫酸钠和水
D. 氯酸钠和水
4. 水的共轭酸是:
A. H2SO4
B. H3O+
C. OH-
D. H2O
5. 下列有关化学反应方程式的正确描述是:
A. 反应物在方程式中写在箭头的右边,生成物在箭头的左边
B. 反应物在方程式中写在箭头的左边,生成物在箭头的右边
C. 方程式中的物质越多越好
D. 方程式中不能使用括号
二、填空题
(本题共10分,每小题2分)
6. 原子序数为24的金属元素是__________。
7. 化学式NaCl表示含有1个钠离子和__________个氯离子。
8. 氨气(NH3)分子中的氢原子是__________。
9. 氧化反应是指物质与__________之间的反应。
10. 单质是由同种____________组成的物质。
三、简答题
(本题共25分)
11. 请简要描述电解质和非电解质的区别。
12. 请解释化学键的形成原理,并举一个例子说明。
13. 请解释物质的宏观性质和微观性质,并列举一个例子说明。
14. 请解释酸和碱的性质、颜色以及酸碱指示剂的作用原理。
15. 请解释气体的压力和压强之间的关系,并解释气体的压强如何影响化学反应。
四、解答题
请回答下面的问题(本题共40分,每个问题10分)
16. 请用化学方程式表示下列反应:
铝与氧气反应生成氧化铝。
17. 请用化学方程式表示下列反应:
氨与盐酸反应生成氯化铵。
18. 请说明质量守恒定律,并用一个活动组合反应的例子进行解释。
19. 请定义物质的密度,并解释它的计算公式。
20. 简要说明电解的原理,并提供一个实际应用的例子。
五、分析题
请分析下列化学方程式,并回答问题。
(本题共20分,每小题5分)
21. 化学方程式:2H2 + O2 → 2H2O
a) 请说明该方程式中的反应物和生成物分别是什么?
b) 请写出该方程式中适当的化学反应条件。
c) 根据该方程式,能否判断该反应是放热反应还是吸热反应?请解
释原因。
d) 请简要解释该反应的平衡原理。
22. 化学方程式:2Na + Cl2 → 2NaCl
a) 请说明该方程式中的反应物和生成物分别是什么?
b) 请写出该方程式中适当的化学反应条件。
c) 根据该方程式,能否判断该反应是放热反应还是吸热反应?请解释原因。
d) 请简要解释该反应的平衡原理。
六、实验题
请设计一个简单的实验,测试一种物质的酸碱性质。
请描述实验步骤,并解释实验结果。
(本题共20分)
七、综合题
请根据广东化学选修教材的相关内容,回答以下问题。
(本题共30分,每小题10分)
23. 请列举至少3种可以生产氢气的方法,并简要解释每种方法的原理。
24. 请解释酸溶液的酸度如何进行测定,并提供一个具体的实验方法。
25. 请解释混合物和化合物的区别,并提供一个具体的实验方法来鉴别它们。
总结:本试题内容涵盖了高考化学的多个知识点,包括选择题、填空题、简答题、解答题、分析题、实验题和综合题。
希望对广东化学的复习和备考有所帮助。