蛋白酪氨酸激酶简介
- 格式:doc
- 大小:22.00 KB
- 文档页数:1

蛋白酪氨酸激酶酪氨酸酶蛋白酪氨酸激酶和酪氨酸酶是两类重要的蛋白质调节因子,它们在细胞的信号转导过程中扮演着重要的角色。
本文将对这两类蛋白质的结构、功能以及其在生理和病理过程中的作用进行探讨。
一、蛋白酪氨酸激酶蛋白酪氨酸激酶(protein tyrosine kinase,PTK)是一类主要负责磷酸化酪氨酸残基的酶。
它们是一种膜相关或可逆性质的酵素,在多个细胞信号转导通路中发挥着重要的调节作用。
1. 结构特征蛋白酪氨酸激酶有多种结构,基本上都是由膜结合域、负载域、催化域以及调控结构域组成。
其中催化域是最重要的结构,它由300个氨基酸缀合而成,具有保守的核心酶活性结构。
2. 功能特征蛋白酪氨酸激酶的功能主要是磷酸化酪氨酸残基,并发挥调节作用,从而影响多个细胞信号转导通路。
如PTK 参与调节细胞增殖、分化、凋亡、分泌等生理调节过程。
3. 生理和病理作用蛋白酪氨酸激酶在细胞增殖、分化等生理过程中具有积极的作用,但当PTK在恶性肿瘤等病理过程中异常激活时,就会诱导癌细胞生长、分化,从而促进肿瘤的发展。
此外,一些致病性细菌和病毒也能通过干扰PTK活性来引起脱落的细胞增殖、炎症反应的激活等。
二、酪氨酸酶酪氨酸酶(Tyrosine phosphatase,PTP)是一类可以选择性地去磷酸化酪氨酸残基的酶类,主要通过神经系统的信号转导链路来调控细胞内的生物过程。
1. 结构特征酪氨酸酶结构由几个反应中具有活性的序列域组成,包括催化域(Cys-X(5)-Arg或Cys-X(3)-Cys)和配体结合域。
其中催化域的含硫的半胱氨酸(Cys)残基与底物酪氨酸残基反应,从而实现去除底物酪氨酸残基上的磷酸基团。
2. 功能特征酪氨酸酶的主要功能是去除酪氨酸残基上的磷酸基团,并对多个细胞信号转导通路的调节发挥重要作用。
3. 生理和病理作用酪氨酸酶可以对与不同类型的细胞信号转导相关的酪氨酸激酶降解。
在有些肿瘤细胞中,酪氨酸酶的表达水平降低,从而不能去除酪氨酸酶相关的活性激酶上的磷酸基团,导致磷酸化的酪氨酸激酶异常激活,从而引起了癌症的发生、发展。
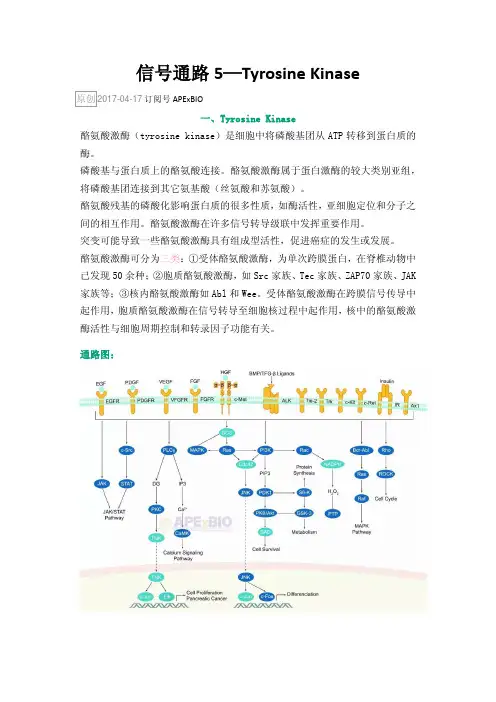
信号通路5—Tyrosine KinaseAPExBIO一、Tyrosine Kinase酪氨酸激酶(tyrosine kinase)是细胞中将磷酸基团从ATP转移到蛋白质的酶。
磷酸基与蛋白质上的酪氨酸连接。
酪氨酸激酶属于蛋白激酶的较大类别亚组,将磷酸基团连接到其它氨基酸(丝氨酸和苏氨酸)。
酪氨酸残基的磷酸化影响蛋白质的很多性质,如酶活性,亚细胞定位和分子之间的相互作用。
酪氨酸激酶在许多信号转导级联中发挥重要作用。
突变可能导致一些酪氨酸激酶具有组成型活性,促进癌症的发生或发展。
酪氨酸激酶可分为三类:①受体酪氨酸激酶,为单次跨膜蛋白,在脊椎动物中已发现50余种;②胞质酪氨酸激酶,如Src家族、Tec家族、ZAP70家族、JAK 家族等;③核内酪氨酸激酶如Abl和Wee。
受体酪氨酸激酶在跨膜信号传导中起作用,胞质酪氨酸激酶在信号转导至细胞核过程中起作用,核中的酪氨酸激酶活性与细胞周期控制和转录因子功能有关。
通路图:二、相关蛋白或基因1. Bcl-AblBcl-Abl是组成型激活的嵌合酪氨酸激酶。
Bcr-Abl酪氨酸激酶失活导致慢性粒细胞白血病(CML)。
Bcr-Abl酪氨酸激酶抑制剂用于大多数CML患者的一线治疗。
2. GSK-3Glycogen synthase kinase 3,糖原合成酶激酶3。
GSK-3是一种丝氨酸/苏氨酸激酶,主要作用是使糖原合成酶发生磷酸化而失活。
GSK-3基因家族包括GSK-3α和 GSK-3β。
胰岛素引起的Akt激活,上皮生长因子、血小板衍化生长因子等引起的Ras/Raf/ERK/p90Rsk1激活以及p90Rsk、P70S6K均能引起GSK-3α和 GSK-3β磷酸化使其失去活性,参与调节多种疾病的生理过程,包括II型糖尿病,阿尔茨海默病,炎症,癌症和双相情感障碍。
3. SykSpleen tyrosine kinase,脾脏酪氨酸激酶。
Syk是非受体细胞质酪氨酸激酶家族,在各种细胞表面受体(包括CD74,Fc受体和整合素)信号传导中起作用。


蛋白酪氨酸激酶综述目前至少已有近六十种分属20个家族的受体酪氨酸激酶被子识别。
所有受体酷氨酸激酶都属于I型膜蛋白,其分子具有相似的拓朴结构:糖基化的胞外配体结合区,疏水的单次跨膜区,以及胞内的酪氨酸激酶催化结构域及调控序列。
不同受体酪氨酸激酶结合,将导致受体发生三聚化,并进一步使受体胞内区特异的受体酪氨酸残基发生自身磷酸化或交叉磷酸化,从而激活下游的信号转导通路。
许多肿瘤的发生、发展都与酪氨酸激酶的异常表达有着极其密切的联系,下面将对几类与肿瘤的发生发展最为密切的受体酪氨酸激酶的研究迸展做一简介。
一、表皮生长因子受体(Epidermal grovth factor receptor, EGFR)家族EGFRPE包括EGFR、ErbB2、ErbB4等4个成员,其家族受体酪氨酸激酶(RTK)以单体形式存在,在结构上由胞外区、跨膜区、胞内区3个部分组成,胞外区具有2个半氨酸丰富区,胞内区有典型的ATP结合位点和酪氨酸激酶区,其酪氨酸激酶活性在调节细胞增殖及分化中起着至关重要的作用。
人的egfr基因定位于第7号染色体的短臂(7p12.3-p12.1),它编码的产物EGFR由1210个氨基酸组成,蛋白分子量约为170kDa,其中,712-979位属于酪氨酸激酶区。
EGFR的专一配体有EGF、TGF、amphiregulin,与其他EGFR家庭成员共有的配体有(cellulin(BTC)、heparin-bindingEGF(HB-EGF)、Epiregulin(EPR) )等。
EGFR在许多上皮业源的肿瘤细胞中表达,如非小细胞性肺癌,乳腺癌、头颈癌,膀胱癌,胃癌,前列腺癌,卵巢癌、胶质细胞瘤等。
另外,在一些肿瘤如恶性胶质瘤、非小细胞性肺癌、乳腺癌、儿童胶质瘤、成神经管细胞瘤及卵巢癌等中还可检测到EGFR缺失。
最为常见的EGFR缺失突变型是EGFRⅧ,EGFR Ⅷ失去了配体结合区,但是可自身活化酪氨酸激酶,刺激下游信号通路的激活,而不依赖于与其配全结合。



简述酪氨酸蛋白激酶的作用和有关信
号通路
酪氨酸蛋白激酶(Tyrosine protein kinase,TPK)是一类催化蛋白质酪氨酸残基磷酸化的酶,在细胞的生长、分化、增殖和凋亡等过程中起着重要的调节作用。
酪氨酸蛋白激酶的主要作用是通过将蛋白质上的酪氨酸残基磷酸化,从而改变蛋白质的结构和活性,影响其功能。
这种磷酸化修饰可以引发一系列的细胞内信号转导事件,进而调节细胞的行为。
与酪氨酸蛋白激酶相关的信号通路包括:
1. MAPK(丝裂原活化蛋白激酶)通路:这是一条重要的细胞增殖和分化信号通路,涉及到多种酪氨酸蛋白激酶的激活,如 ERK、JNK 和 p38。
2. PI3K(磷脂酰肌醇-3-激酶)通路:这条通路参与细胞的存活、增殖和代谢等过程,与 AKT 等酪氨酸蛋白激酶的激活有关。
3. STAT(信号转导和转录激活因子)通路:这是一条涉及细胞因子和生长因子信号转导的通路,通过酪氨酸蛋白激酶的激活,引发 STAT 家族蛋白的磷酸化和转录激活。
4. RTK(受体酪氨酸激酶)通路:这类通路通过细胞膜上的受体酪氨酸激酶与外部信号分子结合,引发细胞内的信号转导,调节细胞的生长、增殖和分化。
综上所述,酪氨酸蛋白激酶通过对蛋白质的酪氨酸残基进行磷酸化修饰,参与了众多细胞信号通路的调节,对细胞的生长、分化、代谢和免疫等过程具有重要的影响。



蛋白酪氨酸激酶(2)互作用。
CD4是分子量为55-60kDa的糖蛋白,以单体形式表达。
CD8是由二致辞体组成,有两种形式:一种是由两条α链(32-34kDa)组成的同源二聚体;另一种形式是由α链和β链(25-26kDa)组成的异源二聚体。
CD4和CD8分子中胞浆内部分子不具有激酶功能区,因此它们与受体酪氨酸激酶如EGF-R或PDGF-R无同源性。
目前已经证实CD4和C D8均与信号转导成份p56lckPTK相连接。
p56lck几乎在所有淋巴细胞中表达,包括全部成熟T细胞和胸腺细胞,提示它可能在T细胞活化和分化调节过程中起作用。
有关p56lck在T细胞活化信号中正调节作用的最初发现是p56lck直接同CD4或CD8复合受体分子胞浆内功能域相连接,在体外具有酪氨酸激酶活性,在体内,T细胞受到刺激后酪氨酸磷酸化水平增加。
即使在静止的鼠CD4-T细胞中也有大约50%细胞内p56lck是同CD4糖蛋白相连接。
图8-7 p56lck同CD4、CD8作用的模式图2.p56lck与CD4/CD8分子的连接p56lck同CD4/CD8相互作用的区域位于分子的氨基端的底物作用区(图8-7),此区域在src相关PTKs 中是独特的,含有4个半胱氨酸,这对于p56lck与CD4和CD8相互作用是必须的。
底物作用区中6个带负电荷的氨基酸可使p56lck与CD4/CD8结合位点内相对应的碱性氨基酸残基相结合。
在CD4和CD8α分子的胞浆内有一个含13个氨基酸的相似区域,经突变研究和肽竞争分析法证实此区域可能为p56lck结合区域。
CD4和CD8α含有两个对于p56lck结合起关键作用的半胱氨酸以及与p56lck氨基末端负电荷相互作用的5个带正电荷的氨基酸。
证实此区域中有6个氨基酸直接与p56lck结合有关,如果把这6个氨基酸残基从CD8α胞浆功能域转移到一个非相关蛋白水泡性口炎病毒糖蛋白(VSV-G)胞浆功能区域上,p56lck即可结合到这个杂交分子上去。
蛋白酪氨酸激酶在癌症发生和发展中的作用研究癌症一直是一个危害人类健康的巨大问题,对于癌症的研究一直是医学界的重中之重。
蛋白酪氨酸激酶(Protein tyrosine kinase,PTK)则是近些年来得到广泛研究的一种与癌症有关的基因家族。
这篇文章将探讨蛋白酪氨酸激酶在癌症发生和发展中的作用及其研究现状。
一、蛋白酪氨酸激酶的基本概念蛋白酪氨酸激酶是一类酶,在细胞内起到传递信号、调节生长和分化的作用。
它们属于酪氨酸激酶家族(tyrosine kinase family)中的一种。
酪氨酸激酶家族是一种庞大的酶家族,涉及到细胞的许多生物学过程,包括细胞分化、增殖和凋亡等。
这些过程对于正常的细胞生长和发育都起着至关重要的作用。
蛋白酪氨酸激酶是一种单体的酶,其结构包括氨基酸序列、催化区、连接区和再生化区。
它们可以在细胞膜上定位,或者在细胞质内构成复合物。
它们通过识别和磷酸化酪氨酸残基来传递信号。
二、蛋白酪氨酸激酶与肿瘤的联系研究表明,蛋白酪氨酸激酶在肿瘤的发生和发展中起到了至关重要的作用。
肿瘤细胞通常表现出异常的细胞生长和分化,往往伴随着PTK家族蛋白的异常表达和异常激活水平的升高。
这种异常表达和升高使得PTK家族蛋白参与了癌症细胞的增殖、转变和转移等过程,从而加速了癌症的发展。
比如,研究者们发现在多种癌症中的细胞内都存在着PTK家族蛋白异常表达的情况。
肝细胞癌和乳腺癌中表达激酶家族蛋白ERBB2的患者,生存时间的缩短非常明显。
而Bcr-Abl等蛋白激酶的异常表达,则与慢性髓系白血病、急性淋巴细胞白血病的发生和发展密切相关。
这些研究标志着我们在癌症治疗领域已经迈出了重要一步,因为每一种癌症都有其对应的蛋白酪氨酸激酶家族等肿瘤相关基因。
三、蛋白酪氨酸激酶在肿瘤治疗中的应用蛋白酪氨酸激酶在癌症治疗中的应用,可以通过靶向特定的激酶,抑制其活性来达到抑制癌症细胞增殖的目的。
例如赫赛汀和曲妥珠单抗IN1480等化学物质可以与肝肿瘤中的EGFR和VEGFR等多种酪氨酸激酶靶标发生结合,从而起到抑制癌症细胞增殖的作用。
蛋白酪氨酸磷酸酶蛋白酪氨酸磷酸酶(protein tyrosine phosphatase,PTP)是细胞增殖和信号传导的调节过程中,调节蛋白酪氨酸残基磷酸化水平的酶家族。
PTP 和蛋白酪氨酸激酶(protein tyrosine kinase,PTK)及其各自相应的底物协同作用,形成一个复杂的信号传导网络,通过调控蛋白氨基酸残基的磷酸化水平,调节生物体内细胞的生长、分化、代谢过程,参与细胞周期调控、细胞迁移、基因转录和免疫应答等过程。
目前的研究发现人类共有112 种PTPs,依据它们的结构分为酪氨酸特异性、双特异性和低分子量磷酸酶,其中蛋白酪氨酸磷酸酶-1B (Protein Tyrosine Phos-phatase-1B,PTP-1B)于1988 年由Tonks 等首次在人的胎盘细胞中分离和纯化得到,属于酪氨酸特异性磷酸酶,依据受体结构可分为受体样PTP-1B 和胞内PTP-1B。
PTP-1B 专一水解芳香族磷酸,由435 个氨基酸残基组成,分子量约50ku。
其结构中有一个氨基末端催化区和两个富含脯氨酸的模序。
PTP-1B 在肌肉、心、肝、睾丸、肾、脾、脑和脂肪等组织中广泛表达,主要集中在细胞浆的内质网的表面。
PTP-1B 的N 端为包含半胱氨酸和精氨酸残基的催化中心,朝向胞浆方向;C 端通过35 个特异性氨基酸与内质网相结合,羧基末端水解断裂后从内质网释放出有活性的PTP1B;N 端和C 端之间为两段富含脯氨酸的区域,在PTP1B 与其他蛋白之间的相互作用上发挥重要作用。
PTP-1B DNA 的启动子上有一个转录因子Y 盒结合蛋白-1 的结合位点,它的过度表达可使PTP-1B 的表达水平增加。
使用反义寡核苷酸技术减少其表达后,PTP-1B 的表达随之降低,呈正相关趋势。
PTP-1B 在体内没有自身的特异性受体,而是在细胞信号传导过程中,与PTP 家族中的其他成员以及蛋白酪氨酸激酶协同作用,调控蛋白底物中酪氨酸的磷酸化水平,进而对细胞的生长、分化、代谢、基因转录和免疫应答等功能进行调节。
蛋白酪氨酸激酶(1)第二节蛋白酪氨酸激酶蛋白酷氨酸激酶(protein tyrosine kinase,PTK)是一类催化AT P上γ-磷酸转移到蛋白酪氨酸残基上的激酶,能催化多种底物蛋白质酪氨酸残基磷酸化,在细胞生长、增殖、分化中具有重要作用。
迄今发现的蛋白酪氨酸激酶中多数是属于致癌RNA病毒的癌基因产物,也可由脊椎动物的原癌基因产。
根据PTK是否存在于细胞膜受体可将其分成非受体型和膜受体型。
1.非受体型以src基因产物为代表,此外还有Yes、Fyn、Lck、F gr、Lyn、Fps/Fes及Ab1等。
徐后两者外,其余非受体型蛋白酪氨酸激酶src家族分子理约为60kDa的蛋白质,它们之间除了N末端80个氨基酸组成不同外,其作部分都非常相似。
2.受体型根据它们的结构不同,受体型酪氨酸激酶可以分为9种类型,其中较常见的有4种类型(图8-5)。
(1)表皮生长因子受体(EGFR)家族:EGF-R家族成员包括EGF-R (分子量为170kDa,广泛表达于多种组织细胞中)、erbB2/neu 及erb B-3基因表达产物。
其家族成员的特点是在胞膜外有两个富含半胱氨酸的区域,胞浆内含有一个有酪氨酸激酶活化性的区域。
(2)胰岛素受体家族:其家族成员包括胰岛素受体(insulin re ceptor,IR)、胰岛素样生长因子-1受体(insulin-like growth fact or-1receptor,IGF-1R)以及胰岛素相关受体(insulin related rece ptor,IRR)。
胰岛素受体家族成员是由二个α亚单位和二个β亚单位通过链间二硫键形成的异源四聚体。
其中α亚单位为配体结合部位;β亚单位的胞浆内部分含有酪氨酸激酶活性区域。
(3)PDGF/MCSF/SCF受体家族:其家族成员包括血小板衍生的生长因子α受体(PDGF-αR)、PDGF-βR、巨噬细胞集落刺激因子受体(M-CSFR)以及干细胞生长因子受体(SCFR)。
蛋白酪氨酸激酶综述目前至少已有近六十种分属20个家族的受体酪氨酸激酶被子识别。
所有受体酷氨酸激酶都属于I型膜蛋白,其分子具有相似的拓朴结构:糖基化的胞外配体结合区,疏水的单次跨膜区,以及胞内的酪氨酸激酶催化结构域及调控序列。
不同受体酪氨酸激酶结合,将导致受体发生三聚化,并进一步使受体胞内区特异的受体酪氨酸残基发生自身磷酸化或交叉磷酸化,从而激活下游的信号转导通路。
许多肿瘤的发生、发展都与酪氨酸激酶的异常表达有着极其密切的联系,下面将对几类与肿瘤的发生发展最为密切的受体酪氨酸激酶的研究迸展做一简介。
一、表皮生长因子受体(Epidermal grovth factor receptor, EGFR)家族EGFRPE包括EGFR、ErbB2、ErbB4等4个成员,其家族受体酪氨酸激酶(RTK)以单体形式存在,在结构上由胞外区、跨膜区、胞内区3个部分组成,胞外区具有2个半氨酸丰富区,胞内区有典型的ATP结合位点和酪氨酸激酶区,其酪氨酸激酶活性在调节细胞增殖及分化中起着至关重要的作用。
人的egfr基因定位于第7号染色体的短臂(7p12.3-p12.1),它编码的产物EGFR由1210个氨基酸组成,蛋白分子量约为170kDa,其中,712-979位属于酪氨酸激酶区。
EGFR的专一配体有EGF、TGF、amphiregulin,与其他EGFR家庭成员共有的配体有(cellulin(BTC)、heparin-bindingEGF(HB-EGF)、Epiregulin(EPR) )等。
EGFR在许多上皮业源的肿瘤细胞中表达,如非小细胞性肺癌,乳腺癌、头颈癌,膀胱癌,胃癌,前列腺癌,卵巢癌、胶质细胞瘤等。
另外,在一些肿瘤如恶性胶质瘤、非小细胞性肺癌、乳腺癌、儿童胶质瘤、成神经管细胞瘤及卵巢癌等中还可检测到EGFR缺失。
最为常见的EGFR缺失突变型是EGFRⅧ,EGFR Ⅷ失去了配体结合区,但是可自身活化酪氨酸激酶,刺激下游信号通路的激活,而不依赖于与其配全结合。
新型蛋白酪氨酸激酶抑制剂类抗肿瘤药物的研究进展一、概要随着肿瘤发病机制的深入研究和抗肿瘤作用靶点的不断发现,蛋白酪氨酸激酶(PTK)作为信号转导中的关键酶,已经成为抗肿瘤药物研发的重要靶点之一。
PTK在细胞内的信号转导中扮演着至关重要的角色,与肿瘤细胞的生长、增殖、分化和凋亡密切相关。
新型蛋白酪氨酸激酶抑制剂类抗肿瘤药物的研究与开发,对于提高肿瘤治疗效果、改善肿瘤患者生活质量具有重要意义。
本文综述了近年来新型蛋白酪氨酸激酶抑制剂类抗肿瘤药物的研究进展。
我们介绍了PTK的分类及其作用机制,包括受体型和非受体型PTK在细胞信号转导中的作用。
我们详细阐述了PTK抑制剂的设计原理与策略,包括基于结构的小分子抑制剂、抗体药物以及多肽类药物等。
我们还介绍了PTK抑制剂在临床应用中的现状,包括已上市药物的疗效及安全性评价,以及正在研发的药物的临床试验进展。
通过对新型蛋白酪氨酸激酶抑制剂类抗肿瘤药物的深入研究,我们发现这类药物具有显著的抗肿瘤活性,并且在临床上已经取得了一定的疗效。
目前仍存在一些问题,如耐药性、副作用等,需要进一步研究和解决。
未来的研究方向将集中在优化药物结构、提高治疗效果、降低副作用等方面,以期开发出更加安全、有效的蛋白酪氨酸激酶抑制剂类抗肿瘤药物。
新型蛋白酪氨酸激酶抑制剂类抗肿瘤药物的研究进展迅速,为肿瘤治疗提供了新的思路和手段。
随着科学技术的不断进步和临床应用的不断推广,相信这类药物将在未来肿瘤治疗中发挥更加重要的作用。
1. 肿瘤治疗的挑战与现状作为一种复杂的生物学现象,一直是医学界面临的重大挑战。
尽管医学技术和治疗手段不断进步,肿瘤的治疗仍然面临着诸多难题。
肿瘤的异质性使得每一个病例都具有其独特的生物学特征,这为制定统一的治疗方案带来了极大的困难。
肿瘤细胞的快速增殖和侵袭性转移,使得传统的手术、放疗和化疗等手段往往难以彻底清除肿瘤细胞,且在治疗过程中容易产生耐药性。
许多抗肿瘤药物在杀灭肿瘤细胞的也会对正常细胞造成损伤,导致患者的生活质量下降。
蛋白酪氨酸激酶在细胞信号转导中的作用研究细胞是生命的基本单位,通过不同的分子和信号进行不同的反应,从而维持生命的正常运作。
细胞信号传递是指从细胞外膜信号物质到细胞内,再经过一系列分子互相作用,最终到达细胞核,激活或抑制基因表达的过程。
其中一类关键蛋白质是蛋白酪氨酸激酶,它们在细胞信号转导中具有重要的作用。
蛋白酪氨酸激酶介绍蛋白酪氨酸激酶是一种酵素,它的作用是催化蛋白质中的酰胺键上的酐化反应,从而将蛋白质中的酪氨酸转化为磷酸酪氨酸,有些还能将苏氨酸转化为磷酸苏氨酸。
蛋白酪氨酸激酶在生物体内广泛存在,与生长发育、细胞增殖、细胞分化、免疫、代谢等相关。
蛋白酪氨酸激酶的分类根据其在蛋白质中不同的位置和结构特征,蛋白酪氨酸激酶可以分为两类:一类是膜结合型蛋白酪氨酸激酶,如生长因子受体(growth factor receptor)、细胞膜受体(cell membrane receptor)等。
这类蛋白质主要位于细胞外膜上,当外源性激素或细胞外蛋白质结合到这些蛋白质时,会使其激活,从而导致内部信号传递的开始。
另一类是非膜结合型蛋白酪氨酸激酶,如淋巴瘤激酶(Lck)、Src家族激酶等。
这些蛋白质主要位于细胞内,当细胞外信号到达时,它们被激活,进而影响细胞内生化反应和基因表达。
蛋白酪氨酸激酶的作用机理蛋白酪氨酸激酶与蛋白质衍生物发生反应,将分子内的酪氨酸残基磷酸化,从而改变蛋白质的立体构象,使其具有不同的生物学功能。
这种过程与信号传导通路息息相关,典型的信号传导通路通过膜受体特异性激活蛋白酪氨酸激酶,从而诱导下游组分的磷酸化,最终调节细胞的生长增殖、分化及凋亡等生理功能。
在信号传导通路中,蛋白酪氨酸激酶还有一些非经典的参与方式。
比如,它可以参与细胞的粘附、细胞重构以及蛋白质稳定性等多种生理过程。
蛋白酪氨酸激酶在疾病中的作用由于蛋白酪氨酸激酶在生命活动中具有重要作用,因此,与之相关的疾病也可能与其异常有关。
例如,蛋白酪氨酸激酶的过度激活或失活都与肿瘤的发生密切相关。
蛋白酪氨酸激酶简介
癌症极大威胁人类健康,抗肿瘤研究是当今生命科学中极富挑战性且意义重大的领域。
目前,临床上常用的抗肿瘤药物主要是细胞毒类药物,这类抗癌药具有难以避免的选择性差、毒副作用强、易产生耐药等缺点。
近年来,随着生命科学研究的飞速进展,恶性肿瘤细胞内的信号转导、细胞周期的调、细胞凋亡的诱导、血管生成以及细胞与胞外基质的相互作用等各种基本过程正在被逐步阐明。
以一些与肿瘤细胞分化增殖相关的细胞信号转导通路的关键酶作为药物筛选靶点,发现选择性作用于特定靶点的高效、低毒、特异性强的新型抗癌药物已成为当今抗肿瘤药物研究开发的重要方向。
蛋白酪氨酸激酶是一类具有酪氨酸激酶活性的蛋白质,可分为受体型和非受体型两种,它们能催化ATP上的磷酸基转移到许多重要蛋白质的酪氨酸残基上,使其发生磷酸化。
蛋白酪氨酸激酶在细胞内的信号转导通路中占据了十分重要的地位,调节着细胞体内生长、分化、死亡等一系列生理化过程。
蛋白酪氨酸激酶功能的失调则会引发生物体内的一系列疾病。
已有的资料表明,超过50%的原癌基因和癌基因产物都具有蛋白酪氨酸激酶活性,它们的异常表达将导致细胞增殖调节发生紊乱,进而导致肿瘤发生。
此外,酪氨酸基酶的异常表达还与肿瘤的侵袭和转移,肿瘤新生血管的生成,肿瘤的化疗抗性密切相关。
因此,以酪氨酸激酶为靶点进行药物研发成为国际上抗肿瘤药物研究的热点,为此投入的研究经费也是其它任何一个非传统的肿瘤靶点所无法匹敌的。
目前为止,已有十多种蛋白酪氨酸激酶抑制剂和抗体进入I-Ⅱ期临床试验阶段,个别的已经上市,并取得了令人鼓舞的治疗结果。
基中,Genentech公司和罗氏药厂联合研究和生产的HerceptinTM(Trastuzumab)是一种抗酪氨酸激酶受体HER2/neu的人源化的单克隆抗体。
1998年,美国食品的药物管理局(Food and Drug Administration, FDA)正式批准Herceptin用于治疗某些HER2阳性的转移性乳腺癌。
2001年5月,N ovartis公司研发的针对酪氨酸激酶Bcr-Abl的抑制剂GleevecTM (imatinib mesylate)由于对治疗慢性髓样白血病(chronic myelogenous leukemia,CML)具有非常好的疗效,尚未完成Ⅲ期临床就被FDA批准提前上市,用于治疗费城染色体呈阳性(Philadelphia chromosome – positive, Ph+)的慢性髓样白血病患者,引起了巨大的轰动。
GleevecTM是第一个在了解癌症的病因后鸽是设计开发,并取得了显著成效和的肿瘤治疗药物,它的研发成功可以说是癌症治疗的一个里程碑。
这一重大成就被美国《科学》杂志列入2001年度十大科技新闻。
纽约《时代》杂志将其作为杂志的封面,称GleevecTM 开创了药物研发的新时代。
2002年2月,美国FDA又批准GleevecTM 用于胃肠基质瘤(gastrointestinal stromal tumors, GLST)的治疗。
2002年7月,AstraZeneca公司研发的IressaTM (ZD1839又被美国FDA批准用于治疗经过标准含铂类方案和紫杉萜化疗后仍然继续恶化的终未期非小细胞肺癌患者,这也是第一种用于实体瘤治疗的针对特定靶点挑战分子酪氨酸激酶抑制剂。
Herceptin,Gleevec以及Iressa的上市进一步证明了以特定靶点尤其是以酪氨酸激酶为靶点进行抗肿瘤药物的研发是21世纪最有可能获得突破性进展的抗肿瘤药物领域,具有十分广阔的前景。