植物体内游离脯氨酸含量的测定
- 格式:ppt
- 大小:141.00 KB
- 文档页数:8

实验:植物体内游离脯氨酸含量的测定摘要:本实验采用比色法对植物体内游离脯氨酸含量进行了测定。
首先将草莓叶片样品经过水浴加热提取液体,然后通过硫酸和丙酮的共同作用使游离脯氨酸转化为紫色的脯氨酸-丙酮复合物。
测定复合物的吸光度,通过标准曲线得出样品中的游离脯氨酸含量。
实验结果表明,草莓叶片中的游离脯氨酸含量为3.87μg/g。
引言:脯氨酸是一种非常重要的代谢产物,在植物生长和逆境适应中都扮演着重要角色。
在逆境胁迫下,植物体内会产生大量的脯氨酸,起到保护细胞膜和抗氧化等作用。
因此,对植物中脯氨酸的含量进行准确测定具有重要意义。
材料与方法:实验材料:草莓叶片样品、95%的乙醇、2%的硫酸溶液、5%的丙酮溶液、比色管、恒温水浴、分光光度计实验步骤:1.称取0.2g新鲜草莓叶片样品,加入10ml 95%的乙醇,放入恒温水浴中,60℃水浴1小时。
2.将提取液过滤,取上清液转移到10ml量筒中,用96%的乙醇补至刻度。
3.取出2ml的标准液注入比色管中,分别加入0.5ml、1ml、1.5ml、2ml、2.5ml的氢氧化钠溶液,用96%的乙醇补至刻度,充分混合。
4.在每个标准管中加入0.5ml的2%硫酸溶液和1ml的5%丙酮溶液,立即迅速搅拌均匀。
5.将每个标准管与草莓叶片提取液比色管同时放置于25℃的水浴中,15min后,分别测定其吸光度。
结果与分析:标准曲线绘制如图1所示,其中R2为0.998。
测得草莓叶片提取液的吸光度为0.287。
从标准曲线上查得对应的游离脯氨酸含量为3.87μg/g。
绘制标准曲线:游离脯氨酸含量/μg/mL 吸光度0 020 0.139100 0.664结论:本实验采用比色法测定了草莓叶片中游离脯氨酸的含量为3.87μg/g。
该方法操作简便、准确性高,可用于多种植物样品中脯氨酸含量的测定。

游离脯氨酸(文档8篇)以下是网友分享的关于游离脯氨酸的资料8篇,希望对您有所帮助,就爱阅读感谢您的支持。
第1篇脯氨酸含量的测定在逆境条件下(旱、盐碱、热、冷、冻),植物体内脯氨酸(proline,Pro)的含量显著增加。
植物体内脯氨酸含量在一定程度上反映了植物的抗逆性,抗旱性强的品种往往积累较多的脯氨酸。
因此测定脯氨酸含量可以作为抗旱育种的生理指标。
另外,由于脯氨酸亲水性极强,能稳定原生质胶体及组织内的代谢过程,因而能降低冰点,有防止细胞脱水的作用。
在低温条件下,植物组织中脯氨酸增加,可提高植物的抗寒性,因此,亦可作为抗寒育种的生理指标。
一、原理用磺基水杨酸提取植物样品时,脯氨酸便游离于磺基水杨酸的溶液中,然后用酸性茚三酮加热处理后,溶液即成红色,再用甲苯处理,则色素全部转移至甲苯中,色素的深浅即表示脯氨酸含量的高低。
在520nm波长下比色,从标准曲线上查出(或用回归方程计算)脯氨酸的含量。
二、材料、仪器设备及试剂(一)材料:待测植物(水稻、小麦、玉米、高粱、大豆等)叶片。
(二)仪器设备:1. 722型分光光度计;2. 研钵;3. 100ml小烧杯;4. 容量瓶;5. 大试管;6. 普通试管;7. 移液管;8. 注射器;9. 水浴锅;10. 漏斗;11. 漏斗架;12. 滤纸;13 剪刀。
(三)试剂1.酸性茚三酮溶液:将 1.25g茚三酮溶于30ml冰醋酸和20ml6mol/L磷酸中,搅拌加热(70℃)溶解,贮于冰箱中;2.3%磺基水杨酸:3g磺基水杨酸加蒸馏水溶解后定容至100ml;3. 冰醋酸;4. 甲苯。
三、实验步骤1. 标准曲线的绘制(1)在分析天平上精确称取25mg脯氨酸,倒入小烧杯内,用少量蒸馏水溶解,然后倒入250ml容量瓶中,加蒸馏水定容至刻度,此标准液中每ml含脯氨酸100μg。
(2)系列脯氨酸浓度的配制取6个50ml容量瓶,分别盛入脯氨酸原液0.5,1.0,1.5,2.0,2.5及3.0ml,用蒸馏水定容至刻度,摇匀,各瓶的脯氨酸浓度分别为1,2,3,4,5及6μg/ml。

实验三十六植物体内游离脯氨酸的测定,更改本实验旨在测定植物体内游离脯氨酸的含量。
脯氨酸是一种常见的非蛋白氨基酸,在植物中广泛存在,具有调节植物生长和逆境适应等重要生理作用。
因此,了解植物体内的脯氨酸含量对于研究植物生长发育和逆境耐受机制具有很重要的意义。
实验所需材料:1. 植物样品(例如油菜籽、小麦、水稻等)2. 冰乙酸3. 丙酮5. 次氯酸钠6. 清水7. 去离子水8. 绝对乙醇9. 氯仿10. 水杨酸11. 毛细玻璃管12. 离心管13. 取样管14. 毒理性废物桶操作步骤:1. 取适当的植物材料,如茎或叶片,用清水洗净并晾干。
2. 将清洁的植物样品切成小片,并置于离心管中。
称取一定重量的样品,通常为0.5g。
3. 在样品中加入丙酮,使样品完全浸泡在溶液中。
放置室温下浸泡12小时,以提取植物中的游离脯氨酸。
4. 将提取的液体离心10分钟,将上清液取出并过滤,以去除残渣。
5. 将上清液分别转移入不同的试管中,备用。
6. 为了去除植物中的蛋白质、多酚和色素等干扰物,需要加入一定量的三氯乙酸。
加入三氯乙酸后,样品变成了米黄色混浊液。
7. 将加入三氯乙酸后的样品冷藏4℃下静置60分钟,使游离脯氨酸沉淀。
离心5分钟,将上清液放出并倒掉。
8. 向沉淀中加入10ml冰乙酸,使其彻底溶解。
在加入冰乙酸时需小心,避免冲击。
然后离心5分钟,取上清液进行后续检测。
9. 取出一定量的上清液,加入等量的氯仿。
深橙色的游离脯氨酸会迅速转移到氯仿层,并形成清晰的分界线。
10. 将氯仿层转移入干燥的试管中,加入少量水杨酸溶液,并充分振荡。
待其完全混合后,待其沉淀,即可进行下一步检测。
11. 将上述样品溶液分别取出20μl,分别加入已经标定好的质谱仪或高效液相色谱仪中。
12. 高效液相色谱仪以270nm来检测并分析样品中的脯氨酸含量。
质谱仪则将游离脯氨酸质谱信号转换成游离脯氨酸含量。
实验注意事项:1. 在实验过程中,所有的器具和溶液需严格按照实验要求进行洗涤和消毒。

实验20 植物体内游离脯氨酸含量的测定一、原理当植物缺水时体内的脯氨酸含量增加。
植株体内脯氨酸含量在—定程度上反映了植株体内的水分情况,因而可以作为植物缺水情况的参考性生理指标。
用人造沸石在 pH 1~7 范围内振荡溶液,可除去干扰的氨基酸或使不与茚三酮反应(如甘氨酸、谷氨酸、天冬氨酸、丙氨酸、缬氨酸、胱氨酸、苯丙氨酸、精氨酸等),脯氨酸与茚三酮试剂呈显色反应,其含量与颜色深浅成正相关,可用分光光度计测定。
此法有专一性。
二、实验材料、试剂与仪器设备(一)实验材料植物叶片。
(二)试剂• 80%乙醇。
• 人造沸石。
• 活性炭。
4 .茚三酮试剂:将 2.50 g 茚三酮于 60 mL 冰醋酸和 40 mL 6 mol/L 磷酸中,加热( 70 ℃)溶解。
试剂至少在 24 小时内稳定。
5 .脯氨酸标准液:准确称取 25 mg 脯氨酸溶于少量 80 % 乙醇中,再用蒸馏水定容至 250 mL ,其浓度为100 μg/mL 。
再取此液 10 mL ,用蒸馏水稀释至 100 mL ,即成10 μg/mL 的脯氨酸标准液。
(三)仪器设备分光光度计,水浴锅,移液管,容量瓶,冰醋酸,仪器药品,离心机,烧杯,研钵,试管,恒温水浴三、实验步骤1 .绘制标准曲线吸取脯氨酸标准母液 0 、 0.2 、 0.4 、 0.8 、 1.2 、 1.6 、 2.0 mL 分别放入 7 支具塞刻度试管,分别加入蒸馏水至 2.0 mL, 其脯氨酸含量分别为0 、 2.0 、 4.0 、 8.0 、 12.0 、 16.0 、20.0 μg 。
分别吸取上述标准溶液 2 mL ,加冰醋酸 2 mL, 茚三酮试剂 2 mL 加入试管中,混匀后加玻璃球塞,在沸水浴中加热 15 min 。
用分光光度计于波长 515 nm 下进行比色测定,以零浓度为空白对照。
将测定结果以脯氨酸浓度为横坐标,以吸光度为纵坐标作标准曲线。
2. 植株样品液的提取选取植株功能叶片 2 g ,用 3 mL 80 % 乙醇研磨(放少许石英砂)成浆状。

植物中脯氨酸含量的测定实验目的:测定不同植物中脯氨酸的含量,并比较它们之间的差异。
实验原理:脯氨酸是一种非必需氨基酸,广泛存在于植物中,具有多种生物学功能。
在光合作用过程中,植物体内光合色素的降解产物中可以生成脯氨酸。
本实验使用比色法对不同植物中脯氨酸的含量进行测定。
实验步骤:1.收集不同植物的叶片样品,如红细胞苔藓、菠菜和小麦。
2.将收集到的样品冷冻在液氮中。
3.将样品取出,立即用离心机将其制成细胞匀浆。
4.在一个试管中加入适量的离心细胞匀浆,再加入几滴三氯乙酸,充分混合。
5.离心测得脯氨酸在样品提取液中的浓度。
6.制备标准曲线,将一系列不同浓度的脯氨酸溶液与苏丹黑R混合,测量吸光度。
7.根据标准曲线计算出各样品提取液中脯氨酸的浓度。
实验结果:以菠菜、小麦和红细胞苔藓为样品进行测定得到如下结果:菠菜中的脯氨酸含量为0.27 mg/g。
小麦中的脯氨酸含量为0.15 mg/g。
红细胞苔藓中的脯氨酸含量为0.08 mg/g。
讨论与结论:根据实验结果,可以看出不同植物中的脯氨酸含量存在差异。
菠菜中的脯氨酸含量最高,小麦次之,红细胞苔藓最低。
这可能是由于植物的基因差异、生长环境、生长阶段等因素导致的。
脯氨酸作为一种抗氧化物质和氮源,对植物的生长发育、抗逆性等都有重要影响。
因此,研究不同植物中脯氨酸含量的差异,对于了解植物的生理功能及其适应策略具有一定意义。
实验中使用的比色法测定脯氨酸含量的方法简便、快速,并且可以同时测定多个样品。
然而,该方法在样品预处理过程中会导致一定的失真,且对其他物质的干扰较大。
因此,在进行进一步的研究时,需结合其他方法进行验证。
注:以上为生成的实验报告假象,并非真实数据。

目的意义植物在正常条件下游离脯氨酸(proline,Pro)含量很低,但在干旱、高温、低温、盐碱、水涝等逆境条件下便会大量积累,并且积累指数与植物的抗逆性呈正相关关系。
因此,脯氨酸可作为植物抗逆性的一项生化指标,测定其含量也成为抗性生理研究的重要内容之一。
本实验的目的是掌握游离脯氨酸含量的测定方法、原理及操作技术。
一、酸性茚三酮法(一)原理植物体内的氨基酸只有脯氨酸能与酸性茚三酮发生反应,生成稳定的红色产物。
该产物在515nm有一最大吸收高峰,其吸收值与脯氨酸的含量呈直线关系。
因此,样品中的脯氨酸含量可用酸性茚三酮法测定。
除脯氨酸外,酸性和中性氨基酸不能与酸性茚三酮形成红色产物,碱性氨基酸对这一反应只有轻度干扰,在同类样品的测定中可忽略不计,在不同样品的测定中可加入人造沸石排除这种干扰。
(二)实验材料、仪器与试剂1. 实验材料:正常生长与经逆境处理的植物茎、叶、穗等器官或组织。
2. 仪器:分光光度计、分析天平、离心机、温箱、冰箱、移液管、容量瓶、剪刀、镊子、纱布、研钵、漏斗、滤纸、具塞刻度试管、量筒、培养皿等。
3. 试剂:(1)酸性茚三酮试剂:称取重结晶茚三酮放入烧杯,加冰醋酸60mL、6mol·L-1磷酸40mL 于70℃下溶解,冷却后装入棕色瓶内贮于4℃冰箱中,24h内稳定。
现用现配。
(2)100μg·mL-1脯氨酸母液:精确称取脯氨酸溶于少量80%乙醇中,用蒸馏水定容至100mL。
(3)其他试剂:人造沸石、活性炭粉、冰醋酸、80%乙醇。
(三)操作步骤1. 标准曲线制作:(1)取7个50mL容量瓶,分别放入脯氨酸母液、、、、、、,用蒸馏水定容至刻度,摇匀,各瓶的脯氨酸浓度分别为、、、、、、μg·mL-1。
(2)另取具塞刻度试管8只(0~7号),0号加入2mL蒸馏水,1~7号分别加入不同浓度的标准系列各2mL,再分别加入冰醋酸2mL和茚三酮试剂2mL,充分摇匀,加盖,沸水浴10~15min。

植物的抗性(低温、高温)评价测定实验方法(张平贤收集)实验一植物体内游离脯氨酸含量的测定一、目的在逆境条件下(旱、热、冷、冻),植物体内脯氨酸的含量显著增加,植物体内脯氨酸含量在一定程度上反映了植物的抗逆性,抗旱性强的品种积累的脯氨酸多。
因此测定脯氨酸含量可以作为抗旱育种的生理指标。
另外,由于脯氨酸亲水性极强,能稳定原生质胶体及组织内的代谢过程,因而能降低冰点,有防止细胞脱水的作用。
在低温条件下,植物组织中脯氨酸增加,可提高植物的抗寒性,因此,亦可作为抗寒育种的生理指标。
二、原理磺基水杨酸对脯氨酸有特定反应,当用磺基水杨酸提取植物样品时,脯氨酸便游离于磺基水杨酸溶液中。
然后用酸性茚三酮加热处理后,茚三酮与脯氨酸反应,生成稳定的红色化合物,再用甲苯处理,则色素全部转移至甲苯中,色素的深浅即表示脯氨酸含量的高低。
在520nm波长下测定吸光度,即可从标准曲线上查出脯氨酸的含量。
三、材料、仪器及试剂1. 材料:植物叶片。
2. 仪器:分光光度计;电子分析天平;离心机;小烧杯;普通试管;移液管;注射器;恒温水浴锅;漏斗;漏斗架;滤纸;剪刀;洗耳球。
3 .试剂及配制:2.5﹪酸性茚三酮溶液配制:将1.25g茚三酮溶于30ml冰醋酸和20ml 6mol·L -1磷酸中,搅拌加热(70℃)溶解,贮于4℃冰箱中,2-3日有效。
3%磺基水杨酸配配制:3g磺基水杨酸加蒸馏水溶解后定容至100ml。
10μg·ml-1脯氨酸标准母液配制:精确称取20mg脯氨酸,倒入小烧杯内,用少量蒸馏水溶解,再倒入200ml容量瓶中,加蒸馏水定容至刻度(为100μg·ml -1脯氨酸母液),再吸取该溶液10ml, 加蒸馏水稀释定容至100ml, 即为10μg·ml-1脯氨酸标准液。
100μg·ml-1脯氨酸母液:称10mg脯氨酸溶于少量的乙醇中,用蒸馏水定容至100ml冰醋酸;甲苯。
四、实验步骤1、脯氨酸标准曲线的制作1.1取6支试管,编号,按下表配制每管含量为0~12μg的脯氨酸标准液。

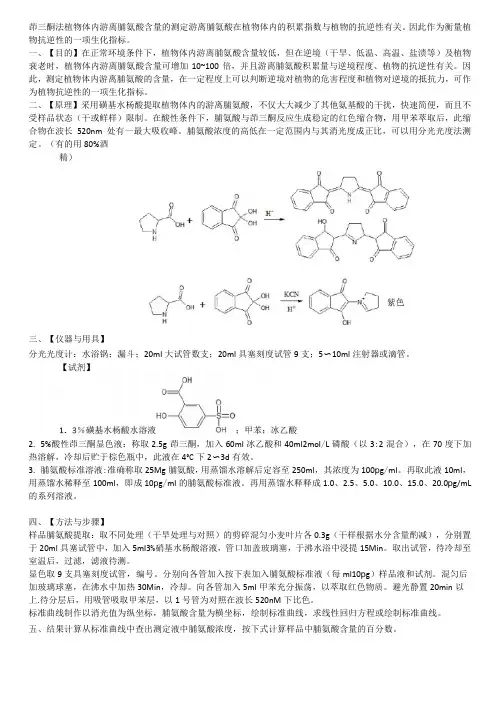
茚三酮法植物体内游离脯氨酸含量的测定游离脯氨酸在植物体内的积累指数与植物的抗逆性有关。
因此作为衡量植物抗逆性的一项生化指标。
一、【目的】在正常环境条件下,植物体内游离脯氨酸含量较低,但在逆境(干旱、低温、高温、盐渍等)及植物衰老时,植物体内游离脯氨酸含量可增加10~100倍,并且游离脯氨酸积累量与逆境程度、植物的抗逆性有关。
因此,测定植物体内游离脯氨酸的含量,在一定程度上可以判断逆境对植物的危害程度和植物对逆境的抵抗力,可作为植物抗逆性的一项生化指标。
二、【原理】采用磺基水杨酸提取植物体内的游离脯氨酸,不仅大大减少了其他氨基酸的干扰,快速简便,而且不受样品状态(干或鲜样)限制。
在酸性条件下,脯氨酸与茚三酮反应生成稳定的红色缩合物,用甲苯萃取后,此缩合物在波长520nm处有一最大吸收峰。
脯氨酸浓度的高低在一定范围内与其消光度成正比,可以用分光光度法测定。
(有的用80%酒三、【仪器与用具】分光光度计:水浴锅;漏斗;20ml大试管数支;20ml具塞刻度试管9支;5〜10ml注射器或滴管。
2.5%酸性茚三酮显色液:称取2.5g茚三酮,加入60ml冰乙酸和40ml2mol/L磷酸(以3:2混合),在70度下加热溶解,冷却后贮于棕色瓶中,此液在4°C下2〜3d有效。
3.脯氨酸标准溶液:准确称取25Mg脯氨酸,用蒸馏水溶解后定容至250ml,其浓度为100p g/ml。
再取此液10ml,用蒸馏水稀释至100ml,即成10p g/ml的脯氨酸标准液。
再用蒸馏水释释成1.0、2.5、5.0、10.0、15.0、20.0p g/mL 的系列溶液。
四、【方法与步骤】样品脯氨酸提取:取不同处理(干旱处理与对照)的剪碎混匀小麦叶片各0.3g(干样根据水分含量酌减),分别置于20ml具塞试管中,加入5ml3%硝基水杨酸溶液,管口加盖玻璃塞,于沸水浴中浸提15Min。
取出试管,待冷却至室温后,过滤,滤液待测。
显色取9支具塞刻度试管,编号。

脯氨酸(Pro)含量的提取和测定脯氨酸在植物体内起到很重要的渗透调节作用。
当植物体处在逆境的环境(如干旱、冷害、高温、盐渍、病害等)中时,植物体内游离的脯氨酸的含量会出现明显的升高。
植物体内的脯氨酸的作用主要有两种,一种是调节植物体内的渗透压,使植物体不易失水;另一种则是与细胞内的蛋白质相互作用,共同维持细胞膜蛋白的稳定性。
在逆境条件下,植物体内的脯氨酸的含量越高,植物体维持体内渗透压和膜蛋白稳定的能力就越强,也就是说植物体的抗性就越强。
植物体内的脯氨酸比较容易溶于磺酸水杨酸的水溶液中,实验室一般选用3%的磺酸水杨酸溶液提取植物体内的脯氨酸。
在弱酸性条件下,脯氨酸可以与茚三酮发生反应生成黄色物质,但是在强酸性条件下,则会生成红色物质,这种红色物质可以用甲苯萃取,并且在520nm处有最大的吸光值。
(1)绘制脯氨酸的标准曲线配制浓度10mg/ml的脯氨酸溶液,然后稀释成10-9~1m g/ml的十个浓度梯度的标准液。
各取2ml加入已经编号的试管中,然后每只试管分别加入加入2ml3%的磺酸水杨酸溶液、2ml冰醋酸和4ml 2.5%的酸性茚三酮溶液(现配现用),混匀,在沸水浴中显色60min。
待试管冷却后每只试管中加入4ml的甲苯,充分摇匀后,红色物质存在于上层甲苯相中。
取甲苯相测定520nm出的吸光值,并用甲苯做空白对照,根据脯氨酸的含量的对数和相应的光吸收值绘制出脯氨酸含量的标准曲线。
(2)取0.1g植物组织,剪碎放置于一个2mlEP管中,加入200ul 3%的磺酸水杨酸溶液,研磨10min至材料充分磨碎。
(3)再加入800ul的3%的磺酸水杨酸溶液,混匀。
(4)将材料放在沸水浴中浸提10分钟。
(5)等材料完全冷却后,3000rpm/min室温离心10分钟,上清液即为含有脯氨酸待测液。
(6)在一个2ml的EP管中加入200ul的上清液,然后再加入200ul的水、200ul 的冰乙酸和400ul的2.5%的酸性茚三酮溶液[将1.25g茚三酮溶于30ml冰乙酸和20ml 6mol/L磷酸混合溶液中,搅拌加热(70℃)溶解,仅在24小时内稳定],混匀,在沸水浴显色60分钟。

植物中脯氨酸含量的测定实验报告及结果摘要
本文介绍了有关植物中脯氨酸含量的测定实验报告。
首先,对脯氨酸
的性质和结构进行简要的介绍。
然后介绍了设计用于测定植物脯氨酸含量
的试验方法。
最后,本文提供了一系列实验结果,以表明所采取的实验方
法是正确的。
关键词:脯氨酸,测定,实验报告
1引言
脯氨酸(Proline)是一种结构上尤其复杂的氨基酸。
它具有异构和
加氧作用,在蛋白质调节中起着重要作用。
脯氨酸在植物体内具有多种功能,如参与胞内多种代谢过程,从而提高植物的抗逆能力。
为了评估植物
的调节性能,有必要定量研究它们在体内的脯氨酸含量。
2材料与方法
2.1实验材料
本实验采用新鲜的植物材料,自土壤中收集30份样品,每份样品重
约3克。
样品在实验室内放置,经过24小时的调节,以保证其质量和完
整性。
2.2试验方法
2.2.1样品处理
将每份样品加入15ml的酒精,用搅拌机搅拌30秒,然后用水或乙醇
冲洗,以去除样品表面残留的酒精,冷冻干燥样品,记录样品残留的重量。
2.2.2经碱水合、脱羧和油酸酰胺处理。
植物体内游离脯氨酸的测定在正常环境条件下生长的植物,体内游离脯氨酸的含量较低。
但在逆境(如旱、寒、盐等)条件下,植物体内游离脯氨酸的含量可增加10-100倍,因此有人提出游离脯氨酸的含量可作为植物抗逆性指标。
植物体内的游离脯氨酸用磺基水杨酸或酒精提取。
在酸性条件下,脯氨酸和茚三酮反应生成稳定的红色产物(结构如下),用比色法于520um波长下测定脯氨酸的含量。
仪器设备:分光光度计、析天平、恒温水浴、研钵、容量瓶、具塞试管:25毫升9支、移液管:2毫升4支、5毫升2支、漏斗、滤纸。
1.称取0.5000g剪碎烟叶加入试管,加5ml 3%磺基水杨酸,封口,沸水浴10min;过滤后备用。
2.吸取2ml提取液加入试管(对照管用2ml水代替),各加入2ml冰醋酸,4ml 茚三酮,摇匀,煮沸30min,冷却比色(OD520)试剂配制:1.3%磺基水杨酸:称3.000g磺基水杨酸溶解,定容至100ml。
2.茚三酮:称2.50g茚三酮,加60ml冰醋酸和40ml 6M磷酸,在热水(70°C)溶解,一般现用现配(24小时)6M磷酸:吸取86ml磷酸,定容至250ml.试剂酸性茚三酮:称取2.5克弗三酮,加入60毫升冰醋酸和40毫升6M磷酸(冰乙酸和6mol/L磷酸以3︰2混合,作为溶剂进行配制),于70℃下加热溶解。
冷却后贮于棕色试剂瓶中备用。
4℃下2~3日内有效。
脯氨酸标准溶液:称取0.0250克脯氨酸,溶解在250毫升蒸馏水中,其浓度为100微克/毫升。
再取此液10毫升,用蒸馏水稀释至100毫升,即为10微克/毫升之脯氨酸标准液。
冰醋酸甲苯若用磺基水杨酸提取,需要配制3%的磺基水扬酸溶液。
(若用酒精提取,需要80%的酒精,活性炭,人造沸石)。
采用磺基水杨酸提取植物体内的游离脯氨酸,不仅大大减小了其他氨基酸的干扰,快速简便,而且不受样品状态(干或鲜样)限制。
在酸性条件下,脯氨酸与茚三酮反应生成稳定的红色缩合物,用甲苯萃取后,此缩合物在波长520nm处有一最大吸收峰。
各生理指标的测定方法一、脯氨酸含量的测定1.苗三酮法1.1原理在正常坏境条件卞,植物体内游离脯氨酸含量较低,但在逆境(干旱、低温、高温、盐渍等)及植物衰老时,植物体内游离脯氨酸含量可增加10-100倍,并且游离脯氨酸枳累量与逆境程度、植物的抗逆性有关。
用磺基水杨酸提取植物样品时,脯氨酸游离于磺基水杨酸的溶液中,然后用酸性苗三酮加热处理后,溶液即成红色,再用甲苯处理,则色素全部转移至甲苯中,色素的深浅即表示脯氨酸含量的高低。
在520nm波长下比色,从标准曲线上查出(或用回归方程计算)脯氨酸的含量。
1. 2步骤试剂:(1) 25%苗三酮:帝三酮----------- 0. 625g冰乙酸------------ 15ml6mol/L 磷酸 ------- 10ml70° C水浴助溶;(2)6mol/L磷酸:85%磷酸棉释至原体积的2. 3倍;(3) -------------------------------------------- 3%磺基水杨酸:磺基水杨酸3g加蒸饰水至----- 100ml实验步骤:(1)称取0. 1名样品放入研钵,加5ml3%磺基水杨酸研磨成匀浆,100° C沸水浴15min;(2)冰上冷却,4000rpm离心lOmin:(3)提取液2ml+冰醋酸2ml+25%苗三酮2ml混合均匀,100° C沸水浴30min,冰上冷却;(4)加4ml甲苯混合均匀,震荡30s,静置30min;(5)以甲苯为空白对照,再520nm下测定吸光值。
1.3计算方法脯氨酸含量(Ug/gFW) = X *提取液总量(ml) /样品鲜重(G *测定时提取液用量(ml) *10飞公式中:X——从标准曲线中查得的脯氨酸含量(Pg)提取液总量 --------------------------- 5ml测定时提取液用量---------------------- 2ml问题及质疑:1.酸性体系下,脯氨酸与苗三酮加热反应后的最终产物为红色,再实验过程中,仅有少数时候能发现红色产物。
植物体内脯氨酸含量测定植物体内脯氨酸含量测定是评估植物生理状态的重要方法,也是研究植物逆境适应性的关键指标。
脯氨酸是一种氨基酸,能够调节植物的生长发育和逆境响应。
因此,准确测定植物体内脯氨酸含量对于探究植物生理机制和优化植物生长具有重要意义。
脯氨酸是一种含有羧基和氨基的氨基酸,通常以游离态的形式存在于植物体内。
衡量植物体内脯氨酸含量的方法有多种,其中较常用的是酸水解法和直接检测法。
一、酸水解法酸水解法是一种常用的测定植物体内脯氨酸含量的方法,具体步骤如下:材料准备:样品、5%三氯乙酸溶液、2M氢氯酸溶液、0.2M醋酸钠缓冲液、酚酞指示液。
1. 取适量样品,磨碎成粉末,并过筛筛掉颗粒均匀的样品。
2. 取约0.2g的样品加入10ml 5%三氯乙酸溶液中,放在80℃恒温水浴中加热1小时。
酸水解旨在将脯氨酸从蛋白质中释放出来。
3. 将样品冷却后,在离心管中以8000rpm的速度进行离心5分钟。
4. 从上层液体中取出约1ml的提取液,放在烧杯中加入1.2ml的2M氢氯酸溶液,并在水浴中加热沸腾10分钟,旨在保持脯氨酸的游离态。
5. 再将烧杯中的液体冷却后,在其中加入1ml醋酸钠缓冲液和2滴酚酞指示液,并加入1ml 1M氢氧化钠溶液,旨在使酸碱度中和。
6. 最后,以0.1M硼酸溶液进行稀释,将反应液稀释至适宜的浓度,使用分光光度计测量脯氨酸的吸光度值,然后按一定的公式计算出样品中的脯氨酸浓度。
二、直接检测法材料准备:样品、4%硫酸溶液、10%二氧化硫溶液、巴氏试剂。
1. 取适量样品,磨碎成粉末,并称取约0.1g的样品加入10ml的4%硫酸溶液中,放在温度为80℃的恒温水浴中加热5分钟。
3. 从上层液体中取出约2ml的提取液,放在试管中,并加入10%二氧化硫溶液和巴氏试剂。
在这个过程中,二氧化硫旨在使脯氨酸分子与巴氏试剂分子结合,使过氧化氢水平升高。
4. 然后,将试管振荡混合,并用分光光度计测量波长为550nm处的吸光度值。
黄瓜和番茄体内游离脯氨酸的含量测定摘要在逆境条件下黄瓜和番茄体内脯氨酸的含量显著增加,黄瓜和番茄体内脯氨酸含量在一定程度上反映了黄瓜和番茄的抗逆性。
另外,由于脯氨酸亲水性极强,能稳定原生质胶体及组织内的代谢过程,因而能降低冰点,有防止细胞脱水的作用。
在低温条件下,黄瓜和番茄组织中脯氨酸增加,可提高植物的抗寒性,因此,可作为抗寒育种的生理指标。
用不同浓度的磺基水杨酸处理过的黄瓜和番茄,脯氨酸的含量会有所不同,所以适宜浓度的磺基水杨酸处理能够提高番茄和黄瓜果实的抗冷性。
关键词:脯氨酸,磺基水杨酸,茚三酮,抗冷性水杨酸( salicylic acid) 是一种广泛存在于高等植物中的简单酚类化合物。
近年来, 研究发现其有诱导某些植物开花、产热和诱导烟草、黄瓜等对病毒、真菌及细菌病害的抗性等多种重要生理作用[ 6]。
采后冷害是限制冷敏感性果蔬冷藏期的重要因素, 虽然有用外源磺基水杨酸处理减轻果品和蔬菜腐烂的研究, 但对其采后冷害的影响尚未见研究报道。
我们曾研究发现外源磺基水杨酸处理的大久保桃在冷害温度下( 2 ± 2) ℃贮藏期间, 游离脯氨酸和丙二醛积累都小于对照 , 说明磺基水杨酸处理有可能对减轻冷害起作用。
黄瓜和番茄为典型的冷敏感性果蔬。
黄瓜在10 ℃以下受到伤害, 其发生与贮藏温度和品种有关,1℃冷藏时, 不同品种在4d 或7d 出现冷害[ 7, 6]。
1.试验材料与方法1.1 试验材料与处理1.1.1 试验材料采收后运回实验室,并挑选大小均匀、无病虫害和机械损伤的绿色黄瓜和绿熟期的番茄。
1.1.2试验材料处理番茄和黄瓜分别用浓度为0、0. 01、0. 05、0. 1 g/ L 的磺基水杨酸溶液浸。
番茄和黄瓜的浸泡时间均为15min, 取出果实, 沥干水分, 自然晾干。
然后将每1 组( 即同一浓度的) 番茄或黄瓜, 每2 个装入1 个透气性好的塑料中( 以防失水) , 挽口, 立即放入( 2 ± 1)℃的冷藏库中, 上架摆放贮藏。