上海财经大学附属北郊高级中学高二化学会考复习—定量实验
- 格式:doc
- 大小:113.00 KB
- 文档页数:8

高二化学会考复习——有机化合物第一节有机化学的基本概念【考纲解读】【知识梳理】1.有机物(1)概念:有机物通常指含有________元素的化合物。
但是,CO、CO2、H2CO3、碳酸盐、HCN(CN—盐)、KSCN、SiC、CaC2等不属于有机物。
(2)有机物的种类繁多,其主要原因①碳原子有____个价电子,能和碳或其他原子形成____个________键(填“共价”或“离子”);②碳链长度可以不同,碳碳原子之间的结合方式可以形成,还可以形成;③有机物普遍存在___________________(填“同系物”或“同分异构”)现象。
(3)有机物的主要特点①溶解性:一般难溶于________,易溶于___________;②可燃性:一般___________________(填“易燃”或“不易燃烧”);③导电性:一般___________________(填“易导电”或“不易导电”);④熔沸点:一般___________________(填“较高”或“较低”);⑤是否电解质:大多数有机物是___________(填“电解质”或“非电解质”);⑥相互反应:大多比较复杂,一般_______(填“较快”或“较慢”),且常伴有副反应。
2.同系物(1)概念:化学上,将_______相似;在分子组成上相差一个或若干个______________的化合物互称为同系物。
(2)特点①原子间的结合方式相似,除组成元素要求相同外,官能团的______,甚至_____相同。
②符合同一通式,但_______肯定不相同。
③化学性质_____(填“相似”或“完全不同”),物理性质一般随原子数的增加而递变。
3.同分异构现象(1)概念:________相同而_______不同的化合物互称为同分异构体。
你能分辨同分异构体和同一种物质吗?(2)①书写C4H10的同分异构体的结构简式,并命名(系统命名):②书写C5H12的烷烃的同分异构体的结构简式,并命名(系统命名):4.反应类型5.化学用语(1)以乙炔为例,写出:分子式___________,最简式___________,电子式_______________,结构式_______________,结构简式_______________。
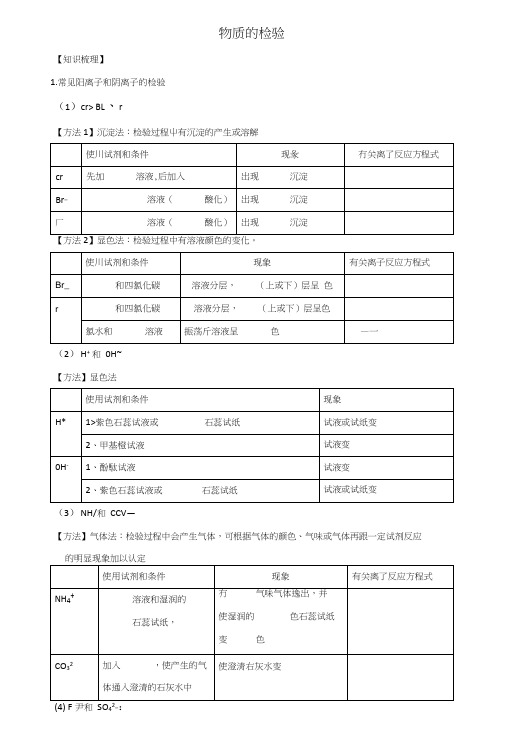
物质的检验【知识梳理】1.常见阳离子和阴离子的检验(1)cr> BL、r【方法1】沉淀法:检验过程屮有沉淀的产生或溶解【方法2】显色法:检验过程中有溶液颜色的变化。
(2) H+和0H~【方法】显色法(3) NH/和CCV—【方法】气体法:检验过程中会产生气体,可根据气体的颜色、气味或气体再跟一定试剂反应的明显现象加以认定(4) F尹和SO42_:使用方法使用试剂和条件现象有关离子反应方程式Fe3显色法溶液生成色溶液沉淀法溶液生成色沉淀SO42-法加入,再加入溶液加入吋无明显现象,加溶液后产生【水平诊断1】【知识点1: —•种离子的检验】1.请在以下空白处填上实验现象或化学式。
------- 气味,能使湿润的红色石蕊试纸一一色)—色,加过蜀氢氧化钠溶液_______ 加氨水_一色)()2.检验未知溶液中是否含有SO,-的下列操作中,最合理的是A.加入硝酸酸化了的Ba(NO3)2溶液B.加入盐酸酸化了的BaCJ溶液C.先加入硝酸酸化,再加Ba(NO3)2溶液D.先加盐酸酸化,再加BaCJ溶液【知识点2:几种离了的鉴别】()3.卜•列各组溶液,能川CaCb溶液鉴别的是A.Na2CO3和NaHCO3B. NaCI 和NH4C1C. AgNO3和Na2CO3D. NaCI 和NaNC)3( )4.下列混合的离子溶液,加氢氧化钠溶液可以将它们分离的是A. Fe"和Mg2+B. CO32和A102C. Fe酣和Al3+D. Ca2+和K+()5.某溶液中加入BaCH溶液牛•成白色沉淀,再加入稀硝酸沉淀不溶解也无气体逸出, 则这种溶液中A. 一定含冇SO42B. 一定含冇Ag+C.可能含有一或Ag*或CO32'D.可能含有SO/一或Ag+【知识点3:离子共存和离子方程式书写】( )6.下列各组离子能大量共存的是A. Ba2\ K\ CO32_> Cl'B. Na\ Fe3\ 、NO3—色)C. NH4\ Ag\ Cl \ NO3一D. Na\ NH4\ 0H"> SO42-)7.以下离了方程式屮,错谋的是A.红氧化镁跟硫酸Mg(OH)2 + 2H+— Mg2+ + 2H2OB.碳酸钙跟盐酸CO32" + 2H+ f C02 t + H20C.漠化钾跟氯水2Br~ +CI2— Br2 + 2CHD.硝酸银跟盐酸Ag++ Cl-— AgCI I()8.以下离子方程式的书写,错误的是A.石灰水中通入过量CO? Ca2+ + 20H _ + 2CO2 Ca(HCO3)2B.碳酸钾溶液屮加入氯化饮溶液Ba2+ + CO32 - BaCO3 IC.氯化彼溶液屮加入氢氧化钠溶液(加热)NHr + OK t NH3T +出0D.硫酸中加入氧氧化顿溶液Ba2+ + OFT + H* + SO42-〜BaSO4 I + H20【知识点4:用一种试剂鉴别多种离了】( )9.有三瓶无色溶液,他们分别是KCI、N/Os和NH4CI,以下能鉴别这三种溶液的试剂是A.盐酸B.紫色石蕊试液C.氯化钞!溶液D.硝酸银溶液( )10.限用一种试液可区别NazS、Na2S2O3> Na2CO3^ NaAQ、Na2SO4五种溶液。

物质的检验【知识梳理】1. 常见阳离子和阴离子的检验(1)Cl—、Br—、I—【方法1】沉淀法:检验过程中有沉淀的产生或溶解【方法2】显色法:检验过程中有溶液颜色的变化。
(2)H+ 和OH—【方法】显色法(3)NH4+和CO32—【方法】气体法:检验过程中会产生气体,可根据气体的颜色、气味或气体再跟一定试剂反应的明显现象加以认定(4)Fe 3+和SO 42—:【水平诊断1】【知识点1:一种离子的检验】1. 请在以下空白处填上实验现象或化学式。
( )2. 检验未知溶液中是否含有SO 42-的下列操作中,最合理的是A. 加入硝酸酸化了的Ba(NO 3)2溶液B. 加入盐酸酸化了的BaCl 2溶液C. 先加入硝酸酸化,再加Ba(NO 3)2溶液D. 先加盐酸酸化,再加BaCl 2溶液 【知识点2:几种离子的鉴别】( )3. 下列各组溶液,能用CaCl 2溶液鉴别的是 A. Na 2CO 3和NaHCO 3 B. NaCl 和NH 4C1 C. AgNO 3和Na 2CO 3 D. NaCl 和NaNO 3( )4. 下列混合的离子溶液,加氢氧化钠溶液可以将它们分离的是 A. Fe 3+和Mg 2+ B. CO 32—和A1O 2—C. Fe 3+和A13+D. Ca 2+ 和K +( )5. 某溶液中加入BaCl 2溶液生成白色沉淀,再加入稀硝酸沉淀不溶解也无气体逸出,则这种溶液中A. 一定含有SO 42—B. 一定含有Ag +C. 可能含有SO42—或Ag+或CO32—D. 可能含有SO42—或Ag+【知识点3:离子共存和离子方程式书写】()6. 下列各组离子能大量共存的是A. Ba2+、K+、CO32—、C1-B. Na+、Fe3+、C1—、NO3—C. NH4+、Ag+、C1—、NO3—D. Na+、NH4+、OH—、SO42—()7. 以下离子方程式中,错误的是A. 氢氧化镁跟硫酸Mg(OH)2 + 2H+→Mg2+ + 2H2OB. 碳酸钙跟盐酸CO32—+ 2H+→CO2↑+ H2OC. 溴化钾跟氯水2Br—+ Cl2→Br2 + 2Cl—D. 硝酸银跟盐酸Ag+ + Cl—→AgCl↓()8. 以下离子方程式的书写,错误的是A. 石灰水中通入过量CO2Ca2+ + 2OH—+ 2CO2 →Ca(HCO3)2B. 碳酸钾溶液中加入氯化钡溶液Ba2+ + CO32—→BaCO3↓C. 氯化铵溶液中加入氢氧化钠溶液(加热) NH4+ + OH—→NH3↑+ H2OD. 硫酸中加入氢氧化钡溶液Ba2+ + OH—+ H+ + SO42—→BaSO4↓+ H2O【知识点4:用一种试剂鉴别多种离子】()9. 有三瓶无色溶液,他们分别是KCl、Na2CO3和NH4Cl,以下能鉴别这三种溶液的试剂是A. 盐酸B. 紫色石蕊试液C. 氯化钡溶液D. 硝酸银溶液()10. 限用一种试液可区别Na2S、Na2S2O3、Na2CO3、NaAlO2、Na2SO4五种溶液。

化学中的计量问题【知识梳理】1. 物质的量(1)概念:表示物质所含微粒数目多少的物理量(2)__________ 符号:(3)__________ 单位:2. 摩尔(1)________________ 概念:摩尔是_________________________ 的单位,每1摩尔物质含有个结构微粒。
(2)符号:_(3)说明:必须指明物质微观微粒的名称,不能是宏观物质名称。
常见的微观粒子有:—、—、—、电子、质子、中子或它们特定的组合(原子I才I)。
3. 阿伏加德罗常数(1)__________________含义:实验测定屮碳原子的个数(2)___________ 符号:(3)___________ 单位:(4) ___________________________ 说明:①叱还是的基准②试写出N A与6.02X1023的区别和联系_______________________________4. 摩尔质量(1)_____________ 概念:的物质的质量。
(2)___________ 符号:(3)___________ 单位:(4) ___________________________________________ 说明:摩尔质量与式量的比较:5. 气体摩尔体积(1)________________ 概念:的气体的体积(2)___________ 符号:(3)___________ 单位:(4)标准状况下的气体摩尔体积①标准状况:____________________ o②通常状况:____________________ 0③标准状况下的气体摩尔体积:____ 0(5)影响物质体积犬小的因素:①构成物质的微粒的大小(物质的本性)② 结构微粒Z 间距离的大小(温度少压强来共同决定)③ 结构微粒的多少(物质的虽的大小)请参考上述内容,写出决定指定物质的量气体体积人小的因素有: ___气体体积的大小与气体种类 ____ (填写冇关或者无关),(6)阿伏加徳罗定律:温度和压强相同时,相同体积的任何气体都含有相同数目的分子 V\ _ n\卩2 力26. 物质的量浓度(1) ____________________ 概念:用单位体积的 含 的物质的量的多少来表示溶液的浓度(2) ___________ 符号:(3) ___________ 单位:请标出下表中各项运算的箭头方向X M (g/mol)7. 转化关系(1)己知溶液密度P (g/cm 3)推导物质的量浓度(C )和质量百分含量(w%)的关系。

高中化学四大定量实验综观近几年高考,有关定量实验的考题时常出现在高考卷中,命题的方式是定量与定性相结合,题型以填空、简答为主。
定量实验题不仅考查考生的观察能力、操作能力、分析能力,还考查考生的数据处理能力。
高中化学中最重要的定量实验有:①一定体积一定物质的量浓度溶液的配制;②中和滴定;③硫酸铜晶体中结晶水含量的测定;④中和热的测定等。
下面对这四个定量实验作简要的解读。
定量实验之一:一定体积、一定物质的量浓度溶液的配制[实验仪器]容量瓶、托盘天平(或量筒)、烧杯、玻璃棒、胶头滴管和药匙。
[实验步骤](1)计算:根据要求计算出固体溶质的质量或液体的体积;(2)称量或量取;(3)溶解:往小烧杯中放入溶质,加入适量的蒸馏水,用玻璃棒搅拌溶解。
(但用98%浓硫酸配制溶液时,一定要把98%浓硫酸沿烧杯壁倒入盛水的烧杯中,边倒边搅拌)(4)转移:将溶解的溶液冷却至室温,沿玻璃棒注入容量瓶;(5)洗涤:用少量蒸馏水冲洗玻璃棒和烧杯2~3次,并将每次的洗涤液也倒入容量瓶中;(6)定容:向上述容量瓶继续加蒸馏水至离刻度线1~2厘米,改用胶头滴管逐滴加入蒸馏水,直到凹液面最低点与刻度线相切;(7)装瓶:将溶液转入试剂瓶,贴好标签放在指定位置存放。
[注意事项](1)容量瓶在使用前要检验是否漏水;(2)转移溶液要用玻璃棒引流;(3)只能配制容量瓶上规定的容积的溶液,溶液温度需与标注温度相仿。
(4)配制好的溶液不能长期存放在容量瓶中,要及时倒入指定的细口瓶中。
(5)定容时,仰视读刻度,液面会看低,所加水量增大,浓度变小;反之,俯视浓度变大。
(6)用胶头滴管滴加蒸馏水时,若液面过了刻度线,就宣布实验失败,重做实验。
[经典习题之一]医用生理盐水是质量分数为0.9%,物质的量浓度是0.154mol/L。
现欲配制此溶液1L,请填写下列空白:(1)配制过程用到的仪器有:托盘天平、烧杯、玻璃棒、和。
(2)如果转移过程中,不慎将烧杯中的溶液洒落于容量瓶外或加水超过刻度线,其处理方法为。

科学探究活动【知识梳理】1.科学探究的一般过程2.实验数据的处理和分析【例】用己知浓度的O.lOOmol/LNaOH溶液滴定未知浓度的盐酸,数据记录如下:验次数1234实验数待测盐酸体积/mL20.0020.0020.0020.00滴定管初读数/mL0.000.200.100.15滴定管末读数/mL16.9517.2515.6517.15完成填空如下:(1)___________________________________________ 在上述数据中,直接测量值为__ ,间接测量值是 _________________________________________ 。
(2)_________________________________________ 上述实验,消耗NaOH溶液的平均体积为mL,待测盐酸的浓度为 _________________________mol/L。
(3)__________________________________ 计算公式:绝度误差二_____________ ,相对误差二o(4)_______________________________________________________________________ 若该盐酸浓度的真值(又称实际值)为0.090mol/L,则该实验的绝对误差为____________________,相对误差为_________ %。
(5) ________________________________________________________________________ 为什么说,在实际应用中相对误差更能说明问题?________________________________________ o(6)有效数字:当使用测量工具从事测量时,工具的最小刻度限制了测量值的有效位数,通常我们以仪器的最小刻度值外加一位 __________ 作为记录的结果。
上海财经大学附属北郊高级中学2023-2024学年高三上学期开学考试化学试题学校:___________姓名:___________班级:___________考号:___________一、解答题1.某学习小组进行实验探究3FeCl 溶液和2Na S 溶液的反应原理。
已知:①和FeS 均为黑色、不溶于水,能溶于酸的固体,23Fe S 固体常温下易转变为黄绿色。
①sp K 近似数据:()3Fe OH 为3910-,23Fe S 为8810-,FeS 为1910-。
(1)2Na S 的电子式为 ;常温下,0.11mol L -⋅ 2Na S 溶液pH=13的原因是 (用离子方程式表示),该溶液中水的电离程度是相同温度下纯水的 倍。
(2)配制3FeCl 溶液时,先将32FeCl 6H O ⋅晶体溶于浓盐酸,再稀释至指定浓度。
结合平衡移动原理说明浓盐酸的作用 。
学习小组尝试结合相关原理预测产物。
(3)甲同学依据酸碱理论的相关知识预测3FeCl 与2Na S 可能发生双水解生成()3Fe OH ,则该反应的离子方程式可以表示为 。
(4)乙同学依据难溶电解质的溶解平衡理论的相关知识预测反应主要产生23Fe S 而不是()3Fe OH 。
理由是 。
(5)丙同学依据氧化还原反应理论的相关知识预测3FeCl 溶液与2Na S 溶液反应可生成FeS 和S 的混合物,则反应的离子方程式为 。
学习小组进行实验,探究反应生成沉淀物的成分。
实验一:实验二:(6)乙同学设计实验证明试管①中黑色物质含有23Fe S ,该同学的实验操作为 。
(7)丙同学将试管①中黑色沉淀过滤洗涤后溶解于稀硫酸,获得淡黄色悬浊液并闻到臭鸡蛋气味,判断沉淀为FeS 和S 的混合物,但甲同学认为此判断不合理,请说明理由: 。
(8)由上述实验可知,3FeCl 溶液与2Na S 溶液间可发生复分解反应也可发生氧化反应,且反应的产物、实验的现象与等有关 (写出一条即可)。
物质的制备【知识梳理】12.乙酸乙酯的实验室制备:(1)反应原理(用相应的化学方程式表示)(2)实验装置和步骤①在试管里加入3mL __________ ,然后一边摇动,一边慢慢地加入2mL ___________________ 和2mL _______ ,再加入少量 __________ ,用酒精灯小心均匀地加热lOmin,将产生的蒸气经导管通到______________________ 的液面上。
②在制取乙酸乙酯的实验中,为什么要把浓硫酸慢慢加入到乙醇中,且边加边搅拌,而不能反过来加?______________________________________________________________________ O③试管为什么要放入水浴中加热? ____________________________________________________ C④浓硫酸所起的作用是什么? ________________________________________________________ O⑤为什么导出的蒸气要通到饱和碳酸钠溶液的液面上? __________________________________ O⑥从生成的混合物中分离出乙酸乙酯时,要用到的主要仪器是什么?如何操作?1.装配气体发生髀2.3.接受蒸憎出的液体中和滴定或溶解物质时一般只作均匀旋转的振荡1.液体量不超过容器的。
2.放置在铁圈或三脚架上直接加热。
将近蒸干时耍。
蔺灼烧固体2.要用夹持,放在上,用火焰直接加热。
2.加热完毕,用夹持取下,放在上。
名称图形主要用途&常见的尾气处理方法和装置:【水平诊断1】【知识点1:乙烯和乙炊的实验室制备】( )1.实验室中下面用浓硫酸和乙醇混合加热制取乙烯的实验操作正确的是A.浓硫酸和乙醇的体积比为1: 3B.为控制反应温度,在反应容器内插入一支温度计,温度计的水银球应在液面以上C.在反应容器内放几块碎瓷片,加热应迅速升温到170°CD.反应完毕先灭火,再从水中取出导管()2.碳化钙与水反应制取乙烘不用启普发生器作为气体的发生装置的主要原因是A.乙烘易溶于水B.块状的碳化钙遇水成为糊状物C.碳化钙与水反应很剧烈,大量放热D.乙烘是可燃性气体【知识点2:实验室制乙酸乙酯】( )3.从乙酸乙酯中除去少量乙酸的适宜方法是A.加入乙醇使乙酸酯化B.加热使乙酸蒸发C.加入饱和碳酸钠溶液后用分液漏斗分离D.加入氢氧化钠溶液使之与乙酸反应()4.炒菜时,又加酒、又加醋,可使菜变得味香可口,原因是A.有盐类物质生成B.有酸类物质生成C.有醇类物质生成D.有酯类物质生成【知识点3:常见的反应容器】( )5.下列实验操作或装置符合实验要求的是A.实验室制取乙烯B.定容 C.电解制Cl?和H2( )6D.高温灼烧硫酸铜晶体BCD【知识点4:常见物质的发生装置】( )7.下列有关实验原理或操作正确的是A.选择合适的试剂,用图1所示装置可分别制取少量CO2、NO 和。
2022-2023学年上海市上海财经大学附属北郊高级中学高二下学期等级班阶段性检测(5月)化学试题1. 2020年9月,中国明确提出2030年“碳达峰”与2060年“碳中和”目标。
为实现碳的中性平衡,绿色碳科学受到广泛关注。
(1)“碳氢氧元素三元体系”(如图)是构建绿色碳科学的基础。
①从元素组成角度考虑,烃应属于图___________区域。
A.Ⅰ B.Ⅱ C.Ⅲ D.Ⅳ②属于区域Ⅱ且相对分子质量最小的化合物是___________(用结构简式表示)。
(2)二氧化碳排放主要来源之一是工业生产中煤、石油、天然气等化石燃料的燃烧。
除了作为燃料,它们还可以转化为其他更有价值的产品。
①下列过程是物理变化的是___________。
A.煤的干馏 B.石蜡裂化 C.石油分馏 D.丁烷裂解②下列有机物的系统命名正确的是___________。
A.2-乙基丁烷 B.2-甲基-1,3-丁二烯C.3,3-二甲基丁烷 D.2,2-二甲基-3-戊炔③丁苯橡胶是重要的石油化工产品,其化学组成为,合成丁苯橡胶的单体中一定有___________。
A.2-丁炔 B.1,3-丁二烯 C.乙苯 D.乙烯(3)的转化是实现碳中和的重要途经。
如催化氢化可以合成乙醇:①二氧化碳的电子式___________。
乙醇水溶性非常好,可以与水任意比例互溶,其原因是乙醇中的___________(填基团名称)能与水形成___________(填作用力名称)。
②关于该合成反应判断正确的是___________。
A., B.,C., D.,③催化氢化合成甲醇反应的平衡常数的表达式为___________。
④为了加快该反应的速率并提高乙醇的产率,可以采取措施___________(任写一种)。
2.水杨酸及其衍生物具有抑菌作用,其主要合成过程可以表示为:(1)水杨酸的分子式为___________。
(2)水杨酸需密闭保存,其原因是___________。
定量实验【考纲解读】【知识梳理】1. 配制一定物质的量浓度的溶液【例1】用NaCl固体配制500毫升0.1mol/L的NaCl溶液为例:(1)实验目的:配制500毫升0.1mol/L的NaCl溶液(2)实验原理:配制前后NaCl的物质的量相等(3)实验仪器:药匙、电子天平、烧杯、________________________________。
(4)实验步骤:① __________:所需固体溶质的质量为____________克,②___________:用_____________________称取NaCl固体。
③___________:将称取的固体在烧杯中放入适量的蒸馏水用玻璃棒搅拌使溶质全部溶解并_________才能转入到中。
④__________:将烧杯中的溶液注入容量瓶后,还须用蒸馏水洗涤烧杯和玻璃棒____次,并将洗涤后的溶液全部转入容量瓶中。
⑤__________:继续向容量瓶中注入蒸馏水,待至距离液面刻度2~3厘米处;改用_________滴加,直至溶液凹液面的最低点与刻度线相切,塞好瓶塞,反复摇匀。
(5)误差分析:(填“偏大”“偏小”或“没影响”)①不洗涤烧杯、玻璃棒,会造成所配制的溶液浓度_______;②先定容后上下倒置摇匀,发现液面低于刻度线时,再加水至刻度线,则所配制溶液的浓度_______;③定容时加水过多,又用滴管把多余的溶液吸出少许,所得溶液浓度_______;④转移溶液前容量瓶内已存有少量蒸馏水未将其倒掉,所配溶液浓度_______;⑤在溶解、转移和洗涤过程中,溶液溅到容器外,则所配制的溶液浓度_______。
2. 气体摩尔体积的测定(测定某温度下1mol氢气的体积)(1)实验目的:测定某温度下1mol氢气的体积(2)实验原理:V m = ________________________________________(其中V排—液体量瓶中液体的体积,V H2SO4—注入硫酸的体积,V抽—第二次抽出气体的体积,M镁—称取镁条的质量,M镁—镁的相对原子质量)(3)实验仪器:化学反应气体体积测定仪(由三部分组成:_________、_________、_________、针筒)(4)实验步骤:①连接装置,检查_________________;②精确称取镁条的质量____________________克;③气体发生器内加入20mL水,目的是_________________,然后加入镁带。
④第一次抽气,目的是_____________________________________________________。
⑤用针筒加入10mL 3nol/L硫酸,读出、记录_____________中液体的体积;⑥第二次抽气,目的是____________________________________________________。
⑦记录数据,重复实验。
(5)误差分析:①镁带表面的氧化膜没有除尽,结果______________;②测定仪装置漏气,结果_________________;③镁带中含有跟硫酸不反应的杂质,结果________________。
3. 结晶水含量的测定(重量法)【例4】以测定硫酸铜晶体结晶水的含量为例:(1)实验目的:测定CuSO4 · xH2O晶体中的_________的值(2)实验原理:CuSO4 · xH2O →CuSO4 + xH2O(用m0、m1、m2来表示)(m0:瓷坩埚的质量,m1:瓷坩埚与晶体的质量,m2:瓷坩埚与无水硫酸铜的质量)(3)实验仪器:研钵、瓷坩埚、坩埚钳、铁架台、泥三角、____________________________(4)实验步骤:①研磨:在____________中硫酸铜晶体研碎;②称量:先准确称量干燥的____________的质量,并用此仪器准确称取一定质量的已研碎的硫酸铜晶体。
③加热:将盛有硫酸铜晶体的________放在____________上,用酒精灯缓慢加热,同时用____________轻轻搅拌硫酸铜晶体,直到蓝色硫酸铜晶体失去全部结晶水(由____色完全变为_____色),且不再有水蒸气逸出;④冷却称量:将______用__________取下并及时放在___________内冷却后称量。
⑤恒重:把上述仪器和药品再次加热,待再放入______________里冷却后再称量,记下质量(m4),直至连续两次称量的质量相差不超过____________g为止。
⑥计算:根据实验测得的结果求硫酸铜晶体中结晶水的x值:(5)误差分析:【分析CuSO4·xH2O中的x值】(填“偏大”、“偏小”或“没影响”)①用来做实验的坩埚在称量前不干燥:_______;②坩埚内附有不挥发也不易分解的杂质:_______;③所称量的硫酸铜晶体表面带有水份:_______;④晶体不纯,含有不易挥发也不易分解的杂质:_______;⑤晶体并未研成细粉末(或粉末未完全变白就停止加热):_______;⑥加热时间过长,已有部分变灰黑:_______;⑦加热后并未放在指定的容器中冷却,而是放在空气中冷却:_______;⑧加热过程中搅拌不及时不均匀,有少量晶体溅出:_______;⑨两次称量的相差值>0.1g:_______。
4. 中和滴定(酸碱中和滴定)(称为“滴定法”或容量法)(1)实验目的:用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)【例5】用已知浓度的盐酸来滴定未知浓度的NaOH溶液为例(2)实验原理:c(NaOH) = _____________________[用V(HCl)、c(HCl)、V(NaOH)来表示](3)实验仪器:滴定管夹、铁架台、______________________________(4)指示剂的选择:指示剂的用量为滴①若锥形瓶中装的是碱溶液,则用________________指示剂;变色情况_____________;②若锥形瓶中装的是酸溶液,则用________________指示剂;变色情况_____________;(5)实验步骤:①准备阶段:查漏:检查滴定管的活塞是否_____________润洗:先用______________洗涤2~3次,再用_____________润洗2~3次。
赶气泡:调整液面:滴定管里液体的液面在__________或略低于______________。
②滴定阶段:滴定时,左手控制___________,右手摇动___________,眼睛注视_____________________,滴定开始时可以快些,随着滴定进行,速度逐渐__________,最后要_______加入。
当看到指示剂的颜色发生了变化且在_______________________ 时即可判断为到达滴定终点。
③记录数据:记录数据要保留小数点后_______位有效数字,同一样品至少滴定两次,取两次测定数据的_____。
(6)误差分析(以标准浓度盐酸滴定未知浓度NaOH溶液为例来分析,滴定管中装盐酸)①滴定前,所用的滴定管在用蒸馏水洗净后未用标准液润洗:_______;②滴定前,滴定管的尖嘴部位有气泡,滴定后气泡消失:_______;③滴定用的锥形瓶用水洗净后又用待测液润洗了一遍:_______;④取用待测液的移液管用蒸馏水洗涤后,未用待测液润洗:_______;⑤将移液管内的液体放入锥形瓶时,尖端的残留液吹入锥形瓶中:_______;⑥滴定过程中,锥形瓶振荡太剧烈,有少量溶液溅出:_______;⑦向锥形瓶内注入待测液时发现锥形瓶内有少量蒸馏水:_______;⑧滴定前仰视读数,滴定后平视刻度读数:_______;⑨刚看到指示剂发生颜色变化后立即停止滴定并记录数据:_______。
6.实验误差:(1)系统误差:产生系统误差的主要原因有:①仪器刻度不准;②试剂不纯;③个人的习惯与偏好(2)偶然误差:是由一些难以控制、无法避免的偶然因素造成的,其大小与正负值都不固定。
如温度、湿度等的影响。
偶然误差可用_______________________________方法减小。
(3)过失误差:主要是由于实验人员粗心大意所致,这种过失是能避免的。
多次进行平行实验的目的就是为了减小__________误差。
【水平诊断1】1.医用生理盐水是质量分数为0.9%,物质的量浓度是0.154mol/L,现欲配制此溶液1L。
(1)配制过程用到的仪器有:托盘天平、烧杯、玻璃棒、____________和______________。
(2)如果转移过程中,不慎将烧杯中的溶液洒落于容量瓶外或加水超过刻度线,其处理方法为________________________。
(3)在配制过程中,其它操作都正确,下列操作会引起误差偏高的是____________。
A.未洗涤烧杯和玻璃棒B.容量瓶不干燥,含有少量水C.定容时俯视刻度线D.定容时仰视刻度线;2. 右图是气体摩尔体积测定装置。
(1)指出测定装置中仪器名称:a.__________________ ;b. __________________使用该装置前必须作的第一步操作为__________________________________________________________。
(2)为测定1mol氢气的体积,实验时,在气体发生器中,先加入称取除去表面氧化膜的镁带0.120 g,用橡皮塞塞紧。
用______________(填仪器名称)在加料口将10.00mL稀硫酸加入气体发生器中,产生的氢气会把a中的液体压入b中,读出b中液体数据,转化成H2体积。
(3)测定操作中三次用到注射器,依次为:第一次,第二次__________,第三次____________。
(选填序号)a.从A瓶加料口抽气,使B瓶中导管内外液面持平b.向A瓶内加入稀硫酸(4)测得的标准状况时气体的摩尔体积的表达式为______________________。
3.根据实验室中测定硫酸铜晶体结晶水含量的实验,填写下列空白。
(1)从下列仪器选出所需仪器___________________________(用标号字母填写)A.电子天平;B.研钵;C.试管夹;D.酒精灯;E.蒸发皿;F.玻璃棒;G.坩埚;H.坩埚钳;I.石棉网;J.三脚架除上述仪器外,还需要的仪器是____________________________________。
(2)某学生实验后得到以下数据:请写出结晶水含量(n)的计算公式(用W1、W2、W3表示):n=________________________,该生测定结果是偏高还是偏低?____________。