机械分离过程
- 格式:ppt
- 大小:12.93 MB
- 文档页数:106

化工工艺分离过程解析摘要:在中国的化学生产行业中,生产相关化学产品所涉及的一些原材料和最终产品实际上需要分离和纯化。
这一分离措施几乎是任何化学生产系统实施中不可错过的核心环节。
因此,在化工过程的实际应用中,必须最大限度地保证分离方法的合理性,选择最佳的分离技术,从而大大降低不同环节的成本,这是实施分离顺序的一个至关重要的综合目的。
本文主要对化学过程分离过程进行了分析和研究。
关键词:化学技术;生产;分离技术前言:在当前我国化学工业快速发展的过程中,为了保证化学产品的质量,人们采用分离提纯的方法对原料进行相应的处理,从而有效控制化学工艺生产的成本。
目前,分离技术在中国化学工业的发展中具有重要意义。
它不仅保证了化工生产原料的质量,而且有效地提高了化工产品的质量,从而提高了化工行业的经济效益和社会效益。
以下是化学过程分离的介绍。
一、化学分离过程概述化工生产中常用的分离过程基本上可分为三大类,第一类是以能量为分离剂,例如精馏、蒸发、结晶、干燥、闪蒸等;第二类是以物质为分离剂,例如解吸、吸收、萃取、吸附、离子交换等;第三类是利用物质的密度、粒度、表面等性质不同而进行的机械分离过程,例如沉降、离心分离、过滤、浮选等过程。
在以上分离方法中,精馏方法往往是首选的分离方法,是实现传质分离的重要手段,通过对精熘分离过程流程合理设计以降低各项费用,是精馏分离序列综合的主要内容。
二、化学分离工艺的分类和特点化学生产中常用的分离工艺可分为机械分离和传质分离。
机械分离过程的分离对象是由两个或多个相组成的混合物。
目的只是将每个阶段分开。
只要使用简单的机械方法,两个相就可以分离,并且两个相之间没有物质转移;例如,过滤、沉淀、离心分离、旋风分离和静电沉淀。
传质分离过程用于分离各种均相混合物,其特征是传质。
根据物理和化学原理的不同,工业中常用的传质和分离过程可分为平衡分离过程和速率分离过程,即从物质中分离能量的过程。
2.1化学平衡分离过程在该方法中,利用分离介质将均质混合物系统转化为两相系统,然后根据两相系统中混合物中各组分的不同分布实现相平衡分离。

第一章 绪论分离过程的分类:机械分离、传质分离机械分离:处理两相以上的混合物如过滤、沉降、离心分离等 传质分离:处理均相混合物传质分离可分为:平衡分离过程如精馏、吸收、萃取、结晶、吸附等,借助分离剂使均相混合物系统变成两相系统,再利用混合物中各组分在处于相平衡的两相中的不等同分配而实现分离。
速率分离过程如微滤、超滤、反渗透、电渗析等,在某种推动力(浓度差、压力差、温度差、电位差等)的作用下,利用各组分扩散速率的差异实现分离。
分离媒介:能量媒介ESA 、质量媒介MSA第二章 单级平衡过程相平衡关系:混合物所形成的若干相保持物理平衡而共存的状态。
热力学:整个物系的自由能最小。
动力学:相间表观传递速率为零。
相平衡条件(准则):各相的温度相等、压力相等,每个组分的化学位相等。
相平衡常数:i i i x y K /= 分离因子:ji j i j i ij K K/x x /y y ==α,平衡分离过程,常采用分离因子表示平衡关系。
相对挥发度对温度和压力变化不敏感,常视为常数,简化计算。
分离因子与1的偏离程度表示组分间分离的难易程度。
相平衡方程:C 个 C 1,2,...,i ==i i i x K y 摩尔分率加和方程:2个0.11=∑=Cii x0.11=∑=Cii y汽液平衡常数关联式: C 个 C 1,2,...,i ),,,(==y x P T f K i 泡点方程: ()011=-=∑=Ciii x K Tf泡点压力的计算:泡点方程: ()011=-=∑=Ciii x K pf露点方程:()0.1/1=∑=cii i K y 闪蒸过程:连续单级蒸馏过程。
它使进料混合物部分汽化或冷凝得到含易挥发组分较多的蒸汽和含难挥发组分较多的液体。
物料衡算—M 方程 C 个 ,...C ,i Vy Lx Fz i i i 21=+= 相平衡—E 方程 C 个 C i x K y i i i ,...2,1== 摩尔分率加和式—S 方程 2个11=∑=Cii x11=∑=Cii y热量平衡式— H 方程 1个 L V F LH VH Q FH +=+设计前需预先给定数值的变量称为设计变量。

分离工程习题 一、填空: 1、分离过程分为(机械分离方法)和(传质分离)两大类。
2、传质分离过程分为(平衡分离过程)和(速率分离过程)两大类。
3、分离剂可以是(能量)和(物质)。
4、机械分离过程是(过滤、离心分离)、旋风分离、静电除尘 5、速率分离过程是超滤、渗析(膜分离、渗透)。
6、平衡分离过程是(吸收、萃取)、精馏、蒸发。
7、气液平相衡常数定义为(气相组成与液相组成的比值)。
8、理想气体的平衡常数与(组成)无关。
9、活度是(修正的)浓度。
10、低压下二元非理想溶液的相对挥发度α12等于(022011p p γγ)。
11、气液两相处于平衡时,(化学位)相等。
12、Lewis 提出了等价于化学位的物理量(逸度)。
13、逸度是(修正的)压力。
14、在多组分精馏中塔顶温度是由(露点方程)方程求定的。
15、露点方程的表达式为(∑=1K /y i i )16、泡点方程的表达式为(∑=1x K i i )。
17、泡点温度计算时若1x K i i >∑,温度应调(小)。
18、泡点压力计算时若1x K i i >∑,压力应调(大)。
19、在多组分精馏中塔底温度是由(泡点)方程求定的。
20、绝热闪蒸过程,节流后的温度(降低)。
21、若组成为Z i 的物系,1K /Z 1Z K i i i i >∑>∑且时,其相态为(气液两相)。
22、若组成为Z i 的物系,1Z K i i <∑时,其相态为(过冷液相)。
23、若组成为Z i 的物系,1K /Z i i <∑时,其相态为(过热气相)。
24、绝热闪蒸过程,饱和液相经节流后会有(气相)产生。
25、设计变量与独立变量之间的关系可用下式来表示(Ni =Nv -Nc )。
26、设计变量分为(固定设计变量)与(可调设计变量)。
27、回流比是(可调)(固定、可调)设计变量。
28、关键组分的相挥发度越大,精馏过程所需的最少理论板数(越少)。

分离过程绪论:1:分离过程:1:机械分离:用于两相混合物;如过滤、沉降、离心分离、旋风分离、静电除尘 2:传质分离:用于均相混合物;1:平衡分离过程:借助分离媒介(能量(ESA )媒介和物质(MSA )媒介)使变成两相系统。
例子:闪蒸、部分冷凝、精馏、萃取精馏、吸收蒸出、解吸、共沸精馏、液液萃取、干燥、蒸发、结晶、升华、浸取、吸附、离子交换、泡沫分离、区域熔炼、膜萃取2:速率分离过程:借助某种推动力(浓度差、压力差、温度差、电位差) 例子:微滤、超滤、反渗透、渗析、电渗析、气体分离、渗透蒸发、乳化液膜 (均为膜分离)2:设计变量:在计算前应该指定的物理量(1) 总变量数Nv :一个C 组分数的物流:每1股物流独立变量数为:c+2 (c+3-1)系统总变量数 Nv :Nv= nm (C+2)+nw+nqNv= 4(C+2)+1+2 = 4(C+2)+3(2) 约束(条件)数N C:1) 物料平衡约束:一个C 组分的物流有C 个物衡算式。
2) 能量平衡约束:对于和外界无机械能交换的分离过程有1个热衡算程。
3) 相间分配关系的约束:C 组分汽液平衡体系有C 个相间分配关系。
4) 固有约束:它们的温度、压力相等,这样就有两个固有约束。
(3) 设计变量数Ni : 为固定设计变量 如:进料物流的变量(流量、组成、温度和压力)及系统的压力。
为可调设计变量 真正需要设计者确定的变量1:单元的设计变量:单元(或基元)——“e ”分离过程中的单元可分为两大类:1:单元中无浓度变化:每一物流都只有三个独立变量。
通常考虑取流率、温度和压力。
2:有浓度变化的单元:描述一个单相物料的独立变量数及一个两相(互成平衡)物料的独立变量数都是c+2。
3:几种重要综合单元:1)串级单元:一块理论板可看作为混合器+分相器2)侧线采出板:是理论板和分配器的组合。
3)加料板单元:是一个分相器和两个混合器组成的综合单元。
c V i N N N -=a x i N N N +=aNx N ec eV e i N N N -=exe a e i N N N +=1=e a N 1=e a N 0=ea N 1=ua N 1=ua N2:装置的设计变量:装置的设计变量——“u ”(1)装置的设计变量总数Niu精馏塔的精馏段和提馏段分别是一个串级单元,所以精馏塔Nr =2 。

第一章定义:分离工程就是将混合物分离成两种或两种以上较纯物质的一门工程技术学科。
按分离过程中有无物质传递现象发生:1、机械分离过程 对象:非均相混合物 特点:用机械法将非均相物系分离,而相间并无物质传递发生 2、传质分离过程 特点:相间有质量传递现象平衡分离 利用两相平衡组成不等的原理:常采用平衡级(理论板)作为处理手段,并把其它影响归纳于效率中。
速率分离 利用溶液中不同组分在某种推动力(如压差、浓度差、电位差)作用下经过某种介质(如半透膜)时的传质速率(透过率、迁移率、扩散速率)差异而实现分离 特点:所处理的物料和产品属于同一相态,仅有组成的差别。
通用 根据汽液相平衡组成将实际分离设备所能达到的分离因子与理想分离因子之间的差别用效率来表示: 效率第二章 吸收的定义:吸收是利用液体溶剂对气体混合物中各组分溶解度的差异来分离气体混合物的过程。
吸收的类别: 物理吸收 化学吸收 吸收过程:吸收→吸收塔 解吸→再生塔 解吸方法(1)减压冷再生(2)气提冷再生(3)间接蒸汽热再生气液相平衡---热力学体系:等T ,等P 下: 又 则 气相 液相 平衡时 ―― 气液平衡常数 大多数气液吸收过程中溶剂的温度高于气体的T C ,此时,气体不再被冷凝而只是溶解于液相: 其中 饱和液体的逸度=饱和蒸汽的逸度Pis 为纯物质i 的饱和蒸汽压。
理想溶液 低压下:Pei (平衡分压)代替f i G 则 亨利定律 若以浓度Ci 代替xi ,则: 其中 C M 溶液的总摩尔浓度 高压下 其中:Hi 为溶液中i 组分的标准态逸度,Pi 为纯物质i 的压力。
xi (溶质浓度)非常小的非电解质溶液 其中:x 0为溶液中吸收剂的摩尔分率(x0=1-xi ), A 为常数,是温度、压力的函数。
对于理想溶液,A=0化学反应平衡常数 理想溶液Kr=1 其中溶解时相平衡服从亨利定律: 连解得 ①:物理溶解,H A ②:化学反应,K A 化学平衡根据K A 求C A ,再根据亨利定律求P A 双膜论 可简化为 Fick 定律如下: G Li i μμ=ln ()i i RT f T μλ=+GL i if f ∧∧=G i i i f P y φ∧∧=L L i i i i f f x γ∧=G L i if f ∧∧=L i i i i iP y f x φγ∧=Li i i i ii y f m x p γφ∧==ln ()L is i i v i f V p p f RT -=-v s i i f f=G i i if H x ∧=ei i i p H x =ei i i p H C '=i i M H H C '=()ln ln G i i i i i f V P P H x RT ∧--=+20ln ln (1)Gi i i f A H x x RT ∧=--/m n M N a a b A B a a K K K a a γ==m n /M N a b A BC C K C C =m n M N a bA B K γγγγλ=/A A A p H C =/1//()m n aM N A A bBC C p H K C =A A C N dz dz t z ∂∂=-∂∂)()(Ai Al l Ai Al lAB l Ai Al AB AABA C C k C C D C C D zC D N -=-=--=∂∂-=δδA AC N t z∂∂-=∂∂j i j i ij x x y y =α对于液相 对于气相 渗透论 物料衡算+费克定律 可得到 求解得其中 l 正比表面更新论 模型参数S (表面更新率) 传质总系数 K G 和K L双膜论的要点1) 传质在稳态下进行;2) 传质阻力集中在相界面两侧的滞留膜中,膜内进行分子扩散传递;3) 相界面保持气液平衡, 无界面阻力。

分离机、离心机分离过程分离机、离心机分离过程::工业生产中,常常需要把悬浮液和乳浊液中的固体颗粒和液体分离,以满足不同的工艺目的。
凡是利用离心力来分离固—液、液—液以及液—液—固混合物的机械统称为离心机,它是一种典型的化工机器。
采用离心机进行分离的过程一般可分为离心过滤、离心沉降和离心分离三种。
1、离心沉降过程。
离心沉降常用于分离固体含量较少而且颗粒较细微的悬浮液。
转鼓壁上是不开孔的。
当悬浮液随着转鼓一起高速旋转时,其中固体颗粒由于离心力的作用向鼓壁沉降,积在外层,而液体则留在内层。
2、离心分离过程。
离心分离常用于分离两种密度不同的液体所形成的乳浊液或含有极微量固体颗粒的悬浮液。
在离心力的作用下,液体按密度不同分为里外两层,密度大的在外层,密度小的在里层,通过一定的装置将它们分别引出;固相则沉于鼓壁上,间歇排出。
其转鼓壁也是不开孔的。
3、离心过滤过程。
离心过滤通常用于固相含量较高、颗粒较大的悬浮液的分离。
过滤式离心机转鼓壁上有孔,一般转鼓内壁上衬有金属底网及滤网。
转鼓回转时,液体因离心力的作用透过滤渣、过滤介质(滤网)、底网及转鼓小孔甩出鼓外,固体被截留在转鼓内的滤网上形成滤渣,随着转鼓不停地转动,滤渣层在离心力作用下被逐步压实,其孔隙中的流体则在离心力的作用下,被不断甩出,最后得到较为干燥的滤渣。
4、分离因数。
当一物体绕一中心轴作匀速圆周运动时,则有向心力作用于该物体上,力的方向沿半径指向轴心,根据牛顿第三运动定律知,必将会产生一个大小相等,方向相反的力,此力称为离心力。
离心力随着转鼓的旋转不断改变方向,故离心力即物体运动方向改变。
本文由欣惠泽奥提供。

三、名词解释1、分离过程 : 将一混合物转变为组成互不相同的两种或几种产品的那些操作。
2、分离工程: 研究分离过程中分离设备的共性规律,分离与提纯的科学。
3、传统分离过程的绿色化:对过程(如蒸馏、干燥、蒸发等)利用系统工程的方法,充分考虑过程对环境的影响,以环境影响最小(或无影响)为目标,进行过程集成。
4、传质分离过程:一类以质量传递为主要理论基础、用于各种均相混合物分离的单元操作。
可分为平衡分离过程和速率分离过程两大类,遵循物质传递原理。
5、平衡分离过程:大多数扩散分离过程是不相溶的两相趋于平衡的过程,而两相在平衡时具有不同的组成,这些过程称为平衡分离过程。
6、速率控制分离过程::利用溶液中不同组分在某种推动力的作用下,经过某种介质时的传质速率差异而实现分离的过程。
7、泡点温度:是指液体在恒定的外压下,加热至开始出现第一个气泡时的温度。
8、露点温度:在恒压下冷却气体混合物,当气体混合物开始凝聚出第一个液滴时的温度。
9、汽化率:液体汽化所减少的质量占原液体质量的比率。
10、液化率:e=液化量/总加入量=L/F11、分离因子: 表示任一分离过程所达到的分离程度 表示组分i 及j 之间没有被分离 表示组分i 富集于1相,而组分j 富集于2相表示组分i 富集于2相,而组分j 富集于1相12、分离剂 : 在两种相同的或不同的材料之间、材料与模具之间隔离膜,使二者间不发生粘连,完成操作后易于分离的液剂。
种类为:(1)石膏分离剂(2)树脂分离剂(3)蜡分离剂 (4)其他分离剂如硅油、凡士林等。
13、固有分离因子: αij 称为固有分离因子,也称相对挥发度,它不受分离设备的影响。
14、机械分离过程:分离对象为两相以上的混合物,通过简单的分相就可以分离,而相间并无物质传递发生。
15、膜分离:是利用液体中各组分对膜的渗透速率的差别而实现组分分离的单元操作。
16、关键组分:由设计者指定浓度或提出分离要求的两个组分称为关键组分。


第一部分 填空题非常全的一份复习题, 各个方面都到了。
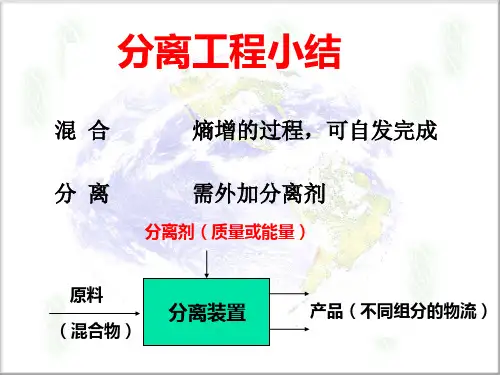
1. 分离作用是由于加入(分离剂)而引起的,因为分离过程是(混合过程)的逆过程。
2. 衡量分离的程度用(分离因子)表示,处于相平衡状态的分离程度是(固有分离因子)。
3. 分离过程是(混合过程)的逆过程,因此需加入(分离剂)来达到分离目的。
4. 工业上常用(分离因子)表示特定物系的分离程度,汽液相物系的最大分离程度又称为(理想分离因子)。
5. 固有分离因子是根据(气液相平衡)来计算的。
它与实际分离因子的差别用(板效率来表示。
6. 汽液相平衡是处理(汽液传质分离)过程的基础。
相平衡的条件是(所有相中温度压力相等,每一组分的化学位相等)。
7. 当混合物在一定的温度、压力下,满足(1,1 ∑∑iK i z i z i K )条件即处于两相区,可通过(物料平衡和相平衡)计算求出其平衡汽液相组成。
8. 萃取精馏塔在萃取剂加入口以上需设(萃取剂回收段)。
9. 最低恒沸物,压力降低是恒沸组成中汽化潜热(小)的组分增加。
10. 吸收因子为( A=L/KV ),其值可反应吸收过程的(难易程度)。
11. 对一个具有四块板的吸收塔,总吸收量的80%是在(塔顶釜两块板 )合成的。
12. 吸收剂的再生常采用的是(用蒸汽或惰性气体的蒸出塔),(用再沸器的蒸出塔),(用蒸馏塔)。
13. 精馏塔计算中每块板由于(组成)改变而引起的温度变化,可用(泡露点方程)确定。
14. 用于吸收过程的相平衡关系可表示为( L = AV )。
15. 多组分精馏根据指定设计变量不同可分为(设计)型计算和(操作)型计算。
16. 在塔顶和塔釜同时出现的组分为(分配组分)。
17. 吸收过程在塔釜的(i N x i K iN y ,,1≥+ ),它决定了吸收液的(该组分的最大浓度)。
18. 吸收过程在塔顶的限度为(ix i K i y ,0,1≤ ),它决定了吸收剂中(自身挟带)。
19. 限度为(吸收的相平衡表达式为(L = AV ),在(温度降低、压力升高)操作下有利于吸收,吸收操作的限度是(i N x i K iN y ,,1≥+,ix i K i y ,0,1≤ )。

重点:掌握分离过程的特征,分离因子和固有分离因子的区别,平衡分离和速率分离的原理。
难点:用分离因子判断一个分离过程进行的难易程度,分离因子与级效率之间的关系。
•1、说明分离过程与分离工程的区别?•2、实际分离因子与固有分离因子的主要不同点是什么?•3、怎样用分离因子判断分离过程进行的难易程度?•4、比较使用ESA与MSA分离方法的优缺点。
•5、按所依据的物理化学原理不同,传质分离过程可分为那两类?•6、分离过程常借助分离剂将均相混合物变成两相系统,举例说明分离剂的类型. 1、下列哪一个是机械分离过程()(1)蒸馏(2)吸收(3)膜分离(4)离心分离2、下列哪一个是速率分离过程()(1)蒸馏(2)吸附(3)膜分离(4)沉降3、下列哪一个是平衡分离过程()(1)蒸馏(2)热扩散(3)膜分离(4)离心分离1、分离技术的特性表现为其()、()和()。
2、分离过程是(混合过程)的逆过程,因此需加入()来达到分离目的。
3、分离过程分为()和()两大类4、分离剂可以是()或(),有时也可两种同时应用。
5、若分离过程使组分i及j之间并没有被分离,则()。
6、可利用分离因子与1的偏离程度,确定不同分离过程分离的()。
7、平衡分离的分离基础是利用两相平衡(组成不等)的原理,常采用()作为处理手段,并把其它影响归纳于()中。
8、传质分离过程分为()和()两类。
9、速率分离的机理是利用溶液中不同组分在某种()作用下经过某种介质时的()差异而实现分离。
10、分离过程是将一混合物转变为组成()的两种或几种产品的哪些操作。
11、工业上常用()表示特定物系的分离程度,汽液相物系的最大分离程度又称为()。
12、速率分离的机理是利用传质速率差异,其传质速率的形式为()、()和()。
13、绿色分离工程是指分离过程()实现。
14、常用于分离过程的开发方法有()、()。
1、分离过程是一个()a.熵减少的过程;b.熵增加的过程;c.熵不变化的过程;d. 自发过程2、组分i、j之间不能分离的条件是()a.分离因子大于1;b.分离因子小于1;c.分离因子等于13、平衡分离的分离基础是利用两相平衡时()实现分离。
器械分离处理方法器械分离,顾名思义,是指将器械从其他物质中分离出来的过程。
在工业、实验室和日常生活中,我们经常需要处理各种类型的器械,而这些器械往往与其它物质紧密结合,难以分离。
因此,掌握正确的器械分离处理方法就显得尤为重要。
本文将详细介绍器械分离的概念、原因、重要性,以及不同类型器械的分离方法、操作步骤与技巧、影响因素、实际应用与案例展示,以期为读者提供全面而深入的参考。
一、器械分离的概念、原因和重要性器械分离是指将器械从与其结合的物质中分离出来的过程。
在工业生产、实验室研究以及日常生活中,我们经常需要处理各种类型的器械,如金属零件、玻璃器皿、塑料制品等。
这些器械在制造、使用和废弃过程中,往往会与其它物质紧密结合,难以分离。
例如,金属零件可能因为长期使用而沾满了油污和锈迹;玻璃器皿可能因为化学反应而附着了大量沉淀物;塑料制品则可能因为老化而与所接触的物质形成了牢固的粘合。
在这种情况下,正确的分离方法不仅可以帮助我们获得清洁的器械,而且对于环境保护、资源回收和安全性也具有重要意义。
一方面,清洁的器械可以提高其使用寿命和性能;另一方面,正确分离可以减少对环境的污染,实现资源回收和再利用。
二、器械分离方法根据不同的分离原理,器械分离方法主要可分为机械分离、化学分离和物理分离三种。
这三种方法在原理、适用范围和优缺点上存在明显差异。
1. 机械分离机械分离主要是通过外力作用,使器械与结合物质之间产生松动或分离。
常见的机械分离方法包括刷洗、刮擦、破碎等。
这种方法的优点是简单易行,适用于大型或表面较粗糙的器械;缺点是对小型或表面光滑的器械效果不佳,且容易造成损伤。
2. 化学分离化学分离主要是利用化学反应原理,使结合物质溶解、分解或氧化,从而达到分离目的。
常见的化学分离方法包括酸洗、碱洗、氧化还原等。
这种方法的优点是适用范围广,对各种类型的器械均可使用;缺点是化学试剂可能对环境造成污染,且处理不当可能对器械造成腐蚀。
如何用机械法获得原生质体的方法
首先,机械法获得原生质体的方法通常涉及细胞破碎和分离步骤。
最常见的方法是通过离心来分离原生质体。
首先,将细胞悬浮
液置于高速离心管中,然后以高速离心来分离细胞器。
这种方法可
以将细胞器按照密度差异分离出来,包括原生质体。
其次,另一种常见的方法是使用震荡器或超声波机械破碎细胞,然后通过不同的离心步骤来分离原生质体。
这种方法通过机械力将
细胞破碎,然后利用离心来分离原生质体。
此外,还可以利用研磨和过滤的方法来获得原生质体。
通过将
细胞悬浮液置于研钵中,使用研钵和研棒对细胞进行研磨,然后通
过过滤的方法分离出原生质体。
另外,也可以利用超低温破碎的方法来获得原生质体。
通过将
细胞置于液氮中,使细胞迅速冷冻并变脆,然后通过机械力破碎细胞,最终分离出原生质体。
总的来说,机械法获得原生质体的方法多种多样,可以根据实
验需要选择合适的方法。
需要注意的是,在操作过程中要注意细胞
的完整性和原生质体的纯度,以确保获得的原生质体适合后续的实验应用。
希望以上回答能够帮助你理解如何用机械法获得原生质体的方法。
石油化工行业学习资料——分离过程(基础)1、相平衡定义由混合物或溶液形成若干相,这些相保持物理平衡而共存状态。
热力学上看物系的自由焓最小;动力学上看相间表观传递速率为零。
2、分离过程的特征分离某种混合物成为不同产品的过程,是个熵减小的过程,不能自发进行,因此需要外界对系统作功(或输入能量)方能进行。
分离因子表示任一分离过程所达到的分离程度。
3、萃取精馏与共沸精馏的相同点和不同点是什么?(1)相同点:都是加入溶剂改变原溶液的相对挥发度,使其可以用精馏方法分离。
(2)不同点:①可供选择的共沸剂数目远不及萃取剂多,且萃取剂用量不像共沸剂受限制;②共沸剂从塔顶蒸出,萃取剂从塔底出,因此消耗能量多;③共沸精馏受组成限制,操作条件比较苛刻,萃取精馏可在较大范围变化,操作比较容易,流程较简单,只用于连续操作;④同样压力下共沸精馏温度低,适于热敏性物料。
4、超临界萃取定义?超临界萃取是利用流体在临界点附近所具有的特殊溶解性能进行萃取的一种化工分离技术。
在超临界状态下,将超临界流体(SCF)与待萃取的物质接触,利用超临界流体的高渗透性、高扩散性和高溶解能力,对萃取物中的目标组分进行选择性提取,然后借助减压、升温的方法,使超临界流体变为普通气体,被萃取物质则基本或完全排出,从而达到分离提纯的目的。
超临界流体与萃出物的分离方法有3种:恒温加压溶质与气体分离、恒压升温溶质与气体分离、吸附分离(在分离器中加入吸附剂吸附不需要的溶质后,萃取物的目标产物与气体分离)。
超临界流体是温度及压力均处于临界点以上的流体。
5、超临界流体的特性?①处于临界点的状态可实现液态到气态的连续过度;②无论多大压力都不会使其液化;③具有接近于液体的密度和类似于液体的溶解能力,还具有类似于气体的高扩散性、低粘度、低表面张力等特性。
影响萃取效率的因素除萃取物的特性外,主要决定于超临界流体的温度、压力及改性剂的种类和含量。
一般而言,增大压力可提高SCF的浓度,有利于萃取;升高温度可提高溶质的溶解度,有利于溶质的扩散。
分离过程绪论:1:分离过程:1:机械分离:用于两相混合物;如过滤、沉降、离心分离、旋风分离、静电除尘 2:传质分离:用于均相混合物;1:平衡分离过程:借助分离媒介(能量(ESA )媒介和物质(MSA )媒介)使变成两相系统。
例子:闪蒸、部分冷凝、精馏、萃取精馏、吸收蒸出、解吸、共沸精馏、液液萃取、干燥、蒸发、结晶、升华、浸取、吸附、离子交换、泡沫分离、区域熔炼、膜萃取2:速率分离过程:借助某种推动力(浓度差、压力差、温度差、电位差) 例子:微滤、超滤、反渗透、渗析、电渗析、气体分离、渗透蒸发、乳化液膜 (均为膜分离)2:设计变量:在计算前应该指定的物理量(1) 总变量数Nv :一个C 组分数的物流:每1股物流独立变量数为:c+2 (c+3-1)系统总变量数 Nv :Nv= nm (C+2)+nw+nqNv= 4(C+2)+1+2 = 4(C+2)+3(2) 约束(条件)数N C:1) 物料平衡约束:一个C 组分的物流有C 个物衡算式。
2) 能量平衡约束:对于和外界无机械能交换的分离过程有1个热衡算程。
3) 相间分配关系的约束:C 组分汽液平衡体系有C 个相间分配关系。
4) 固有约束:它们的温度、压力相等,这样就有两个固有约束。
(3) 设计变量数Ni : 为固定设计变量 如:进料物流的变量(流量、组成、温度和压力)及系统的压力。
为可调设计变量 真正需要设计者确定的变量1:单元的设计变量:单元(或基元)——“e ”分离过程中的单元可分为两大类:1:单元中无浓度变化:每一物流都只有三个独立变量。
通常考虑取流率、温度和压力。
2:有浓度变化的单元:描述一个单相物料的独立变量数及一个两相(互成平衡)物料的独立变量数都是c+2。
3:几种重要综合单元:1)串级单元:一块理论板可看作为混合器+分相器2)侧线采出板:是理论板和分配器的组合。
3)加料板单元:是一个分相器和两个混合器组成的综合单元。
c V i N N N -=a x i N N N +=aNx N ec eV e i N N N -=exe a e i N N N +=1=e a N 1=e a N 0=ea N 1=ua N 1=ua N2:装置的设计变量:装置的设计变量——“u ”(1)装置的设计变量总数Niu精馏塔的精馏段和提馏段分别是一个串级单元,所以精馏塔Nr =2 。
浓密机的工作原理和过程浓密机是用于矿物浆体固体颗粒沉降和脱水的设备,主要用于矿山、冶金、化工、污水处理等领域。
它根据浆体颗粒的密度差异,通过区别沉降速度来实现颗粒的分离。
浓密机的主要工作原理是利用重力作用使得颗粒沉降,通过机械推动将底部的浆体推向中心底部的排料口,浆体被排出,而固体颗粒则留在浓密机中。
浓密机的过程可以分为入浆、沉降、压滤和排浆四个步骤。
首先是入浆过程。
通过进料管将含有固体颗粒的浆体送入浓密机的上部,浆体在一定压力下进入浓密机的池体中。
接下来是沉降过程。
浆体中的固体颗粒在池体中开始沉降,颗粒的沉降速度取决于其大小、形状和密度。
固体颗粒在重力作用下向池体底部沉降,而清水则向上浮起,形成浓稠的固液分离区。
然后是压滤过程。
固体颗粒堆积在池体底部形成浓稠的浆泥,在机械推动的作用下向池体的中心底部逐渐压缩。
这个过程中,固体颗粒的固体相互间的接触面积增大,有助于进一步排除水分。
最后是排浆过程。
通过排料口将压缩的固浆推出浓密机,形成固体颗粒和水的分离。
固体颗粒被胶束上提升,而清水则流出浓密机。
浓密机的运行稳定性和脱水效果的好坏与诸多因素有关。
首先是浓密机的结构设计和参数选择。
浓密机的直径和高度将影响其容积和处理量,斜槽的角度和长度会影响浆体的流动速度和粘度。
其次是进料浆体的性质。
浆体的粒度、浓度、粘度和比重等都会对浓密机的工作产生影响。
最后是机械和电气控制的可靠性。
浓密机需要保持稳定的机械运行和准确的电气控制,以保证其正常工作。
总结起来,浓密机是一种利用重力作用使固体颗粒沉降和脱水的设备。
它通过入浆、沉降、压滤和排浆四个步骤,实现了固液分离。
然而,浓密机的性能与结构设计、进料浆体性质、机械和电气控制等因素密切相关。
只有在这些因素的充分考虑和合理调整下,浓密机才能稳定运行并获得良好的脱水效果。