组培培养基本操作步骤
- 格式:wps
- 大小:56.50 KB
- 文档页数:12

植物组织培养具体操作二、植物组织培养过程(以菊花叶片为外植体)1、培养基的配制:MS培养基母液的配制:MS培养基含有近30种营养成分,为了避免每次都要对这几十种成分进行称量,可将培养基中的各种成分,按照比例配制成MS培养基干粉,用时直接取用即可。
每42g MS培养基加1L蒸馏水。
MS培养基的配制:取1000mL烧杯,称取42g MS培养基干粉于不锈钢盆中,加水至800ml。
使用电磁炉加热使琼脂溶解,按照要求加入浓度为0.5mg/ml的激素NAA0.2ml,定容至1000ml,用1mol/L NaOH和1mol/L HCl调节pH至6.0。
将配好的培养基迅速分装至150ml组培瓶中,拧上盖子,整齐的放入到高压蒸汽灭菌锅的物料篮内,121℃下灭菌20min。
将培养皿用报纸包好,一起放入灭菌锅进行灭菌。
高压蒸汽灭菌锅的使用注意事项:1、排气管通入到盛水的桶中,避免蒸汽将人烫伤。
2、放入灭菌物品后,拧紧阀门,打开开关进行灭菌。
3、在压力表归零之前切勿试图开盖。
2、接种仪器及器具仪器:超净工作台光照培养箱接种器具杀菌器器具:枪形镊剪刀器具架酒精灯培养皿酒精棉球3、外植体类型实验室做植物组织培养实验时采用的是无菌苗,一般以菊花作为培养对象,其中分为芽培和叶培。
芽培:将无菌苗的带有芽的嫩枝条插入生根培养基,经过培养后直接生长并生根,形成一个大的完整的植株。
达到了扩大繁殖培养的目的。
叶培:使用的是诱导培养基,先将叶片剪碎后接种到培养基上,叶片组织经过脱分化会形成愈伤组织,然后经过再分化形成不定芽,转接到生根培养基上之后继续培养,可生长成为一个完整的植株。
此外还可以用植物其他的离体器官、组织以及细胞等作为外植体,但就我们实验室的条件暂时使用叶和芽作为外植体进行培养。
除无菌的菊花苗外,还可以使用烟草、矮牵牛、小丽花以及百合等无菌苗进行扩大繁殖培养。
它们的培养基添加激素的浓度不一样,其他都相同。
菊花无菌苗示意图用带一个叶和一个芽的嫩枝为外植体,将形态学的下端插入培养基。

植物组织培养的工作流程引言:植物组织培养是一项重要的生物技术,用于研究植物的生长和发育过程,以及培养新的植物品种。
本文将介绍植物组织培养的工作流程,包括材料准备、组织采集、培养基制备、植物培养和结果分析等步骤。
一、材料准备:植物组织培养需要准备一系列材料,包括无菌培养器皿、无菌工具、培养基成分、植物种子或组织等。
这些材料需要提前准备并进行无菌处理,以确保实验的准确性和可靠性。
二、组织采集:在进行植物组织培养之前,需要从植物中采集组织样品。
这些组织样品可以是幼苗的种子、叶片、茎段等。
在采集组织样品时,需要注意避免外界的污染,以及及时将样品转移到无菌条件下进行后续处理。
三、培养基制备:培养基是植物组织培养中至关重要的因素之一。
制备培养基时,需要根据具体实验的要求选择不同的成分和浓度。
一般来说,培养基包括基础培养基、激素和营养物质等。
这些成分需要按照一定比例混合,并加入适量的琼脂糖进行凝固。
四、植物培养:将采集到的植物组织样品转移到培养基中进行培养。
在进行植物培养时,需要注意无菌操作,并将培养器皿密封,放置在恒温培养箱中。
培养过程中,还需要定期观察植物的生长情况,并根据实验需要进行必要的处理,如添加激素、调整培养基成分等。
五、结果分析:植物组织培养的最终目的是获得预期的结果,如新的植株、组织或细胞。
在培养过程结束后,需要对培养结果进行分析和评估。
这可以通过观察植物的形态、结构和生长状态,以及进行细胞学和分子生物学等实验手段来完成。
结论:植物组织培养是一项复杂而有趣的技术,通过对植物组织的培养和生长,可以研究植物的生物学特性并培育新的植物品种。
本文介绍了植物组织培养的工作流程,包括材料准备、组织采集、培养基制备、植物培养和结果分析等步骤。
通过遵循这些步骤,我们可以获得准确可靠的实验结果,并为植物科学研究提供有力支持。

植物组织培养实验基本步骤
1. 材料准备:准备所需的植物材料和培养基。
2. 消毒:消毒植物材料,如叶片、茎段等,以防止细菌和真菌的污染。
3. 器具消毒:消毒实验所需的培养瓶、显微镜片、剪刀等器具。
4. 取材料:用消毒过的器具将所需植物材料取出,例如茎段。
5. 材料处理:将植物材料进行预处理,如切割、消毒或暴露在光线下以诱导发芽等。
6. 培养基制备:根据实验需求准备培养基,培养基是一种富含营养物质的液体或凝胶。
7. 培养瓶准备:将培养基倒入消毒过的培养瓶中,通常是将液体培养基加入到瓶中,然后用胶状凝胶封上。
8. 材料接种:将植物材料放入培养瓶中的培养基中,通常是将茎段插入培养基中或将植物组织切割成小块直接放入培养基中。
9. 培养条件调控:设置适宜的光照、温度、湿度和气体浓度等
培养条件,以促进植物组织的生长和分化。
10. 观察和记录:随着时间的推移,观察植物组织的发育和生长情况,并记录相关的数据。
11. 分离和传代:当组织生长到一定程度时,可以将其分离成更小的部分,并继续在新的培养基上进行培养,以扩增植物组织。
12. 实验结束:当实验达到预定的目标或需要终止时,停止培养,处理培养瓶和实验残余物,如进行消毒处理。
需要注意的是,以上步骤只是植物组织培养实验的一般步骤,具体的实验步骤和条件可能因实验目的和植物种类的不同而有所变化。

植物组织培养概念(广义)又叫离体培养,指从植物体分离出符合需要的组织.器官或细胞,原生质体等,通过无菌操作,在人工控制条件下进行培养以获得再生的完整植株或生产具有经济价值的其他产品的技术。
植物组织培养概念(狭义)指用植物各部分组织,如形成层.薄壁组织.叶肉组织.胚乳等进行培养获得再生植株,也指在培养过程中从各器官上产生愈伤组织的培养,愈伤组织再经过再分化形成再生植物。
组织培养的步骤一、培养基配制配制培养基有两种方法可以选择,一是购买培养基中所有化学药品,按照需要自己配制;二是购买商品的混合好的培养基基本成分粉剂,如MS、B5等。
自己配制可以节约费用,但浪费时间、人力、且有时由于药品的质量问题,给实验带来麻烦。
就目前国内的情况看,大部分还是自己配制。
为了方便起见,现以MS培养基为例介绍配置培养基的主要过程。
1、配制几种母液(1)配制MS大量元素母液一般将大量元素分别配制成100倍的母液,使用时再分别稀释100倍。
分别称取NH4NO3 165g KH2PO4 17gKNO3 190g CaCl2·2H2O 44gMgSO4·7H2O 37g各自配成1L的母液。
倒入1L试剂瓶中,存放于冰箱中。
(2)配制MS微量元素母液一般将微量元素配制成100倍母液。
依次称取KI 0.083g Na2MoO4·2H2O 0.025gH3BO3 0.62g CuSO4·5H2O 0.0025gMnSO4·H2O 1.69g CoCl2·6H2O 0.0025gZnSO4·7H2O 0.86g配成1L母液,倒入1L试剂瓶中,存放于冰箱中。
CuSO4·5H2O和CoCl2·6H2O 由于称取量很小,如果天平精确度没有达到万分之一,可先配成调整液。
分别称取CuSO4·5H2O 0.05g CoCl2·6H2O 0.05g各自配成100ml的调整液,然后取5ml就还有0.0025g的量。
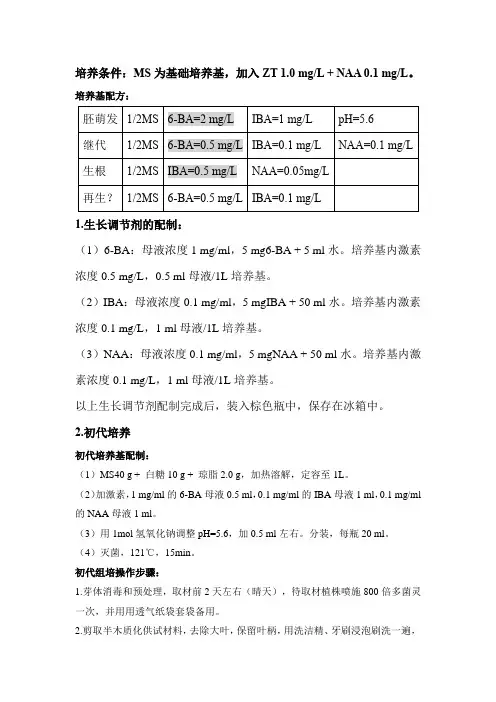
培养条件:MS为基础培养基,加入ZT 1.0 mg/L + NAA 0.1 mg/L。
培养基配方:1.生长调节剂的配制:(1)6-BA:母液浓度1 mg/ml,5 mg6-BA + 5 ml水。
培养基内激素浓度0.5 mg/L,0.5 ml母液/1L培养基。
(2)IBA:母液浓度0.1 mg/ml,5 mgIBA + 50 ml水。
培养基内激素浓度0.1 mg/L,1 ml母液/1L培养基。
(3)NAA:母液浓度0.1 mg/ml,5 mgNAA + 50 ml水。
培养基内激素浓度0.1 mg/L,1 ml母液/1L培养基。
以上生长调节剂配制完成后,装入棕色瓶中,保存在冰箱中。
2.初代培养初代培养基配制:(1)MS40 g + 白糖10 g + 琼脂2.0 g,加热溶解,定容至1L。
(2)加激素,1 mg/ml的6-BA母液0.5 ml,0.1 mg/ml的IBA母液1 ml,0.1 mg/ml 的NAA母液1 ml。
(3)用1mol氢氧化钠调整pH=5.6,加0.5 ml左右。
分装,每瓶20 ml。
(4)灭菌,121℃,15min。
初代组培操作步骤:1.芽体消毒和预处理,取材前2天左右(晴天),待取材植株喷施800倍多菌灵一次,并用用透气纸袋套袋备用。
2.剪取半木质化供试材料,去除大叶,保留叶柄,用洗洁精、牙刷浸泡刷洗一遍,清水冲洗1 h,晾干,将枝条剪成3-5 cm的含2-3个腋芽的茎段。
3常规灭菌,在超净工作台上用75%酒精浸泡30 s,无菌水冲洗3次,每次1 min。
4. 2%次氯酸钠溶液加几滴Tween80,消毒6-15 min,无菌水冲洗3-4次,每次1 min。
5.用无菌滤纸吸干水分,将腋芽部分剥离,接种于无糖初代培养基上,一周后转接。
3.继代培养培养基配制同初代培养。
(1)用75%酒精处理超净工作台台面、搁板、两侧。
(2)将培养基及接种工具等放在超净工作台上,打开紫外灯灭菌30min(3)接种前用75%酒精擦拭培养皿和接种工具,再在火焰上烘烤。

植物组织培养的培养基配制、分装与灭菌一、实验目的1.配制培养基母液是植物组织培养的基本技术。
掌握植物组织培养基母液的配制方法和分装原则与方法。
2.掌握大量元素母液、微量元素母液、铁盐、有机物质、植物激素的配制和灭菌方法。
二、仪器设备及试剂电磁炉天平(0.0001 g) 高压灭菌锅、量筒: 10ml、20ml、100ml、500 ml烧杯: 1000ml、500 ml、250 ml 、移液管: 1ml、2ml、5 ml 吸管若干、记号笔、三角瓶或试管、试管架锡铂纸、玻璃棒配制好的各种母液,如大量元素母液、微量元素母液、铁盐、有机物、生长调节剂等,个别生长调节剂要随配随用。
蒸馏水、pH试纸蔗糖、琼脂等1 molL NaOH溶液、1 mol/L HC1溶液。
三、方法和步骤1.量取所配培养基总体积的2/3体积的蒸馏水,如要配1升培养基,先量取约700 m1体积的水。
2.根据培养基配方,用量筒量取所需要的各种元素的母液。
物质加入体积或重量大量元素母液(10x)100ml 、微量元素母液( 100)1 ml有机物质母液(200x)5ml 、铁盐母液(200x)5 ml、肌醇(200x)5 ml、蔗糖30g、琼脂7g吸取母液时,注意应先将几种母液按顺序排好,不要弄错以免使培养基中药品成分发生改变。
在培养不同的外植体时,应加入不同的激素,如培养康乃馨侧芽或茎段时加入1ml的1mg/ml 的6 BA;而胡萝卜愈伤组织培养中应加入2ml的1mg/ml 的24-D。
加入一种母液后应先搅拌均匀,避免因不均而使局部浓度过高而引起沉淀,琼脂可在加入蔗糖调节完pH值后再加入,此时应注意搅拌,以免琼脂或蔗糖沉淀于烧杯底而炭化。
3.调节培养基的pH值,用pH计或pH试纸测定培养基的pH按照培养材料的要求分别用1moILNaOH溶液、1molL HC1溶液来调节所配制培养基的pH值,- -般培养基的pH值约为5.8,培养的材料不同,对培养基的pH值要求也不同4.分装加热至沸腾片刻,以使琼脂充分溶解,检查时可注意烧杯内溶液是否透明。


组培育苗的流程一、准备工作。
1.1 选好材料。
1.2 配置培养基。
接下来就是配置培养基啦。
培养基就像是植物组织的“小食堂”,里面得有各种各样的营养成分。
像氮、磷、钾这些大量元素,那是必不可少的,就像咱们吃饭得有主食一样。
还有微量元素,虽然量少,但是作用可不小,就好比调料,少了就没味儿。
另外,还得加上植物激素,这就像是给小植物们的“成长激素”,能让它们快快长大、分化。
这个培养基的配置可不能马虎,各种成分的比例得拿捏得死死的,不然就会“差之毫厘,谬以千里”。
二、接种操作。
2.1 消毒处理。
在接种之前啊,咱们得先把选好的植物组织和工具都进行消毒处理。
这就像是进手术室之前得消毒一样,要做到干干净净,一尘不染。
植物组织表面可能有很多细菌、真菌啥的,要是不消毒,这些小坏蛋就会在培养基里捣乱,把咱们的小植物组织给破坏掉。
消毒的时候,那可得严格按照规程来,不能偷工减料。
2.2 接种过程。
然后就是接种啦。
这个过程得小心翼翼的,就像捧着宝贝一样。
用镊子把植物组织轻轻地放到培养基上,动作要轻,可不能把组织给弄伤了。
这就像是把小婴儿放到摇篮里,得轻手轻脚的。
接种的时候,也要注意组织的摆放位置和方向,要让它们在培养基里舒舒服服的,这样才能更好地生长。
三、培养过程。
3.1 光照温度控制。
接种完了,就到了培养阶段啦。
光照和温度可是关键因素呢。
不同的植物对光照和温度的要求不一样,咱们得像伺候小皇帝一样,满足它们的需求。
比如说有些植物喜欢阳光充足的环境,那咱们就得给它足够的光照;有些植物喜欢阴凉的地方,那就不能让它晒太多太阳。
温度也是一样,不能太高也不能太低,得让植物在一个适宜的温度下生长,这就是所谓的“因地制宜”。
3.2 观察与调整。
在培养的过程中啊,咱们得时刻观察植物组织的生长情况。
就像照看自己的孩子一样,得时刻盯着。
如果发现有什么异常,比如说组织变黄了或者是有腐烂的迹象,那就得赶紧调整培养条件。
可能是光照太强了,或者是培养基里的营养成分不够了,咱们就得对症下药,让植物组织重新健康生长起来。

组培的操作流程一、引言组培是一种常见的实验技术,用于研究细胞生物学、药物筛选、组织工程等领域。
本文将介绍组培的操作流程,包括材料准备、培养基配制、细胞处理、培养条件等方面。
二、材料准备1. 培养皿:选择适合的培养皿,如培养瓶、96孔板等。
2. 细胞培养基:根据实验需求选择合适的培养基,如DMEM、RPMI 1640等,并添加适量的血清和抗生素。
3. 细胞:选择需要培养的细胞株或原代细胞。
4. 培养箱:调节好培养箱的温度、湿度和二氧化碳浓度。
三、培养基配制1. 根据培养基配方,称取适量的培养基粉末。
2. 加入适量的去离子水,搅拌均匀。
3. 调节pH值,通常为7.2-7.4。
4. 过滤消毒:使用0.22μm孔径的滤膜将培养基过滤,以去除微生物污染。
5. 将培养基分装至培养皿中,避免接触外界环境。
四、细胞处理1. 细胞解冻:从液氮罐中取出细胞,迅速放入37℃的水浴中解冻。
2. 细胞计数:使用血球计数板或细胞计数仪计数细胞数目。
3. 细胞离心:将细胞离心沉淀,去除上清液。
4. 细胞复悬:加入预先配制的培养基,将细胞悬浮均匀。
5. 细胞接种:将细胞悬浮液加入培养皿中,根据实验需求确定细胞密度。
6. 培养皿处理:轻轻晃动培养皿,使细胞均匀分布在培养皿上。
五、培养条件1. 温度:根据细胞类型选择合适的培养温度,通常为37℃。
2. 湿度:保持培养箱内的湿度,可以通过在培养箱中放置湿度盒或湿纸巾来增加湿度。
3. CO2浓度:根据细胞类型选择合适的CO2浓度,通常为5%。
4. 培养时间:根据实验设计确定培养时间,一般为24小时至数周不等。
5. 培养液更换:根据实验需求和细胞的生长情况,定期更换培养液,以保持细胞的健康状态。
六、细胞观察与实验1. 细胞观察:使用显微镜观察细胞的形态、增殖情况和细胞密度。
2. 细胞实验:根据实验需求进行各种细胞实验,如细胞增殖、细胞凋亡、细胞迁移等。
七、实验结束与结果分析1. 实验结束:根据实验设计和时间安排,结束细胞培养实验。

组织培养的操作流程
一、准备工作:接种人员在正式接种之前要做好准备工作,包括准备灭菌用脱脂棉以及接种工具、分取培养基、接种用苗和工作台灭菌等。
1、工作台灭菌包括两步:一是上台前用紫外灯照射20分钟;二是开机鼓风,正式接种前再用75%酒精仔细擦一遍。
操作人员双手也要用75%酒精擦拭。
2、接种盘的取放:从布袋(报纸)里取出接种盘时,一定要注意,手不能接触接种盘的边沿,同时要尽可能减少与接种盘的接触面,一般规定只能用双手的拇指和食指取放。
二、接(转)苗:包括取苗、切苗和接苗三步。
1、取苗:先拧开培养瓶的瓶盖,最好一次将苗取出,取苗时,瓶口不要斜向外;双手尽量避免再瓶子或者接种盘的正上方移动,若瓶中苗数太多,一次不要全部取出,以免风干。
2、切苗:接种盘在操作台里放置不可太往外;从灭菌器取出镊子和手术刀后放在架子上晾凉;在操作过程中,手术刀和镊子,不可在培养瓶及接种盘正上方操作;在切苗过程中产生的垃圾可堆放在接种盘内的一侧位置上,不可弄到接种盘外。
3、接苗:培养瓶盖要倒放在操作台里,注意手不要接触到盖子及瓶子的内侧,接苗时,镊子最好不要与瓶口接触,若不小心接触到外边缘,苗弃之,接种用具重新放在灭菌器里灭菌。
一瓶内一般接6~8棵苗,不要放得太多;组培苗在瓶内要排放均匀、整齐、美观。
三、封口、记录:瓶盖要拧紧,下台前要把品种代号、培养基类型、以及接种日期标示到瓶上。
离开之前还要把工作台收拾干净,把接种过程中产生的垃圾清理掉,台上的物品也要摆放整齐。

导读:本文很通俗的介绍了组培快繁技术在实际应用中的5个阶段:准备阶段——初代培养——继代增殖——生根诱导——炼苗移栽,不同品种流程略有差异,不过基本框架大体一样的。
一个完整的植物组织培养过程一般包括以下几个步骤:1. 准备阶段查阅相关文献,根据已成功培养的相近植物资料,结合实际制订出切实可行的培养方案。
准备阶段又分为两步:1. 1 培养基的配置与灭菌根据实验方案配制适当的化学消毒剂以及不同培养阶段所需的培养基,并经高压灭菌或过滤除菌后备用。
1. 2 外植体选择与消毒选择合适的部位作为外植体,采回后经过适当的预处理,然后进行消毒处理。
将消毒后的外植体在无菌条件下切割成一定大小的小块,或剥离出茎尖,挑出花药。
2. 初代培养将外植体接种到诱导培养基后置于培养室或光照培养箱中培养,促使外植体中已分化的细胞脱分化形成愈伤组织,或顶芽、腋芽直接萌发形成芽。
这一阶段主要为获得无菌苗、嫩茎、丛芽或愈伤组织,从而建立起无菌培养体系。
3. 继代增殖培养将初代培养获得的芽、丛芽、嫩茎或胚状体等培养物经切分,反复转移到新的增殖培养基上,进行扩大增殖培养,当芽苗繁殖到一定数量后,再将一部分接种到分化培养基,培养无根芽苗,另一部分保存或继续扩繁。
进行脱毒苗培养的需提前进行病毒检测。
4. 生根诱导刚分化形成的芽苗往往比较弱小,多数无根,此时可以接种到生根培养基上,生根培养基的特点是降低细胞分裂素浓度或不加,提高生长素浓度,促进小苗生根,提高其健壮度。
5. 炼苗移栽选择生长健壮的生根苗进行室外炼苗,待苗适应外部环境后,再移栽到疏松透气的基质中,注意保温、保湿、遮荫,防止病虫危害。
当组培苗完全成活并生长一定大小后,即可移向大田用于生产。
例如:茎尖→表面消毒→接种诱导培养基→茎尖生长→病毒检测鉴定→培养无根小植株→培养生根→完整小植株→炼苗20-25天→移栽成活。
常规情况下详细的生产流程图如下:对不同的品种词流程会略有差异,如进行果树育苗还需进行嫁接等操作流程,但对组培工厂化育苗而言,一般可根据上面的流程图来安排各项作业,只有相互衔接好、配合好,才能提高生产效益。
兰花组培操作方法
兰花组培操作方法如下:
1. 材料准备:准备所需的兰花组培培养基、器具、组织培养植物材料等。
2. 植物材料处理:取自健康、无病虫害的兰花植株,将茎段或叶片进行消毒处理,去除表层细胞,以减少污染物的导入。
3. 组培培养基配制:按照配方将组培培养基溶解,然后倒入培养瓶中,再在高温高压下灭菌消毒。
4. 接种和培养:将经过处理的植物材料小段放入培养基中,利用无菌操作台进行接种操作。
然后将接种好的组织培养瓶放入培养箱中,进行培养。
5. 培养条件:设置适宜的温度、光照、湿度和适宜的培养周期。
不同的兰花品种可能需要不同的培养条件。
6. 菌株筛选:在培养过程中,可以通过观察和筛选方式,筛选出生长良好、无病虫害的菌株。
7. 培养的转接和移栽:待细胞或组织在培养基上生长发育一段时间后,可以选择转接到新的培养基上,或者移栽到土壤中进行继续生长。
8. 监测和管理:在培养过程中,需不断监测细胞生长情况,调整培养条件和管理措施,确保组培培养的成功完成。
植物组织培养实验基本步骤植物组织培养实验基本步骤植物组织培养实验基本步骤一、母液的配置1、MS大量元素母液的配制一般将大量元素配制成10倍的母液,使用时再稀释10倍。
按照配方表中用量依次分别称取扩大10倍的:NH4NO3、KNO3,KH2PO4、MgSO4.7H2O、CaCl2.2H2O 的量,所有药品称取完毕后用蒸馏水逐个溶解,待全部溶解后,最后定容至1000ml,转入1000ml细口试剂瓶中,贴上标签,注明母液名称、放大倍数、配制日期、配制人姓名,置于4℃冰箱中保存备用。
2、MS微量元素母液的配制一般将微量元素配制成100倍的母液,使用时再稀释100倍。
按照配方表中用量分别依次称取:MnSO4?4H2O、ZnSO4?7H2O、H2BO3、NaMoO4?2H2O、CuSO4?5H2O、CoCl2?6H2O扩大100倍的量,用蒸馏水逐个溶解,待全部溶解后,用容量瓶定容至1000ml,转入1000ml细口试剂瓶中,贴上标签,注明母液名称、放大倍数、配制日期、配制人姓名,置于4℃冰箱中保存备用。
3、MS铁盐母液配制一般将铁盐配制成100倍的母液,使用时再稀释100倍。
按照配方表中用量分别称取扩大100倍的:FeSO4?7H2O和Na2?EDTA?2H2O的量,把FeSO4?7H2O和Na2?EDTA?2H2O分别置于200ml蒸馏水中,加热并不断搅拌使之溶解(磁力搅拌器,边加热,边搅拌)。
保持加热,把FeSO4溶液慢慢倒入Na2?EDTA溶液中并不断搅拌,接近沸腾时停止加热,待溶液冷却后加蒸馏水到最终容积1000ml,置于棕色细口瓶中,用力振荡1~2min,贴上标签,注明母液名称、放大倍数、配制日期、配制人姓名。
在室温下避光保存一段时间令其充分反应后,再置于4℃冰箱中保存备用。
4、MS有机化合物母液的配制一般将有机化合物配制成100倍的母液,使用时再稀释100倍。
按照配方表中用量分别称取扩大100倍的:肌醇、维生素B1、烟酸、甘氨酸、维生素B6的量,用蒸馏水依次溶解并定容至500ml后,转入500ml细口试剂瓶中,贴上标签,注明母液名称、配制日期、配制人姓名,置于4℃冰箱中保存备用。
植物组织培养的工作流程
植物组织培养是一种常用的植物繁殖和研究方法,其工作流程包括以下几个主要步骤:
1.材料准备:选择适宜的原植物材料,如茎段、叶片、种子等作为外植体。
确保材料的新鲜性和无病原体污染。
2.表面消毒:将外植体进行表面消毒,以去除表面的微生物和杂质。
这可以通过在消毒剂(如酒精、次氯酸钠等)中浸泡、搅拌等方法进行。
3.分离和切割:根据实验需求,将外植体切割成适当大小的组织片段。
可以使用手工切割、离心分离或显微镜下的操作等方法进行。
4.培养基制备:制备适合植物生长和繁殖的培养基。
培养基通常包括基本盐、有机物、维生素、植物激素和其他添加剂。
根据实验需求可以调整培养基成分。
5.外植体接种:将分离和切割好的外植体进行培养基中的接种。
接种可以通过将外植体直接放置于培养基上或将其插入培养基中的凝胶(如琼脂)中进行。
6.培养条件控制:对培养的温度、光照、湿度和气体条件进行控制。
这些条件可以根据不同植物的生长习性和实验要求进行调整。
7.植物增殖和分化:在培养基中,外植体会通过分裂、再生和分化等过程进行植物增殖和不同类型的器官分化。
植物激素的添加和培养条件的调整可以影响生长和分化的过程。
8.增殖体移栽:将培养的增殖体转移到新的培养基或固体培养基中,以促进继续生长和发育。
9.实验分析:通过观察、记录和分析培养组织的生长情况、形态特征、遗传表达等参数,进行实验结果的分析和研究。
组织培养的操作流程
一、准备工作:接种人员在正式接种之前要做好准备工作,包括准备灭菌用脱脂棉以及接种工具、分取培养基、接种用苗和工作台灭菌等。
1、工作台灭菌包括两步:一是上台前用紫外灯照射20分钟;二是开机鼓风,正式接种前再用75%酒精仔细擦一遍。
操作人员双手也要用75%酒精擦拭。
2、接种盘的取放:从布袋(报纸)里取出接种盘时,一定要注意,手不能接触接种盘的边沿,同时要尽可能减少与接种盘的接触面,一般规定只能用双手的拇指和食指取放。
二、接(转)苗:包括取苗、切苗和接苗三步。
1、取苗:先拧开培养瓶的瓶盖,最好一次将苗取出,取苗时,瓶口不要斜向外;双手尽量避免再瓶子或者接种盘的正上方移动,若瓶中苗数太多,一次不要全部取出,以免风干。
2、切苗:接种盘在操作台里放置不可太往外;从灭菌器取出镊子和手术刀后放在架子上晾凉;在操作过程中,手术刀和镊子,不可在培养瓶及接种盘正上方操作;在切苗过程中产生的垃圾可堆放在接种盘内的一侧位置上,不可弄到接种盘外。
3、接苗:培养瓶盖要倒放在操作台里,注意手不要接触到盖子及瓶子的内侧,接苗时,镊子最好不要与瓶口接触,若不小心接触到外边缘,苗弃之,接种用具重新放在灭菌器里灭菌。
一瓶内一般接6~8棵苗,不要放得太多;组培苗在瓶内要排放均匀、整齐、美观。
三、封口、记录:瓶盖要拧紧,下台前要把品种代号、培养基类型、以及接种日期标示到瓶上。
离开之前还要把工作台收拾干净,把接种过程中产生的垃圾清理掉,台上的物品也要摆放整齐。
组培实验步骤一、培养基的配置(1000ml)。
1.量取液体。
大量元素100 ml(用100 ml的量筒量),微量元素、有机元素、铁盐均10 ml(用10ml的量筒量),2.4—D 200vl(用50 vl的移液枪移取4次),将上述量取的溶液倒入一烧杯中,然后加蒸馏水至400 ml。
(将用过的溶液及时放入冰箱,用完的容器要及时清洗)2.称量蔗糖、琼脂。
蔗糖30 g、琼脂7g。
(称量的同时将电锅洗刷好、插好电源、倒入400 ml蒸馏水)3.熬制。
将(1.)中配置好的溶液及(2.)中称好的物品均放入盛有400 ml蒸馏水的电锅中熬煮至沸腾,熬煮的同时要用玻璃棒不断搅拌。
4.定容。
将熬制好的溶液倒入烧杯中加蒸馏水至1000 ml(实验室中烧杯加至红线处,速度要快)5.测PH值。
用玻璃棒蘸取溶液抹到试纸上,后对比得出PH值。
将PH值调制6.0(若大于6.0则加Hcl若小于6.0则加NaOH)。
(速度要快,以妨培养基凉掉)6.分装。
将配好的培养基分装到洗净的培养瓶中。
倒入高度因培养对象不同而异(月季枝条培养约2cm,胡萝卜愈伤组织培养约1 cm,但做生根培养要多加些)。
(注:分装时,先把洗净的培养瓶横摆在实验台上一排,两人进行操作,一人倒溶液,一人紧随其后移瓶并盖盖。
分装前要把培养基搅匀以防凝固效果不好。
)1000ml约分装13个瓶。
二、无菌皿的制作。
将剪好的滤纸五张循环叠放,放入洗净的无菌皿中,后加蒸馏水将滤纸浸湿,盖好盖子,用干净的报纸包好。
三、无菌水的制作。
用蒸馏水把瓶子涮洗2~3次,后倒入2/3的蒸馏水,拧紧盖子。
四、高压灭菌。
将制作好的培养基、无菌皿、无菌水(接种时所需的工具也可用报纸包住放入锅内灭菌)放入高压灭菌锅中灭菌。
五、接种。
1.接种前准备工作。
(1.)首先将所需物品放入超净工作台内进行紫外灯照射杀菌30分钟。
放入物品前先用酒精棉球将超净台台面擦一遍。
所需物品:酒精灯(4个)、镊子(4把)、无菌皿、无菌水、酒精棉球溶液(2或4瓶)、大烧杯(1只,盛废液)、无菌皿、无菌水、培养瓶(每人至少一瓶)、次氯酸钠(浓度为5%的溶液)。