对蜡烛及其燃烧的探究实验报告单
- 格式:doc
- 大小:28.50 KB
- 文档页数:1

化学实验报告实验名称:对蜡烛及其燃烧的探究实验目的:1、培养观察和描述的能力。
2、学习科学探究的方法。
实验器材:蜡烛、小木条、烧杯2个、澄清石灰水实验步骤:1、点燃前,观察蜡烛的颜色、状态、形状和硬度;观察把蜡烛投入水中的情况。
2、燃着时,火焰分几层,用小木条比拟火焰不同局部温度的上下,用烧杯推测燃烧后的生成物。
3、燃灭后,用火柴去点白烟,蜡烛能否重新燃烧。
现象:1、蜡烛是乳白色,柱状固体、无味,能被轻易切成处,放于水中飘浮于水面上。
2、火焰分为三层。
小木条上外焰接触的局部被烧焦得最厉害,枯燥的烧杯内壁有水珠,涂有石灰水的烧杯变浑浊。
3、白烟能被点燃。
分析及结论:1、蜡烛难溶于水、质软。
2、外焰温度最高,蜡烛燃烧有水和CO2生成。
3、吹灭蜡烛后的白烟是可燃物。
实验名称:对人体吸入的空气和呼出的气体的探究实验目的:探究人体吸入的空气和呼出的气体有何不同实验器材:水槽、集气瓶4个、玻璃片4块、滴管、石灰水、饮料管、小木条实验步骤:1、用吹气排水法收集两瓶呼出的气体。
2、收集两瓶空气。
3、在1瓶空气和1瓶呼出气中滴入石灰水、振荡。
4、将燃着的木条分别插入空气和呼出气中。
5、对着枯燥的玻璃片呼气。
现象:1、滴入石灰水后,充满呼出气的集气瓶更浑浊一些;2、插入呼出气中的木条立即熄灭,插入空气中的木条正常燃烧过了一会儿才熄灭;3、呼气后枯燥的玻璃片上有较多的水珠。
分析及结论:人体呼出的气体中有CO2含量较高,吸入的空气中O2含量较高,呼出气中H2O含量较高。
实验名称:化学实验的根本操作实验目的:熟练掌握药品的取用,给物质的加热,仪器洗涤的操作实验器材:镊子、药匙、试管、量筒、滴管、酒精灯、试管夹、试管刷、锌粒、盐酸、碳酸纳粉末、氢氧化钠溶液、硫酸铜溶液实验步骤:一、药品的取用1、用镊子夹取了粒锌放入试管中,并将试管放在试管架上。
2、取少量碳酸钠粉末放入试管中,并半试管放在试管架上。
3、量取2ml盐酸参加到试管2中,往试管一中滴加盐酸。




学生实验报告(实验报告)
学校班级姓名组序
实验名称蜡烛燃烧的变化
实验目的探究蜡烛燃烧的变实验器材蜡烛、火
柴、干玻璃片、试管夹、酒精灯、小铁盒、
小刀。
实验步骤 1、检查实验物品是否齐全。
2、点燃蜡烛,用试管夹夹住干玻璃片,观
察现象(一)。
3、用小刀把蜡烛切成小块,放在小铁盒上,
然后用试管夹夹住小铁盒放在酒精灯外焰
上加热。
观察现象。
停止加热,冷却一会儿,
再观察现象(二)。
4、得出实验结论。
5、整理实验器材。
实验现象(一)蜡烛开始燃烧,火焰下方蜡烛油固态
变成液态,蜡烛越烧越短,玻璃变黑。
(二)在酒精灯上加热,发现蜡烛融化了,
变成了蜡油,由固态变成了液态,停止加
热,过一会冷却后,蜡烛油又变成固态的,
形状和原来不同了。
实验结论蜡烛燃烧,一是形态发生了变化,二是产
生了新的物质。
蜡烛加热,只是形态发生了改变。

蜡烛及其燃烧的实验报告1. 实验目的在这个实验里,我们主要想知道蜡烛是如何燃烧的,为什么它能在黑暗中发光。
毕竟,谁不想在烛光下享受浪漫呢?同时,我们也想搞明白蜡烛燃烧过程中发生了什么化学反应,来一场科学与生活的亲密接触。
1.1 理论基础蜡烛的主要成分是蜡,燃烧的时候,蜡和氧气发生反应,产生二氧化碳和水,同时释放出热和光。
说白了,蜡烛其实是一个小小的化学工厂,能把固态的蜡转变成气体和能量。
就像我们吃饭,食物被消化,变成能量一样,蜡烛也是在“吃”空气。
1.2 实验准备实验准备的东西其实很简单:几根蜡烛、一个打火机、一个透明的玻璃杯、以及一些水。
听起来是不是很简单?别小看这些东西,咱们要好好利用它们,来一场蜡烛与水的较量。
2. 实验步骤2.1 点燃蜡烛首先,把蜡烛固定在一个安全的地方,确保它不容易倒下。
然后,像个小魔术师一样,用打火机点燃蜡烛。
哇!火苗一冒出来,瞬间就能照亮整个房间,简直是“见光死”的感觉。
2.2 观察燃烧这时候,大家可以观察蜡烛的火焰,注意火焰的颜色、形状,以及它发出的热量。
你会发现,火焰的底部是蓝色的,而顶部是黄色的,简直像个小小的舞台,演员们正在精彩表演呢。
再看看蜡烛周围,蜡烛慢慢地变短,蜡滴在桌子上,简直是“蜡烛流泪”的感觉。
2.3 用水覆盖蜡烛接下来,准备好透明的玻璃杯,慢慢将它放在蜡烛上,像给蜡烛戴上了一顶“小帽子”。
观察杯子内部,火焰慢慢变小,最后熄灭。
这时候,大家可以发现杯子里面的水面开始上升,哇哦,蜡烛是怎么做到的呢?3. 实验结论3.1 化学反应通过这个实验,我们发现蜡烛燃烧的时候,不仅消耗了空气中的氧气,还产生了二氧化碳和水。
这就像是蜡烛在“呼吸”,一边用力“吸气”,一边“吐气”,热量和光亮也是它“吐”出来的。
3.2 实际应用这项实验其实告诉我们很多生活中的小道理,比如说光和热的来源,以及燃烧的必要条件。
生活中,咱们常常需要用到蜡烛,比如停电的时候点一支,瞬间就能让黑暗不再可怕。

一、实验目的1. 了解蜡烛的物理性质和化学性质。
2. 探究蜡烛燃烧的过程及其产生的物质。
3. 学习观察和记录实验现象,培养实验操作技能。
二、实验用品1. 一支新蜡烛2. 火柴3. 一支干净烧杯4. 水5. 水槽6. 澄清的石灰水7. 一把小刀三、实验步骤1. 观察蜡烛的颜色、形状、状态、硬度;嗅其气味。
现象:蜡烛是白色、较软的圆柱状固体,无气味,由白色的棉线和石蜡组成。
2. 用小刀切下一块石蜡,放入水槽,观察其在水中的现象。
现象:石蜡漂浮在水面上,不溶于水。
结论:石蜡是一种密度比水小,不溶于水的固体。
3. 点燃蜡烛,观察其变化及其火焰和其各层温度的比较。
现象:石蜡受热时熔化、蜡烛燃烧时发光、冒黑烟、放热。
烛焰分三层:外焰、内焰、焰心,外焰温度最高,焰心最低。
结论:石蜡受热会熔化,燃烧时形成炭黑。
4. 干燥的烧杯罩在烛焰上方,观察烧杯壁上的现象片刻,取下烧杯,倒入少量石灰水。
振荡,观察其现象。
现象:干燥的烧杯壁上出现了许多小水珠。
取下烧杯后迅速倒入澄清石灰水,振荡,石灰水变得浑浊。
结论:蜡烛燃烧时产生了水和能使石灰水变浑浊的二氧化碳两种物质。
5. 熄灭蜡烛,观察其现象,用火柴点燃刚熄灭时的白烟,观察其燃烧情况。
现象:熄灭蜡烛后,蜡烛芯周围有白烟产生,用火柴点燃白烟,白烟燃烧,产生明亮的火焰。
结论:蜡烛熄灭后,剩余的石蜡蒸汽在接触到火源时能够重新燃烧。
四、实验分析1. 蜡烛的物理性质:蜡烛在常温下为白色固体,密度比水小,不溶于水,熔点较低,易于熔化。
2. 蜡烛的化学性质:蜡烛具有可燃性,燃烧时产生火焰、热量、水和二氧化碳。
3. 蜡烛燃烧过程:蜡烛燃烧分为三个阶段,即熔化、气化和燃烧。
石蜡受热熔化后,在燃烧过程中气化并发生燃烧反应,产生炭黑和灰烬。
4. 蜡烛燃烧产物:蜡烛燃烧时产生水和二氧化碳,其中二氧化碳能使石灰水变浑浊。
五、实验结论1. 蜡烛在常温下为白色固体,密度比水小,不溶于水,熔点较低,易于熔化。
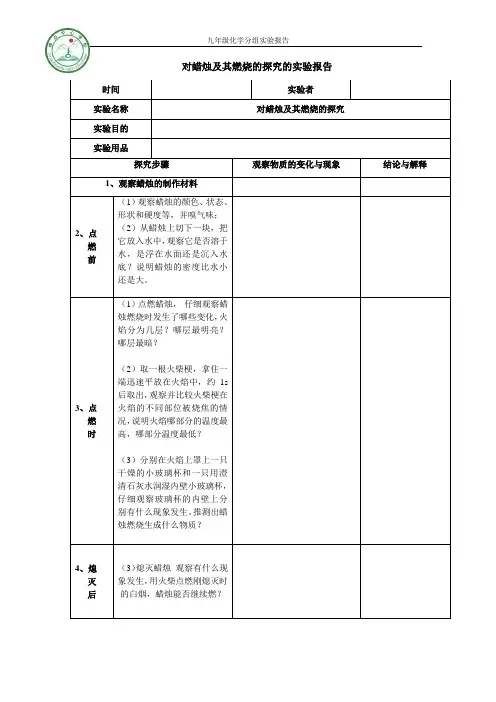
九年级化学分组实验报告
对蜡烛及其燃烧的探究的实验报告
时间实验者
实验名称对蜡烛及其燃烧的探究
实验目的
实验用品
探究步骤观察物质的变化与现象结论与解释
1、观察蜡烛的制作材料
2、点
燃
前(1)观察蜡烛的颜色、状态、形状和硬度等,并嗅气味;(2)从蜡烛上切下一块,把它放入水中,观察它是否溶于水,是浮在水面还是沉入水底?说明蜡烛的密度比水小还是大。
3、点
燃
时(1)点燃蜡烛,仔细观察蜡烛燃烧时发生了哪些变化,火焰分为几层?哪层最明亮?哪层最暗?
(2)取一根火柴梗,拿住一端迅速平放在火焰中,约1s 后取出,观察并比较火柴梗在火焰的不同部位被烧焦的情况,说明火焰哪部分的温度最高,哪部分温度最低?
(3)分别在火焰上罩上一只干燥的小玻璃杯和一只用澄清石灰水润湿内壁小玻璃杯,仔细观察玻璃杯的内壁上分别有什么现象发生。
推测出蜡烛燃烧生成什么物质?
4、熄
灭
后(3)熄灭蜡烛观察有什么现象发生,用火柴点燃刚熄灭时的白烟,蜡烛能否继续燃?。

第1篇一、实验目的1. 了解蜡烛的物理性质和化学性质。
2. 探究蜡烛熔化、燃烧的过程及产生的现象。
3. 分析蜡烛燃烧产物,并验证其成分。
二、实验原理蜡烛主要由石蜡、棉线等材料制成。
石蜡是一种碳氢化合物,具有较低的熔点和沸点。
当蜡烛受热时,石蜡熔化并气化,形成石蜡蒸气。
石蜡蒸气在火焰中燃烧,产生光和热,同时生成水和二氧化碳等物质。
三、实验材料1. 蜡烛一支2. 火柴一盒3. 干燥的烧杯一个4. 澄清石灰水适量5. 水槽一个6. 小刀一把四、实验步骤1. 观察蜡烛的物理性质- 观察蜡烛的颜色、形状、状态、硬度等。
- 用小刀切下一块蜡烛,放入水槽中,观察其在水中的现象。
2. 点燃蜡烛- 用火柴点燃蜡烛,观察蜡烛熔化、燃烧的现象。
- 观察火焰的颜色、形状、大小等。
- 观察蜡烛燃烧时产生的声音、气味等。
3. 探究火焰各层的温度- 将一根火柴横在火焰上方片刻,观察火柴梗的碳化位置,确定火焰各层的温度。
4. 观察燃烧产物- 在蜡烛火焰上方罩一个干燥的烧杯,观察烧杯壁上的现象。
- 取下烧杯,迅速倒入少量澄清石灰水,振荡,观察其现象。
5. 熄灭蜡烛- 观察熄灭蜡烛后的现象,用火柴点燃刚熄灭时的白烟,观察其现象。
五、实验现象1. 蜡烛的物理性质- 蜡烛为白色、圆柱状固体,硬度较小,稍有气味。
- 石蜡密度比水小,不溶于水。
2. 蜡烛燃烧现象- 蜡烛燃烧时,火焰分为三层:外焰、内焰、焰心。
- 外焰温度最高,内焰次之,焰心温度最低。
- 蜡烛燃烧时发光、放热、产生烟雾。
3. 火焰各层温度- 火焰外焰温度最高,内焰次之,焰心温度最低。
4. 燃烧产物- 蜡烛燃烧时,烧杯壁上出现水雾,说明产生了水。
- 澄清石灰水变浑浊,说明产生了二氧化碳。
5. 熄灭蜡烛后的现象- 熄灭蜡烛后,蜡烛逐渐凝固,白色棉线烛心变黑,易碎。
- 用火柴点燃刚熄灭时的白烟,蜡烛重新燃烧。
1. 蜡烛主要由石蜡、棉线等材料制成。
2. 蜡烛燃烧时,石蜡熔化、气化,形成石蜡蒸气。


初中化学实验1 《对蜡烛及其燃烧的探究》
学生实验报告
初中化学实验2《吸入的空气与呼出气体不同的探究》
学生实验报告
初中化学实验3 《氧气的实验室制取与性质》
学生实验报告
将试管固定在铁架台,试管夹应夹在试管的中上部,试管口
使试管预热,然后将火焰集中在药品处加
初中化学实验4 《二氧化碳的实验室制取与性质》
学生实验报告。
初中化学实验5 《燃烧的条件》
学生实验报告
初中化学实验6 《金属的物理性质和某些化学性质》
学生实验报告
初中化学实验7 《一定溶质质量分数的氯化钠溶液的配制》
学生实验报告
初中化学实验8 《酸、碱的化学性质》
学生实验报告
初中化学实验9《溶液酸碱性的检验》
学生实验报告
初中化学实验10《粗盐中难溶性杂质的去除》
学生实验报告。
对蜡烛及其燃烧的探究实验报告引言蜡烛是我们日常生活中常见的物品之一,它不仅可以提供照明,还可以用于氛围营造和庆祝活动。
然而,蜡烛的燃烧过程却是一个复杂的化学反应。
本实验旨在对蜡烛及其燃烧进行探究,深入了解蜡烛的结构、燃烧过程以及与环境的相互作用。
实验材料和方法材料•蜡烛•火柴•支架•钢尺•平衡器•实验室温度计•钢笔•纸张方法1.准备工作:–在实验室中设置支架,将蜡烛固定在支架上。
–使用火柴点燃蜡烛。
–使用钢尺测量蜡烛的高度和直径。
–使用平衡器称量蜡烛的质量。
–使用实验室温度计测量室内温度。
2.观察蜡烛的燃烧过程:–观察蜡烛燃烧时产生的火焰和烟雾。
–记录蜡烛燃烧的时间。
–观察蜡烛燃烧后的残留物。
3.测量蜡烛燃烧产生的热量:–将蜡烛置于一定距离的容器内。
–点燃蜡烛并观察温度的变化。
–使用钢笔在纸张上记录温度的变化。
4.分析实验结果:–对蜡烛的燃烧时间、残留物、产生的热量进行比较和分析。
–探讨蜡烛燃烧产生的物质和环境的关系。
–探究蜡烛的结构对燃烧过程的影响。
实验结果和讨论蜡烛的燃烧过程观察蜡烛点燃后,火焰呈黄色,烟雾从蜡烛顶部升起。
整个燃烧过程持续约2小时。
燃烧结束后,蜡烛留下一小部分未燃烧的蜡和一些灰烬。
蜡烛燃烧产生的热量测量在实验过程中,我们观察到蜡烛燃烧时周围环境的温度上升。
通过记录温度的变化,我们发现蜡烛燃烧产生的热量可以使温度上升约10摄氏度。
实验结果分析根据我们的实验结果,我们可以得出以下结论: 1. 蜡烛的燃烧过程是一个化学反应,产生的火焰和烟雾是燃烧产物。
2. 蜡烛的燃烧时间和残留物与蜡烛的结构和质量有关,较长的蜡烛燃烧时间和较多的残留物可能表示蜡烛质量更大。
3. 蜡烛燃烧产生的热量可以使周围环境的温度上升,这是因为燃烧释放的能量转化为热能。
4. 蜡烛燃烧产生的物质和环境的关系可以通过研究燃烧产物的成分和对环境的影响来探究。
结论通过本次实验,我们对蜡烛及其燃烧过程有了更深入的了解。
第1篇一、实验目的1. 观察蜡烛在燃烧过程中的变化,了解蜡烛燃烧的原理。
2. 掌握蜡烛燃烧时产生的气体成分,分析其对环境的影响。
3. 通过实验,提高学生的动手操作能力和观察分析能力。
二、实验原理蜡烛燃烧是一种化学反应,其主要成分石蜡在点燃后与氧气发生反应,生成二氧化碳和水。
燃烧过程中,蜡烛受热熔化,燃烧产生光和热,同时产生气体和灰烬。
三、实验用品1. 蜡烛:白色、黄色、红色等不同颜色的蜡烛各一支。
2. 火柴:用于点燃蜡烛。
3. 烧杯:用于收集燃烧产生的气体。
4. 石灰水:用于检验二氧化碳气体。
5. 滤纸:用于过滤燃烧产生的灰烬。
6. 镊子:用于取用蜡烛和灰烬。
7. 秒表:用于计时。
8. 实验记录表:用于记录实验数据。
四、实验步骤1. 将不同颜色的蜡烛分别点燃,观察其燃烧现象。
2. 记录蜡烛燃烧时火焰的颜色、形状、高度和燃烧时间。
3. 用烧杯收集蜡烛燃烧产生的气体,观察气体颜色和气味。
4. 将石灰水倒入烧杯中,观察石灰水的变化,检验二氧化碳气体。
5. 用滤纸过滤燃烧产生的灰烬,观察灰烬的颜色和状态。
6. 记录实验数据,分析蜡烛燃烧过程中产生的气体成分及对环境的影响。
五、实验结果与分析1. 蜡烛燃烧时,火焰呈黄色或白色,火焰高度约为10-15厘米,燃烧时间约为1小时。
2. 燃烧产生的气体为无色、无味气体,石灰水变浑浊,说明产生了二氧化碳气体。
3. 燃烧产生的灰烬为黑色粉末,经过滤纸过滤后,灰烬质量约为蜡烛质量的1/10。
4. 分析蜡烛燃烧过程中产生的气体成分及对环境的影响:蜡烛燃烧产生的主要气体为二氧化碳和水蒸气,二氧化碳是一种温室气体,过量排放会导致全球气候变暖;水蒸气对环境无影响。
六、实验结论1. 蜡烛燃烧是一种化学反应,其主要成分石蜡在点燃后与氧气发生反应,生成二氧化碳和水。
2. 蜡烛燃烧时,火焰呈黄色或白色,燃烧产生的气体为无色、无味气体,石灰水变浑浊,说明产生了二氧化碳气体。
3. 蜡烛燃烧对环境有一定影响,过量排放二氧化碳会导致全球气候变暖。
第1篇一、实验目的通过本实验,探究蜡烛燃烧的条件,分析影响蜡烛燃烧的主要因素,包括温度、氧气浓度、燃料性质等,并验证蜡烛燃烧的基本原理。
二、实验原理蜡烛燃烧是石蜡与氧气在高温下发生氧化反应的过程,生成二氧化碳和水。
蜡烛燃烧需要满足以下条件:1. 足够的氧气供应。
2. 燃料(石蜡)达到一定的温度,即着火点。
3. 燃料与氧气接触。
三、实验材料1. 新蜡烛一支2. 火柴一盒3. 干燥的烧杯一个4. 澄清的石灰水一瓶5. 温度计一个6. 氧气浓度计一个7. 秒表一个8. 记录本和笔四、实验步骤1. 观察蜡烛的物理性质:- 观察蜡烛的颜色、形状、硬度等物理性质。
- 用火柴点燃蜡烛,观察火焰的颜色、形状、温度等。
2. 探究氧气浓度对蜡烛燃烧的影响:- 在一个密封的容器中,点燃蜡烛,观察火焰的燃烧情况。
- 每次实验后,打开容器,测量蜡烛燃烧后的氧气浓度,并记录数据。
3. 探究温度对蜡烛燃烧的影响:- 将蜡烛放入不同温度的水中,观察蜡烛的燃烧情况。
- 记录不同温度下蜡烛的燃烧时间和火焰的燃烧情况。
4. 探究燃料性质对蜡烛燃烧的影响:- 将不同种类的蜡烛(如蜡烛、油灯、酒精灯等)进行燃烧实验,观察燃烧情况。
- 记录不同燃料的燃烧时间、火焰的燃烧情况等。
5. 验证蜡烛燃烧的生成物:- 将干燥的烧杯罩在蜡烛火焰上方,观察烧杯壁上的现象。
- 取下烧杯,倒入少量澄清的石灰水,振荡,观察石灰水的变化。
五、实验结果与分析1. 观察蜡烛的物理性质:- 蜡烛是白色、圆柱状固体,硬度较小,无气味。
- 蜡烛燃烧时,火焰呈黄色,温度较高。
2. 探究氧气浓度对蜡烛燃烧的影响:- 随着氧气浓度的降低,蜡烛燃烧的火焰逐渐变弱,燃烧时间缩短。
3. 探究温度对蜡烛燃烧的影响:- 随着温度的升高,蜡烛燃烧的火焰逐渐变强,燃烧时间延长。
4. 探究燃料性质对蜡烛燃烧的影响:- 不同种类的蜡烛燃烧时间、火焰燃烧情况不同,燃烧效率也不同。
5. 验证蜡烛燃烧的生成物:- 烧杯壁上出现水珠,澄清的石灰水变浑浊,说明蜡烛燃烧生成了水和二氧化碳。