醇酚醚与三氯化铁的显色反应
- 格式:doc
- 大小:39.00 KB
- 文档页数:2

浅谈苯酚的检验实验方式方法作者:鄢嘉谟来源:《活力》2013年第08期[摘要]苯酚对皮肤、黏膜有强烈的腐蚀作用,对中枢神经有抑制作用,如果体内含有苯酚,则能损害肝、肾功能。
吸入高浓度苯酚蒸气可导致头痛、头晕、四肢乏力、视力模糊、肺水肿急性等中毒发生。
因此,怎样准确检测出苯酚?由于三氯化铁与苯酚反应,现象明显,反应迅速,因此,医学上常用该方法来检验苯酚的存在。
但该方法是否是检测苯酚的特效试剂呢?我尚存疑问。
本文从对此现象进行试验,找出准确检测苯酚的方法。
[关键词]检验;颜色反应;三氯化铁一、三氯化铁与酚类物质的颜色变化1.三氯化铁与酚类物质的变色原理:由于三氯化铁中的铁离子有空轨道,而酚类物质分子中由于羟基与苯环共同对电子的作用,使得酚类物质中的电子向羟基转移,使羟基一端聚集多余的电子,这样酚类物质与三氯化铁形成了络合物,呈现出颜色。
2.三氯化铁与不同酚类物质的显色现象:与苯酚显蓝紫色,与邻二苯酚显深绿色,与对二苯酚出现绿色结晶,对甲基苯酚显蓝色,偏三苯酚显蓝绿色,与连三苯酚显淡绿色。
由此可知,不同的酚类物质与三氯化铁反应呈现不同的颜色,因此可以用三氯化铁区分不同的份类物质。
但是如果是未知物,是否也能通过此方法判断是否有该物质存在?3.三氯化铁与苯酚反应的酸碱性。
苯酚与三氯化铁溶液混合,所得溶液显紫色,这也是一个平衡体系。
向溶液滴加稀硫酸后,紫色变浅,平衡向左移动;向溶液滴加浓的苯酚或三氯化铁溶液后,紫色加深,平衡向右移动;向溶液滴加NaOH 溶液后,紫色逐渐褪去,生成红褐色沉淀。
根据实验可知三氯化铁与苯酚反应显紫色的反应,与溶液的酸碱性是有关系的。
要想得到紫色的溶液,其酸碱性应保证弱酸性,即PH值在4.5—6.5范围内才能出现紫色现象。
如果酸(碱)度过高,应加碱(酸)调节PH值,以企达到实验效果。
其他酚类物质与三氯化铁反应所需的酸碱性通过实验发现,与苯酚的相同。
二、三氯化铁与酚类物质的显色实验三氯化铁的显色反应:由于三氯化铁与酚类物质的显色反应,本质上是由于烯醇式结构引起的电子偏移,使烯醇式结构物质与三氯化铁形成络合物所致,因此判断三氯化铁是否是苯酚的特效试剂,就是要通过试验验证与三氯化铁反应显紫色的是否只有苯酚这一种物质,而无其他物质。

酚的显色反应[实验]取苯酚的饱和水溶液2滴放入试管中,加入2ml水,并逐滴滴入FeCl3溶液,观察颜色变化。
[解释]酚类或含酚羟基的化合物,大多数能和FeCl3溶液发生各种特有的颜色反应,产生颜色的原因主要是生成了电离度很大的酚铁盐。
Fe3+ + 6 C6H5OH → [Fe(OC6H5)6]3- + 6 H+加入酸、乙醇或过量的FeCl3溶液,均能减少酚铁盐的电离度,有颜色的阴离子浓度也就相应降低,反应液的颜色就将褪去。
酚中的羟基与芳环连接在一起,与烯醇型化合物相似,具有烯醇型结构的分子与FeCl3溶液作用,能够产生颜色反应。
因此,FeCl3能够鉴别酚的存在。
不同的酚有不同的颜色反应。
苯酚:蓝紫色对甲苯酚:蓝色间甲苯酚:蓝紫色对苯二酚:暗绿色晶体邻苯二酚:深绿色间苯二酚:蓝紫色联苯三酚:淡棕红色α-萘酚:紫红色沉淀β-萘酚:绿色沉淀2,4,6-三硝基苯酚:红褐色沉淀3,4,5-三羟基苯甲酸:蓝黑色沉淀醇和三氯化铁不能发生显色反应,但烯醇可以显示,通常显褐色、红色或红紫色。
另外,这里需要指出的是,萘酚虽可以发生显示反应,但是在FeCl3的氧化作用下,萘酚发生双分子偶联反应,生成联萘酚。
如:2 OH+ 2FeCl3→HO OH+ FeCl2 + 2 HCl 2OH32OHOH[附件1][附件2]硫酚、硒酚、碲酚的简介酚的性质在基础有机化学的书上都有,在此不做赘述。
硫酚在性质上和酚有许多相同之处,但是硫原子的核外电子排布是1s22s22p63s23p43d0,在有机硫化合物中,硫原子可以由它的3s,3p,3d轨道(或它们不同的杂化轨道)与碳或氧原子成键,由于硫原子与碳原子、氧原子相互成键的价电子轨道能级不同成键情况与酚相比,轨道交盖不好,及C—S键较弱,S—H键解离能较小,且硫的电负性较小,导致了硫酚的化学性质和酚又有不同之处。
硫酚的沸点要比酚低,但其酸性比酚强,如C6H5OH的p K a为10,C6H5SH的p K a 为7.8,苯硫酚可以和氯化汞作用产生苯硫酚汞盐:2 C6H5SH + HgCl2→(C6H5S)2Hg↓+ 2 HCl自然,苯硫酚可溶于NaHCO3溶液中。

醇、酚、醚的性质目的1.验证醇、酚、醚的主要化学性质。
2.掌握醇、酚的鉴别方法。
原理醇、酚、醚都可看作是烃的含氧衍生物。
由于氧原子连结的基团(或原子)不同,使醇、酚、醚的化学性质有很大的区别。
醇类的特征反应与羟基有关,羟基中的氢原子可被金属钠取代生成醇钠。
羟基还可被卤原子取代。
伯、仲、叔醇与卢卡斯(Lucas)试剂(无水氯化锌的浓盐酸溶液)作用时,反应速度不尽相同,生成的产物氯代烷不溶于卢卡斯试剂中,故可以根据出现混浊的快慢来鉴别伯、仲、叔醇。
立即出现混浊放置分层为叔醇,经微热几分钟后出现混浊的为仲醇,无明显变化为伯醇。
此外,伯仲醇易被氧化剂如高锰酸钾、重铬酸钾等氧化,而叔醇在室温下不易被氧化,故可用氧化反应区别叔醇。
丙三醇、乙二醇及1,2-二醇等邻二醇都能与新配制的氢氧化铜溶液作用,生成绛蓝色产物,此反应可用于邻二醇的鉴别。
酚的反应比较复杂,除具有酚羟基的特性外,还具有芳环的取代反应。
由于两者的相互影响,使酚具有弱酸性(比碳酸还弱),故溶于氢氧化钠溶液中,而不溶于碳酸氢钠溶液中。
苦味酸(2,4,6-三硝基酚)则具有中强的酸性。
苯酚与溴水反应可生成2,4,6-三溴苯酚的白色沉淀,可用于酚的鉴别。
此外,苯酚容易被氧化,可使高锰酸钾紫色退去。
与三氯化铁溶液发生特征性的颜色反应,可用于酚类的鉴别。
醚与浓的强无机酸作用,可生成盐,故乙醚可溶于浓硫酸中。
当用水稀释时,盐又分解为原来的醚和酸。
利用此性质可分离或除去混在卤代烷中的醚。
此外,醇、醛、酮、酯等中性含氧有机物,也都能形成盐而溶于浓硫酸。
乙醚具有沸点低易挥发,易燃、密度比空气重等特点。
故蒸馏或使用乙醚时,严禁明火,并需采用特殊的接受装置。
乙醚在空气中放置易被氧化,形成过氧化物,此过氧化物浓度较高时,易发生爆炸,故蒸馏乙醚时不应蒸干,以防发生意外事故。
药品无水乙醇,正丁醇,仲丁醇,叔丁醇,卢卡斯试剂,甘油,乙二醇,苦味酸,碳酸氢钠溶液(5%),三氧化铁溶液(1%),乙醚,金属钠,酚酞溶液,高锰酸钾溶液(0.5%),浓硫酸(96~98%),异丙醇,稀盐酸(6mol·L-1),苯酚,氢氧化钠(10%,20%),碳酸钠(5%),饱和溴水,稀硫酸(3mol·L-1),重铬酸钾溶液(5%),硫酸亚铁铵(2%),硫氰化铵(1%)。




⼤学有机化学练习题—第七章醇酚醚第七章醇酚醚学习指导:1.醇的构造,异构和命名;2. 饱和⼀元醇的制法:烯烃⽔合,卤烷⽔解,醛、酮、羧酸酯还原和从Grignard试剂制备;3.饱和⼀元醇的物理性质:氢键对沸点的影响;4. 饱和⼀元醇的化学性质:与⾦属的反应;卤烃的⽣成,酸的催化醚作⽤;与⽆机酸的反应;脱⽔反应;氧化与脱氢;5. ⼆元醇的性质(⾼碘酸的氧化,频哪醇重排);6. 酚结构和命名;制法(从异丙苯,芳卤衍⽣物,芳磺酸制备);7.化学性质:酚羟基的反应(酸性,成酯,成醚);芳环上的反应(卤化,硝化,磺化);与三氯化铁的显⾊反应;8. 取代基对酚的酸性的影响。
9、醚(简单醚)的命名、结构;10、醚的制法:醇脱⽔,Williaman合成法;11、环氧⼄烷的性质:与⽔、醇、氨、Grignard试剂的作⽤;12、环醚的开环反应规律;醇、酚与醚等其他有机物在⼀定条件下相互转化的规律。
习题⼀、命名下列各物种或写出结构式。
1、写出4-甲基-2-戊醇的构造式。
2、写出的系统名称并写成Fischer投影式。
3、写出的系统名称。
4、写出的系统名称。
5、写出⼄基新戊基醚的构造式。
6、写出3-⼄氧基-1-丙醇的构造式。
7、写出的名称。
8、写出的系统名称⼆、完成下列各反应式(把正确答案填在题中括号内)。
1、2、3、4、5、6、7、8、9、10、11、12、三、理化性质⽐较题(根据题⽬要求解答下列各题)。
1、将下列化合物按与⾦属钠反应的活性⼤⼩排序:(A) CH3OH (B) (CH3)2CHOH (C) (CH3)3COH2、下列醇与Lucas试剂反应速率最快的是:(A) CH3CH2CH2CH2OH (B) (CH3)3COH(C) (CH3)2CHCH2OH3、将下列化合物按沸点⾼低排列成序:(A) CH3CH2CH3(B) CH3Cl (C) CH3CH2OH4、⽐较下列醇与HCl反应的活性⼤⼩:5、将苯酚(A)、间硝基苯酚(B)、间氯苯酚(C)和间甲苯酚(D)按酸性⼤⼩排列成序。


第六章醇、酚、醚一、学习要求1.掌握醇、酚、醚的结构和命名。
2.掌握醇、酚、醚的主要化学性质和醇的重要的物理性质。
3.了解硫醇、硫醚和冠醚的结构、命名、性质及其重要用途。
二、本章要点醇、酚、醚是三类重要的有机化合物,有的在医药上用作消毒剂、麻醉剂、溶剂,有的是有机合成的常用原料。
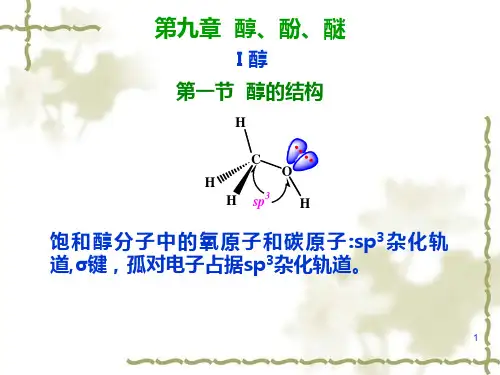
(一)醇1.结构醇分子中的羟基氧为不等性sp3杂化,其中2个杂化轨道被2对未成键电子占据,另2个杂化轨道分别与α- C的sp3杂化轨道和氢原子的S轨道形成σ键。
由于氧的电负性大,故羟基氧电子云密度大,氢电子云密度小,因此氢氧键极性较大。
2. 命名醇的普通命名是在“醇”前加上烃基名称,并省去“基”字。
醇的系统命名原则是:(1)选择含有羟基的最长碳链作为主链,称为“某醇”,并使羟基相连的碳原子编号最小,将羟基位次写在“某醇”之前,其余的原则与烷烃相同。
(2)多元醇,应选择含羟基数目最多的最长碳链作主链,按羟基数目的多少称为“某二醇”、“某三醇”等。
(3)不饱和一元醇:选择既含羟基又含不饱和键数目最多的最长碳链作主链,编号时应使羟基位次最小,根据主链碳原子数称为“某烯(炔)醇”,并在“烯(炔)”、“醇”前面标明不饱和键和羟基的位次。
(4)命名芳香醇时,将芳环作为取代基,以侧链脂肪醇为母体。
(5)脂环醇,根据脂环烃基的名称,称为“环某醇”,从羟基所连接的碳原子开始,按“取代基位次之和最小”的原则给环碳原子编号,将取代基的位次、数目、名称依次写在“环某醇”的名称之前。
3. 性质(1)重要物理性质:由于醇可形成分子间氢键,故低级醇的沸点通常比相对分子质量相近的烷烃高得多。
随着醇中烷基的增大,醇羟基与水形成氢键的能力逐渐减弱,因此低级醇易溶于水,中级醇部分溶于水,高级醇则不溶于水。
(2)主要化学性质:①醇与活泼金属(如Na、K、Mg、Al等)反应,生成相应的醇盐,并放出氢气。
醇与活泼金属的反应速率顺序为:1)低级醇>中级醇>高级醇;2)甲醇>伯醇>仲醇>叔醇②醇可以与氢卤酸、卤化磷及氯化亚砜等发生亲核取代反应。
高中化学醇、羧酸及其盐与氯化铁的显色和褪色反应酚及烯醇式结构的化合物与氯化铁的显色反应已为众所周知,然而醇、羧酸及其盐与氯化铁反应后显黄色或棕黄色容易被认为是氯化铁溶液本身的颜色,没有引起人们的注意,甚至有的教材指明醇不能发生与氯化铁的反应;此类显色反应后遇强酸而褪色及链状邻二醇与氯化铁溶液的特殊反应现象均未曾报导过,本文拟就此作初步探讨。
1. 试剂蒸馏水;无水乙醇(AR);乙二醇(AR);丙三醇(AR);冰醋酸(AR);甲酸(AR);蔗糖(CP);葡萄糖(AR);酒石酸钾钠(AR);氢氧化钠(AR);氯化铁(AR);亚铁氰化钾(AR)。
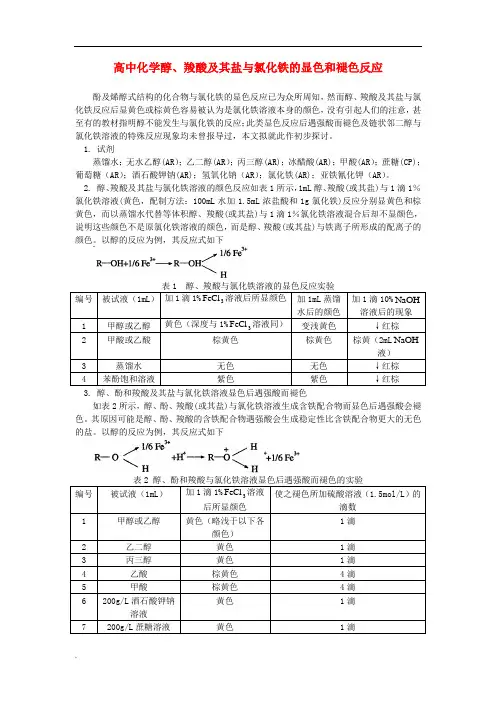
2. 醇、羧酸及其盐与氯化铁溶液的颜色反应如表1所示,1mL醇、羧酸(或其盐)与1滴1%氯化铁溶液(黄色,配制方法:100mL水加1.5mL浓盐酸和1g氯化铁)反应分别显黄色和棕黄色,而以蒸馏水代替等体积醇、羧酸(或其盐)与1滴1%氯化铁溶液混合后却不显颜色,说明这些颜色不是原氯化铁溶液的颜色,而是醇、羧酸(或其盐)与铁离子所形成的配离子的颜色。
以醇的反应为例,其反应式如下编号被试液(1mL)加1滴1%3FeCl溶液后所显颜色加1mL蒸馏水后的颜色加1滴10%NaOH 溶液后的现象1 甲醇或乙醇黄色(深度与1%3FeCl溶液同)变浅黄色↓红棕2 甲酸或乙酸棕黄色棕黄色棕黄(2mL NaOH液)3 蒸馏水无色无色↓红棕4 苯酚饱和溶液紫色紫色↓红棕3. 醇、酚和羧酸及其盐与氯化铁溶液显色后遇强酸而褪色如表2所示,醇、酚、羧酸(或其盐)与氯化铁溶液生成含铁配合物而显色后遇强酸会褪色。
其原因可能是醇、酚、羧酸的含铁配合物遇强酸会生成稳定性比含铁配合物更大的无色的盐。
以醇的反应为例,其反应式如下编号被试液(1mL)加1滴1%3FeCl溶液后所显颜色使之褪色所加硫酸溶液(1.5mol/L)的滴数1 甲醇或乙醇黄色(略浅于以下各颜色)1滴2 乙二醇黄色1滴3 丙三醇黄色1滴4 乙酸棕黄色4滴5 甲酸棕黄色4滴6 200g/L酒石酸钾钠溶液黄色1滴7 200g/L蔗糖溶液黄色1滴4. 醇、羧酸与氯化铁显色后遇碱的褪色作用不同如表1、表2、表3所示,乙二醇、丙三醇等开链状邻二醇遇FeCl 3溶液所显黄色比一元醇更深,且会因氢氧化钠的加入而褪色;乙醇等一元醇与FeCl 3溶液反应后,遇碱会产生棕色沉淀Fe (OH )3。
醇酚醚与三氯化铁的显色反应
酚类与三氯化铁生成有颜色的络合物:
不同的酚其相应的络合物呈现不同颜色,例如:
这种特殊的显色反应可用来检验酚羟基的存在。
除酚类外,凡具有烯醇结构的化合物与FeCl3都有显色反应。
酚与的FeCl3显色反应:
具有烯醇式结构的化合物大多数能与三氯化铁的水溶液反应,显出不同的颜色,称之为显色反应,酚中具有烯醇式结构,也可以与三氯化铁起显色反应。
结构不同的酚所显颜色不同(见表7—3),此反应可用于鉴别含有烯醇式结构的化合物。
表7—3 酚和三氯化铁产生的颜色。
实验报告醇和酚鉴定实验报告醇和酚的鉴定的实验报告 3 篇篇一:实验醇和酚的性质【实验目的】1.进行醇和酚主要化学性质的实验操作。
2.熟练进行水浴加热和点滴板使用的操作。
3.能较快地设计出①伯醇、仲醇与叔醇;②一元醇与多元醇;③醇与酚类物质的鉴别方案,并进行实验操作。
4.具有严肃和实事求是的科学态度,养成爱护公物,节省试剂的良好品德。
【实验用品】金属钠、无水乙醇、酚酞试剂、仲丁醇、叔丁醇、蒸馏水、卢卡斯试剂、1.5mol/L 硫酸、0.17mol/L 重铬酸钾溶液、100g/L NaOH 溶液、乙醇、醋酸、48g/L CuSO4 溶液、甘油、蓝色石蕊试纸、0.1mol/L苯酚溶液、饱和碳酸钠溶液、饱和碳酸氢钠溶液、溴水、0.06mol/L三氯化铁溶液、0.03mol/L 高锰酸钾溶液、浓硫酸。
试管、烧杯、酒精灯、玻璃棒、点滴板、广泛 pH 试纸、表面皿。
【实验原理】羟基是醇的官能团、O-H 键和 C-O 键容易断裂发生化学反应;同时,α-H 和β-H 有一定的活泼性,使得醇能发生氧化反应、消除反应等;而邻多元醇除了具有一般醇的化学性质,由于它们分子中相邻羟基的相互影响,具有一些特殊的性质,如甘油能与 Cu(OH)2 作用。
酚类化合物分子中含有羟基,O -H 键已发生断裂,在水溶液中能电离出少量氢离子,使酚溶液显示弱酸性;-OH 受苯环上大π键的影响,使得 C-OH 键显示一定的活性,易发生氧化反应;而苯环也受-OH 的影响,使得苯环上的 H 的活性增强,易发生取代反应。
【实验指导】(实验内容、步骤、操作事项)一、醇的化学性质1.醇钠的生成及水解在干燥试管中,加入无水乙醇 1mL,并加一小粒新切的、用滤纸擦干的金属钠,观察反应放出的气体和试管是否发热。
随着反应的进行,试管内溶液变稠。
当钠完全溶解后,冷却,试管内溶液逐渐凝结成固体。
然后滴加水直到固体消失,再加一滴酚酞试液,观察并解释发生的变化。
醇酚醚与三氯化铁的显色反应
酚类与三氯化铁生成有颜色的络合物:
不同的酚其相应的络合物呈现不同颜色,例如:
这种特殊的显色反应可用来检验酚羟基的存在。
除酚类外,凡具有烯醇结构的化合物与FeCl3都有显色反应。
酚与的FeCl3显色反应:
具有烯醇式结构的化合物大多数能与三氯化铁的水溶液反应,显出不同的颜色,称之为显色反应,酚中具有烯醇式结构,也可以与三氯化铁起显色反应。
结构不同的酚所显颜色不同(见表7—3),此反应可用于鉴别含有烯醇式结构的化合物。
表7—3 酚和三氯化铁产生的颜色。