检测系统分析性能验证及确认
- 格式:ppt
- 大小:8.75 MB
- 文档页数:83





实验室检测系统性能验证Hessen was revised in January 2021实验室检测系统性能验证检测系统是指完成一个检验项目所涉及的仪器、试剂、校准品、检验程序、保养计划等的组合。
随着检验医学的发展和对质量要求的提高,人们开始认识和关注检测系统的重要性。
新添置的检测系统,虽然仪器厂商已经提供了仪器性能的初步参数,但由于地区、实验室之间的差异,个实验室在仪器正式用来检测患者样品和发检验报告前,应重新进行性能评价。
这是保证检验质量的一个重要措施,也是实验室认可的要求。
实验室如使用的检测系统是公司的系列产品,即使用的是厂商提供的原检测系统,则只需做基本的性能验证。
具体方法如下:一.精密度验证1.批内精密度:根据CLSI EP15-A文件,取2个水平的标本,同一批次尽可能短时间内连续重复测定20次,CV值必须小于或等于厂家的要求。
标准差=方差的算术平方根=s=@sqrt(((x1-x)^2 +(x2-x)^2 +......(xn-x)^2)/(n-1));CV%=SD/mean(x1...xn)*100%.2.批间精密度:参照CLSIEP5-A文件,选取正常水平(Citrol-1)、异常水平(Citrol-2),分别分装成5份,冻存于-20℃冰箱内。
每天取出2个水平的质控,分别测定2批次,每批次测2遍,2次间隔大于2h,连续测定5天,计算SD和CV,CV值必须小于或等于厂家的要求。
二.准确度验证分别取2个水平的定值质控品(Citrol-1,Citrol-2)验证凝血四项的准确度,D-二聚体专用质控品验证其准确度,每个结果重复测定3次,结果应在质控品标识的可控范围内,偏倚应在厂家标识的±10%范围内;同时结合当年卫生部临检中心凝血室间质量评价结果进行评价。
三.检测限验证只验证以浓度为结果的项目,将FBG和D-Dimer的标准品分别使用配套的OVB 稀释液稀释到厂家标识的浓度检测底限值附近,重复检测10次,记录结果,计算CV,应在厂家标识的±20%范围内,该浓度即为该项目的检测下限。

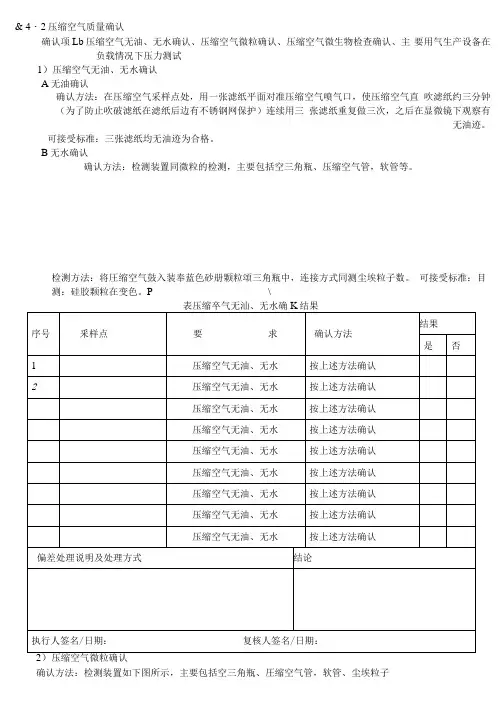
& 4・2压缩空气质量确认确认项Lb压缩空气无油、无水确认、压缩空气微粒确认、压缩空气微生物检查确认、主要用气生产设备在负载情况下压力测试1)压缩空气无油、无水确认A无油确认确认方法:在压缩空气采样点处,用一张滤纸平面对准压缩空气喷气口,使压缩空气直吹滤纸约三分钟(为了防止吹破滤纸在滤纸后边有不锈钢网保护)连续用三张滤纸重复做三次,之后在显微镜下观察有无油迹。
可接受标准:三张滤纸均无油迹为合格。
B无水确认确认方法:检测装置同微粒的检测,主要包括空三角瓶、压缩空气管,软管等。
检测方法:将圧缩空气鼓入装奉蓝色砂册颗粒頌三角瓶中,连接方式同测尘埃粒子数。
可接受标准:目测:硅胶颗粒在变色。
P \确认方法:检测装置如下图所示,主要包括空三角瓶、圧缩空气管,软管、尘埃粒子偏差处理说明及处理方式结论序号 采样点确认内容 要求 确认方法每次实测数(个/m3)结果 123是 否1微粒 $0. 5 u m 同上标准 按上述方2数 △5 P m同上标准 法确认3微粒 $0. 5 Mm 同上标准 按上述方4数$5 u m 同上标准 法确认5 微粒 $0. 5 Mm 同上标准 按上述方6数 △5 u m 同上标准 法确认7微粒 $0. 5 u m 同上标准 按上述方8数 △ 5 P m 同上标准 法确认9微粒 $0. 5 um 同上标准 按上述方10 数 $5 u m 同上标准 法确认11 微粒$0. 5 um 同上标准 按上述方12数 $5 P m同上标准 法确认13 微粒DO. 5 u m 同上标准 按上述方14数$5 P m 同上标准 法确认15 微粒$0. 5 M m 同上标准 按上述方16数$5 u m 同上标准 法确认警报限^0.5nm W1760000 个/m= ^5 Pm W14500 个/灵 纠偏限M0・5um ^2350000个/m‘,^5umW20000 个/m‘J 援受标范:法定限^0. 5 umW3520000 个/m= $5 Um W29000 个/長计数器等。
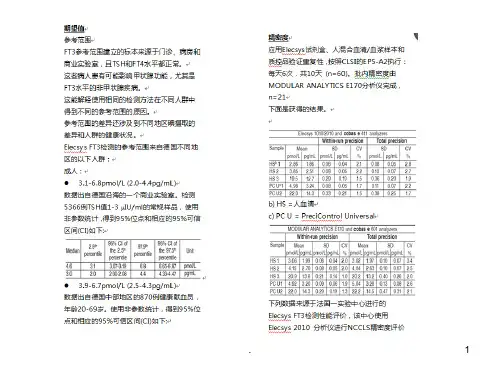


浙江省中医院徐淑贞陈明涛姚轶敏摘要为了提高医学实验室的质量和能力,规范实验室检测系统的性能验证过程,文章从制定计划,确定方案,执行方案三个方面详细的介绍了检测系统分析性能评价的程序。
医学实验室为保证检验结果的可靠有效,最大程度的得到质量和能力方面的认可,近年来各实验室着力推行检验过程的规范化和标准化,用审视的态度评价日常的操作行为,其中对检测系统的验证评价尤其重视。
检测系统的验证是指对实验室新购置的已被政府有关部门认可了其分析性能的检测系统,实验室在投入进行常规病人标本检测前,需对厂商提供的性能资料中的几个分析性能进行实验确认该检测系统是否具有预期的水平。
对检测系统性能验证的内容一般包括精密度,正确度,分析测量范围,临床可报告范围,生物参考区间。
本文就实验室如何开展验证工作做了以下几点探讨:1 制定验证计划1.1 实验室管理层应制定计划,用于定期监测并证实检测系统已适当校准处于正常功能状态。
同时还应有文件化的预防性维护计划并记录[1]。
1.2 实验室技术负责人和各专业组组长共同负责检测系统分析性能评价实验方法的设计,专业组组长负责组织检测系统的分析性能评价实验并成立工作小组。
2 制定验证方案2.1 确认检测系统:检查一个项目检测所涉及的仪器、试剂、校准品、操作程序、质量控制程序、保养计划等组组成的检测系统,若手工操作还包括具体操作人员都准备到位。
2.2 确认性能验证的内容:定量项目包含精密度,正确度,分析测量范围,临床可报告范围,生物参考区间;定性、半定量项目包含检测结果符合率,检出限。
2.3 确认验证时机和周期:实验室对新购置的检测系统在正式用于检测标本前,需要对检测系统的主要性能和指标进行验证;系统每运行12个月后,需要重新对检测系统的主要性能和指标进行验证;遇到重大投诉针对检测系统有质疑时,需要有针对性的进行验证;仪器维修后、重要零件更换后、试剂改变后等需要对系统的主要性能指标重新验证;仪器长距离搬动后,需要对检测系统的主要性能和指标进行验证,从而保证检验结果的可靠性,最大程度的满足临床要求。

检测方法的验证及确认该怎么做检测方法的验证及确认当自己的实验室将标准方法引入到自身的检测工作时,则应对引入的标准方法进行验证,并正确有效地运用。
方法的确认应广泛全面,以满足预定用途或应用领域的需要。
标准方法确认准则是:所用的设备、环境条件、人员技术等。
以证明实验室能够正确使用该新标准实施检测过程。
标准方法的确认或是通过核查方式,并提供客观证据,以证实某一特定预期用途的特殊要求得到满足。
用于确定某方法性能的技术宜是下列情况之一,或是其组合:a.使用参考标准或标准物质(参考物质)进行校准;b.与其他方法所得的结果进行比较;c.实验室间比对;d.对影响结果的因素作系统评审;e.根据对方法的理论原理和实践经验的科学理解,对所得结果不确定度进行的评定。
实验室应按照制定的相关工作程序选择上述方法进行验证,确认将要使用的检测方法是否满足要求,在确认方法确实可行后,方可投入使用。
对于方法确认试验来说主要有:变更后的标准确认和新方法的确认。
在确认时应该做方法的标准曲线、添加标准回收率试验、最低检出限试验和精密度试验等,并考虑方法的特异性和耐用性,如果需要时还应进行不确定度评估。
应用实验数据真实地证明方法的适用性、准确性和灵敏性。
非标方法的确认在《实验室资质认定评审准则》条款中规定:实验室自行制订的非标方法,经确认后,可以作为资质认定项目,但仅限特定委托方的检测。
非标准方法是指未经相应标准化组织批准的检测/校准方法。
只有在尚无国家标准、行业标准、地方标准时,实验室方可自制非标检测方法,应经过确认:a、从理论到实际对方法的理解;b、使用标准物质或参考标准进行校准;c、与不同方法所得的结果进行比较;d、实验室间的比对试验;e、结果不确定度评定。
必要时对方法确认过程得到的测量值是否满足顾客的技术要求进行评审,这些值可包括:测量结果的不确定度、检出限、方法的选择性、线性、重复性限、复现性限、抵抗外来影响的稳健性和抵抗来自样品的基体干扰的交互灵敏度,可根据具体方法确定。