弱酸弱碱的解离常数解离度和稀释定律汇总.
- 格式:ppt
- 大小:275.50 KB
- 文档页数:11
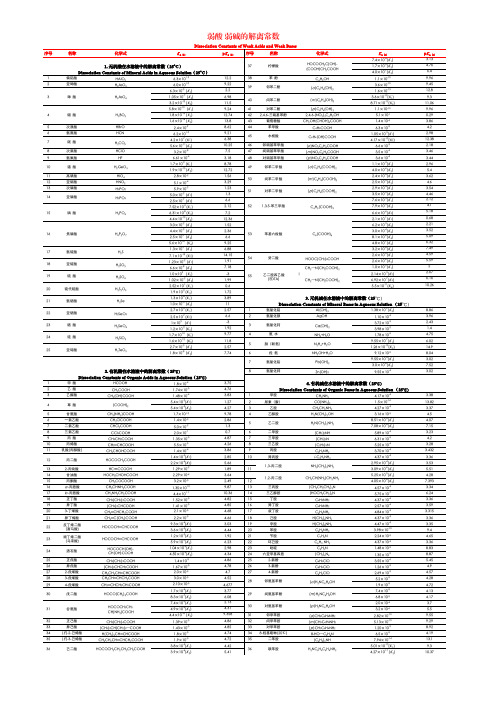

常见酸碱水中的解离常数弱酸、弱碱的解离常数Dissociation Constants of Weak Acids and Weak Bases1. 无机酸在水溶液中的解离常数(25o C)Dissociation Constants of Mineral Acids in Aqueous Solution (25o C)序号名称(Name) 化学式(Chemical formula) K a p K a (No.)1 偏铝酸HAlO2 6.3×10-1312.22 亚砷酸H3AsO3 6.0×10-109.223 砷酸H3AsO46.3×10-3 (K1) 2.2 1.05×10-7 (K2) 6.98 3.2×10-12 (K3) 11.54 硼酸H3BO35.8×10-10 (K1) 9.24 1.8×10-13 (K2) 12.74 1.6×10-14 (K3) 13.85 次溴酸HBrO 2.4×10-98.626 氢氰酸H CN 6.2×10-109.217 碳酸H2CO34.2×10-7 (K1) 6.385.6×10-11(K2) 10.258 次氯酸HClO 3.2×10-87.59 氢氟酸HF 6.61×10-4 3.1810 锗酸H2GeO31.7×10-9 (K1) 8.78 1.9×10-13 (K2) 12.7211 高碘酸HIO4 2.8×10-2 1.5612 亚硝酸HNO2 5.1×10-4 3.2913 次磷酸H3PO2 5.9×10-2 1.2314 亚磷酸H3PO35.0×10-2 (K1) 1.3 2.5×10-7 (K2) 6.615 磷酸H3PO47.52×10-3 (K1) 2.12 6.31×10-8 (K2) 7.2 4.4×10-13 (K3) 12.3616 焦磷酸H4P2O73.0×10-2 (K1) 1.524.4×10-3 (K2) 2.36 2.5×10-7 (K3) 6.65.6×10-10 (K4) 9.2517 氢硫酸H2S 1.3×10-7 (K1) 6.88 7.1×10-15 (K2) 14.1518 亚硫酸H2SO31.23×10-2 (K1) 1.91 6.6×10-8 (K2) 7.1819 硫酸H2SO4 1.0×103 (K1) -31.02×10-2 (K2) 1.9920 硫代硫酸H2S2O32.52×10-1 (K1) 0.6 1.9×10-2 (K2) 1.7221 氢硒酸H2Se 1.3×10-4 (K1) 3.89 1.0×10-11(K2) 1122 亚硒酸H2SeO32.7×10-3 (K1) 2.57 2.5×10-7 (K2) 6.623 硒酸H2SeO41×103 (K1) -3 1.2×10-2 (K2) 1.9224 硅酸H2SiO31.7×10-10 (K1) 9.77 1.6×10-12 (K2) 11.825 亚碲酸H2TeO32.7×10-3 (K1) 2.57 1.8×10-8 (K2) 7.742. 有机酸在水溶液中的解离常数(25o C)Dissociation Constants of Organic Acids in Aqueous Solution (25o C)序号(No .) 名称(Name)化学式K a p K a(Chemical formula)1 甲酸HCOOH 1.8×10-4 3.752 乙酸CH3COOH 1.74×10-5 4.763 乙醇酸CH2(OH)COOH 1.48×10-4 3.834 草酸(COOH)25.4×10-2(K1) 1.27 5.4×10-5(K2) 4.275 甘氨酸CH2(NH2)COOH 1.7×10-109.786 一氯乙酸CH2ClCOOH 1.4×10-3 2.867 二氯乙酸CHCl2COOH 5.0×10-2 1.38 三氯乙酸CCl3COOH 2.0×10-10.79 丙酸CH3CH2COOH 1.35×10-5 4.8710 丙烯酸CH2═CHCOOH 5.5×10-5 4.2611 乳酸(丙醇酸) CH3CHOHCOOH 1.4×10-4 3.8612 丙二酸HOCOCH2COOH 1.4×10-3(K1) 2.852.2×10-6(K2) 5.6613 2-丙炔酸HC≡CCOOH 1.29×10-2 1.8914 甘油酸HOCH2CHOHCOOH 2.29×10-4 3.6415 丙酮酸CH3COCOOH 3.2×10-3 2.4916 α-丙胺酸 CH3CH NH2COOH 1.35×10-109.8717 β-丙胺酸CH2NH2CH2COOH 4.4×10-1110.3618 正丁酸CH3(CH2)2COOH 1.52×10-5 4.8219 异丁酸(CH3)2CHCOOH 1.41×10-5 4.8520 3-丁烯酸CH2═CHCH2COOH 2.1×10-5 4.6821 异丁烯酸CH2═C(CH2)COOH 2.2×10-5 4.6622 反丁烯二酸(富马酸)HOCOCH═CHCOOH9.3×10-4(K1) 3.033.6×10-5(K2)4.4423 顺丁烯二酸(马来酸)HOCOCH═CHCOOH1.2×10-2(K1) 1.925.9×10-7(K2)6.2324 酒石酸HOCOCH(OH)CH(OH)COOH 1.04×10-3(K1) 2.98 4.55×10-5(K2) 4.3425 正戊酸CH3(CH2)3COOH 1.4×10-5 4.8626 异戊酸(CH3)2CHCH2COOH 1.67×10-5 4.7827 2-戊烯酸CH3CH2CH═CHCOOH 2.0×10-5 4.728 3-戊烯酸CH3CH═CHCH2COOH 3.0×10-5 4.5229 4-戊烯酸CH2═CHCH2CH2COOH 2.10×10-5 4.67730 戊二酸HOCO(CH2)3COOH 1.7×10-4(K1) 3.77 8.3×10-7(K2) 6.0831 谷氨酸HOCOCH2CH2CH(NH2)COOH7.4×10-3(K1) 2.13 4.9×10-5(K2) 4.31 4.4×10-10 (K3) 9.35832 正己酸CH3(CH2)4COOH 1.39×10-5 4.8633 异己酸(CH3)2CH(CH2)3—COOH 1.43×10-5 4.8534 (E)-2-己烯酸H(CH2)3CH═CHCOOH 1.8×10-5 4.7435 (E)-3-己烯酸CH3CH2CH═CHCH2COOH 1.9×10-5 4.7236 己二酸HOCOCH2CH2CH2CH2COOH 3.8×10-5(K1) 4.42 3.9×10-6(K2) 5.4137 柠檬酸HOCOCH2C(OH)(COOH)CH2COOH 7.4×10-4(K1) 3.13 1.7×10-5(K2) 4.76 4.0×10-7(K3) 6.438 苯酚C6H5OH 1.1×10-109.9639 邻苯二酚(o)C6H4(OH)23.6×10-109.45 1.6×10-1312.840 间苯二酚(m)C6H4(OH)23.6×10-10(K1) 9.3 8.71×10-12(K2) 11.0641 对苯二酚(p)C6H4(OH)2 1.1×10-109.9642 2,4,6-三硝基苯酚2,4,6-(NO2)3C6H2OH 5.1×10-10.2943 葡萄糖酸CH2OH(CHOH)4COOH 1.4×10-4 3.8644 苯甲酸C6H5COOH 6.3×10-5 4.245 水杨酸C6H4(OH)COOH 1.05×10-3(K1) 2.98 4.17×10-13(K2) 12.3846 邻硝基苯甲酸(o)NO2C6H4COOH 6.6×10-3 2.1847 间硝基苯甲酸(m)NO2C6H4COOH 3.5×10-4 3.4648 对硝基苯甲酸(p)NO2C6H4COOH 3.6×10-4 3.4449 邻苯二甲酸(o)C6H4(COOH)21.1×10-3(K1) 2.96 4.0×10-6(K2) 5.450 间苯二甲酸(m)C6H4(COOH)22.4×10-4(K1) 3.62 2.5×10-5(K2) 4.651 对苯二甲酸(p)C6H4(COOH)22.9×10-4(K1) 3.543.5×10-5(K2)4.4652 1,3,5-苯三甲酸C6H3(COOH)37.6×10-3(K1) 2.12 7.9×10-5(K2) 4.1 6.6×10-6(K3) 5.1853 苯基六羧酸C6(COOH)62.1×10-1(K1) 0.68 6.2×10-3(K2)2.213.0×10-4(K3) 3.52 8.1×10-6(K4) 5.094.8×10-7(K5) 6.323.2×10-8(K6) 7.4954 癸二酸HOOC(CH2)8COOH 2.6×10-5(K1) 4.59 2.6×10-6(K2) 5.5955乙二胺四乙酸(EDTA)CH2—N(CH2COOH)2 1.0×10-2(K1) 2∣ 2.14×10-3(K2) 2.67CH2—N(CH2COOH)2 6.92×10-7(K3) 6.165.5×10-11(K4) 10.263. 无机碱在水溶液中的解离常数(25o C)Dissociation Constants of Mineral Bases in Aqueous Solution (25o C)序号(No .) 名称(Name)化学式K b p K b(Chemical formula)1 氢氧化铝Al(OH)3 1.38×10-9(K3) 8.862 氢氧化银AgOH 1.10×10-4 3.963 氢氧化钙Ca(OH)23.72×10-3 2.43 3.98×10-2 1.44 氨水NH3+H2O 1.78×10-5 4.755 肼(联氨)N2H4+H2O 9.55×10-7(K1) 6.02 1.26×10-15(K2) 14.96 羟氨NH2OH+H2O 9.12×10-98.047 氢氧化铅Pb(OH)29.55×10-4(K1) 3.02 3.0×10-8(K2) 7.528 氢氧化锌Zn(OH)29.55×10-4 3.024. 有机碱在水溶液中的解离常数(25o C)Dissociation Constants of Organic Bases in Aqueous Solution (25o C)序号(No.)名称(Name) 化学式(Chemical formula) K b p K b 1 甲胺CH3NH2 4.17×10-4 3.382 尿素(脲)CO(NH2)2 1.5×10-1413.823 乙胺CH3CH2NH2 4.27×10-4 3.374 乙醇胺H2N(CH2)2OH 3.16×10-5 4.55 乙二胺H2N(CH2)2NH28.51×10-5(K1) 4.07 7.08×10-8(K2) 7.156 二甲胺(CH3)2NH 5.89×10-4 3.237 三甲胺(CH3)3N 6.31×10-5 4.28 三乙胺(C2H5)3N 5.25×10-4 3.289 丙胺C3H7NH2 3.70×10-4 3.43210 异丙胺i-C3H7NH2 4.37×10-4 3.361,3-丙二胺NH2(CH2)3NH22.95×10-4(K1) 3.5311 3.09×10-6(K2) 5.511,2-丙二胺CH3CH(NH2)CH2NH25.25×10-5(K1) 4.2812 4.05×10-8(K2) 7.39313 三丙胺(CH3CH2CH2)3N 4.57×10-4 3.3414 三乙醇胺(HOCH2CH2)3N 5.75×10-7 6.2415 丁胺C4H9NH2 4.37×10-4 3.3616 异丁胺C4H9NH2 2.57×10-4 3.5917 叔丁胺C4H9NH2 4.84×10-4 3.31518 己胺H(CH2)6NH2 4.37×10-4 3.3619 辛胺H(CH2)8NH2 4.47×10-4 3.3520 苯胺C6H5NH2 3.98×10-109.421 苄胺C7H9N 2.24×10-5 4.6522 环己胺C6H11NH2 4.37×10-4 3.3623 吡啶C5H5N 1.48×10-98.8324 六亚甲基四胺(CH2)6N4 1.35×10-98.8725 2-氯酚C6H5ClO 3.55×10-6 5.4526 3-氯酚C6H5ClO 1.26×10-5 4.927 4-氯酚C6H5ClO 2.69×10-5 4.5728 邻氨基苯酚(o)H2NC6H4OH 5.2×10-5 4.28 1.9×10-5 4.7229 间氨基苯酚(m)H2NC6H4OH 7.4×10-5 4.13 6.8×10-5 4.1730 对氨基苯酚(p)H2NC6H4OH 2.0×10-4 3.73.2×10-6 5.531 邻甲苯胺(o)CH3C6H4NH2 2.82×10-109.5532 间甲苯胺(m)CH3C6H4NH2 5.13×10-109.2933 对甲苯胺(p)CH3C6H4NH2 1.20×10-98.9234 8-羟基喹啉(20℃) 8-HO—C9H6N 6.5×10-5 4.1935 二苯胺(C6H5)2NH 7.94×10-1413.136 联苯胺H2NC6H4C6H4NH25.01×10-10(K1) 9.3 4.27×10-11(K2) 10.37。


第8 章酸碱解离平衡8-1-2 水的解离平衡和溶液的pH1. 水的离子积常数(KӨ)wH2O(l)H+(aq)+ OH-(aq)K wӨ= [ H+ ] [ OH-]H2O H++ OH- H> 0 吸热反应T升高时,K wӨ值变大;降低时,K wӨ值变小。
8-1-3 多元弱酸的解离平衡H 3PO 3H 2CO 3, H 2S, H 2SO 3二元酸H 3PO 4, H3A S O 4三元酸三元弱酸的解离:(3) 负二价的酸根离子的浓度等于第二级解离常数K 2。
(1) 其[H +] 是由第一步解离决定;(2) 负一价酸根离子的浓度等于体系中的[H +];和二元酸相似,三元酸也是分步解离的,K 1,K 2,K 3相差很大。
从多元酸的讨论中可得类似结论:二元弱酸解离①二元弱酸的[ H+]由第一步解离决定。
②溶液的负一价酸根浓度也由第一步解离决定。
③负二价酸根浓度由总反应平衡常数计算更方便。
④在强酸溶液中,[H+]取决于强酸的浓度。
8-1-4 缓冲溶液例8−6缓冲溶液的组成为c(HAc)= 0.10 mol ·dm-3酸(NaAc) = 0.10 mol·dm-3c盐求(1)其pH;(2) 向1dm3 该缓冲溶液中,分别加入0.01 mol 盐酸和0.01 mol 氢氧化钠,pH 值各变成多少?忽略加入酸碱时的微小体积变化; (3) 将1.0 dm3 该溶液加水稀释至10 dm3,引起的pH 变化。
(HAc)= 0.10 mol ·dm-3 缓冲溶液c酸(NaAc) = 0.10 mol·dm-3c盐①溶液pH = 4.74②加入0.01 mol H+ ,pH = 4.66③加入0.01 mol OH–,pH = 4.82④加水稀释10倍,pH = 4.74Ac-可与H+ 结合生成HAc,抵抗H+,称为抗酸组分。
HAc可与OH-反应生成Ac-,抵抗OH-,称为抗碱组分。

弱酸弱碱的解离平衡第三节弱酸弱碱的解离平衡弱酸弱碱的电离存在平衡.高中的电离平衡即解离平衡.一.一元弱酸和弱碱的解离平衡弱电解质的解离过程就是质子的传递过程.1.一元弱酸的解离常数例如醋酸:HAc+H 2O H 3O ++Ac -此式可简化成:HAc H ++Ac -在一定温度下达到电离平衡时有:[H +][Ac -]/[HAc]=K a (酸常数)2.一元弱碱的解离常数例如:氨水:NH 3+H 2O NH 4++OH -在一定温度下达到解离平衡时:[OH -][NH 4+]/[NH 3]=K b (碱常数)结论:K 的大小表示了弱电解质在水溶液中的解离程度.在温度相同时,K 越大表示解离程度越大,该弱电解质相对越强.K=10-2-10-7之间的酸或碱为弱酸或弱碱.K<10-7的弱酸或弱碱为极弱酸或极弱碱.3.对一对共轭酸碱,应有K a K b =K WNH 3+H 2O NH 4++OH - K b =[OH -][NH 4+]/[NH 3]NH 4++H 2O H 3O ++NH 3 K a =[H 3O +][NH 3]/[NH 4+] 显然有K a K b =K W[例题]教材P78的7题.解答如下:溶液的pH=9.25,则[H +]=10-9.25mol ·L -1,所以[OH -]=K W /[H +]=10-4.5mol ·L -1 NaX →Na ++X - X -+H 2O HX+OH -K b =[OH -][HX]/[X -]=10-4.5×10-4.5/0.3=10-9/0.3 K a =K W /K b =3×10-6二.弱电解质的解离度(电离度)与浓度和解离常数的关系1.解离度的概念(1)概念:一定温度下弱电解质在水溶液中达到解离平衡时,已解离的弱电解质分子占原来弱电解质分子的百分数叫该弱电解质的解离度.(2)公式:α= ×100% 请看教材P59表. 说明:公式中的分子和分母可用浓度代替.2.解离度与解离常数及弱电解质浓度的关系这里以HAc 为例分析如下.设HAc 的浓度为cmol ·L -1,解离度为α. 已解离的弱电解质分子数原来弱电解质分子总数HAc H+ + Ac-起始浓度mol·L-1 c 0 0平衡浓度mol·L-1 c-cα cα cαK a=[H+][Ac-]/[HAc]=c2α2/(c-cα)=cα2/(1-α) 当α很小时,1-α=1.则有K a=cα2或α=√K a/c容易得到[H+]=cα=√K a c对一元弱碱是类似的.以上公式是近似的,一般当α≤5%即C/K a≥500时才能用.[例题]教材P78的4题.解答提示:(1)方法一:直接代入K a=cα2=0.1×(2%)2=4×10-5.方法二:HAc H+ + Ac-起始浓度mol·L-1 0.1 0 0平衡浓度mol·L-1 0.098 0.002 0.002K a=[H+][Ac-]/[HAc]=0.0022/0.098=4.1×10-5(2)利用α=√K a/c 将K a=4.1×10-5和c=0.001mol·L-1代入得α=20%.(3)将α=1%和K a=4.1×10-5代入α=√K a/c 可得c=0.4mol·L-1[练习]教材P78的5题.解答提示:对0.2mol·L-1HAc,[H+]=√K a c 先查表(教材P172 pK a=4.76→K a=10-4.76=1.76×10-5)得K a 值. 将c和K a代入,结果是[H+]=1.88×10-3mol·L-1[练习]教材P78的3题.解答提示:先由质量分数计算NH3溶液的物质的量浓度:c=0.5mol·L-1.再查表P59氨水的K b=1.77×10-5,利用[OH-]=√K b c =2.97×10-3.利用[H+]=K W/[OH-]=3.367×10-12.则pH=11.47.此处也可查教材P172的NH4+的pK a=9.25,即K a=10-9.25,利用K W=K a K b得到K b=10-4.65=1.77×10-5[作业习题讲解]教材P78的8题(1)加NaAc溶液好.因为HCl电离出的H+可以和NaAc电离出的Ac-结合H++Ac- HAc,使[H+]降低.若加入HAc则其电离产生[H+],[H+]浓度不会有大的变化.(2)设原HCl溶液和加入的NaAc溶液各1LHCl+NaAc→NaCl+HAc反应后溶液中含[Ac-]=0.9mol·L-1,[HAc]=0.1mol·L-1HAc H++Ac-K a=[H+][Ac-]/[HAc]则[H+]=K a[HAc]/[Ac-]=1.76×10-5×0.1/0.9=1.956×10-6pH=5.7(3)设原HCl与加入的NaOH溶液各1LHCl+NaOH→NaCl+H2O 反应后[NaOH]=0.9mol·L-1[H+]=K W/[OH-]=10-14/0.9=1.11×10-14 pH=13.95(4)加入HAc溶液后,[HCl]=0.1mol·L-1,[HAc]=1mol·L-1.HAc的电离被抑制,则[H+]=0.1mol·L-1 pH=1[选学]三.多元弱酸和弱碱的解离平衡1.多元弱酸弱碱的含义凡在水溶液中释放出两个或多个质子的弱酸称为多元弱酸.能够接受两个或多个质子的碱称为多元弱碱.多元弱酸和弱碱是分步电离的.H2S H++HS- K a1=[H+][HS-]/[H2S]=9.1×10-8HS- H++S2- K a2=[H+][S2-]/[HS-]=1.1×10-12显然K a1>>K a2,当K a1/K a2≥100时,考虑第一步电离就可以了.我们一般也只考虑第一步电离.2.计算举例[例题]计算饱和H2S溶液(0.1mol·L-1)中的[H+]、[HS-]、[S2-]和H2S的解离度.(已知:K a1=9.1×10-8, K a2=1.1×10-12)(说明:有时需查表,例如教材P172的H2S的pKa1=7.05,pK a2=11.95→K a1=10-7.05=9.1×10-8,K a2=10-11.95=1.1×10-12) 解.(1)由于K a1>>K a2,则按一元弱酸处理.设[H+]=xmol·L-1H2S H++HS-平衡浓度mol·L-1 0.1-x x xK a1=[H+][HS-]/[H2S]=9.1×10-8由于c/K a1>500则可直接代入[H+]=[HS-]=√K a1c =9.5×10-5(2)计算[S2-]HS- H++S2- K a2=[H+][S2-]/[HS-]=1.1×10-12由于第二步解离极微弱,可认为[H+]=[HS-]则K a2=1.1×10-12mol·L-1(3)求H2S的解离度α=9.5×10-5/0.1=0.095%3.结论(1)计算多元弱酸溶液的[H+],按一元弱酸处理,[H+]=√K a1c(2)二元弱酸溶液中,酸根离子浓度近似等于K a2(3)需要高浓度的多元弱酸根时,用其盐.[选学]四.两性物质的解离平衡常见的两性物质有:多元弱酸的酸式酸根离子(HCO3-、HS-、H2PO4-、HPO42-)和弱酸弱碱盐(NH4Ac)及氨基酸等.1.酸式酸根离子(1)HCO3-作为酸:HCO3- H++CO32- K a2=[H+][CO32-]/[HCO3-]=5.6×10-11作为碱:HCO3-+H2O H2CO3+OH-K b2=[OH-][H2CO3]/[HCO3-]=K W/K a1=2.3×10-8K b2>>K a2.则溶液显碱性.经数学推导有:[H+]=√K a1K a2(2)H2PO4-作为酸:H2PO4- H++HPO42- K a2=[H+][HPO42-]/[H2PO4-]=6.23×10-8作为碱:H2PO4-+H2O OH-+H3PO4K b3=[OH-][H3PO4]/[H2PO4-]=K W/K a1=1.3×10-12K a2>>K b3.则溶液显酸性.经数学推导有:[H+]=√K a1K a2对HPO42-有:[H+]=√K a2K a3(3)弱酸弱碱盐①例如NH4Ac溶液,NH4+显酸性,Ac-显碱性NH4++H2O NH3+H3O+ K a(NH4+)=[NH3][H3O+]/[NH4+]=K W/K b(NH3)Ac-+H2O HAc+OH- K b(Ac-)=[HAc][OH-]/[Ac-]=K W/K a(HAc) 数学推导有:[H+]=√K W K a/K b =√K a K a’[H+]=√K W K a(HAc)/K b(NH3) =√K a(HAc)/K a(NH4+)②结论:K a K a’=K W为中性,K a K a’K W,为酸性.五.同离子效应和盐效应1.同离子效应例如向HAc中加入NaAc则HAc的解离平衡左移.同理向NH3溶液中加入NH4Cl则使NH3的解离平衡左移.HAc H++Ac- NH3+H2O NH4++OH-NaAc=Na++Ac- NH4Cl=NH4++Cl-向弱电解质溶液中加入与该弱电解质有共同离子的强电解质而使解离平衡左移,从而降低弱电解质的解离度的现象叫同离子效应.2.存在同离子效应时的计算[作业习题讲解]教材P79的10题.(1)混合后HCl和NaOH中和,余HCl0.05mol,[HCl]=0.1mol·L-1,pH=1(2)NH4Cl和NaOH恰好反应,得到的[NH3]=0.01/0.1=0.1mol·L-1利用[OH-]=√CK b =√0.1×1.77×10-5=1.33×10-3mol·L-1则[H+]=7.518×10-12mol·L-1则pH=11.12(3)NH4Cl和NaOH溶液反应后,余[NH4Cl]=0.067mol·L-1[NH3]=0.067mol·L-1NH3+H2O NH4++OH-K b=[NH4+][OH-]/[NH3]代入则K b=[OH-]=1.77×10-5mol·L-1则[H+]=K W/[OH-]=5.65×10-10mol·L-1则pH=9.25(4)NH4Cl和NaOH溶液反应后NaOH剩余,[NaOH]=0.005/0.075=0.067mol·L-1[NH3]=0.005/0.075=0.067mol·L-1OH-主要来源于NaOH,则[OH-]=0.067mol·L-1[H+]=K W/[OH-]=10-14/0.067=1.49×10-13mol·L-1 pH=12.82(5)反应后剩余NaOH0.01mol [NaOH]=0.01/0.05=0.2mol·L-1[H+]=5×10-4mol·L-1,pH=13.33.盐效应在弱电解质溶液的平衡体系中,加入不含弱电解质离子的强电解质,将促进弱电解质的电离,称为盐效应.解释:离子浓度加大,离子间互相牵制作用增强,离子结合成弱电解质分子的机会减小.同离子效应的同时也有盐效应,只不过是盐效应微弱.[复习思考题](教材P66的2-4题)2.相同浓度的盐酸和醋酸溶液的pH相等吗?相同pH值的盐酸和醋酸溶液的浓度相等吗?用相同浓度的NaOH溶液中和相同pH值的盐酸和醋酸溶液,哪个用量大?为什么?3.醋酸溶液稀释一倍,[H+]是原来的一半吗?为什么?4.在HAc溶液中分别加入HCl、NaAc、NaOH,对电离平衡有何影响.。

弱酸弱碱解离平衡弱酸弱碱解离平衡实验14弱酸弱碱解离平衡1.概述(1)弱酸解离和同离子效应弱酸在水溶液中存在着解离平衡,且当加入与弱酸解离相同的离子时,解离平衡将移动。
如在醋酸溶液中加入一定量的醋酸钠,由于醋酸钠为强电解质,因而它的解离将增加溶液中醋酸根离子浓度,一定数目醋酸根离子同溶液中氢离子结合,生成醋酸分子,使醋酸解离平衡向着醋酸分子方向移动:HAcH++Ac-即HAc的解高度降低,溶液中氢离子浓度减少。
这种由于加入相同离子而使弱电解质(弱酸、弱碱等)解离度降低的现象,称为同离子效应。
在化学反应中常常要用到同离子效应这一概念,如:MnS是难溶于水的,如在Mn2+离子的中性溶液中通入H2S气可得到MnS沉淀。
但在Mn2+离子的酸性溶液中不能产生MnS沉淀。
这可用同离子效应解释:由于在酸性溶液中H+离子对氢硫酸的解离产生同离子效应,使氢硫酸解离降低,S2-离子浓度很小,所以不能产生MnS沉淀。
弱碱在水溶液中也存在解离平衡和同离子效应。
(2)缓冲溶液1)缓冲溶液作用原理和pH值当往某些溶液中加入一定量的酸和碱时,有阻碍溶液pH变化的作用,称为缓冲作用,这样的溶液叫做缓冲溶液。
弱酸及其盐的混合溶液(如HAc与NaAc),弱碱及其盐的混合溶液(如NH3·H2O与NH4Cl)等都是缓冲溶液。
由弱酸HA及其盐NaA所组成的缓冲溶液对酸的缓冲作用,是由于溶液中存在足够量的碱A-的缘故。
当向这种溶液中加入一定量的强酸时,H+离子基本上被A-离子消耗:A-+H+HA所以溶液的pH值几乎不变;当加入一定量强碱时,溶液中存在的弱酸HA消耗OH-离子而阻碍pH的变化:HA+OH-A-+H2O缓冲溶液中H+浓度可通过下面方程计算:式中c(A-)表示弱酸HA和盐NaA解离产生的A-离子的总浓度。
由于弱酸HA生成的A-离子的量与强电解质NaA所生成的A-离子相比,可以忽略不计,所以,c(A-)=完全解离的盐的浓度=c(盐)因为弱酸HA在NaA解离的A-离子所产生的同离子效应下,未解离弱酸的浓度可近似地表示如下:c(HA)=弱酸的总浓度=c(酸)所以等式两边取负对数得:2)缓冲溶液的缓冲能力在缓冲溶液中加入少量强酸或强碱,其溶液pH值变化不大,但若加入酸,碱的量多时,缓冲溶液就失去了它的缓冲作用。