醋酸解离常数测定
- 格式:ppt
- 大小:7.95 MB
- 文档页数:33


醋酸解离常数的测定实验报告醋酸解离常数的测定实验报告引言:醋酸是一种常见的有机酸,广泛应用于食品、医药、化妆品等领域。
醋酸的解离常数是衡量其酸性强弱的重要指标,也是研究其化学性质的基础。
本实验旨在通过测定醋酸的电导率,计算出其解离常数,从而探究醋酸的酸性特性。
实验步骤:1. 实验前准备:准备所需的实验器材和试剂,包括电导仪、电导池、醋酸溶液、去离子水等。
2. 样品制备:取适量的醋酸溶液,用去离子水稀释至一定浓度,以保证实验的准确性和可重复性。
3. 测定电导率:将电导池浸入稀释后的醋酸溶液中,打开电导仪,记录电导率的数值。
为了提高实验的准确性,需重复测量多次,取平均值。
4. 数据处理:根据电导率的测定结果,利用电导率与浓度之间的关系,计算出醋酸的解离度。
实验结果与分析:根据实验测得的电导率数据,我们可以计算出醋酸的解离度。
解离度是指溶液中解离物的浓度与总浓度之比,可以用来表示酸性的强弱。
根据测定的电导率和浓度数据,我们可以得到醋酸溶液的电导率与浓度之间的线性关系,进而推算出醋酸的解离度。
通过计算,我们得到了醋酸的解离常数。
解离常数是描述酸或碱在溶液中解离程度的指标,它越大表示酸性或碱性越强。
醋酸的解离常数可以用来评价其酸性的强弱,也可以作为比较不同酸的酸性强弱的依据。
实验误差与改进:在实验过程中,可能会存在一些误差,如仪器误差、操作误差等。
为了减小误差,可以采取以下改进措施:1. 保持实验环境的稳定,避免温度和湿度的变化对实验结果的影响。
2. 严格控制实验操作的步骤和时间,避免操作不当导致误差的产生。
3. 增加重复实验次数,取平均值,提高实验结果的可靠性。
结论:通过本实验测定,我们成功得到了醋酸的解离常数。
该实验结果可为研究醋酸的酸性特性提供重要依据。
同时,本实验还展示了电导率测定方法在化学实验中的应用,为进一步研究酸碱性质提供了思路和方法。
总结:本实验通过测定醋酸的电导率,计算出其解离度,进而得到醋酸的解离常数。
醋酸解离常数的测定实验报告数据醋酸解离常数的测定实验报告数据
一、实验目的
本实验旨在通过电位滴定法测定醋酸的解离常数(Ka),了解弱电解质的解离平衡及其影响因素。
二、实验原理
醋酸(CH3COOH)是一种弱电解质,在水溶液中存在解离平衡:
CH3COOH ⇌ CH3COO- + H+
Ka表示醋酸解离平衡中H+离子浓度与醋酸分子浓度的比值,其大小反映了醋酸解离的程度。
电位滴定法是通过测量滴定过程中电位的变化来确定滴定终点的方法,本实验采用电位滴定法测定醋酸的解离常数。
三、实验步骤
1.配制不同浓度的醋酸溶液(0.1mol/L、0.01mol/L、0.001mol/L)。
2.在室温下,用pH计分别测量不同浓度醋酸溶液的pH值,记录数据。
3.根据pH值,计算溶液中H+离子浓度。
4.以H+离子浓度的对数为横坐标,以醋酸浓度的对数为纵坐标,绘制图表。
5.通过线性拟合得到直线的斜率,从而求得醋酸的解离常数Ka。
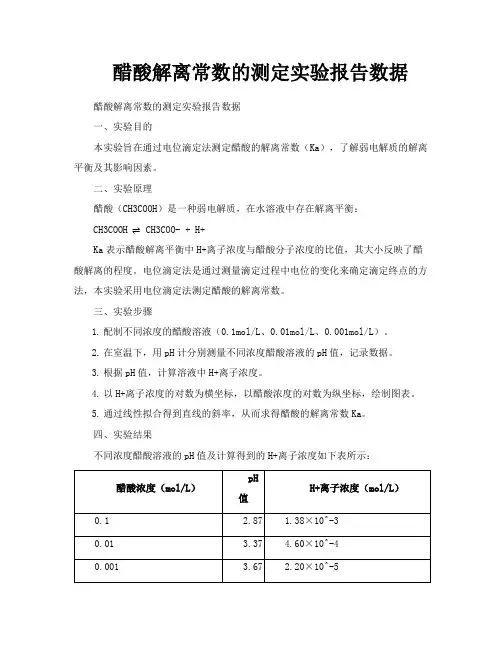
四、实验结果
不同浓度醋酸溶液的pH值及计算得到的H+离子浓度如下表所示:
以H+离子浓度的对数为横坐标,以醋酸浓度的对数为纵坐标,绘制图表如下:
(请在此处插入图表)
通过线性拟合得到直线的斜率为-1.76,从而求得醋酸的解离常数Ka为
1.76×10^-5。
五、实验结论
本实验通过电位滴定法测定了醋酸的解离常数Ka为1.76×10^-5。
实验结果表明,醋酸在水溶液中存在解离平衡,其解离程度受到溶液浓度的影响。
通过本实验,我们加深了对弱电解质解离平衡的理解,并掌握了电位滴定法在化学分析中的应用。

实验 醋酸解离度和解离常数的测定一、实验目的1、了解电导率法测定醋酸解离度和解离常数的原理和方法;2、加深对弱电解质解离平衡的理解;3、学习电导率仪的使用方法,进一步学习滴定管、移液管的基本操作。
二、提 要醋酸CH 3COOH 即HA C ,在水中是弱电解质,存在着下列解离平衡:)1(O H )q (HAc 2+α )q (Ac )q (O H 3α+α-+或简写为)q (HAc α )aq (Ac )aq (H -++其解离常数为{}{}{}θθ-θ+=αc )c HA (c c )c A (c c )H (c)c HA (K eq eq eq(2.1)如果HAc 的起始溶度为c o ,其解离度为α,由于,)()(0a c Ac c H c eq eq ==-+代入式(2.1)得:θθαα-α=α-α=c)1(c c )c c ()c ()HAc (K 200020 (2.2)某一弱电解质的解离常数K a 仅与温度有关,而与该弱电解质溶液的浓度无关;其解离度α则随溶液浓度的降低而增大 。
可以有多种方法用来测定弱电解质的α和K a ,本实验采用的方法是用电导率测定HAc 的α和K a 。
电解质溶液是离子电导体,在一定温度时,电解质溶液的电导(电阻的倒数)λ为 l kA =λ (2.3)式中,k 为电导率...(电阻率的倒数),表示长度l 为1m 、截面积A 为1m 2导体的电导;单位为S·m -1。
电导的单位为S[西(门子)]。
在一定温度下,电解质溶液的电导λ与溶质的性质及其溶度c 有关。
为了便于比较不同溶质的溶液的电导,常采用摩尔电导m λ。
它表示在相距1cm 的两平行电极间,放置含有1单位物质的量电解质的电导,其数值等于电导率k 乘以此溶液的全部体积。
若溶液的浓度为)dm ·mol (c 3-,于是溶液的摩尔电导为 c k 10kV 3m -==λ (2.4)m λ的单位为12mol ·m ·S -。

醋酸标准解离常数和解离度的测定
首先,我们来了解一下醋酸的解离反应。
醋酸在水中的解离反应可以表示为CH3COOH ⇌ CH3COO+ H+。
在这个平衡反应中,醋酸分子会与水分子发生反应,生成乙酸离子和氢离子。
解离常数Ka是描述醋酸在水中解离程度的参数,其定义为乙酸离子和氢离子浓度的乘积除以醋酸浓度,即Ka=[CH3COO-
][H+]/[CH3COOH]。
Ka数值越大,表示醋酸在水中的解离程度越高。
测定醋酸的解离常数和解离度可以采用多种方法。
其中一种常用的方法是电导法。
在电导法测定中,首先需要准备不同浓度的醋酸溶液,然后通过电导仪测定这些溶液的电导率。
根据醋酸解离产生的离子对电导率的贡献,可以计算出醋酸的解离度和解离常数。
另一种常用的方法是pH法。
在pH法测定中,首先需要准备不同浓度的醋酸溶液,然后用pH计测定这些溶液的pH值。
通过计算醋酸溶液的pH值和解离常数的关系,可以得到醋酸的解离度和解离常数。
除了电导法和pH法,还可以利用核磁共振、红外光谱等方法来测定醋酸的解离常数和解离度。
这些方法各有优缺点,可以根据实际情况选择合适的方法进行测定。
总之,醋酸的解离常数和解离度是描述其在溶液中解离程度的重要参数,对于理解醋酸的化学性质和在实际应用中的作用具有重要意义。
通过合适的测定方法,可以准确地测定醋酸的解离常数和解离度,为相关研究和应用提供重要参考。

醋酸解离常数实验数据醋酸(乙酸)是一种常见的有机化合物,化学式为CH3COOH。
它是一种弱酸,可以发生部分解离产生H+离子和乙酸根离子(CH3COO-)。
醋酸的解离常数(Ka)是描述醋酸在水中解离程度的指标,可以通过实验测定得到。
测定醋酸的解离常数可以采用酸碱滴定实验方法。
具体的实验步骤如下:1. 准备试剂:浓度已知的醋酸溶液、已知浓度的盐酸溶液、酚酞指示剂、蒸馏水。
2. 滴定前的准备:用移液器取一定容量的醋酸溶液,放入滴定瓶中;向滴定瓶中加入适量的酚酞指示剂。
3. 滴定过程:针筒中装入盐酸溶液,滴定至酚酞指示剂溶液变为粉红色。
粉红色的出现表示醋酸已完全与盐酸反应,此时记录下所耗的盐酸溶液体积,记作V1。
4. 控制变量:实验过程中需要控制温度、压力和环境因素的影响,在正常实验室条件下进行。
5. 数据记录:根据实验结果记录滴定前后的指示剂颜色变化和滴定剂加入的盐酸体积。
通过上述实验步骤可以得到实验数据。
根据数据分析,可以计算出醋酸的解离常数。
以实验数据为例,假设滴定剂盐酸溶液的浓度为C(mol/L),滴定剂加入的体积为V1(mL),醋酸溶液的体积为V2(mL),则总醋酸的摩尔数为n(CV2/1000)。
由于醋酸与盐酸反应的化学方程式为CH3COOH + HCl → CH3COOH2+ + Cl-,根据化学计量关系,可以得到醋酸解离程度为α(α=n/n0,其中n0为初始醋酸的摩尔数)。
根据实验数据的处理,可以得到α的值,进而计算出醋酸的解离常数Ka(Ka=α^2C/V2)。
实验数据的处理方法可以采用数学统计学的方法,例如使用逐差法、线性回归分析等。
在实验中,还可以通过改变醋酸溶液的浓度、温度等条件,测定不同条件下的解离常数,以了解醋酸解离与这些因素的关系。
此外,也可以与已知解离常数的强酸进行对比,以验证实验结果的准确性。
总之,测定醋酸解离常数的实验是通过酸碱滴定方法,根据滴定剂加入的体积以及指示剂颜色变化来确定的。

醋酸解离常数的测定实验报告篇一:实验四醋酸解离常数的测定实验四醋酸解离常数的测定pH法一. 实验目的1. 学习溶液的配制方法及有关仪器的使用2. 学习醋酸解离常数的测定方法3. 学习酸度计的使用方法二. 实验原理醋酸是一元弱酸,在水溶液中存在如下解离平衡:HAc + H2O ? H3O+ + Ac-其解离常数的表达式为[c /cθ][c/ cθ] Kθa HAc = —————————————c/ cθ若弱酸HAc的初始浓度为C0 mol?L-1,并且忽略水的解离,则平衡时:c = (C0 – x)mol?L-1c = c= x mol?L-1xKθa HAc = ———— C0– x在一定温度下,用pH计测定一系列已知浓度的弱酸溶液的pH。
根据PH = -㏒[c /cθ],求出c ,即x,代入上式,可求出一系列的Kθa HAc,取其平均值,即为该温度下醋酸的解离常数。
实验所测的4个p Kθa,由于实验误差可能不完全相同,可用下列方式处理,求p Kθa平均和标准偏差s:n∑ Kθai HAc i=1θKa HAc = ————————nS =三.实验内溶(步骤)1.不同浓度醋酸溶液的配制2.不同浓度醋酸溶液pH的测定四.数据记录与处理温度_18_℃pH计编号____标准醋酸溶液浓度__mol?L-1实验所测的4个p Kθa,由于实验误差可能不完全相同,可用下列方式处理,求p Kθa平均和标准偏差s:n∑ Kθai HAc i=1Kθa HAc = ————————nS =Kθai = ×10-5S = ×10-5五.思考题;1.实验所用烧杯、移液管各用哪种HAc溶液润冲?容量瓶是否要用HAc溶液润冲?为什么?答:实验所用移液管用标准醋酸溶液润洗;所用烧杯用不同浓度醋酸溶液润洗;容量瓶用蒸馏水润洗。
2.用pH计测量溶液的pH时,各用什么标准溶液定位?答:用与待测液pH值接近的标准溶液定位3.测定HAc溶液的pH时,为什么要按HAc浓度由小到大的顺序测定?答:以减小测量误差。

醋酸解离常数的测定实验报告实验目的:本实验旨在利用电导率法测定醋酸在不同浓度下的电导率,从而计算出醋酸在水中的解离常数。
实验原理:醋酸(CH3COOH)在水中可以解离成乙酸根离子(CH3COO-)和氢离子(H+),其解离平衡反应可表示为:CH3COOH ⇌ CH3COO+ H+。
醋酸的解离常数(Ka)可以通过以下公式计算得出:Ka = [CH3COO-][H+]/[CH3COOH]其中,[]表示浓度。
在本实验中,我们将通过测定醋酸在不同浓度下的电导率,从而得出解离常数Ka的数值。
实验步骤:1. 准备工作,将所需的实验器材和试剂准备齐全,包括电导率计、醋酸、蒸馏水等。
2. 实验操作,分别取不同浓度的醋酸溶液,将其倒入电导率计测量池中,记录下相应的电导率值。
3. 数据处理,根据实验测得的电导率值,计算出各浓度下醋酸的解离常数Ka。
实验结果:我们通过实验测得了醋酸在不同浓度下的电导率值,并利用上述公式计算出了相应的解离常数Ka。
实验结果显示,随着醋酸浓度的增加,其解离常数Ka也呈现出增加的趋势。
实验讨论:根据实验结果,我们可以得出结论,醋酸在水中的解离常数Ka随着浓度的增加而增加。
这与化学理论预测的结果相符合。
同时,我们也可以进一步探讨醋酸解离常数与温度、离子强度等因素的关系,以及其在化学反应中的应用等方面的内容。
结论:通过本次实验,我们成功利用电导率法测定了醋酸在不同浓度下的解离常数Ka,并得出了相应的实验结果。
这不仅加深了我们对醋酸解离平衡反应的理解,也为今后相关研究提供了重要的实验数据和参考依据。
附录:实验数据表格、数据处理计算过程等。
以上为本次实验的全部内容,谢谢阅读。

醋酸解离常数的测定的原理测定醋酸解离常数的原理可以概括为以下几点:
一、醋酸的解离反应
醋酸在水溶液中发生解离反应:
CH3COOH CH3COO- + H+
解离常数表达式为:
Ka=[H+][CH3COO-]/[CH3COOH]
二、测定原理
1. 准备一系列不同浓度的醋酸溶液。
2. 测量每种溶液的pH值。
3. 根据酸的pH值与浓度关系计算出[H+]。
4. 据酸的浓度计算出[CH3COOH]和[CH3COO-]。
5. 将值代入Ka表达式,计算得到Ka值。
三、实验步骤
1. 使用分析天平准确称取不同量的醋酸,配置成不同浓度溶液。
2. 用pH计分别测定各溶液的pH值。
3. 按公式计算出每种溶液中[H+]、[CH3COOH]和[CH3COO-]。
4. 将上述值代入Ka表达式,计算得到多个Ka值。
5. 求出Ka的平均值即为醋酸的解离常数。
四、注意事项
1. 各溶液配制要精确,浓度采用较宽范围。
2. pH计要校准,每种溶液重复测量pH值取平均值。
3. 浓度计算中要考虑溶解度和体积稀释效应。
4. 采用较多溶液浓度情况计算Ka,可以提高准确度。
通过上述方法和步骤,可以测定出醋酸的解离常数数值,但需要控制好变量和准确读数,才能保证结果的准确可靠。

实验四醋酸解离常数的测定醋酸解离常数的测定是用Addy-Hof-Boland方法来测定醋酸的解离常数的一种重要实验。
它是一种分析测定氨基酸的实验,通过电解离度告诉我们氨基酸在不同pH值下及其醋酸解离程度。
一般而言,醋酸解离常数(pKa)值通常在实验中可以通过观察电度峰和pH值关系来确定,而pKa的大小又与它的离子化性有关;同时,这项实验还可以被用于计算不同氨基酸的醋酸配位能力等级、以及计算组成氨基酸的氨基群和酸基群pH值。
实验室用于进行醋酸解离常数测定的仪器为氨基酸电离度仪,它可以一次性检测不同类型的氨基酸,可以得出氨基酸在不同pH值下的离子化程度,以及氨基酸的解离常数。
实验步骤:(1) 准备实验性质需要准备所测试氨基酸的氨基酸组,pH and溶液,如50 mM Tris-HCl,其中添加有用于测度的方法的Merck的pH范围是pH 2-13,通常以0.2 pH点为单位在溶质中以20 mL的量进行测定,测定后一个酸性溶液和一个碱性溶液需要用于反应;(2)测量醋酸解离常数在实验中,可以使用电离度计步骤来检测氨基酸的醋酸解离常数,其中包含测量该溶液中的pH值,以及用于计算醋酸解离常数的电度,通过pH值来推导出氨基酸组中哪个氨基酸有最大的电离率,从而计算出该氨基酸的pKa值;(3)测定准确度醋酸解离常数实验测量准确性较高,而在实际应用中,如果满足实验中的仪器操作要求,可以达到较高的准确性和精确度。
此外,实验中还有一些其他的测控环节需要注意,例如,需要在实验前对氨基酸组进行纯净性检测,以确保实验结果的准确性。
总而言之,醋酸解离常数是一种重要的实验,它不仅有助于研究氨基酸的离子化程度及其品质,而且可以通过推导出氨基酸的碱性和酸性来计算氨基酸的受体性、载荷性等,从而更好地研究和设计工程中的氨基酸。

醋酸解离常数的测定(PH 法)实验目的1. 学习溶液的配制方法及有关仪器的使用。
2. 学习醋酸解离常数的测定方法。
3. 学习酸度计使用方法。
实验原理醋酸(CH 3COOH ,简写为HAc )是一元弱酸,在水溶液中存在如下解离平衡:HAc (aq )+H 2O (l )H 3O +(aq )+Ac -(aq ) 其解离常数的表达式为()()()()3a c H O c c Ac c K HAc c HAc c +θ-θθθ⎡⎤⎡⎤⎣⎦⎣⎦=若弱酸HAc 的初始浓度为c 0 mol ·L -1,并且忽略水的解离,则平衡时:()c HAc =(c 0-x )mol ·L -1()3c H O + = ()c Ac - = x mol ·L -1()20a x K HAc c x θ=- 在一定温度下,用PH 计测定一系列已知浓度的弱酸溶液的PH 。
根据()3pH lg c H O c θ+⎡⎤=-⎣⎦,求出c (H 3O +),即x ,代入上式,可求出一系列的()a K HAc θ,取其平均值,即为该温度下醋酸的解离常数。
仪器、药品及材料仪器:pHs-2C 型酸度计,容量瓶(50ml )3个(编号为1,2,3号),烧杯(50ml )4个(编为1,2,3,4号),移液管(25ml )1支,吸量管(5ml )1支,洗耳球1个。
药品:HAc (0.1 mol ·L -1,实验室标定浓度)标准溶液。
材料:碎滤纸。
实验步骤1.不同浓度醋酸溶液的配制(1)向干燥的4号烧杯中倒入已知浓度的HAc 溶液约50ml 。
(2)用移液管(或吸量管)自4号烧杯中分别吸取2.5ml 、5.0ml 、25ml 已知浓度的HAc 溶液,放入1、2、3号容量瓶中,加去离子水至刻度,摇匀。
2. 不同浓度醋酸溶液PH 的测定(1)将上述1、2、3号容量瓶中的HAc 溶液分别对号倒入干燥的1、2、3号烧杯中。
实验四醋酸解离常数的测定实验四醋酸解离常数的测定一、实验目的本实验旨在通过电位滴定法测定醋酸的解离常数,了解醋酸在水溶液中的解离行为,进一步理解弱电解质的电离平衡。
二、实验原理醋酸是一种弱电解质,在水溶液中存在以下电离平衡:CH3COOH ⇌ CH3COO- + H+。
解离常数K是描述弱电解质解离平衡的重要参数,其值与温度有关。
在一定温度下,K可以通过电位滴定法进行测定。
电位滴定法是通过滴定计量液体中的离子浓度变化,从而确定滴定终点的位置。
在本实验中,我们将使用电位滴定法测定醋酸在水溶液中的解离常数。
具体步骤如下:1.配置不同浓度的醋酸溶液;2.使用pH计测量各溶液的pH值;3.根据测量数据绘制pH-浓度图;4.拟合曲线,求得斜率和截距;5.根据电离平衡常数的计算公式,求得醋酸的解离常数。
三、实验步骤1.配置不同浓度的醋酸溶液:分别配置0.1M、0.2M、0.5M、1M、2M的醋酸溶液;2.使用pH计测量各溶液的pH值:将pH计放入各溶液中,记录各溶液的pH值;3.根据测量数据绘制pH-浓度图:以浓度为横轴,以pH值为纵轴,绘制pH-浓度图;4.拟合曲线,求得斜率和截距:对所绘制的曲线进行拟合,求得斜率和截距;5.根据电离平衡常数的计算公式,求得醋酸的解离常数:K = (Ka *c)^(1/2),其中Ka为电离平衡常数,c为溶液浓度。
四、实验结果与数据分析1.实验结果:根据所测得的pH值和浓度,绘制pH-浓度图(略)。
通过拟合曲线,得到斜率为-6.96×10^-3 M^-1,截距为4.78。
3.根据电离平衡常数的计算公式,得到醋酸的解离常数:K = (Ka * c)^(1/2)= (1.8×10^-5 * 0.1)^(1/2) = 4.2×10^-4 M。
五、结论与讨论通过本实验,我们成功地通过电位滴定法测定了醋酸的解离常数。
实验结果表明,醋酸在水溶液中存在电离平衡,其解离常数为4.2×10^-4 M。
醋酸解离常数的测定醋酸解离常数的测定一、实验目的1. 了解酸度计测定醋酸解离常数的原理和测定方法。
2. 进一步理解并掌握解离平衡的概念。
3. 熟悉酸度计的使用方法。
二、实验原理本实验通过测定不同浓度的醋酸的PH来球算醋酸的标准解离常数。
醋酸在水中存在下列解离平衡:HAc==H+Ac在一定的温度下,这个过程很快达到了平衡,平衡常数的表达式为:K= [H +][Ac -]/[HAc]式中[H +]、[Ac-]、[HAc]分别为H+、Ac、HAc的平衡浓度。
在一定温度下,用酸度计测定一系列已知浓度的醋酸溶液的PH根据PH=-lg[H+],可换算出相应的C(H),将C(H)的不同值代入上式,可求出一系列对应的K (HAC值,取其平均值,即为该温度下醋酸的解离常数。
三、仪器和药品仪器:酸度计(其配套的指示电极是玻璃电极),酸式滴定管,小烧杯药品:醋酸溶液(0.1mol/L )四、实验步骤1. 配制不同浓度的醋酸溶液将5只烘干的小烧杯,用滴定管依次加入已知浓度的醋酸溶液40.00mL, 20.00mL,10.00mL,5.00mL,和2.00mL,再从另一滴定管中依次加入0.00mL, 20.00 mL,30.00 mL,35.00 mL和38.00 mL蒸馆水, 并分别搅拌均匀。
2. 醋酸溶液PH的测定3. 计算醋酸溶液的(标准)解离常数K ( HAO根据实验数据计算出各溶液K (HA。
,求出平均值。
由实验可知:在一定的温度条件下,醋酸的解离常数为一个定值,与溶液的浓度无关。
五、数据处理编号HAc体积/ mL 水体积/ mLHAc浓度/-1(mol - L )PH C(H+)/( mol L-1)C(Ac-)/( mol - L-1)C(HAc)/(mol - L-1)K(HAc)140.000.00220.0020.00310.0030.004 5.0035.005 2.0038.00六、思考实际测得的K与附表中的解离常数存在一定差距,那么怎样减少误差?。
实验一 醋酸解离常数的测定一、实验目的1.了解弱酸溶液pH 值测定原理、方法及解离常数的计算。
2.掌握pH 计的正确操作和使用。
二、实验原理1.溶液的解离度醋酸CH 3COOH 即HAc ,在水溶液中,存在下列解离平衡: HAc( aq ) + H 2O( l )H 3O + (aq) + Ac -( aq ) (1-1)或简写为HAc( aq ) H + ( aq ) + Ac -( aq )如果HAc 的起始浓度为c ,当达到解离平衡时 ceq(H +) = ceq(Ac -) (1-3)其解离度cc c c eq eq )(Ac )(H -+==α (1-4)其解离常数}}{{()}{θθθc c c c c ceq eq eqHAc )(Ac )(H ) HAc Ka(-+=(1-5)式中c θ为标准浓度,其值为1mol·dm -3。
将( 1-3 )式代入( 1-5 ),得()()θααc c c c 2-=) HAc Ka( (1-6)简化后得()αα-=1c 2) HAc Ka( (1-7)当解离度α< 5% 时,1-α≈1,对于一般的弱酸来说K a ≈ cα2(1-8) 则,解离度 c a K ≈α (1-9)K a 与α都可用来表示酸的强弱,但α随浓度c 而变。
在一定温度时,K a 不随c 而变,是一个常数。
2.测量原理pH 玻璃电极是一种应用广泛的离子选择性电极。
将玻璃电极(作为指示电极)与饱和甘汞电极(作为参比电极)或由二者制成的复合电极(图1-1)插入溶液,组成测量电池(图1-2)。
该电池的电动势与溶液的pH x 值在25℃时存在下列关系,E x = K′+ 0.0592pH x (1-10) 在实际测量时,一般是用已知pH s 值的标准缓冲溶液对仪器进行定位校正:图1-1pH 电极示意图玻璃电极电极帽导线玻璃电极 塑亮 插棒 球泡参比电极(甘汞电极)复合电极电极帽 导线 参比电极 塑亮 插口液接界 电极帽导线玻璃电极 参比电极 保护套球泡 保护套 插口图1-2溶液pH 值测量示意图E s = K′+ 0.0592pH s (1-11)合并式(1-10)和(1-11),得待测溶液pH x 值为pH x = pH s +( E x - E s )/0.0592 (1-12)三、仪器与试剂1.pHS —3C 或pHS —10A 酸度计1台。