混合碱中碳酸根和碳酸氢根含量的测定_双混合指示剂法
- 格式:pdf
- 大小:391.83 KB
- 文档页数:7

碳酸根和碳酸氢根的测定(双指示剂中和法)方法原理:第一步在待测液中加入酚酞指示剂,用标准酸滴定至溶液由红色变为无色(),此时CO32-只被中和为HCO3- ;第二步加入甲基橙指示剂,继续用标准酸滴定至溶液由黄色变为橙红色(),此时溶液中原有的HCO3-和第一步由CO32-生成的HCO3-全被中和为CO32-。
由标准酸的两次用量可分别求得土壤中CO32- 和HCO3-的含量。
适用于含有机质较低的各类型土壤中CO32-和HCO3-的测定仪器及试剂:往复式电动振荡机;漏斗;广口瓶,500ml;具塞三角瓶,500ml去除二氧化碳的水:将蒸馏水煮沸15min,冷却后立即使用硫酸标准溶液:吸取浓硫酸(p=)加入1L去二氧化碳水中,此溶液浓度约为L硫酸标准溶液。
将此溶液用碳酸钠标定后,准确稀释5倍,即为c(1/2 H2SO4)=L的硫酸标准溶液%(m/v)酚酞指示剂:称取酚酞溶于100ml 50%(v/v)乙醇溶液%(m/v)甲基橙指示剂:称取甲基橙溶于100mL水中分析步骤:称取过2mm孔径筛的风干试样50g(精确至),置于500mL广口瓶(矿泉水瓶)中,加250mL去除CO2的水,用橡皮塞塞紧瓶口,在振荡机上振荡3min,立即过滤,开始滤出的10mL滤液弃去,以获得清亮的滤液,加塞备用。
电导、CO32- 、HCO3- 等项测定应立即进行,其他离子的测定亦应在当天完成。
吸取试样待测液放入150mL三角瓶中,加入酚酞指示剂2滴,如待测液不显红色,表示没有CO32- 存在,如溶液显红色,用硫酸标准溶液滴定至红色刚消失为止,记录所用硫酸标准溶液的体积(V1)。
在滴定过的溶液中加入甲基橙指示剂2滴,用硫酸标准溶液滴定至由黄色转变成明显的橙红色为止。
记录加甲基橙后滴定所用硫酸标准溶液的体积(V2)结果计算:CO32-(g/kg)=2V1*C*D*1000/m*HCO3-(g/kg)=(V2-V1)*C*D*1000/m*C硫酸标准溶液浓度;D分取倍数,250/25;m称取试样质量,本试验为50g平行测定结果用算术平均值表示,保留二位有效数字。
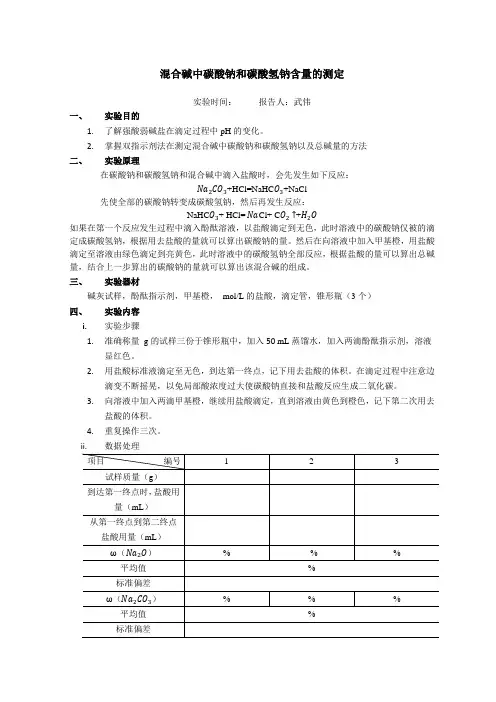
混合碱中碳酸钠和碳酸氢钠含量的测定实验时间:报告人:武伟一、实验目的1.了解强酸弱碱盐在滴定过程中pH的变化。
2.掌握双指示剂法在测定混合碱中碳酸钠和碳酸氢钠以及总碱量的方法二、实验原理在碳酸钠和碳酸氢钠和混合碱中滴入盐酸时,会先发生如下反应:Na2CO3+HCl=NaHC O3+NaCl先使全部的碳酸钠转变成碳酸氢钠,然后再发生反应:NaHC O3+ HCl= Na Cl+ C O2↑+H2O如果在第一个反应发生过程中滴入酚酞溶液,以盐酸滴定到无色,此时溶液中的碳酸钠仅被的滴定成碳酸氢钠,根据用去盐酸的量就可以算出碳酸钠的量。
然后在向溶液中加入甲基橙,用盐酸滴定至溶液由绿色滴定到亮黄色,此时溶液中的碳酸氢钠全部反应,根据盐酸的量可以算出总碱量,结合上一步算出的碳酸钠的量就可以算出该混合碱的组成。
三、实验器材碱灰试样,酚酞指示剂,甲基橙,mol/L的盐酸,滴定管,锥形瓶(3个)四、实验内容i.实验步骤1.准确称量g的试样三份于锥形瓶中,加入50 mL蒸馏水,加入两滴酚酞指示剂,溶液显红色。
2.用盐酸标准液滴定至无色,到达第一终点,记下用去盐酸的体积。
在滴定过程中注意边滴变不断摇晃,以免局部酸浓度过大使碳酸钠直接和盐酸反应生成二氧化碳。
3.向溶液中加入两滴甲基橙,继续用盐酸滴定,直到溶液由黄色到橙色,记下第二次用去盐酸的体积。
4.重复操作三次。
ii.数据处理五、思考题1.本实验用酚酞做指示剂时,所消耗的盐酸较用甲基橙少,为什么因为用酚酞做指示剂时只是盐酸和碳酸钠反应,而用甲基橙做指示剂时,是上一步反应完的生成的碳酸氢根和溶液中本身存在的碳酸氢根的和来反应,反应的比例又相同,所以第二次总会多一点。
2.在总碱量的计算式中,V有几种求法如果只要求测定总碱量,实验应该怎样做V表示用去盐酸的总体积,可以直接读出来;如果只要求测定总碱量,只需要用甲基橙做指示剂,滴定至橙色。
3.在测定一批烧碱或碱灰样品时,若分别出现V1<V2,V1=V2,V1>V2,V1=0,V2=0的情况,说明样品的组成有什么差别4.待测液润洗因为滴定管的移液管要求里面的溶液的浓度一定要准确,所以要润洗,避免内壁的水珠对溶液的稀释;而烧杯或锥形瓶要求里面的总物质的量要准确,所以不可以润洗,避免液体挂在内壁上。

【分析方法】土壤中碳酸根和重碳酸根的测定---双指示剂中和滴定法引言在盐土中常有大量HCO3-,而在盐碱土或碱土中不仅有HCO3-,也有CO32-。
在盐碱土或碱土中OH-很少发现,但在地下水或受污染的河水中会有OH-存在。
在盐土或盐碱土中由于淋洗作用而使Ca2+或Mg2+在土壤下层形成CaCO3和MgCO3或者CaSO4·2H2O和MgSO4·H2O沉淀,致使土壤上层Ca2+、Mg2+减少,Na+/(Ca2++Mg2+)比值增大,土壤胶体对Na+的吸附增多,这样就会导致碱土的形成,同时土壤中就会出现CO32-。
这是因为土壤胶体吸附的钠水解形成NaOH,而NaOH又吸收土壤空气中的CO2形成Na2CO3之故。
因而CO32-和HCO3-是盐碱土和碱土中的重要成分。
土壤 - Na+ + H2O→土壤-H+ + NaOH2NaOH + CO2 → Na2CO3 + H2ONa2CO3 + CO2 + H2O → 2NaHCO3方法原理土壤水浸出液的碱度主要决定于碱金属和碱土金属的碳酸盐及重碳酸盐。
溶液中同时存在碳酸根和重碳酸根时,可以应用双指示剂进行滴定。
Na2CO3+HCl= NaHCO3+NaCl (pH8.3为酚酞终点)(1)NaHCO3+HCl=NaCl+CO2+H2O (pH4.1为溴酚蓝终点(2)由标准酸的两步用量可分别求得土壤中CO32-和HCO3-的含量。
滴定时标准酸如果采用H2SO4,则滴定后的溶液可以继续测定Cl-的含量。
对于质地粘重,碱度较高或有机质含量高的土壤,会使溶液带有黄棕色,终点很难确定,可采用电位滴定法(即采用电位计指示滴定终点)。
所用试剂(1)5g·L-1酚酞指示剂:称取酚酞指示剂0.5g,溶于100mL 600mL·L-1的乙醇中。
(2) 1g L-1溴酚蓝(BromophenoL blue)指示剂:称取溴酚蓝0.1g在少量950mL·L-1乙醇中研磨溶解,然后用乙醇稀释至100mL。



实验八混合碱中碳酸钠和碳酸氢钠含量的测定一、实验目的1、掌握采用双指示剂法测定混合碱中碳酸钠和碳酸氢钠含量的原理和方法。
2、巩固酸碱滴定的有关知识。
二、实验原理(双指示剂法)在混合碱试液中先加入酚酞指示剂,用HCl标准溶液滴定至由红色刚好变为无色,达到第一终点。
此时NaCO3被滴定生成2NaHCO3,用去酸的体积为V1(mL),反应式为:NaOH+HCl= NaCl+H2ONa2CO3+HCl= NaHCO3+NaCl然后加入甲基橙指示剂,继续用HCl标准溶液滴定至由黄色变为橙色,达到第二终点。
所消耗酸的体积为V(mL)。
此时2NaHCO3全部被滴定,产物为H2CO3(CO2+H2O),反应式为:NaHCO3+HCl=NaCl+H2CO3CO2+H2ONa 2CO 3为多元碱,能被强酸准确滴定的条件是:cK b ≥10-8能分步滴定的条件是:K b1 /K b2≥104Na 2CO 3的K b1=2.08×10-4,K b2=2.33×10-8,K b1 /K b2≈104。
所以Na 2CO 3第一步离解产生的OH -可勉强被分步滴定,有一个突跃,理论终点时产物NaHCO 3为两性物质,故第一终点时:8106.5102.4lg KK lg 11721≈×××−=×−−−ΘΘa a pH =第二终点时:9.3102.404.0lg K c lg 71≈××−=⋅−−Θa pH =三、实验步骤(1)准确称取混合碱样品4.5~5.0 g于150 mL烧杯中,加50 mL蒸馏水溶解。
然后定量转移至250 mL容量瓶中,加蒸馏水至刻度,摇匀。
(2)用25 mL移液管移取试液25.00mL置于250mL锥形瓶中,加入1~2滴酚酞指示剂,用HCl标准溶液滴定至红色恰好消失,(mL);然后加入1~2滴甲基橙指示剂,继续记下HCl用量V1用HCl标准溶液滴定至溶液由黄色变为橙色,记录HCl溶液的体(mL)。

混合碱中碳酸钠和碳酸氢钠含量的测定演示教学
混合碱中碳酸钠和碳酸氢钠含量的测定
精品资料
仅供学习与交流,如有侵权请联系网站删除谢谢2 实验五、混合碱中碳酸钠和碳酸氢钠含量的测定一、实验目的
1.了解双指示剂法测定混合碱的原理;
2.理解混合碱中各组分的测定方法以及相关计算。
二、实验原理
混合碱试样溶液(含Na 2CO 3、NaHCO 3)
↓酚酞指示剂
红色
↓HCl 溶液滴定(V 1mL )
无色(反应:Na 2CO 3+HCl=NaHCO 3+NaCl ),
(cV 1)HCl =n(Na 2CO 3)=n 1(NaHCO 3)
↓溴甲酚绿-二甲基黄指示剂(混合指示剂)
绿色
↓HCl 溶液滴定(V 2mL )
亮黄色(反应:NaHCO 3+HCl=NaCl+H 2O+CO 2),(cV 2)HCl =n 1(NaHCO 3)+n 2(NaHCO 3)
100001.84))((%1000
.106)(%123132??-=??=s s m V V HCl c NaHCO m V HCl c CO Na
又 Na 2O+CO 2=Na 2CO 3
n 1(Na 2O)=n(Na 2CO 3)=(cV 1)HC l
Na 2O+2CO 2+H 2O=2NaHCO 3
n 2(Na 2O)=n(2NaHCO 3)=1/2n(NaHCO 3)=1/2c(V 2-V 1)HCl
所以 n(NaO)=n 1(Na 2O)+n 2(Na 2O)=1/2c(V 1+V 2)HCl。

双指示剂法测定混合碱的原理一、引言混合碱是由Na2CO3和NaHCO3组成的碱性物质,常用于制备肥皂、玻璃等工业产品。
在工业生产中,混合碱的纯度对产品质量有着重要影响。
因此,准确测定混合碱的纯度十分必要。
本文将介绍一种常用的双指示剂法测定混合碱纯度的原理。
二、实验原理1. 双指示剂法双指示剂法是一种常用于酸碱滴定分析中的方法。
该方法利用两种不同颜色的指示剂,在酸碱滴定过程中变色,以判断溶液中酸、碱物质的浓度。
2. 混合碱溶液的酸碱滴定反应当混合碱溶液与盐酸反应时,生成以下反应式:Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑当NaHCO3与盐酸反应时,生成以下反应式:NaHCO3 + HCl → NaCl + H2O + CO2↑由上述反应式可知,混合碱和NaHCO3都能与盐酸发生完全中和反应,生成CO2气体。
因此,在酸碱滴定过程中,混合碱和NaHCO3的滴定曲线相同。
3. 双指示剂法测定混合碱纯度的步骤(1)将待测混合碱溶液加入滴定瓶中,加入适量甲醇和几滴酚酞指示剂。
(2)用标准盐酸溶液进行初步滴定,记录初次终点体积。
(3)加入甲基橙指示剂,继续滴定至第二个终点。
记录最终终点体积。
(4)根据上述数据计算混合碱的纯度。
三、实验步骤1. 实验器材准备滴定瓶、移液管、磁力搅拌器、蒸馏水、甲醇、双指示剂(甲基橙和酚酞)、标准盐酸溶液。
2. 操作步骤(1)将约0.5g混合碱样品称入干净的250mL锥形瓶中,加入50mL 蒸馏水,并用磁力搅拌器充分搅拌使样品完全溶解。
(2)将约25mL样品溶液移入滴定瓶中,加入适量甲醇,并加入几滴酚酞指示剂。
(3)用标准盐酸溶液进行初步滴定,记录初次终点体积。
(4)加入甲基橙指示剂,继续滴定至第二个终点。
记录最终终点体积。
(5)根据上述数据计算混合碱的纯度。
四、实验结果分析通过上述步骤,我们可以得到混合碱的纯度数据。
根据计算公式,可以得到混合碱的纯度为:Purity = (V2 - V1) × N × 106 / m其中,V1为初次终点体积,V2为最终终点体积,N为盐酸标准溶液浓度,m为混合碱样品质量。

利用雙重指示劑滴定法滴定碳酸鈉及碳酸氫鈉一、試題規範(一) 操作時間:三時三十分(二) 操作說明:利用碳酸之K A1及K A2之不同,以變色區域不同之兩種指示劑分別滴定碳酸根及碳酸氫根。
(三) 操作步驟:1. 精秤約1克碳酸鹽試樣,以水溶解後稀釋至250 mL。
2. 吸取50 mL試樣溶液於250 mL錐形瓶中,加50 mL水及2滴酚指示劑後,以0.1M鹽酸標準溶液滴定至第一終點,記錄鹽酸用量。
3. 於上述溶液中,另加入2滴甲基橙指示劑,繼續以0.1 M鹽酸標準溶液滴定至溶液由黃色變為橙紅後,將此反應液煮沸,除去CO並置於小水盆中以冷水冷卻,然後再繼續以0.1 M鹽2酸標準溶液或0.1 M氫氧化鈉標準溶液滴定至第二終點,記錄標準酸及標準鹼之用量。
4. 重覆2次步驟(二)及(三)。
5. 由所得數據計算試樣中所含碳酸鈉及碳酸氫鈉百分率之平均值。
二、器具及材料名稱規格數量1.天平靈敏度0.0001 g 1台2.燒杯250 mL 2個3.燒杯刷1支4.錐形瓶250 mL 3個5.量瓶250 mL,A級2個6.刻度吸量管50 mL,A級2支7.球形吸量管50 mL,A級2支8.本生燈或加熱板1套9.滴定管50 mL,鐵氟龍活栓,A級2支10.滴定管刷1支11.滴定管架1台12.洗瓶500 mL 1個13.稱量瓶 5 mL 1個14.玻棒 5 mm×15 cm 1支15.藥匙1支16.漏斗 5 cm 2個17.安全吸球1個18.點火槍1盒19.0.1 M HCl標準溶液由主辦單位配製,標示精確濃度150 mL20.0.1 M NaOH標準溶液由主辦單位配製,標示精確濃度50 mL21.酚指示劑1克溶於60 mL乙醇,加水稀釋成100 mL 10 mL22.甲基橙指示劑0.2克溶於熱水,稀釋成100 mL 10 mL23.碳酸鹽試樣 2 g24.玻璃器皿洗滌用清潔劑Merck 20 mL25.清潔劑20 g26.蒸餾水或去離子水500 mL27.面紙適量三、分析原理碳酸鈉和碳酸氫鈉的混合物,一般可採用鹽酸溶液滴定的方法,分別計算出混合物中碳酸鈉和碳酸氫鈉的含量。
讲稿5双指示剂法测定混合碱中各组分的含量第一篇:讲稿5 双指示剂法测定混合碱中各组分的含量南昌大学抚州医学分院讲稿实验五双指示剂法测定混合碱中各组分的含量一、实验目的1、学会用双指示剂法测定混合碱的原理和方法;2、进一步熟练滴定操作技术和正确判断滴定终点。
二、实验原理混合碱系指Na2CO3与NaOH或Na2CO3与NaHCO3的混合物,可采用“双指示剂”法测定其组成及各组分含量。
若混合碱是Na2CO3与NaOH的混合物,用HCl标准溶液进行滴定时首先发生如下的反应:HCl + NaOH ═ NaCl + H2O HCl + Na2CO3 ═ NaHCO3 + NaCl 当NaOH完全被中和,而Na2CO3被中和至NaHCO3时,即达到南昌大学抚州医学分院讲稿三、实验仪器与试剂酸式滴定管(25ml),锥形瓶,洗耳球,移液管(25ml、20ml),容量瓶(100ml);0.1mol·L-1HCl标准溶液,待测混合碱溶液,甲基橙指示剂,酚酞指示剂。
四、实验内容与步骤1、混合碱溶液的稀释移取25.00ml待测混合碱溶液至100ml容量瓶,用蒸馏水稀释、定容至刻度,摇匀后备用。
2、双指示剂法测定混合碱中各组分的含量用移液管准确移取20.00mL混合碱稀释液于锥形瓶中,加1滴酚酞,用已标定好的HCl标准溶液滴定至溶液由红色变为微红色,为南昌大学抚州医学分院讲稿(B)V1=0,V2≠0(C)V1=V2≠0(D)V1>V2>0(E)V2>V1>0第二篇:盐酸及氯化铵各组分含量测定盐酸及氯化铵各组分含量测定(大致步骤)一实验目的:1.掌握强酸滴定强碱的过程,以及如何选择合适的指示剂2.掌握强化法中的甲醛法步骤及注意事项.二实验原理:盐酸为强酸,首先用KHC8H4O4(邻苯二甲酸氢钾)【用分析天平准确称量邻苯二甲酸氢钾0.4-0.5克与250ML锥形瓶中,加入20ML水使之溶解,加入1滴酚酞指示剂,用NaOH溶液滴定至溶液显淡红色半分钟不退色,平行三次】标定NaOH (KHC8H4O4+NaOH=KNaC8H4O4+H20)求出准确浓度,再用NaOH标液去测定HCL的含量。
混合碱的含量测定实验报告一、实验目的1、掌握双指示剂法测定混合碱中碳酸钠和碳酸氢钠含量的原理和方法。
2、学会正确使用酸式滴定管、移液管等仪器。
3、培养分析问题和解决问题的能力。
二、实验原理混合碱是指碳酸钠与碳酸氢钠或碳酸钠与氢氧化钠的混合物。
常用双指示剂法进行测定,即先以酚酞为指示剂,用盐酸标准溶液滴定至溶液由红色恰好变为无色,此时溶液中的碳酸钠被滴定为碳酸氢钠,氢氧化钠被完全中和,记下消耗盐酸的体积$V_1$。
然后再加入甲基橙指示剂,继续用盐酸标准溶液滴定至溶液由黄色变为橙色,此时碳酸氢钠被完全中和,记下消耗盐酸的体积$V_2$。
根据$V_1$ 和$V_2$ 的大小,可以判断混合碱的组成,并计算各组分的含量。
(1)若$V_1 > V_2$,则混合碱为碳酸钠与氢氧化钠。
碳酸钠的含量计算公式为:\w(Na_2CO_3)&=\frac{c(HCl)\times V_1\times M(Na_2CO_3)}{m} \times 100\%\\\end{align}\氢氧化钠的含量计算公式为:\\begin{align}w(NaOH)&=\frac{c(HCl)\times (V_1 V_2) \times M(NaOH)}{m} \times 100\%\\\end{align}\(2)若$V_1 < V_2$,则混合碱为碳酸钠与碳酸氢钠。
碳酸钠的含量计算公式为:\\begin{align}w(Na_2CO_3)&=\frac{c(HCl)\times V_1\times M(Na_2CO_3)}{m} \times 100\%\\\碳酸氢钠的含量计算公式为:\\begin{align}w(NaHCO_3)&=\frac{c(HCl)\times (V_2 V_1) \timesM(NaHCO_3)}{m} \times 100\%\\\end{align}\其中,$c(HCl)$为盐酸标准溶液的浓度(mol/L),$V_1$、$V_2$ 分别为酚酞和甲基橙指示剂变色时消耗盐酸标准溶液的体积(mL),$M(Na_2CO_3)$为碳酸钠的摩尔质量(g/mol),$M(NaOH)$为氢氧化钠的摩尔质量(g/mol),$M(NaHCO_3)$为碳酸氢钠的摩尔质量(g/mol),$m$ 为混合碱的质量(g)。
双指示剂法测定混合碱之答禄夫天创作一.实验目的1、进一步熟练滴定操纵和滴定终点的判断;2、学会标定酸尺度溶液的浓度;3、掌握混合碱分析的测定原理、方法和计算。
二.实验原理混合碱是Na 2CO 3与NaOH 或Na 2CO 3与NaHCO 3的混合物,可采取双指示剂法进行分析,测定各组分的含量。
在混合碱的试液中加入酚酞指示剂,用HCl 尺度溶液滴定至溶液呈微红色。
此时试液中所含NaOH 完全被中和,Na 2CO 3也被滴定成NaHCO 3,反应如下:NaOH + HCl = NaCl + H 2ONa 2CO 3+ HCl = NaCl + NaHCO 3设滴定体积为V 1ml 。
再加入甲基橙指示剂,继续用HCl 尺度溶液滴定至溶液由黄色变成橙色即为终点。
此时NaHCO 3被中和成H 2CO 3,反应为:NaHCO 3 + HCl = NaCl + H 2O + CO 2↑设此时消耗HCl 尺度溶液的体积为V 2ml 。
根据V 1和V 2可以判断出混合碱的组成。
设试液的体积为Vml 。
当V 1>V 2时,试液为NaOH 和Na 2CO 3的混合物,NaOH 和Na 2CO 3的含量 .可由下式计算:%1001000)(%21mM V V C NaOH NaOH-=;当V 1<V 2时,试液为Na 2CO 3和NaHCO 3的混合物,NaOH 和Na 2CO 3的含量。
可由下式计算:%1001000212%32132mM V C CO Na CO Na ⨯⨯=; 三.试剂及仪器(试剂):a. mol/L HCl 尺度溶液;b.甲基橙(1g/L 水溶液);c.酚酞(2g/L 乙醇溶液);d.混合碱样品(仪器):电子天平,mL酸式滴定管,25.00mL容量瓶,25.00mL移液管,25mL锥形瓶;500mL烧杯;经常使用滴定仪器。
四.实验步调1、盐酸溶液浓度的配制及标定a.配制. 量取 4.5ml HCl(12 mol/L) ,倒入500ml烧杯中,加入300ml蒸馏水摇匀再稀释至500ml,贴上标签待标定。