封闭抗体教程文件
- 格式:ppt
- 大小:1.82 MB
- 文档页数:32
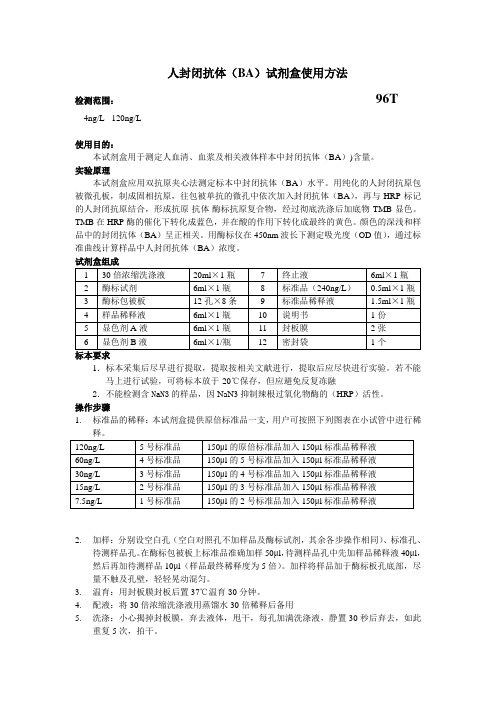
人封闭抗体(BA)试剂盒使用方法检测范围:96T4ng/L - 120ng/L使用目的:本试剂盒用于测定人血清、血浆及相关液体样本中封闭抗体(BA))含量。
实验原理本试剂盒应用双抗原夹心法测定标本中封闭抗体(BA)水平。
用纯化的人封闭抗原包被微孔板,制成固相抗原,往包被单抗的微孔中依次加入封闭抗体(BA),再与HRP标记的人封闭抗原结合,形成抗原-抗体-酶标抗原复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的封闭抗体(BA)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中人封闭抗体(BA)浓度。
试剂盒组成1.标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。
若不能马上进行试验,可将标本放于-20℃保存,但应避免反复冻融2.不能检测含NaN3的样品,因NaN3抑制辣根过氧化物酶的(HRP)活性。
操作步骤1.标准品的稀释:本试剂盒提供原倍标准品一支,用户可按照下列图表在小试管中进行稀2.加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、待测样品孔。
在酶标包被板上标准品准确加样50μl,待测样品孔中先加样品稀释液40μl,然后再加待测样品10μl(样品最终稀释度为5倍)。
加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。
3.温育:用封板膜封板后置37℃温育30分钟。
4.配液:将30倍浓缩洗涤液用蒸馏水30倍稀释后备用5.洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30秒后弃去,如此重复5次,拍干。
6.加酶:每孔加入酶标试剂50μl,空白孔除外。
7.温育:操作同3。
8.洗涤:操作同5。
9.显色:每孔先加入显色剂A50μl,再加入显色剂B50μl,轻轻震荡混匀,37℃避光显色15分钟.10.终止:每孔加终止液50μl,终止反应(此时蓝色立转黄色)。





封闭抗体阴性淋巴细胞提取流程1.在实验室的无菌条件下,取出外周血样本。
In a sterile laboratory environment, take a peripheral blood sample.2.将外周血样本放入离心管中,轻轻旋转离心管混合均匀。
Place the peripheral blood sample in a centrifuge tube and gently mix by rotating the tube.3.将混合后的外周血样本放入离心机中,以3000 rpm离心10分钟。
Centrifuge the mixed peripheral blood sample at 3000 rpm for 10 minutes.4.取出上清液,放入新的离心管中。
Remove the supernatant and place it in a new centrifuge tube.5.向上清液中滴加等体积的PBS缓冲液,轻轻旋转混合。
Add an equal volume of PBS buffer to the supernatant and gently mix by rotating.6.将混合后的上清液+PBS溶液放入离心机中,以3000 rpm离心10分钟。
Centrifuge the mixed supernatant + PBS solution at 3000 rpm for 10 minutes.7.取出上清液,弃渣,得到淋巴细胞。
Remove the supernatant, discard the sediment, and obtain lymphocytes.8.将淋巴细胞放入新的离心管中,加入PBS缓冲液洗涤。
Place the lymphocytes in a new centrifuge tube, and wash with PBS buffer.9.重复以上洗涤步骤2-3次,以去除残留的血液成分。
封闭抗体样本制备方法
1.取两支试管,为对照管和测定管;
2.对照管:加入患者配偶(男性)混匀抗凝全血50μl +丈夫血清50μl+CD3/CD 4/CD 8/CD45 单克隆抗体20μl,室温避光孵育20min;
3.测定管:丈夫抗凝全血100μ+患者血清50μl+CD3/CD 4/CD 8/CD45 单克隆抗体20μl,室温避光孵育20min;
4. 每管加入红细胞溶解液0.5ml,充分混匀,室温避光孵育10min;
5.流式分析对照管和测定管CD +3/CD +4 /CD +8 细胞比例;
6.计算公式
封闭效率(%)= 对照管- 测定管CD比例
7.结果判断
①三项中只要有一项出现负值,提示封闭抗体缺乏。
②封闭抗体阳性:三项全部正值,提示正常。
淋巴细胞亚群样本制备方法
1.取两支试管,分别标记为A管和B管;
2.A管加入BD Multitest CD3/CD 4/CD 8/CD45 单克隆抗体20μl到试
管底部;
3.B管加入BD Multitest CD3/CD16+CD56/CD45/CD19 单克隆抗体20
μl到试管底部;
4.分别加入50μl混匀抗凝全血到A、B两管底部,避免让血液污染
管壁;
5.轻轻混匀,室温避光孵育15min;
6.分别加入450μl的1×BD Multitest溶血素,充分混匀,室温避光
孵育15min;
7.涡旋混匀器充分混匀,上机分析。
人外周血淋巴细胞分离操作规程原理:采用密度梯度离心法提取人外周血淋巴细胞用于培养或治疗材料:淋巴细胞分离液、RPMI1640(无血清)/PBS/Hank’s液、RPMI1640完全培养液、刻度离心管、吸管、血球计数板、水平转头离心机等。
步骤:1.将采到的肝素抗凝血取样计数白细胞总数。
2.使用Hank’s液/PBS液/无血清RPMI1640将血样1:1稀释,混匀时要沿管壁吹出,避免产生气泡。
吹匀后于37℃水浴中平衡。
3.从冰箱中取出4℃避光保存的淋巴细胞分离液。
摇匀后在无菌状态下加入刻度离心管中。
操作中尽量避免吸管碰触管壁。
原则上分离液的高度不超过管高的1/4。
4.将盛有分离液的离心管放入37℃水浴中平衡。
5.用吸管将稀释的血液沿离心管壁徐徐加到分离液面上,用力要轻,避免血液冲入分离液中,使得稀释血重叠在分离液面以上,拧紧管盖。
稀释血与分离液的高度比在1:2-2:1之间。
原则上两者的总高度不超过离心管的2/3。
6.将离心管放置于水平离心机中,室温下 2000rpm离心20min。
离心过程中要观察离心速度是否正确,且在停止时选择“no break”,避免因为急剧减速将已经分离的单个核细胞层重新弄混。
注意离心结束时的减速过程,不要太快。
7.离心结束后可见管内分为四层,从上至下分别为:血浆层(含部分血小板)、白膜层(含单个核细胞及少量血小板)、分离液层、粒细胞及红细胞层。
将吸管轻轻穿过血浆层至白膜层,沿离心管周缘吸出血浆层与分离液层界面间的白膜层细胞,置于新离心管中。
尽量少吸取分离液。
8.加吸出体积5倍以上的Hank’s/PBS/无血清RPMI1640液体,用吸管吹打均匀,避免产生气泡,液拄高度不要超过离心管的2/3。
室温1500rpm离心10min,快速倾倒出上清液。
9.用Hank’s/PBS/无血清RPMI1640重悬细胞,注意吹打均匀,不要有细胞团块。
室温下1500rpm离心5min,洗涤两次。
最后一次洗涤时定量加入RPMI1640,吹打均匀后取样计数细胞。