果蔬过氧化物酶酶学特性进展
- 格式:pdf
- 大小:2.08 MB
- 文档页数:5
实验五果蔬中过氧化物酶活力测定一、目的要求了解过氧化物酶的生物氧化作用,学习过氧化物酶的测定方法。
二、实验原理过氧化物酶属氧化还原酶,能催化底物过氧化氢对某些物质的氧化。
反应中的供氢体可为各种多元酚(愈创木酚、间苯二酚)或芳香族胺(苯胺、联苯胺、邻苯二胺)以及NADH2、NADFH2。
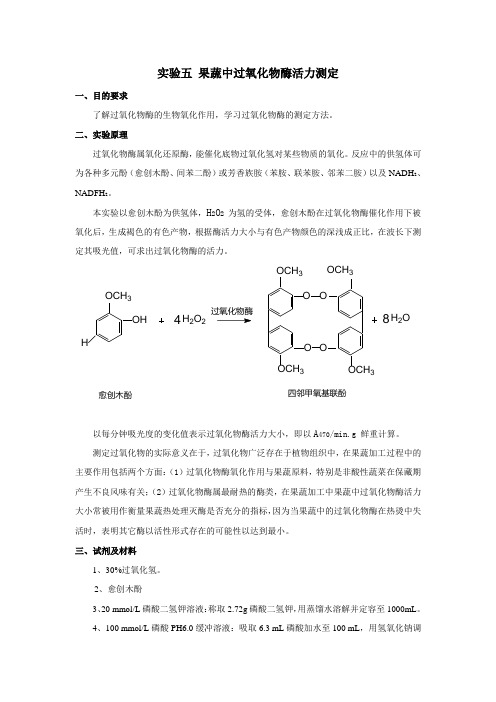
本实验以愈创木酚为供氢体,H2O2为氢的受体,愈创木酚在过氧化物酶催化作用下被氧化后,生成褐色的有色产物,根据酶活力大小与有色产物颜色的深浅成正比,在波长下测定其吸光值,可求出过氧化物酶的活力。
OCH3HOH4H2O2OOOCH3OCH3OCH3OCH38H2O 愈创木酚四邻甲氧基联酚OO以每分钟吸光度的变化值表示过氧化物酶活力大小,即以A470/min.g 鲜重计算。
测定过氧化物的实际意义在于,过氧化物广泛存在于植物组织中,在果蔬加工过程中的主要作用包括两个方面:(1)过氧化物酶氧化作用与果蔬原料,特别是非酸性蔬菜在保藏期产生不良风味有关;(2)过氧化物酶属最耐热的酶类,在果蔬加工中果蔬中过氧化物酶活力大小常被用作衡量果蔬热处理灭酶是否充分的指标,因为当果蔬中的过氧化物酶在热烫中失活时,表明其它酶以活性形式存在的可能性以达到最小。
三、试剂及材料1、30%过氧化氢。
2、愈创木酚3、20 mmol/L磷酸二氢钾溶液:称取2.72g磷酸二氢钾,用蒸馏水溶解并定容至1000mL。
4、100 mmol/L磷酸PH6.0缓冲溶液:吸取6.3 mL磷酸加水至100 mL,用氢氧化钠调整至所需的PH。
5、反应混合液:取25 mL磷酸缓冲溶液于烧杯中,加入愈创木酚140μl,于磁力搅拌器中搅拌至愈创木酚溶解,加入30%过氧化氢95μl,混匀置冰箱保存备用。
6、新鲜白菜梗。
四、仪器设备可见光分光光度计。
五、操作方法1、酶液提取:取白菜梗10g,加入磷酸盐溶液30mL,置于研钵中充分研磨,用磷酸盐溶液定容至100 mL,过滤备用。
2、取两根试管,其中一根试管加入反应混合液3.0 mL,磷酸盐溶液1.0 mL,作为光度计调零对照;另一试管加入反应混合液3.0 mL,酶液0.1 mL,补充磷酸盐溶液至总体积为4.0 mL,迅速混匀。

实验一卷心菜中过氧化物酶热稳定性的初步研究一、实验原理果蔬中的过氧化物酶(peroxidase)往往具有较高的热稳定性,对果蔬进行热烫处理时,常以过氧化物酶是否失活作为热烫是否充分的标准。
许多研究表明果蔬中的过氧化物酶有热稳定和热不稳定两部分。
这两部分的比例取决于果蔬的品种和热烫处理的温度。
过氧化物酶催化的典型反应为:H2O2+AH2→A+2H2O。
AH2是无色的还原性化合物,如果它经过氧化转变成有色的A,那么反应体系在特定波长下的吸光值就会随反应进行而增加。
因此,可以用分光光度法测定过氧化物酶的活力。
二、试剂和仪器试剂:0.05mol/L磷酸盐缓冲液pH7.0,含1.0mol/L NaCl(缓冲液Ⅰ)、0.1mol/L 磷酸盐缓冲液pH7.0(缓冲液Ⅱ)、1%邻苯二胺-乙醇溶液、0.3%过氧化氢溶液仪器:组织捣碎机、抽滤装置、水浴锅、721分光光度计(含比色皿)、秒表、常规玻璃仪器三、实验步骤1、从卷心菜中提取过氧化物酶125g卷心菜+125mL缓冲液Ⅰ↓均质(20000rpm,2min)匀浆↓抽滤液体↓离心(8000rpm,15min,4℃)↓ˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉˉ↓残渣滤过液(粗酶液)2、过氧化物酶热处理将从卷心菜中萃取得到的过氧化物酶粗酶液置于试管中。
取适量酶液稀释5倍左右,过滤后测定酶活。
另取适量酶液分别置于已编号的试管中,将试管在60℃水浴中保温 1 min,然后移至85℃水浴锅中,分别处理0.5min、1min、1.5 min、2 min、3 min、5 min、7 min和10 min,然后立即将试管转移至冰浴中,快速冷却至0℃。
再取适量酶液分别置于已编号的试管中,并将试管在60℃水浴中保温 1 min,然后在100℃下分别处理15s、30 s、45 s、1 min、1.5 min、2 min和3 min,然后在冰浴中快速冷却,测定残余过氧化物酶活力。
3、过氧化物酶活力测定如果热处理后酶液中产生混浊,应在比色前过滤去除沉淀。



大白菜过氧化物酶的分离及某些性质的研究1引言过氧化物酶是一类解剖水解物质的酶,它们也是保护植物防御物质的重要组成部分。
大白菜过氧化物酶是一种植物保护酶,在大白菜中大量存在,具有其独特的生物学性质和功能特征,为大白菜特有的有益物质的生物降解提供了良好的前景。
所以,对大白菜过氧化物酶的分离及某些性质的研究具有重要的理论意义和应用价值。
2研究内容采用技术分析大白菜过氧化物酶的性质,以弄清其特性的原理,为分离及鉴定大白菜过氧化物酶的组成物及活力做准备,搞清各型及酶活力对不同环境和条件的适应性等。
在大白菜中对过氧化物酶的抽提研究主要采用分子筛选方法,用低温反应进行分离,结合抗原的存在,利用免管抗体的特性,有效地从大白菜中分离出java组成的过氧化物酶结合物。
同时,为了更加全面地揭示过氧化物酶的作用机理和功能,对大白菜过氧化物酶的调控特性、底物特性、pH特性等特性进行全面的分析比较,从而进一步深入了解过氧化物酶的生物学特性。
3技术手段研究过氧化物酶的相关性质,主要采用生物化学实验室采用一系列生物化学技术,如电泳,冷冻凝结,回流电泳和凝胶渗透.对大白菜过氧化物酶的特性进行分析,如抗原特性,抗体底物特性,pH特性,温度特性,离子弹性及其底物特性等。
4成果由于大白菜过氧化物酶是一种植物防御酶,所以经过筛选,我们可以找到具有抗性能的大白菜过氧化物酶结合物,这些大白菜过氧化物酶结合物的组成物和酶活使得大白菜有效地抗抑制病原体的生长,即可以降低植物的病害风险。
此外,研究还可以揭示大白菜过氧化物酶的底物特性、抑制特性、pH特性以及酶活的温度和离子弹性,从而为合理利用大白菜中的过氧化物酶,提高植物抗性提供有益的参考依据。
5结论经过对大白菜过氧化物酶的分离及某些性质的研究,成功获取了大白菜中具有一定抗性性能的过氧化物酶结合物。
并且研究还探明了大白菜过氧化物酶的底物特性,抗原特性,pH特性等特性,为提高大白菜抗性提供了有益的参考依据,为保护植物,促进植物的健康发展做出贡献。

收稿日期:2002211225 基金项目:湖南省科技厅资助项目(00N KY 1005201) 作者简介:杨大伟(19682),男,白族,湖南沅陵人,湖南农业大学硕士研究生. 文章编号:100721032(2003)0320258204黄花菜中过氧化物酶活性的测定及褐变控制杨大伟,夏延斌,谭兴和,龚吉军(湖南农业大学食品科学技术学院,湖南长沙 410128)摘 要:为了探索黄花菜预处理过程中合理抑制POD 活力的方法,以鲜黄花菜为材料,研究其在采后及加工过程中POD 的活性及变化情况.发现外花瓣和花梗的POD 活力强,内花瓣的弱,并随着采收后贮藏时间的延长,活力缓慢下降,经贮藏2d 以上的黄花菜不宜用来作为脱水黄花菜的原料.比较热(沸)水杀酶、蒸汽杀酶与非蒸汽(干燥空气,远红外线,微波)杀酶等方法发现,热(沸)水与非蒸汽不能有效的杀灭黄花菜中的POD ,湿热空气(蒸汽)比干热空气灭酶效果好,蒸汽灭酶的工艺参数为漂烫温度98℃,漂烫时间70~80s .关 键 词:过氧化物酶;黄花菜;酶活力;酶促褐变中图分类号:T S 201.2+5 文献标识码:AO n the Inhibiti on of Peroxidase in the P rocess of D ehydrated D aylilyY ANG Da 2w e i ,XI A Yan 2bi n ,T AN Xi ng 2he ,GONG J i 2j un(Co llege of Food Science and T echno l ogy ,HNAU ,Changsha 410128,PRC )Abs trac t :In o rder to discuss the m ethod fo r inh ibiting POD reas onably ,the activity and variati on ofPOD in fresh daylily are researched w hen it w as harvested and p rocessed .R esults show that POD ac 2tivity is vari ous in differen t parts ,the POD activity of ste m and ex ternal petal is strong and that of in 2ner petal is w eak .M eanw h ile the POD activity sl ow ly decreases w ith sto rage ti m e after harvesting ,s o day 2lily w h ich is sto red mo re than 2d is no t suitable fo r the m aterial of dehydrated day 2lily .W ith the comparis on of m ethods of k illing enzym e by heat o r bo iling w ater ,stea m and non 2stea m such as drying at mo s phere ,infrared ray and m icrow ave ,it indicates that heat o r bo iling w ater and non 2stea m do no t k ill the POD efficien tly ,and at mo s phere w ith stea m k ills enzym e mo re efficien tly than drying at mo 2s phere does .T he op ti m al techno l ogy fo r k illing enzym e is to blanch the m aterial by stea m fo r 70~80seconds.Ke y w o rds :perox idase ;daylily ;enzym e activity ;enzym atic brow n ing 黄花菜营养价值高,香味浓郁,深受人们喜爱,在湖南祁东、邵东等地已成为一项特色产业.但黄花菜脱水加工过程中存在褐变问题,在多种引起褐变的原因中,过氧化物酶(POD )引起的酶褐变对脱水黄花菜产品的品质影响最大.据报道[1],过氧化物酶是一种非常耐热的酶,当果蔬中的过氧化物酶在热加工中失活时,其他的酶(如多酚氧化酶,PPO )以活性形式存在的可能性很小,因而在果蔬加工中POD常被用作热处理是否充分的指标.目前,国内外文献中有关POD 对黄花菜加工品质影响的报道不多[2],还未见有对黄花菜干制影响的研究报道,因而有必要对其进行系统的研究.笔者在大量试验的基础上,研究黄花菜中POD 的特性,找到了一条在预处理工艺中合理抑制酶活力的方法,从而为生产高品质的脱水黄花菜奠定了基础.1 材料与方法1.1 材 料仪器与设备有721分光光度计,TD 25多管架自第29卷第3期湖南农业大学学报(自然科学版) V o l .29N o .32003年6月Journal of H unan A griculturalU n iversity (N atural Sciences )Jun .2003动平衡离心机,101A 21型电热鼓风干燥箱,远红外鼓风干燥箱,格兰仕W P 700型微波炉,电子万用炉,电热恒温水浴锅.试剂有N a 2H PO 4,N aH 2PO 4,H 2O 2,N a 2H PO 4・12H 2O ,愈创木酚,邻苯二酚.供试材料为湖南祁东黄花集团公司提供的鲜黄花菜.1.2 方 法1.2.1 酶活力的测定POD 活力采用愈创木酚法[3],多酚氧化酶PPO 活力采用吸光光度法[4].将完整的黄花菜在形态结构上分解成四部分:外花瓣、内花瓣、整花及花梗,并分别测定不同部位的POD 活力.将刚采收的鲜黄花菜在4℃冰箱中贮藏1,2,3d 后,分别测定外花瓣和花梗的POD 活力.1.2.2 非蒸汽灭酶分别取鲜黄花菜100g ,放在100℃热风干燥箱中和远红外干燥箱中干燥5m in ,用高功率、中等功率、低功率微波辐射3m in ,以及用70℃和80℃热水漂烫2m in ,90℃和98℃热水漂烫1m in ,以褐变程度为评价指标,褐变严重为POD 活力高,无褐变则为POD 无活力.1.2.3 蒸汽灭酶各取鲜黄花菜100g ,分别采用家庭液化气灶(98℃,漂烫时间设60,65,70,75,80,90,100,110s ),电子万用炉(98℃,时间设60,70,80,90,100,110,120s )及电热恒温水浴锅(80℃,时间设150,180,210,240,270,300s ;90℃,时间设60,90,120,150,180,210s ;98℃,时间设10,20,30,40,50,60s )作蒸汽发生的热源进行灭酶处理,然后在75℃的热风干燥箱中干制到含水量为15%时止.以灭酶、冷却、干燥过程中褐变程度和产品质量为评价指标.2 结果与分析2.1 鲜黄花菜不同部位POD 和PPO 的活力POD 的活力水平在不同部位上相差较大(表1),花梗上POD 分布均匀且含量较高,因而总的POD 活力水平最高.外花瓣POD 分布极不均匀,离花嘴越近的部位,POD 活力水平越高,因而外花瓣POD 活力平均水平比花梗的低.由于内花瓣POD 活力水平为零,故整花POD 活力水平比外花瓣与花梗均低.2种酶的活力水平与苹果、桃、梨、马铃薯、蘑菇等相关酶的活力水平[5]相比要小得多.PPO 不耐热,用热力灭酶很容易将其抑制,干制过程中不会引起褐变现象.而POD 非常耐热,需要严格的抑制酶活力工艺条件,否则在灭酶过程中或者后续干制脱水过程中产生褐变,使产品质量下降.表1 黄花菜不同部位的POD 及PPO 活力值Tabl e 1 Ac ti v ity of POD and PPO i n d i ffe rentpa rts of daylil yU(m in ・100g )酶整花花梗外花瓣内花瓣POD 310±7420±14 370±9 9±0.5PPO 248±11283±10 273±13 230±8.02.2 不同贮藏时间的POD 活力花梗和外花瓣的POD 活力随贮藏时间的延长有所下降,但下降幅度不大(图1).这表明黄花菜脱水加工存在较大的难度,一方面采后的黄花菜仍然有较强的呼吸作用,随着贮藏时间的延长,将促使植物组织结构变得越来越脆弱,植物细胞在外力的作用下容易崩解;另一方面,POD 活力并没有随贮藏时间延长而显著减少,抑制酶活力的热力强度不能减弱,这样会引起植物组织结构的破坏、崩溃,细胞破裂,蛋白质与糖类等化合物密切接触,促进美拉德反应的发生,脱水干制容易形成油条状产品.因此黄花菜脱水干制应采用刚采收的新鲜原料,贮藏2d 以上的原料不宜用来生产脱水黄花菜.图1 不同贮藏时间POD 的活力变化F i g .1 Ac ti v ity va ri a ti on of POD w ith d i ffe rent s to rage ti m e2.3 不同灭酶方法对产品质量的影响2.3.1 非蒸汽灭酶效果100℃干燥空气,100℃远红外线辐照和70,80℃热水灭酶时产生严重的褐变,用90℃热水和微波处理也产生较为严重的褐变,98℃热水灭酶虽不产生褐变但易散花.上述结果表明:1)100℃干燥空952 第29卷第3期杨大伟等 黄花菜中过氧化物酶活性的测定及褐变控制气和100℃远红外线辐照根本起不到抑制酶活力的作用,其原因是:灭酶时在物料表面存在一气膜层,这一层气膜大大增加了热量传递时的阻力(热量在气膜层中的传递是以传导方式进行的),使热量很难在较短时间内到达POD部位,其温度也很难在较短时间内升到应有的灭酶温度,POD在一定的时间内、较低的温度下发生了褐变反应.2)微波不能杀灭黄花菜中的POD,说明微波灭酶并不适合所有的食品原料.因POD主要集中在黄花菜的外花瓣和花梗上,而微波灭酶时物料表面温度较低,不能杀灭非常耐热的POD.3)虽然沸水灭酶能抑制褐变,但会出现散苞开花现象,而花已开放的黄花菜是不宜作干制原料的.热水或沸水灭酶易导致开花的原因是:花苞在热水或沸水里很易吸水,被吸收进花苞里的水在受热情况下其体积会增大,在一定的压力下花苞就会开放.此外,热水或沸水漂烫灭酶容易引起维生素C等营养成分的损失,使干制品的营养品质下降.2.3.2 蒸汽灭酶效果由于在黄花菜干制过程中的褐变反应既包括酶褐变也有部分非酶褐变.反应过程较慢,且很复杂.为了便于分析,观察每一个样品灭酶过程中的变化、冷却过程中的变化、干燥后的变化,以便找到影响褐变的重要因素,结果见表2,3.表2 不同温度的蒸汽灭酶对产品质量的影响Tabl e2 Effec t of killi ng enzym e by s team w ith d i ffe rent tem pe ra ture on qua lity of produc t脱水过程80℃150s180s210s240s270s300s330s90℃60s90s120s150s180s210s240s98℃10s20s30s40s50s60s灭酶时++++++++++++++++—————————————冷 却+++++++++++++++++++++++————++—————干 燥+++++++++++++++++++++++++———++++++———产品质量▲▲▲▲▲▲▲▲▲▲●★●▲▲▲●★●▲ +++.褐变很严重;++.褐变严重;+.褐变较严重;—.无褐变;▲.质量差;●.质量较好;★.质量好.表3 98℃时家庭液化气灶和电子万用炉发生的蒸汽灭酶对产品质量的影响Tabl e3 Effec t of killi ng enzym e by s team from li quefi ed gas fo r cooki ng and uni ve rsa l e l ec tri c s tove on qua lity of produc t脱水过程家庭液化气灶60s65s70s75s80s90s100s110s120s电子万用炉60s70s80s90s100s110s120s灭酶时+————————+++—————冷 却+++———————+++++————干 燥+++———————++++++++———产品质量▲●★★★●●▲▲▲●●●★●▲ 从表2和表3可知:1)当温度低于80℃时,不能有效杀灭POD,必须使温度大于90℃时才能将其杀灭,这与文献[1]报道的相符;2)湿热空气(蒸汽)比干热空气灭酶效果好,原因是湿热空气在上升流动的过程中将热量以对流的方式传递到黄花菜表面,热量通过物料表面气膜层时产生的传热阻力很小,能在极短的时间内使物料表面的温度上升到规定的灭酶温度,将POD杀灭;3)同是常压下98℃饱和蒸汽,家庭液化气灶、电子万用炉、水浴锅3种热源的灭酶时间,以水浴锅灭酶时间最短,电子万用炉最长,其原因是水浴锅产生的蒸汽对流效果最好,电子万用炉产生的蒸汽对流效果最差.由不同热源蒸汽灭酶对相对活力的影响结果(图2)可以看出:1)不同蒸汽灭酶时,POD失活的速率不同.水浴锅灭酶的速率最大,大于或小于最佳灭酶时间时,产品质量将下降,可操作性差.电子万用炉灭酶的速率最小,在最佳灭酶时间两侧的缓冲时间比较长,但受热时间过长也会影响产品质量.家庭液化气灭酶的速率适当,可操作性好,受热时间不长,能保证产品质量.家庭液化气灭酶时有3个有效灭酶时间,另外2种灭酶方式只有一个有效灭酶时间.生产中灭酶时间掌握不好,会影响产品质量.2)无论是水浴锅蒸汽灭酶,还是电子万用炉蒸汽灭酶,灭酶时间要适当,时间太短,POD抑制不彻底,容易导致酶再生,灭酶失败,产品质量下降.时间太长, POD虽能杀灭,由于热处理时间过长,导致黄花菜中组织网络结构崩溃,细胞破裂,内含物流出,相互密切接触,加速褐变反应的进程,产品呈干瘪的油条状,复水时持水性下降,复原性差.062湖南农业大学学报(自然科学版)2003年6月 图2 不同热源蒸汽灭酶对POD相对活力的影响F i g.2 I m pac t of killi ng enzym e by s team from d i ffe rentw ays on POD re l a ted ac ti v ity3 结 论通过POD不同部位以及经过不同贮藏时间的活力水平的分析测定,POD活力并没有随贮藏时间延长而显著减弱,热力灭酶容易破坏采后逐渐脆弱的植物细胞组织,导致干制品的复水性差,质量下降,因此应选择刚采收的黄花菜作脱水产品的原料.通过POD不同部位的活力水平的分析测定以及POD杀灭方法的比较研究,POD在外花瓣和花梗中的活力强,在内花瓣中的活力弱,表明微波不能杀灭POD,湿热空气(蒸汽)比热(沸)水和干热空气(含远红外线)灭酶效果好,且适宜的蒸汽灭酶工艺参数为漂烫温度98℃,漂烫时间70~80s.参考文献:[1] 王 璋.食品科学[M].北京:中国轻工业出版社,1999.2242225.[2] 张 欣,马 明.黄花菜速冻工艺的研究[J].冷饮与速冻食品工业,2002,(2):10211.[3] 宁正祥.食品成分分析手册[M].北京:中国轻工业出版社,1997.7502752.[4] 姜 通,罗志刚,蒲丽军.甘薯中多酚氧化酶活性的测定及褐变控制[J].食品科学,2001,(3):19222.[5] 张 .特种脱水蔬菜加工贮藏和复水学专论[M].北京:科学出版社,1996.33235.简 讯湖南农业大学期刊社成立 根据湘农大[2003]61号文件,为整合出版资源,湖南农业大学学报编辑部已从湖南农业大学科技处分离出来,单独成立湖南农业大学期刊社(正处级).期刊社的成立,标志着湖南农业大学的办刊模式将分步分层次地变更,即由主要依赖学校财政拨款办刊向主要依托市场自主经营自负盈亏转变;由单一从事编辑出版向多种经营转变;由只出版学术期刊向出版多类型期刊转变,以便做大做强,加速期刊的专业化与产业化发展.162 第29卷第3期杨大伟等 黄花菜中过氧化物酶活性的测定及褐变控制。
· 62 ·过氧化物酶(peroxidase,POD,EC1.11.1.7)收稿日期:2012-03-30 *通讯作者基金项目:国家自然科学基金项目(31071625)。
作者简介:丁薪源(1989—),女,吉林德惠人,硕士研究生,研究方向为食品质量与安全。
是广泛存在于各种动物、植物和微生物体内的一丁薪源,曹建康*(中国农业大学食品科学与营养工程学院,北京 100083)摘要:综述了过氧化物酶在植物抗性方面的作用及研究意义,并对抗性相关酶POD 的分离纯化、同工酶谱、酶结构及分布等酶学特性进行了综述。
分析得到,果蔬中过氧化物酶的最适pH 范围大部分集中在5.0~7.0之间,最适温度集中在30~60 ℃,对于大部分果蔬的过氧化物酶,Fe 2+、Fe 3+、Ca 2+、Mg 2+等金属离子有不同程度的激活作用,表面活性剂PEG 、SDS 和DETA 的激活作用不明显,甲醇、乙醇、丙酮、抗坏血酸、柠檬酸、L-半胱氨酸也有不同程度的抑制作用。
研究表明,大多数植物的过氧化物酶分子量在30~60 ku 范围内,不同品种、不同发育期、不同器官之间的同工酶种类有所差异。
同时,对过氧化物酶的发展前景进行了展望。
关键词:植物抗性;过氧化物酶;酶学特性;同工酶;果蔬中图分类号:TS 201.2+5 文献标志码:A 文章编号:1005-9989(2012)10-0062-05Characteristics of peroxidase from fruit and vegetable researchprogressDING Xin-yuan, CAO Jian-kang *(College of Food Science & Nutritional Engineering, Chinese Agricultural University,Beijing 100083)Abstract: This paper described the peroxidase’s role in plant resistance and research significance, and summarized the characteristic of peroxidase, such as purification, isozymes, structure and distribution of POD. The result showed that, the optimum pH of the peroxidase in many fruits and vegetables concentrated in 5.0~7.0, the optimum temperature concentrated in 30~60 ℃. For many fruits and vegetables, peroxidase activities were stimulated in different degrees by some metal ions like Fe 2+, Fe 3+, Ca 2+, Mg 2+, and almost weren’t stimulated by surfactant like PEG, SDS, DETA. Methanol, ethanol, acetone, ascorbic acid, citric acid, L-cysteine have different degrees of inhibition to the peroxidase. Molecular weights of most of the PODs vary from 30 ku to 60 ku, and isoenzyme types are different between the different varieties, different developmental stages and different organs. This paper gave an overview of peroxidase development prospects.Key words : plant resistance; peroxidase; enzymatic characteristics; isozymes; fruits and vegetables果蔬过氧化物酶酶学特性研究进展· 63 ·2012年 第37卷 第10期类氧化酶,可催化由过氧化氢参与的各种氧化反应,如催化酚类和胺类化合物的氧化反应。
目前,关于植物过氧化物酶功能特性和酶学特性的研究已取得较大进展。
过氧化物酶(如辣根过氧化物酶)已被广泛应用于治理环境污染,应用于酶联免疫分析、生物传感器、癌症靶向治疗、药物诊断、有机合成和水污染治理等[1]。
1 过氧化物酶的功能研究进展从1809年过氧化物酶以愈创木酚为底物进行颜色反应,至今人们对过氧化物酶的认识逐渐深入,根据其等电点大小可分为酸性、中性和碱性,跟据催化底物可分为愈创木酚过氧化物酶、谷胱甘肽过氧化物酶和抗坏血酸过氧化物酶等,还可根据来源、分离酶的生理功能等原则划分。
研究表明,过氧化物酶在植物体内主要有两方面的作用[2]:一方面与植物正常的形态发生和形态建成有关,通过氧化分解吲哚乙酸,在植物的生长、发育过程中起作用,例如,在酚类聚合成木质素过程中起重要作用;另一方面与植物的抗性有关,包括抗旱、抗寒、抗盐、抗病、抗氧化等机能,是植物的重要保护酶之一。
例如,Park 等人[3]实验证明,在植株受到病菌侵染与机械损伤时,过氧化物酶积极地作出反应,使细胞壁交联扩张,并产生大量活性氧,通过形成一个有毒环境来抑制和杀死入侵的病菌。
同时,植物体内过氧化物酶及同工酶与植物的抗病性密切相关。
它可使O 2、H 2O 2等转变为活性较低的物质,消除植物体内生物氧化产生的有毒物质,使植物组织及细胞得到保护。
病菌侵染植物组织后刺激植株内部产生一些特殊的代谢变化,导致其过氧化物酶活性及同工酶谱相应改变。
过氧化物酶是果蔬成熟和衰老的生理指标,参与果蔬酶促褐变,可以催化酚类物质、谷胱甘肽、抗坏血酸的氧化,使果皮变色。
由于过氧化物酶对新鲜果蔬的色泽造成不良影响,影响产品感官品质和运销,在果蔬加工中需要对过氧化物酶进行防治,常采用高温瞬时热处理(HTST),或利用温度、pH、抑制剂等手段处理原料,抑制或降低其酶活。
由于过氧化物酶非常耐热,常作为选择热处理条件的指标。
传统研究过氧化物酶的方法是从测定其酶活开始,用不同的抽提缓冲液对各种结合状态下的(细胞质游离态、细胞壁以离子键结合态、细胞壁以共价键结合态、溶酶体等)过氧化物酶分别提取测定[4],以此说明其作用。
随着生物化学及分子生物学技术的发展,不同来源、不同种类的过氧化物酶的酶学特性[5-6]、过氧化物酶与抗性的关系等相关研究逐步兴起,掀起过氧化物酶研究热潮。
2 过氧化物酶酶学特性2.1 酶的提取与分离纯化利用传统硫酸铵沉淀、有机溶剂沉淀、透析、离子交换层析、凝胶过滤以及两相分配色谱等方法进行植物过氧化物酶的分离纯化[7],还可以利用电泳技术进行POD酶的分离和鉴定。
刘金磊等[6]发现,经过真空冷冻干燥后得到过氧化物酶干制品,置干燥器低温保存,效果比较理想。
提取纯化时应注意,植物组织要充分破碎使酶尽可能的完全提取,硫酸铵沉淀要达到一定的时间和沉淀度,凝胶过滤前注意平衡胶体的pH及离子强度等。
2.2 酶活性的测定适量的酶液通过催化过氧化物氧化底物,发生氧化聚合反应,该化合物在一定波长下具有较强的吸收峰,使反应液发生颜色变化,通过测定特定波长下反应液的吸光度值,即可计算出过氧化物酶的催化活性。
一般以愈创木酚为底物,加入乙酸-乙酸钠缓冲液,适量酶液催化H 2O 2氧化底物,于470 nm波长下测定其吸光度值的变化,可定义每毫升酶液每分钟吸光度改变0.1为1个酶活性单位(U)[8]。
实验现象多为反应液由无色或淡色逐渐发生褐变,在一定时间范围内,最终形成褐色或棕褐色。
2.3 底物对过氧化物酶酶活的影响植物来源的过氧化物酶多为非特异性的氧化还原酶,其对H 2O 2非常专一,可利用H 2O 2氧化供氢体,而对供氢体的要求则较为广泛:酚类、胺类化合物、某些杂环化合物和一些无机离子等都可以作为过氧化物酶的供氢体[2]。
在选择过氧化物酶催化反应的合适底物时,应从两方面考虑:一是要有合适的空间结构,利于和酶活性中心结合;二是要有较强的还原性,如酚类物质。
针对底物荧光结构考虑,底物的最佳结构应具备:(1)酚羟基是底物的基本结构;(2)酚羟基邻位被羟基或甲氧基等给电子基团取代,以羟基更佳;另一邻位位置必须空出;(3)酚羟基的对位,以碳链取代更佳。
· 64 ·通过配制不同浓度梯度的底物溶液,测定不同底物浓度对过氧化物酶酶活的影响,制作底物浓度与反应初速度关系的v -1-[S]-1曲线,并拟合各直线斜率,即为反应初速度,计算最大反应速度Vmax和米氏常数Km值。
Km越小,酶与底物亲和力越大。
不同果蔬中过氧化物酶结构和种类存在一定差异,根、茎、果实等组织中POD含量也不尽相同,导致果蔬过氧化物酶的最适底物种类和浓度存在特异性。
但是大部分果蔬过氧化物酶对愈创木酚有较强的亲和力,例如,雪莲果[9]、黑美人马铃薯[10]、山药[11]的愈创木酚底物Km值分别为0.004182、0.0032、0.08231 mol/L。
2.4 pH对过氧化物酶酶活的影响分别用不同pH的提取液进行粗酶提取,测定其酶活性,制作pH和POD活性关系曲线,确定过氧化物酶酶促反应最适pH。
研究表明,苦瓜[6]、番薯[1]、洋葱[12]、富士苹果[13]、雪莲果[9]中的过氧化物酶最适pH分别为4.6、5.5、6.5、5.0、6.0;3个香蕉品种果实威廉斯蕉、大蕉及粉蕉过氧化物酶最适pH值分别为6.5、5.0、5.5,pH值稳定性范围分别在6.0~9.0、8.0~9.0、5.0~9.0[5]。
哈密瓜在50 ℃的条件下,最适pH范围为5.5~7.5,在30 ℃条件下,最适pH范围为6.0~7.0[14]。
可见,过氧化物酶的最适pH范围大部分集中在5.0~7.0之间。
过氧化物酶具有一定的稳定性,但过酸或过碱均可破坏其空间结构,影响酶活性中心基团和底物的解离状态,从而降低酶的活性和酶促反应速度。
2.5 温度对过氧化物酶酶活的影响2.5.1 过氧化物酶最适温度 将反应酶液分别置于20~90 ℃等不同梯度温度条件下反应一定的时间,测定其酶活性,制作温度和POD活性关系曲线,确定最佳酶促反应温度。