PCR产物胶回收实验
- 格式:doc
- 大小:21.00 KB
- 文档页数:3

一、目的基因的扩增
(四)、PCR产物的提纯
实验目的:
回收得到纯的目的DNA,去除影响DNA连接酶活性的物质及其它DNA片段。
纯化产物用于酶切和连接反应。
主要实验仪器:
冰箱,为试剂、样品或菌种提供冷冻、冷藏的保存环境制冰机,用于制备碎冰块
微量移液器,用于吸取微量试剂及样品
超净工作台,提供无菌工作台面
常温离心机,用于样品的常温离心分离
核酸电泳仪,用于核酸的电泳分离分析
主要实验室剂:
酚/氯仿/异戊醇、无水乙醇、70%乙醇、TE。
实验步骤:
将PCR反应液转入1.5ml离心管中,加入50ulTE和100ul 酚/氯仿/异戊醇,盖好离心管盖子,上下颠倒混匀。
将管置于离心机中,12000rpm离心5min。
取上清,加入1/10体积3mol醋酸钠和2.5倍体积预冷的无水乙醇,上下颠倒混匀,室温放置20min沉淀DNA。
将管置于离心机中,12000rpm离心10min。
离心后现象:(图片)。
弃上清,加入1ml70%乙醇,12000rpm离心5min。
离心后现象:(图片)。
弃上清。
将管口打开,倒置于纸巾上数秒,使液体尽可能流尽,再平放于纸巾上室温干燥10min。
加30ulTE溶解沉淀,取5ul样品跑电泳。
电泳图谱为:(图片)。
确认回收到PCR产物后,剩余样品置于-20℃冰箱中备用,用于酶切。
END。


PC产物的回收与鉴定PCR产物的回收(胶回收试剂盒)1、胶回收的目的(1)去除非特异性扩增的产物(2)去除多余的底物(3)去除多余的Taq酶(4)得到目的片段2、胶回收的过程(1)切胶:紫外下切胶,称重。
之后用枪头将胶块捣碎。
切胶的刀片最好选用一次性刀片,实验台等也尽可能用乙醇擦拭干净。
可通过空EP管与装胶EP管质量的差值计算胶的质量。
注意切胶时尽可能避免切到条带外的凝胶,且避免紫外时间过长。
别忘记胶条有厚度,前后多余的部分也尽量切除。
如果感觉手感不好,可以试试切胶神器:(2)溶胶:每1mg胶加入1μL膜结合液(MB),按比例1:1加入MB,55℃水浴溶解。
每1—2min震荡混匀,待溶解后至少在水浴中保持1—2min,保证胶块完全溶解。
在电泳过程中,DNA会与大分子的多糖紧密结合,凝胶的种类和质量不同,DNA与之结合力也不同,只有凝胶充分溶解DNA才能充分释放。
否则,凝胶将与DNA一起沉淀下来,洗脱后将影响回收结果的纯度。
(3)结合:将溶胶转移至纯化柱内,12000rpm离心1min,倒掉收集管中的废液,将纯化柱重新插回收集管中。
胶块完全溶解后最好将胶液温度降至室温再上柱,因为纯化柱在温度较高时结合DNA的能力较弱。
离心时注意对称放置离心管。
(4)漂洗:向纯化柱正中加入600μL漂洗液(预先加过无水乙醇),12000rpm离心30s,去除废液。
重复一次后,将纯化柱开盖离心2min,彻底去除残余漂洗液中的乙醇。
纯化柱正中为硅基材料,在高盐环境下能够吸附DNA,在低盐环境下能够释放DNA。
漂洗液中乙醇的残留会影响后续的酶切、PCR等实验。
(5)洗脱:将纯化柱置于1、5mL离心管中,向纯化柱正中加入30μL洗脱缓冲液或无菌水,放置1min后,12000rpm离心1min,洗脱DNA。
务必将洗脱缓冲液或无菌水加入纯化柱正中,若沾在管壁上,一定要震动离心管,使液体滑落到管底,以便被纯化柱吸收。
(6)保存:将获得的DNA片段于-20℃保存,或直接用于后续实验。


pcr切胶回收的步骤
PCR切胶回收呀,这可是个很有趣的小实验呢。
先说说准备工作吧。
你得有已经跑过PCR并且经过琼脂糖凝胶电泳的胶块哦。
然后呢,把要用的工具都准备好,像干净的刀片啦,还有专门的切胶回收试剂盒。
开始切胶啦。
在紫外灯下看胶块的时候,就像寻宝一样呢。
找到你要的那条DNA 条带,然后用刀片小心翼翼地把它周围的胶切下来。
可别切太大块啦,不然会有好多杂质的。
切的时候就像在给小宝贝做精细的手术一样,要很小心哦。
切好胶之后,就按照试剂盒的说明来操作啦。
一般是把切下来的胶放到一个离心管里,然后加入一些溶液,让胶融化。
这时候你就看着胶慢慢变成液体,感觉就像魔法一样呢。
接着呢,要把融化后的液体加到吸附柱里。
这个吸附柱就像一个小卫士,专门把DNA吸附住,而那些杂质就被留在外面啦。
把液体加进去之后,离心一下,就像坐小过山车一样,让液体在离心力的作用下快速通过吸附柱。
然后呢,要清洗一下吸附柱。
这一步就像是给小卫士洗个澡,把它身上可能残留的杂质都洗干净。
再离心一下,把清洗的液体甩掉。
最后就是把我们想要的DNA从吸附柱上洗脱下来啦。
加入洗脱液,再离心,这个时候我们的DNA就乖乖地跑到洗脱液里啦。
就像把小宝贝从保护它的小房子里接出来一样。
这样,PCR切胶回收就完成啦。
虽然过程有点小复杂,但是只要按照步骤来,就可以得到我们想要的纯净的DNA啦。
每次做这个实验都感觉像是在和小小的DNA分子玩一场有趣的游戏呢。

PCR产物的TA克隆(DNA的胶回收和连接)
【实验原理】
1.DNA片段回收方法:DNA片段在适当浓度的琼脂糖凝胶中,通上一定电压进行电泳,不同大小的DNA分子由于迁移率的不同而分离开。
切下带有所需DNA片段的凝胶,用冻融法、玻璃奶回收法或商品化胶回收试剂盒将目的片段回收纯化。
2.利用Taq酶能够在PCR产物的3’末端加上一个非模板依赖的A,而T载体是一种带有3’T突出端的载体,在连接酶作用下,可以把PCR产物插入到质粒载体的多克隆位点,可用于PCR产物的克隆和测序。
商品化的T载体有很多。
本实验采用TaKaRa公司的pMDTM18-T Simple Vector。
这个载体以pUC19载体为基础,消除了pUC18载体上的多克隆酶切位点,经EcoRⅤ酶切后在两侧的3'端添上“T”制备而成(见附录1)。
由于本载体上消除了多克隆酶切位点,克隆后的PCR产物将无法使用载体上的限制酶切下,需要在PCR扩增引物上导入合适的酶切位点。
【试剂与器材】
(一)试剂
1.pMDTM18-T Simple Vector Kit(Takara公司)。
2.TAE电泳缓冲液
3.琼脂糖(Agarose)
4.6×电泳加样缓冲液:0.25%溴粉蓝,40%(w/v) 蔗糖水溶液,贮存于4℃。
1 / 9。
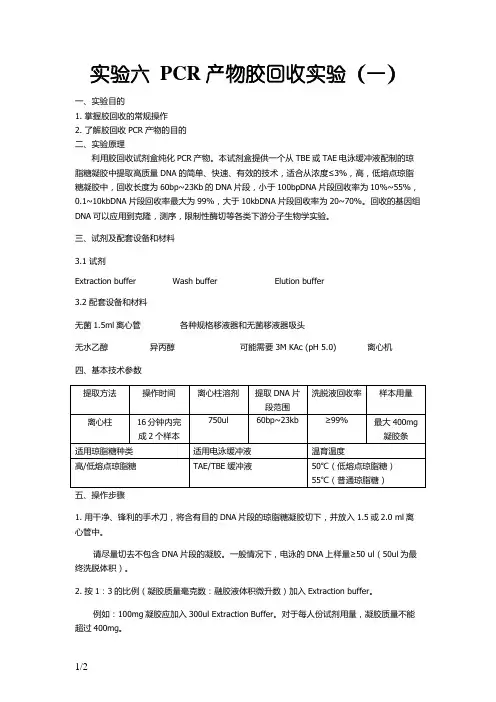
实验六 PCR产物胶回收实验(一)一、实验目的1. 掌握胶回收的常规操作2. 了解胶回收PCR产物的目的二、实验原理利用胶回收试剂盒纯化PCR产物。
本试剂盒提供一个从TBE或TAE电泳缓冲液配制的琼脂糖凝胶中提取高质量DNA的简单、快速、有效的技术,适合从浓度≤3%,高,低熔点琼脂糖凝胶中,回收长度为60bp~23Kb的DNA片段,小于100bpDNA片段回收率为10%~55%,0.1~10kbDNA片段回收率最大为99%,大于10kbDNA片段回收率为20~70%。
回收的基因组DNA可以应用到克隆,测序,限制性酶切等各类下游分子生物学实验。
三、试剂及配套设备和材料3.1 试剂Extraction buffer Wash buffer Elution buffer3.2 配套设备和材料无菌1.5ml离心管各种规格移液器和无菌移液器吸头无水乙醇异丙醇可能需要3M KAc (pH 5.0) 离心机四、基本技术参数1. 用干净、锋利的手术刀,将含有目的DNA片段的琼脂糖凝胶切下,并放入1.5或2.0 ml离心管中。
请尽量切去不包含DNA片段的凝胶。
一般情况下,电泳的DNA上样量≥50 ul(50ul为最终洗脱体积)。
2. 按1:3的比例(凝胶质量毫克数:融胶液体积微升数)加入Extraction buffer。
例如:100mg凝胶应加入300ul Extraction Buffer。
对于每人份试剂用量,凝胶质量不能超过400mg。
3. 于恒温水浴或金属浴中50℃温育,直到凝胶融化。
一般温育时间为10分钟,温育过程中没隔23分钟混匀一次。
如果温育后,混合液体颜色变紫,请加入10 ul 3M KAc (pH 5.0),使混合液颜色变回黄色。
4. 可选:按1:1的比例(凝胶质量毫克数:异丙醇体积微升数)加入异丙醇,并混合均匀。
如DNA片段大于500bp/小于4kb,不需要加异丙醇。
5. 将混合液全部转移到Spin column内,于6,000g离心1分钟,并弃去接液管内液体。

质粒或PCR酶切产物切胶回收实验材料实验耗材:枪头(10μl、200μl、1ml)、EP管(200μl、1ml)试剂:普通琼脂糖凝胶DNA回收试剂盒(天根)、ddH2O准备工作:50˚C加热块、质粒或PCR酶切产物、PCR产物实验操作步骤:使用前请先在漂洗液PW中加入无水乙醇。
1. 柱平衡步骤:向吸附柱CA2中(吸附柱放入收集管中)加入500 μl平衡液BL,12,000 rpm (~13,400×g )离心1 min,倒掉收集管中的废液,将吸附柱重新放回收集管中。
(请使用当天处理过的柱子)2. 将单一的目的DNA条带从琼脂糖凝胶中切下(尽量切除多余部分)放入干净的离心管中,称取重量。
3. 向胶块中加入等倍体积溶液PN(如果凝胶重为0.1 g,其体积可视为100 µl,则加入100 µl PN溶液),50℃水浴放置,其间不断温和地上下翻转离心管,以确保胶块充分溶解。
如果还有未溶的胶块,可继续放置几分钟或再补加一些溶胶液,直至胶块完全溶解(若胶块的体积过大,可事先将胶块切成碎块)。
注意:对于回收<300bp的小片段可在加入PN完全溶胶后再加入1/2胶块体积的异丙醇以提高回收率;胶块完全溶解后最好将溶液温度降至室温再上柱,因为吸附柱在室温时结合DNA的能力较强。
4. 将上一步所得溶液加入一个吸附柱CA2中(吸附柱放入收集管中),室温放置2 min,12,000 rpm (~13,400×g )离心30-60 sec,倒掉收集管中的废液,将吸附柱CA2放入收集管中。
注意:吸附柱容积为800 μl,若样品体积大于800 μl可分批加入。
5. 向吸附柱CA2中加入600 μl漂洗液PW(使用前请先检查是否已加入无水乙醇),12,000 rpm (~13,400×g )离心30-60 sec,倒掉收集管中的废液,将吸附柱CA2放入收集管中。
注意:如果回收的DNA是用于盐敏感的实验,例如平末端连接实验或直接测序,建议PW 加入后静置2-5 min再离心。

实验三PCR产物电泳回收检测(D2500-01型号)1..琼脂糖凝胶电泳分离DNA片段,推荐使用新鲜的TAE/TBE Buffer和新配制的胶。
2.片段完全分离后,在紫外灯下迅速切取所需条带,DNA在紫外灯下爆光时间不超过30s。
3.称取凝胶块的重量,按照每1g凝胶加入1ml Binding Buffer对应量,加入适量体积的Binding Buffer,55-60℃水浴至凝胶完全溶解(约7-10min)。
每隔2-3min振荡一次。
注意:当Binding Buffer完全溶解凝胶后,请注意溶液颜色的变化。
如果溶液颜色已经变成紫色或红色,必须加入5ul 5M NaAc, pH 5.2至溶液中调整pH值。
4.把HiBind DNA 柱子套在2ml收集管。
5.将DNA/凝胶混合液转移至套在2ml收集管的HiBind DNA柱子中,10,000xg离心1min。
6.倒去滤液,把柱子装回收集管中。
HiBind柱一次能装700ul溶液,若混合液超过700ul,每次转移700ul至柱子中,然后重复5-6步骤。
7.把柱子重新装回收集管,加入300ul Binding Buffer,按上述条件离心,弃去滤液。
8.把柱子重新装回收集管,加入700ul SPW Wash Buffer,按上述条件离心,弃去滤液。
注意:使用前SPW Wash Buffer必须用无水乙醇稀释。
9.(可选)重复步骤8一次。
10.弃去滤液,把柱子重新装回收集管,13,000xg离心空柱2min以甩干柱子基质。
11.把柱子装在干净的1.5ml离心管上,加入30ul 65℃预热的Elution Buffer到柱子基质上,室温静置2min。
≥13,000xg离心2 min洗脱出DNA。

PCR产物胶回收实验引言:PCR(聚合酶链式反应)是一种用于扩增DNA片段的常用技术。
在PCR实验中,扩增产物通常需要从琼脂糖凝胶上回收和纯化,以便进一步的分析和应用。
本文将介绍一种PCR产物胶回收的实验方法。
实验材料:1. 扩增产物:经过PCR扩增得到的DNA片段。
2. 琼脂糖凝胶:用于扩增产物分离和纯化。
3. 胶回收缓冲液:用于胶回收的缓冲液。
4. 真空浓缩仪:用于回收DNA片段。
5. 无菌纯水:用于制备实验溶液。
6. DNA电泳仪:用于检测和分析PCR产物。
实验步骤:1. 准备琼脂糖凝胶:a. 根据实验需要,制备适合的琼脂糖凝胶。
b. 加入适量的琼脂糖凝胶染料(如安全染料)。
2. 进行PCR扩增:a. 根据所需扩增片段的序列,设计引物,并合成引物。
b. 准备PCR反应体系,包括DNA模板、引物、Taq DNA聚合酶等。
c. 进行PCR扩增反应。
3. 分析PCR产物:a. 用电泳法将PCR产物与DNA标准品一同进行电泳。
b. 根据需要,记录PCR产物的迁移距离和片段大小。
4. 准备胶回收缓冲液:a. 根据实验所需,制备合适的胶回收缓冲液。
5. 胶回收:a. 使用刮胶刀将PCR产物切下,放入离心管中。
b. 添加足够的胶回收缓冲液,使产物完全浸没其中。
c. 低温热激活离心管以使产物与缓冲液充分混合。
d. 放入离心机中离心,以使产物完全沉积到离心管底部。
6. 剔除上清:a. 使用吸走器小心地吸取上清,避免吸取产物。
b. 检查离心管底部是否完全干燥,如有残余液体则继续吸取。
7. 回收DNA片段:a. 加入适量的无菌纯水,以溶解和洗涤DNA片段。
b. 用手轻轻摇晃离心管,使DNA片段溶于水中。
c. 使用真空浓缩仪,将溶解的DNA片段浓缩至所需浓度。
8. 分析纯化后的PCR产物:a. 用电泳法将纯化后的PCR产物与DNA标准品一同进行电泳。
b. 检查PCR产物的迁移距离并与之前的分析结果进行比较。
结论:通过PCR产物胶回收实验,我们成功地从琼脂糖凝胶中回收和纯化了PCR扩增的DNA片段。

pcr产物纯化回收跑胶试验结果分析PCR产物的回收(玻璃奶吸附法)SYBR会使DNA部分显出绿色荧光,在紫外灯下辨认绿色荧光,可将胶切下。
实验结果及分析本次试验中,在最后一步检测中看到了荧光,说明了DNA的存在,证明回收到了PCR的产物PCR产物的直接纯化:一、原理PCR产物一般都含有过量的引物、Taq DNA酶及dNTP,这些成分的存在将直接影响到后续的酶切、双脱氧PCR测序反应等过程,因此有必要除去。
目前核酸纯化的方法有很多,商用化试剂盒的出现使得DNA的纯化过程变得更加简便快捷。
本实验中, Buffer PCR-A促使大于100bp 的DNA片段选择性地吸附到 silica膜上。
经 Buffer W. BufferW2洗涤去除残留在sica膜上的小于50-mer的引物、酶蛋白、单核苷酸、荧光染料或放射性同位素标记的单核苷酸后,吸附到sica膜上的DNA片段经微量水或 Eluent洗脱下来,即可用于各种分子生物学的操作。
二、材料与方法1、材料PCR产物2、仪器、用具恒温孵育器(65C)、离心机、移液器、1.5ml离心管3、试剂Buffer_PCR -A Buffer w1;已加无水乙醇的 Buffer V2 Eluent或去离子水4、方法(1)在PCR反应液中加入3倍体积的Buffer PCR-A若需加入的BufferPCR-A不足100ul,则加入100ul。
(2)将DNA --prep Tube置于2 -ml Microfuge Tube中,将步骤(1)中的混合液移入DNA -prep Tube I中,5500rpm离心1min。
(3)弃滤液,将DNA -prep Tube置回到原2 -ml Microfuge Tube 中,加入500 ul Bufer W1,5500rpm离心1min。
(4)弃滤液,将DNA -prep Tube置回到原2 -ml Microfuge Tube 中,加入700山已加无水乙醇的 Buffer V2,5500rpm离心1min,以同样的方法再用700山己加无水乙醇的 Buffer\2洗涤一次。
PCR产物的胶回收分离纯化一、实验仪器1、琼脂糖凝胶电泳系统2、紫外观察分析仪3、离心机4、单面刀片5、恒温水浴锅二、试剂1、DNA回收试剂盒2、50×TAE3、ddH2O三、步骤1 在紫外灯下切分含DNA的琼脂糖块,尽可能除去多余的琼脂糖.放入1.5ml离心管中。
4. 称量胶块重量,计算胶块体积。
计算胶块体积时,以1 mg=1 μl 进行计算。
5. 向胶块中加入胶块融化液DR-I Buffer,DR-I Buffer 的加量如下表:凝胶浓度DR-I Buffer 使用量1.0% 3 个凝胶体积量1.0%~1.5% 4 个凝胶体积量1.5%~2.0% 5 个凝胶体积量6. 均匀混合后75℃加热融化胶块(低熔点琼脂糖凝胶只需在45℃加热)。
此时应间断振荡混合,使胶块充分融化(约6~10 分钟)。
注)胶块一定要充分融化,否则将会严重影响DNA 的回收率。
7. 向上述胶块融化液中加入DR-I Buffer量的1/2体积量的DR-II Buffer,均匀混合。
当分离小于400 bp 的DNA 片段时,应在此溶液中再加入终浓度为20% 的异丙醇。
8. 将试剂盒中的Spin Column 安置于Collection Tube 上。
9. 将上述操作7 的溶液转移至Spin Column 中,12,000 rpm 离心 1 分钟,弃滤液。
注)如将滤液再加入Spin Column 中离心一次,可以提高DNA 的回收率。
10. 将500 μl的漂洗液Rinse A加入Spin Column中,12,000 rpm 离心30 秒钟,弃滤液。
11. 将700 μl的Rinse B加入Spin Column中,12,000 rpm 离心30 秒钟,弃滤液。
注)请确认Rinse B中已经加入了指定体积的100%乙醇。
12. 重复操作步骤11。
13. 将Spin Column 安置于新的1.5 ml 的离心管上,在Spin Column 膜的中央处加入25 μl 的灭菌蒸馏水或Elution Buffer,室温静置 1 分钟。
胶回收一. 提高胶回收量的办法:1)增加电泳时的上样量。
2)电泳缓冲液用新鲜配制的。
3)切胶时尽量只切有条带的胶,减小切胶体积:含目的片断很少的胶就不要要了,不然影响回收率。
4)把切的两块或多块胶融化后,无论多大的体积都用一个管子,转移到同一个柱子上。
5)溶胶时所加的溶液可多一点,这样更有利于DNA与膜的结合,不过一般不要多余750ul。
6)胶回收的关键是通过柱子的溶液的盐浓度、酸碱性(电荷)和疏水性使DNA与柱子结合,因此,若电泳缓冲液的PH偏高,可在溶胶液中加入10ul (PH 5.0,3mol/L的 NaAC);为了使DNA分子更好的拦截在膜上,可以添加30%异丙醇在加热溶解胶后的液体里。
7)加洗脱液之前,将柱子在室温放置几分钟(大约需10分钟),以使乙醇充分挥发。
8)最后少加些洗脱液,尽量减少回收体积,一般用30-50μl洗脱液洗脱(不能太少,否则无法浸湿膜反而不利于洗脱);洗脱液滴在膜中央,以充分洗脱结合在膜上的DNA。
9)可以在加入洗脱液之后,可以在55度水浴5分钟或放在50度水浴10分钟以上再洗脱,或用封口膜密封4度过夜,第二天再离心回收,效果不错。
10)将离心后的洗脱液加回吸附柱,再次离心。
DNA胶回收实验技术总结胶回收一. 提高胶回收量的办法:1)增加电泳时的上样量。
2)电泳缓冲液用新鲜配制的。
3)切胶时尽量只切有条带的胶,减小切胶体积:含目的片断很少的胶就不要要了,不然影响回收率。
4)把切的两块或多块胶融化后,无论多大的体积都用一个管子,转移到同一个柱子上。
5)溶胶时所加的溶液可多一点,这样更有利于DNA与膜的结合,不过一般不要多余750ul。
6)胶回收的关键是通过柱子的溶液的盐浓度、酸碱性(电荷)和疏水性使DNA与柱子结合,因此,若电泳缓冲液的PH偏高,可在溶胶液中加入10ul(PH 5.0,3mol/L的 NaAC);为了使DNA分子更好的拦截在膜上,可以添加30%异丙醇在加热溶解胶后的液体里。
PCR产物的TA克隆(DNA的胶回收和连接)【实验原理】1.DNA片段回收方法:DNA片段在适当浓度的琼脂糖凝胶中,通上一定电压进行电泳,不同大小的DNA分子由于迁移率的不同而分离开。
切下带有所需DNA片段的凝胶,用冻融法、玻璃奶回收法或商品化胶回收试剂盒将目的片段回收纯化。
2.利用Taq酶能够在PCR产物的3’末端加上一个非模板依赖的A,而T载体是一种带有3’T突出端的载体,在连接酶作用下,可以把PCR产物插入到质粒载体的多克隆位点,可用于PCR产物的克隆和测序。
商品化的T载体有很多。
本实验采用TaKaRa公司的pMDTM18-T Simple Vector。
这个载体以pUC19载体为基础,消除了pUC18载体上的多克隆酶切位点,经EcoRⅤ酶切后在两侧的3'端添上“T”制备而成(见附录1)。
由于本载体上消除了多克隆酶切位点,克隆后的PCR产物将无法使用载体上的限制酶切下,需要在PCR扩增引物上导入合适的酶切位点。
【试剂与器材】(一)试剂1.pMDTM18-T Simple Vector Kit(Takara公司)。
2.TAE电泳缓冲液3.琼脂糖(Agarose)4.6×电泳加样缓冲液:0.25%溴粉蓝,40%(w/v) 蔗糖水溶液,贮存于4℃。
5.溴化乙锭(EB)溶液母液:配制成10mg/mL,用铝箔或黑纸包裹容器,储于室温即可。
6.70%乙醇7.胶回收试剂盒(Omega公司)(二)器材水平式电泳装置,电泳仪,台式高速离心机, 恒温水浴锅, 微量移液枪, 微波炉或电炉,紫外透射仪, 凝胶成像系统或其它照相设备。
【操作方法】(一)胶回收试剂盒回收PCR产物(以Omega公司Gel Extraction Kit为例)1.当目的片段DNA完全分离时,转移凝胶至紫外灯上尽可能快地切下目的片段。
2.凝胶块转移至1.5ml离心管(离心管已经称重了)中,称重得出凝胶块的重量。
近似地确定其体积(假设其密度为1g/ml)。
分子生物学实验报告实验名称:PCR反应及PCR产物的鉴定、回收与载体连接班级:生工xx姓名:xxx学号:xxxx日期:xxxPCR反应及PCR产物的鉴定、回收与载体连接1 引言聚合酶链式反应(polymerase chain reaction,PCR)是体外酶促合成特异DNA片断的一种技术。
由于这种方法高效、敏感、特异性高[1],因而在分子生物学、基因工程研究以及对遗传病、传染病和恶性肿瘤等基因诊断和研究中得到广泛应用。
通过本次实验来学习PCR反应的基本原理与实验技术,了解引物设计的一般要求,同时学习PCR产物的回收及其与载体连接的原理和方法。
2 材料和方法2.1 实验原理2.1.1 PCR反应的基本原理聚合酶链式反应(PCR)是体外酶促合成特异DNA片段的一种方法,由高温变性、低温退火(复性)及适温延伸等几步反应组成一个周期,循环进行,使目的DNA得以迅速扩增,具有特异性强、灵敏度高、操作简便、省时等特点[2]。
PCR进行的基本条件是:以DNA为模板(在RT-PCR中模板是RNA);以寡聚核苷酸为引物;需要4种dNTP作为底物;有耐高温的Taq DNA聚合酶。
PCR每一个循环由三个步骤组成:①变性:加热模板DNA,使其解离成单链;②退火:降低温度,使人工合成的寡聚核苷酸引物在低温条件下与模板DNA所需扩增序列结合;③延伸:在适宜温度下,DNA聚合酶利用dNTP使引物3’端向前延伸,合成与模板碱基序列完全互补的DNA链。
每一个循环产物可作为下一个循环的模板,因此通过35-45个循环后,目标片段的扩增可达106-107倍。
由于DNA的琼脂糖凝胶电泳已于实验一详细阐述与实验,此次不再赘述。
2.1.2 PCR产物的回收与载体连接原理DNA片段回收方法:DNA片段在适当浓度的琼脂糖凝胶中通上一定电压进行电泳,不同大小的DNA分子由于迁移率的不同而分离开。
切下带有所需DNA片段的凝胶,用冻融法、玻璃奶回收法或商品化胶回收试剂盒将目的片段回收纯化。
PCR产物纯化和切胶回收一、pcr产物纯化PCR扩增完成后需要进行琼脂糖凝胶电泳检测,在条带单一无其他杂带的情况下,可以直接对产物进行纯化,常见的纯化方法有:1、硅胶层析柱法原理:大多数离心柱中吸附DNA的是一层硅胶膜,实际上就是一层玻璃纤维,其表面有大量修饰的硅羟基(Si-OH),硅羟基在溶液中解离后带负电,然后与带正电盐离子、带负电DNA形成电桥,从而吸附住DNA,使得DNA双链变单链,不会被生物大分子溶剂洗脱,但能经水溶性缓冲液水化后,被定量回收,从而实现纯化分离。
2、磁珠法(abs60151)原理:磁珠是有磁性的能吸附DNA的物质,其内部核心是铁离子,在磁场作用下可以吸附在磁体上。
在核心外,经过羧化,带有羧基基团,在特定的离子条件下,可以与DNA结合。
结合后,在外磁场的作用下,磁珠与DNA结合体移动到磁体周围,可以很方便去除其他多余的液体,这时,不能与磁珠结合的所有杂质都随水溶液一并去除。
然后,在洗脱条件下,DNA与磁珠分离,溶解在水中,将溶解有DNA的溶液转移,就得到了纯化后的DNA样本。
3、其他纯化方法①渗透液结合醇沉纯化原理:利用分子大小不同,小分子的物质能够通过渗透膜溶解到大量的溶液中去,而大分子的物质不能通过渗透膜,所以继续留存在透析袋中,通过乙醇沉淀最后达到去除小分子物质,得到纯化的有机大分子的效果。
②直接沉淀纯化原理:DNA分子在高盐离子醇溶液中会被沉淀出来,而其他物质继续溶液在溶液中,沉淀出来的DNA分子经过离心与溶液成分分开,达到纯化的目的。
二、凝胶回收纯化如电泳检测结果存在非特异性条带,则需要将目的条带切出来,再用胶回收试剂盒(abs60098)对凝胶进行回收纯化,相较于直接纯化,只是多了一步溶胶的过程,相应的产物纯度提高,回收率则下降。
附:在PCR扩增完成后,反应体系中除了DNA片段,还存在离子、dNTP、引物及聚合酶等物质,这些物质会影响后续克隆测序等实验,因此对其产物进行纯化是必不可缺的步骤,不同的纯化手段各有自己的优缺点。
PCR产物得胶回收分离纯化一、实验仪器1、琼脂糖凝胶电泳系统2、紫外观察分析仪3、离心机4、单面刀片5、恒温水浴锅二、试剂1、DNA回收试剂盒2、50×TAE3、ddH2O三、步骤1在紫外灯下切分含DNA得琼脂糖块,尽可能除去多余得琼脂糖。
放入1.5ml离心管中、4。
称量胶块重量,计算胶块体积。
计算胶块体积时,以1mg=1 μl 进行计算。
5. 向胶块中加入胶块融化液DR-I Buffer,DR-IBuffer 得加量如下表:凝胶浓度DR-I Buffer使用量1。
0% 3 个凝胶体积量1.0%~1。
5% 4个凝胶体积量1、5%~2。
0%5个凝胶体积量6。
均匀混合后75℃加热融化胶块(低熔点琼脂糖凝胶只需在45℃加热)。
此时应间断振荡混合,使胶块充分融化(约6~10分钟)。
注)胶块一定要充分融化,否则将会严重影响DNA 得回收率。
7、向上述胶块融化液中加入DR—I Buffer量得1/2体积量得DR-IIBuffer,均匀混合。
当分离小于400bp得DNA片段时,应在此溶液中再加入终浓度为20%得异丙醇。
8。
将试剂盒中得SpinColumn安置于Collection Tube 上。
9。
将上述操作7得溶液转移至SpinColumn 中,12,000 rpm 离心 1 分钟,弃滤液、注)如将滤液再加入Spin Column 中离心一次,可以提高DNA 得回收率。
10.将500 μl得漂洗液Rinse A加入Spin Column中,12,000 rp m离心30秒钟,弃滤液。
11、将700μl得Rinse B加入Spin Column中,12,000 rp m离心30 秒钟,弃滤液。
注)请确认RinseB中已经加入了指定体积得100%乙醇。
12。
重复操作步骤11、13。
将SpinColumn安置于新得1.5ml 得离心管上,在Spin Column 膜得中央处加入25μl 得灭菌蒸馏水或Elution Buffer,室温静置1 分钟。
实验六 PCR产物胶回收实验
一、实验目的
1. 掌握胶回收的常规操作
2. 了解胶回收PCR产物的目的
二、实验原理
利用胶回收试剂盒纯化PCR产物。
本试剂盒提供一个从TBE或TAE电泳缓冲液配制的琼脂糖凝胶中提取高质量DNA的简单、快速、有效的技术,适合从浓度≤3%,高,低熔点琼脂糖凝胶中,回收长度为60bp~23Kb的DNA片段,小于100bpDNA片段回收率为10%~55%,0.1~10kbDNA片段回收率最大为99%,大于10kbDNA片段回收率为20~70%。
回收的基因组DNA可以应用到克隆,测序,限制性酶切等各类下游分子生物学实验。
三、试剂及配套设备和材料
3.1 试剂
Extraction buffer Wash buffer Elution buffer
3.2 配套设备和材料
无菌1.5ml离心管各种规格移液器和无菌移液器吸头
无水乙醇异丙醇可能需要3M KAc (pH 5.0) 离心机
四、基本技术参数
五、操作步骤
1. 用干净、锋利的手术刀,将含有目的DNA片段的琼脂糖凝胶切下,并放入1.5或
2.0 ml离心管中。
请尽量切去不包含DNA片段的凝胶。
一般情况下,电泳的DNA上样量≥50 ul (50ul为最终洗脱体积)。
2. 按1:3的比例(凝胶质量毫克数:融胶液体积微升数)加入Extraction buffer。
例如:100mg凝胶应加入300ul Extraction Buffer。
对于每人份试剂用量,凝胶质量不能超过400mg。
3. 于恒温水浴或金属浴中50℃温育,直到凝胶融化。
一般温育时间为10分钟,温育过程中没隔2-3分钟混匀一次。
如果温育后,混合液体颜色变紫,请加入10 ul 3M KAc (pH 5.0),使混合液颜色变回黄色。
4. 可选:按1:1的比例(凝胶质量毫克数:异丙醇体积微升数)加入异丙醇,并混合均匀。
如DNA片段大于500bp/小于4kb,不需要加异丙醇。
5. 将混合液全部转移到Spin column内,于6,000g离心1分钟,并弃去接液管内液体。
如混合液体积大于750ul可先转移750ul,其余的液体待离心弃液后,再转移。
6. 向Spin column内加500ul Extraction Buffer,于12,000g离心30~60秒,并弃去接液管内液体。
7. 向Spin column内加750ul Wash Buffer,于12,000g离心30~60秒,并弃去接液管内液体。
如果回收的DNA片段将用于盐浓度敏感的实验,请在加入Wash buffer后静置2~5分钟,再离心。
8. 再次于12,000 rpm离心1分钟,然后将spin column转移到无菌的1.5ml离心管中。
如不进行该步离心,则无法保证离心柱内残液被彻底清除。
9. 向Spin column内加50ul Elution Buffer、水或TE溶液,并于室温静置1分钟。
可根据实验的实际需要决定Elution Buffer用量。
但不要低于20ul。
10. 于12,000g离心1分钟,微量离心管内溶液中含有目的DNA片段。
回收的DNA可直接用于各类下游分子生物学实验,如果不立即使用,请保存于-20℃。
六、注意事项
1. 为了保证没有外源DNA的污染,电泳的buffer和gel都是新制的,切胶的台子清理干净,刀片最好洗净灭菌。
2. 为了减少胶的体积,我们可以用相对比较薄的胶来跑电泳,这样可以减少回收试剂引起的一些后续麻烦。
2. 在洗脱前,将洗脱液于30~60℃温浴,可提高提取效率。
七、思考题
1. 简述影响DNA在琼脂糖凝胶中迁移速率的因素。
2. 简述PCR上样缓冲液(loading buffer)的成分及其作用。